Похожие презентации:
Титриметрические методы анализа
1.
Титриметрическиеметоды анализа
ВЫПОЛНИЛИ:
РУСАКОВ Н.И.
КИРБИЖЕКОВ В.В.
ЕФРЕМОВ С.Д.
ПРОВЕРИЛ
ПРЕПОДАВАТЕЛЬ:
КРАСЮК О.М.
2.
Титриметрические методы количественного анализаоснованы на точном измерении объема раствора реагента
(титранта), вступающего в химическую реакцию с исследуемым
веществом.
Сущность титриметрического
анализа
заключается
в
следующем. К раствору,
приготовленному из навески
анализируемого вещества ( или
к определенной
части
этого
раствора),
постепенно приливают раствор
точно известной концентрации до тех пор, пока
взаимодействующие вещества
не прореагируют
полностью.
3.
Титриметрические методы анализа⦿ Титрование
– прибавление титрованного
раствора к анализируемому до момента
окончания реакции.
⦿ Титрующий
раствор называют
раствором, или титрантом.
⦿ Момент
рабочим
окончания
реакции,
когда
количество
добавленного
титранта
химически
эквивалентного
количеству
титруемого вещества, называется точкой
эквивалентности (Т.Э.).
4.
ТИТРИМЕТРИЧЕСКИЕ МЕТОДЫ АНАЛИЗА⦿ Титрованный
или стандартный раствор это раствор, концентрация которого точно
известна.
⦿ Рабочим
раствор, или титрант - называется
титрующий раствор.
⦿ Титрование
– прибавление титрованного
раствора к анализируемому до момента
окончания реакции.
5.
Определение конечной точки титрования - точки на кривойтитрования, в которой регистрируется резкое изменение
наблюдаемого свойства
По резким изменениям
Визуально
по аналитическим
эффектам
(изменению
цвета, помутнению
раствора и т.д.)
Вспомогательные
вещества –
индикаторы
измеряемой физической
величины системы
в процессе титрования
(рН потенциомерическое
титрование;
электропроводности кондуктометрическое
титрование;
силы тока,
протекающей
через раствор –
амперометрическое
титрование и т.д.)
6.
Для титриметрического анализа может бытьиспользована
только
такая
реакция,
которая
удовлетворяет
следующим
требованиям:
⦿−
реакция должна быть необратимой;
⦿−
скорость реакции должна быть высокой;
должен существовать способ определения
окончания титрования;
⦿−
реакция не должна осложняться
протеканием побочных реакций.
⦿−
7.
Приготовление и стандартизация растворовПод стандартизацией раствора титранта понимают
установление его точной концентрации
Различают
Приготовленные и Установленные
растворы титрантов
8.
ТРЕБОВАНИЯ К ИСХОДНЫМВЕЩЕСТВАМ
состав вещества должен отвечать строгой
химической формуле;
⦿−
вещество должно быть химически чистым, т.
е. содержание примесей не должно превышать
0,05–0,1 %;
⦿−
вещество должно быть устойчивым как в
твердом виде, так и в виде раствора.
⦿−
9.
Приготовление титрованных растворов1. по точной навеске исходного вещества (приготовленный
раствор);
10.
ПЕРВИЧНЫЕ СТАНДАРТНЫЕ РАСТВОРЫ ГОТОВЯТТОЛЬКО ИЗ СТАНДАРТНЫХ ВЕЩЕСТВ, КОТОРЫЕ
ДОЛЖНЫ ОТВЕЧАТЬ СЛЕДУЮЩИМ ТРЕБОВАНИЯМ:
вещество должно легко получаться в химически чистом виде,
иметь состав, который точно соответствует химической
формуле и не изменяется в процессе хранения;
быть стойким при хранении как в сухом виде, так и в растворе;
вещество должно хорошо растворяться в воде (или в другом
растворителе);
иметь, по возможности, большую молярную массу, что
уменьшает ошибки при взвешивании навески.
Таким способом можно приготовить титрованные растворы из
химически чистых веществ: K2Cr2O7, KBrO3, H2C2O4, Na2B4O7 и
др.
11.
Приготовление титрованных растворов2. с помощью "фиксанала"
(первичный стандартный раствор)
Фиксаналы (стандарт-титры, первичные стандарты) – вещества
в строго определенном количестве, обычно 0,1 моль, содержащиеся
в стеклянных ампулах. Ампулу разбивают специальным бойком в
воронке. Содержимое переносят количественно в мерную колбу и
разбавляют до определенного объема. Полученный раствор часто
используют в титриметрии как титрант. В качестве фиксанала
применяют, например, KMnO4, K2Cr2O7, HCl, AgNO3 и др.
Соединения, используемые как фиксаналы, должны быть
предельно чистыми, устойчивыми при комнатной температуре, не
должны адсорбировать Н2О и СО2 из воздуха.
12.
Приготовление титрованных растворов3. готовят раствор с приблизительной концентрацией,
близкой к требуемой, определяют точную концентрацию с
помощью стандартного вещества или стандартного раствора
13.
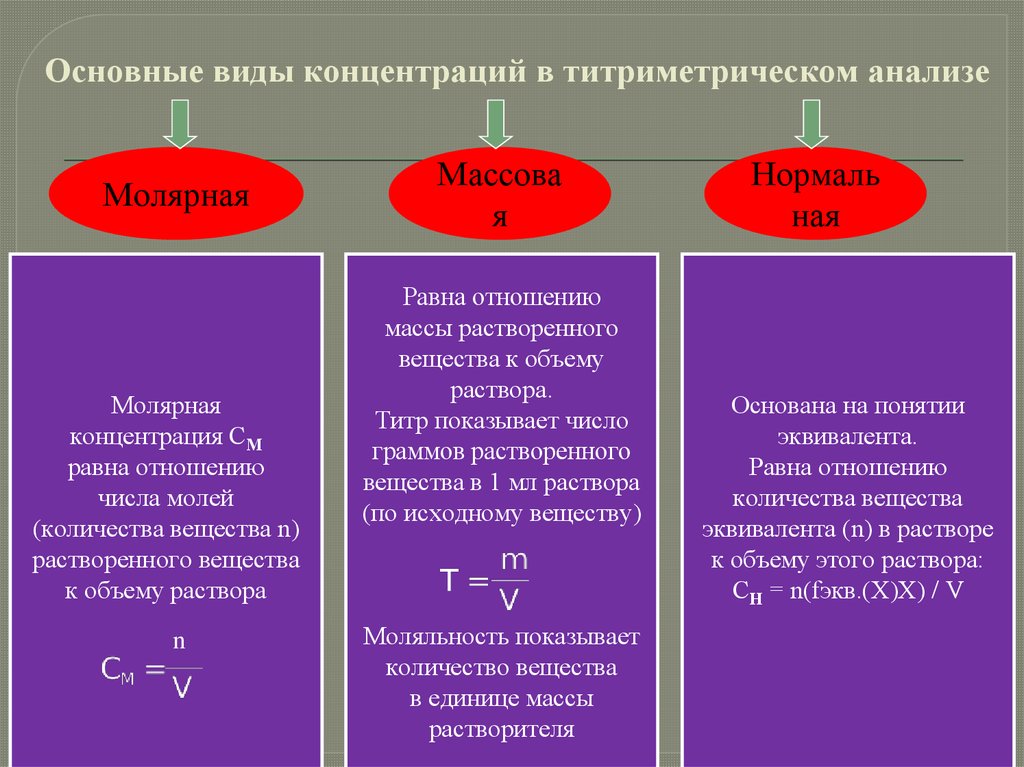
Основные виды концентраций в титриметрическом анализеМолярная
Молярная
концентрация СМ
равна отношению
числа молей
(количества вещества n)
растворенного вещества
к объему раствора
n
Массова
я
Равна отношению
массы растворенного
вещества к объему
раствора.
Титр показывает число
граммов растворенного
вещества в 1 мл раствора
(по исходному веществу)
Моляльность показывает
количество вещества
в единице массы
растворителя
Нормаль
ная
Основана на понятии
эквивалента.
Равна отношению
количества вещества
эквивалента (n) в растворе
к объему этого раствора:
СН = n(fэкв.(Х)Х) / V
14.
КЛАССИФИКАЦИЯ СПОСОБОВТИТРОВАНИЯ
Обратное
титрование
Прямое титрование
Классификация
титриметрических
методов
по способу титрования
Заместительное
титрование
15.
⦿−прямое: пробу титруют раствором
⦿−
обратное: титрант (вспомогательное
⦿−
заместительное: к пробе добавляют не сам
титранта, на основании точного измерения
объема реактива вычсляют содержание
определяемого вещества
вещество) добавляют к пробе в избытке, а
затем оттитровывают не прореагировавший
титрант стандартным раствором другого
вещества (основным титрантом);
титрант, а какой-либо вспомогательный
реагент, взаимодействующий с
определяемым веществом и дающий
эквивалентное количество продукта
реакции, который оттитровывают.
16.
Классификация способов титрования в зависимости от подходак выполнению
Метод отдельных навесок
Рассчитывают навеску анализируемого вещества. На
аналитических весах взвешивают отдельные, близкие по
величине, навески вещества. Растворяют в удобном для
титрования объеме растворителя и титруют стандартным
раствором.
Метод отдельных навесок наиболее точен, но требует
больших затрат времени.
17.
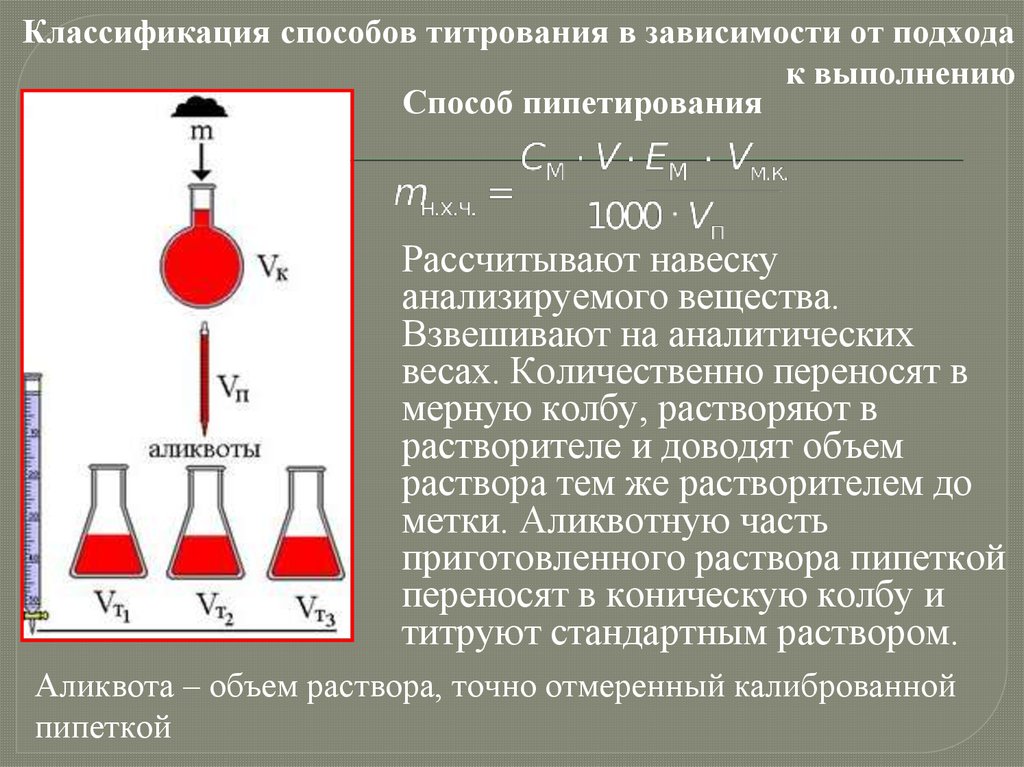
Классификация способов титрования в зависимости от подходак выполнению
Способ пипетирования
Рассчитывают навеску
анализируемого вещества.
Взвешивают на аналитических
весах. Количественно переносят в
мерную колбу, растворяют в
растворителе и доводят объем
раствора тем же растворителем до
метки. Аликвотную часть
приготовленного раствора пипеткой
переносят в коническую колбу и
титруют стандартным раствором.
Аликвота – объем раствора, точно отмеренный калиброванной
пипеткой
18.
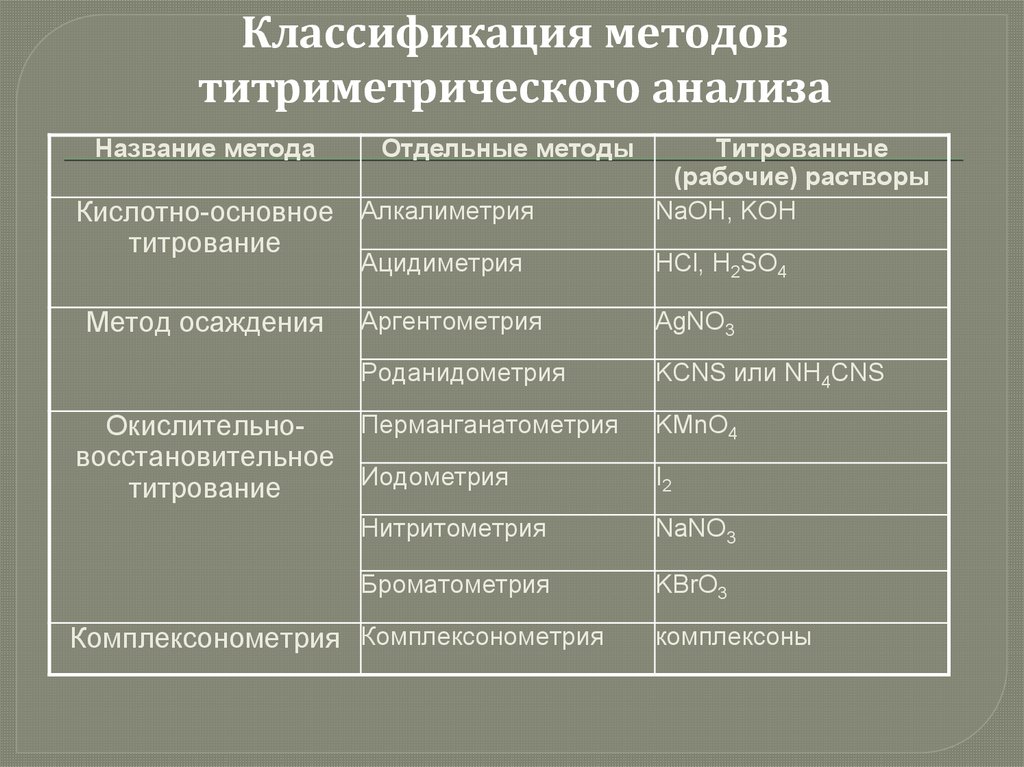
Классификация методовтитриметрического анализа
Название метода
Отдельные методы
Кислотно-основное Алкалиметрия
титрование
Метод осаждения
Титрованные
(рабочие) растворы
NaOH, KOH
Ацидиметрия
HCl, H2SO4
Аргентометрия
AgNO3
Роданидометрия
KCNS или NH4CNS
Перманганатометрия
Окислительновосстановительное
Иодометрия
титрование
KMnO4
I2
Нитритометрия
NaNO3
Броматометрия
KBrO3
Комплексонометрия Комплексонометрия
комплексоны
19.
Классификация титриметрическихметодов анализа по типам
химических реакций
Методы кислотно-основного титрования
Основаны на использовании реакции
нейтрализации. Применяют для определения
кислот, оснований и солей, которые при
гидролизе создают кислую и щелочную
реакцию среды.
20.
Прямымкислотно-основным
титрованием
определяют
концентрацию кислот или оснований
или содержание элементов, входящих в
их состав.
21.
Кривые титрования⦿ Кривые
титрования — графическое
изображение зависимости определяемой
в ходе титрования величины от объёма
добавленного стандартного раствора
титранта.
22.
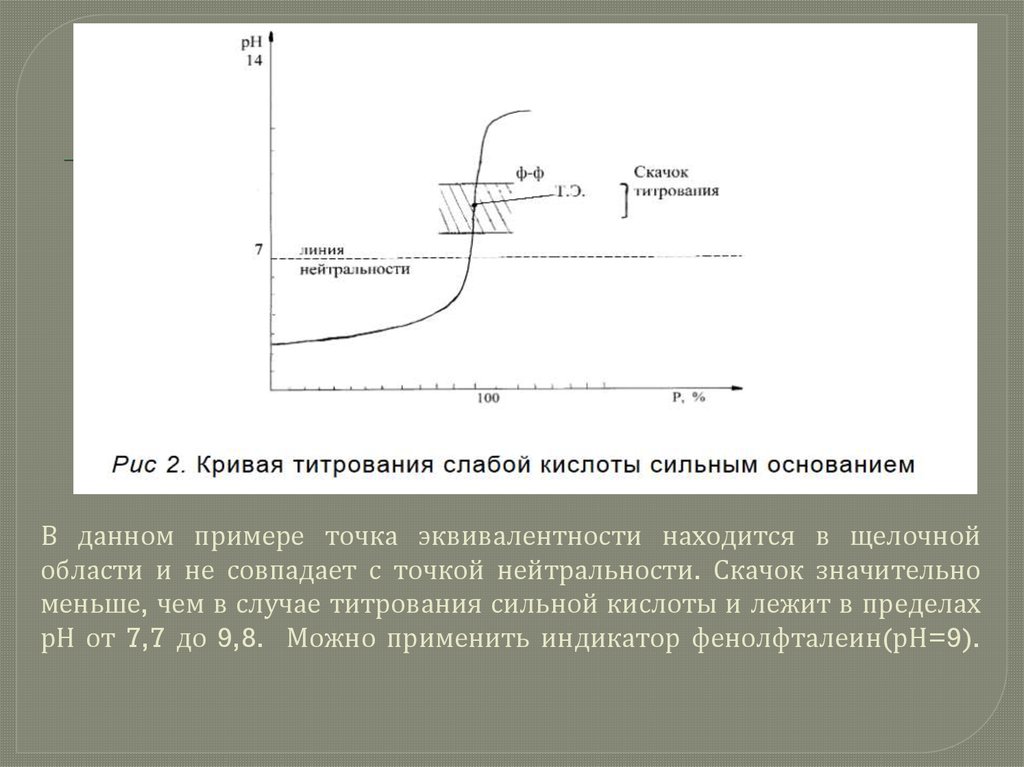
В данном примере точка эквивалентности находится в щелочнойобласти и не совпадает с точкой нейтральности. Скачок значительно
меньше, чем в случае титрования сильной кислоты и лежит в пределах
рН от 7,7 до 9,8. Можно применить индикатор фенолфталеин(рН=9).
23.
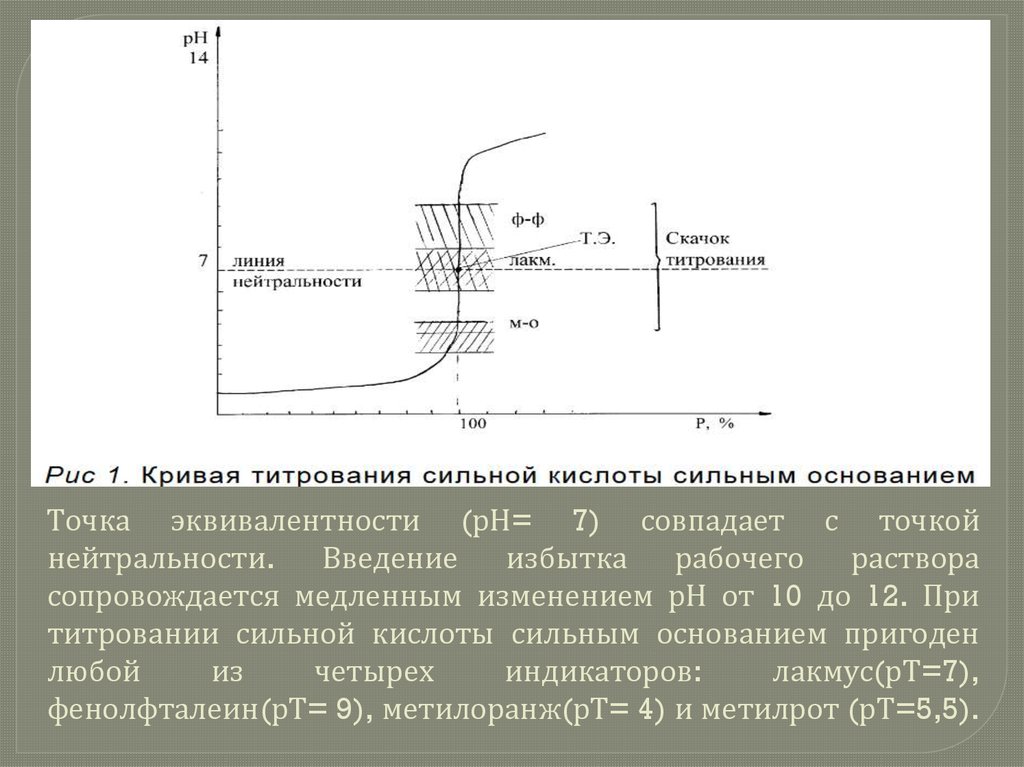
Точка эквивалентности (рН= 7) совпадает с точкойнейтральности.
Введение
избытка
рабочего
раствора
сопровождается медленным изменением рН от 10 до 12. При
титровании сильной кислоты сильным основанием пригоден
любой
из
четырех
индикаторов:
лакмус(рТ=7),
фенолфталеин(рТ= 9), метилоранж(рТ= 4) и метилрот (рТ=5,5).
24.
Вследствие гидролиза соли, образующейся в ходе реакции, точкаэквивалентности не совпадает с точкой нейтральности, но смещается в
данном случае уже в кислую область (рН<7). к следует из ее вида, для
фиксирования точки эквивалентности в данном случае могут быть
использованы только те индикаторы, интервал перехода которых
смещен в кислую область значений рН: метиловый оранжевый,
бромфеноловый синий, метиловый красный
25.
Методы осадительного титрованияИсследуемое вещество при взаимодействии
с титрантом образует малорастворимые
соединения.
Ag+ + Cl- = AgCl↓
Для определения анионов применяют нитрат
серебра, для определения катионов серебра –
хлорид
натрия.
Аргентометрическим
методом пользуются главным образом для
количественного определения галогенидионов и ионов серебра.
26.
Методы комплексометрического титрованияОснованы
на
образовании
слабоионизированных комплексов титранта с
исследуемым веществом.
Са2+ + Н2Y2- = CaH2Y
Mg2+ + Н2Y2- = MgH2Y
Конечную точку титрования определяют с
помощью
металлоиндикаторов
или
потенциометрически.
27.
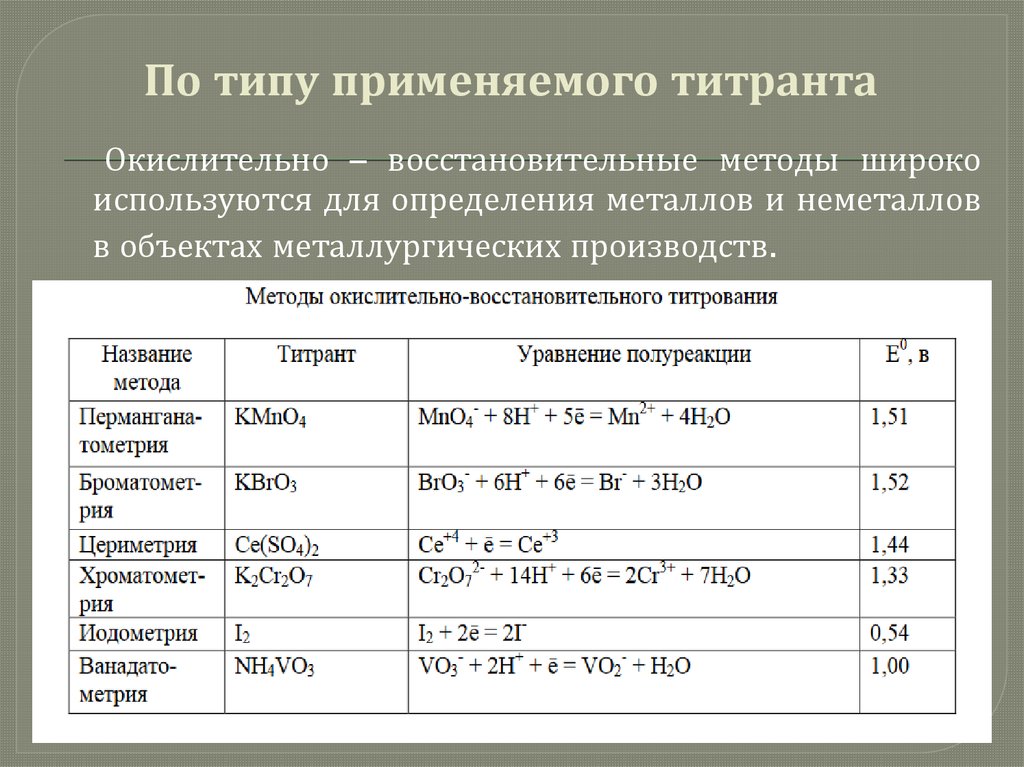
По типу применяемого титрантаОкислительно – восстановительные методы широко
используются для определения металлов и неметаллов
в объектах металлургических производств.
28.
Перманганатометрия: в качестве титрантаиспользуют
раствор
перманганата
калия,
окислительные
свойства
которого
можно
регулировать в зависимости от кислотности
раствора.
Применяют
для
определения
восстановителей
неорганического
и
органического происхождения.
Перманганатометрия
применяется
для
определения V, Mo, W, U, Ti, Nb, Sn, Sb, Fe, Ca,
Mg.
29.
Броматометрия: основанатитранта раствора KBrO3.
на
применении
в
качестве
Броматометрия применяется для определения As, Fe, S,
Sb, Sn
Дихроматометрия: в качестве титранта
стандартный раствор дихромата калия K2Cr2O7.
используют
Применяют для определения Fe2+, SO32-, Fe(CN)64-,
органических веществ (гидрохинон, аскорбиновая кислота и
др.)
30.
Йодометрия: в качестве титрантаиспользуется йод или йодид калия
I3- + 2е = 3IВ результате реакции выделяется
йод
в
количестве,
эквивалентном
количеству окислителя; йод титруют
раствором тиосульфата натрия
⦿
Йодометрия
применяется
определения Cu,Sn.
для
31.
Расчеты в титриметричом анализе⦿
Число молей эквивалентов (n1) определяемого вещества
равно числу молей эквивалентов титранта (n2)
⦿
Количество вещества эквивалентов можно выразить через
массу вещества (m) и молярную массу эквивалентов:
⦿
Титр – это отношение массы растворенного вещества (m)
к объему раствора (V):
⦿
Определение концентрации:
32.
Титр по определяемомувеществу
Расчет результатов можно везти по известному
титру
⦿ Титра раствора по определяемому веществу – это
масса определяемого вещества (Y), эквивалентная 1
мл раствора вещества (X)
⦿
33.
Расчеты в результатов прямого титрования34.
Расчеты в результатов обратноготитрования
35.
Заместительное титрование⦿ Титрование
заместителя (косвенный
метод) применяют, когда нет
подходящей реакции или индикатора
для прямого тестирования. В этом
случае используют какую-либо реакцию,
в которой анализируемое вещество
замещают эквивалентным количеством
другого вещества, а последнее титруют
рабочим раствором.
36.
Спасибо завнимание!






























 Химия
Химия








