Похожие презентации:
Законы химической термодинамики. Часть 1. Физическая и коллоидная химия
1. Законы химической термодинамики. Часть 1
Физическая и коллоидная химия2.
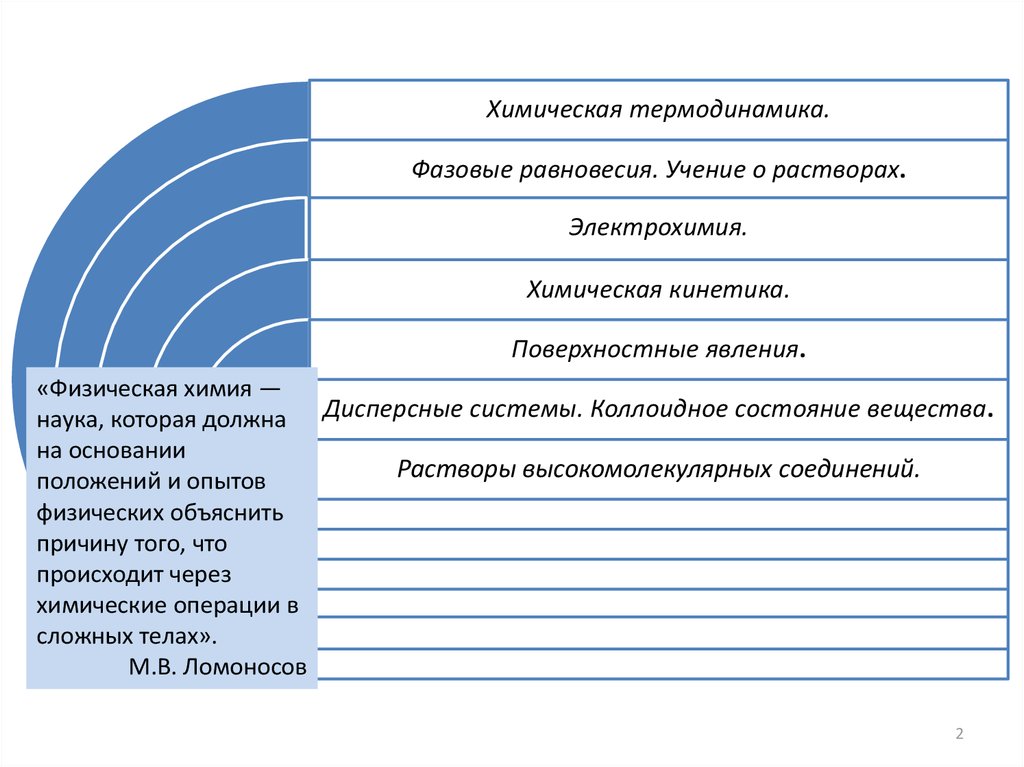
Химическая термодинамика.Фазовые равновесия. Учение о растворах.
Электрохимия.
Химическая кинетика.
Поверхностные явления.
«Физическая химия —
наука, которая должна Дисперсные системы. Коллоидное состояние вещества.
на основании
Растворы высокомолекулярных соединений.
положений и опытов
физических объяснить
причину того, что
происходит через
химические операции в
сложных телах».
М.В. Ломоносов
2
3.
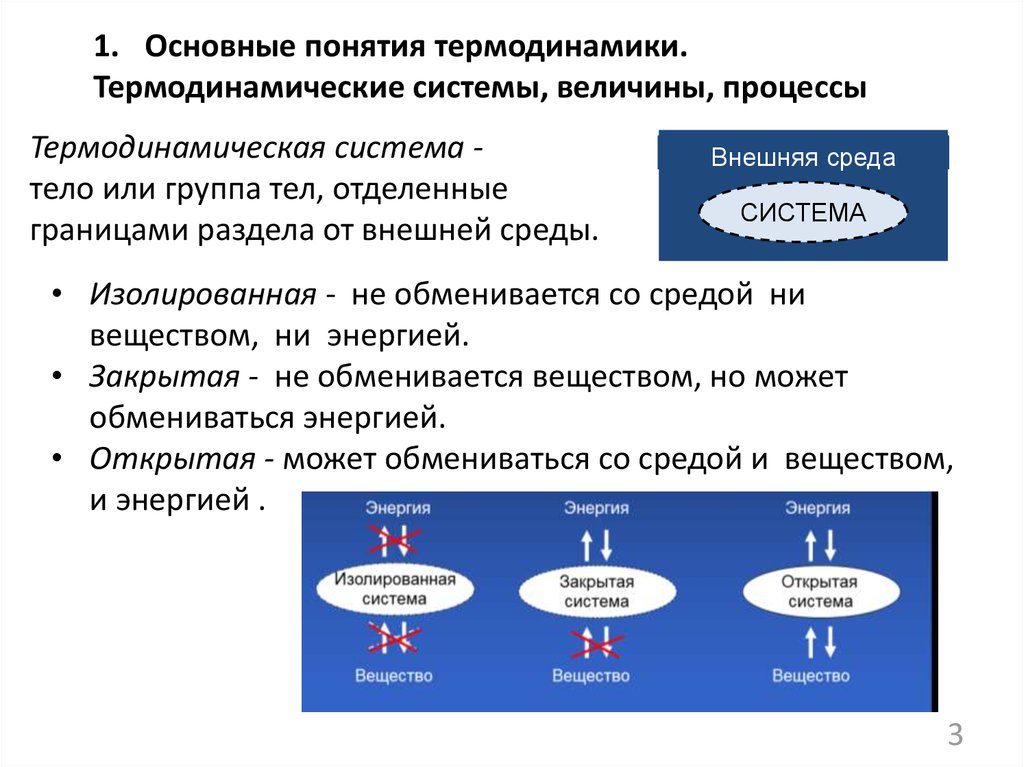
1. Основные понятия термодинамики.Термодинамические системы, величины, процессы
Термодинамическая система тело или группа тел, отделенные
границами раздела от внешней среды.
Внешняя среда
СИСТЕМА
• Изолированная - не обменивается со средой ни
веществом, ни энергией.
• Закрытая - не обменивается веществом, но может
обмениваться энергией.
• Открытая - может обмениваться со средой и веществом,
и энергией .
3
4.
Гомогенная система - т/д свойства одинаковы во всем объеме.(одна фаза).
Гетерогенная система - состоит из нескольких фаз
отделенных друг от друга границами раздела.
Фаза - совокупность всех частей системы с одинаковым
составом и свойствами.
4
5.
Состояние системы - совокупность физических ихимических свойств
Свойства системы количественно выражаются т/д
величинами.
m (общ) = m1 + m2
T (общ) ≠ T1 + T2
• Экстенсивные –
пропорциональные массе
( V, энергия и т.п.)
• Интенсивные –
независимые от массы
(T, P, C,
удельные и мольные величины).
5
6.
Термодинамические величиныФункции состояния –
зависят от состояния системы
(начального и конечного) ,
не зависят от того как
происходили изменения в (не
зависят от пути),
Раб. расширения PdV, QP, QV, Н,
S, G.
Их изменение в элементарном
процессе : dQP, dQV, dН, dS, dG
Функции процесса —
зависят от пути.
В общем случае работа W,
теплота Q
Их изменение в
элементарном процессе : δW,
δQ
Элементарный процесс- вызван бесконечно малым
изменением т/д величины .
6
7.
Самопроизвольные процессы –• происходят без внешних воздействий
• в результате можно получить полезную работу.
• в изолированной системе протекают до достижения
равновесного состояния.
Самопроизвольные процессы могут быть обратимыми
(максимальная работа) и необратимыми
Процессы, для протекания которых требуются затраты
энергии, называют несамопроизвольными.
7
8.
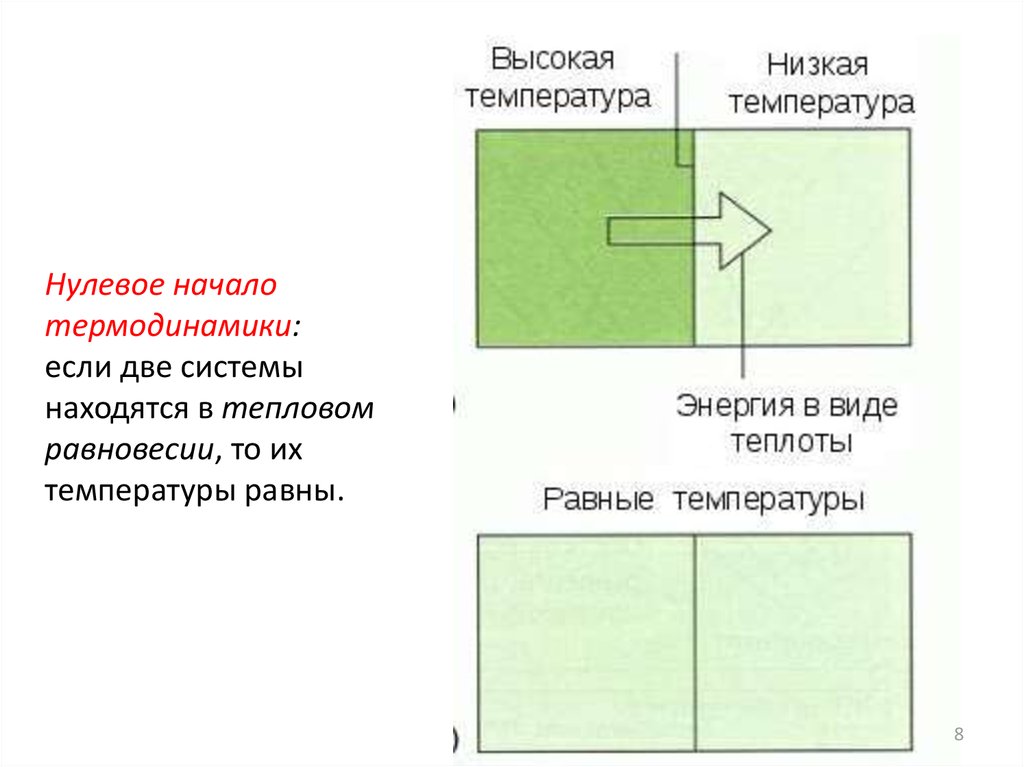
Нулевое началотермодинамики:
если две системы
находятся в тепловом
равновесии, то их
температуры равны.
8
9.
Равновесный процесссистема может вернуться в исходное
состояние. Поэтому равновесные
процессы в Т/Д называют обратимыми.
Можно заставить протекать в обратном направлении,
изменив один из параметров на бесконечно малую
величину (испарение и конденсация, плавление и
кристаллизация и т.п.)
Процесс является неравновесным, когда
он протекает вследствие воздействия на
равновесную систему. Будет проходить до
тех пор, пока не наступит новое
положение равновесия, т.е. он является
односторонним.
9
10.
Важнейшие процессы:изотермические — при постоянной температуре (T =
const);
изобарные – при постоянном давлении (P = const);
изохорные – при постоянном объеме (V = const).
В адиабатическом процессе система не обменивается
теплом с окружающей средой (Q = 0).
10
11.
2*. Первый закон термодинамики. Теплота и работа какформы передачи энергии. Внутренняя энергия системы.
Энтальпия. Теплоемкость
Первый закон (начало) Т/Д — частный случай закона
сохранения и превращения энергии в применении к тепловым
явлениям.
Внутренняя энергия системы U — общий запас всех видов
энергии (движения молекул, атомов, межмолекулярных
взаимодействий и т.д.), за исключением кинетической энергии
системы в целом и ее потенциальной энергии положения.
U- функция состояния.
Формулировка 1 первого закона Т/Д (одна их нескольких)
В любой изолированной системе запас энергии U остаётся
постоянным.
Определить полный запас U невозможно,
рассматривают изменение U, dU.
11
12.
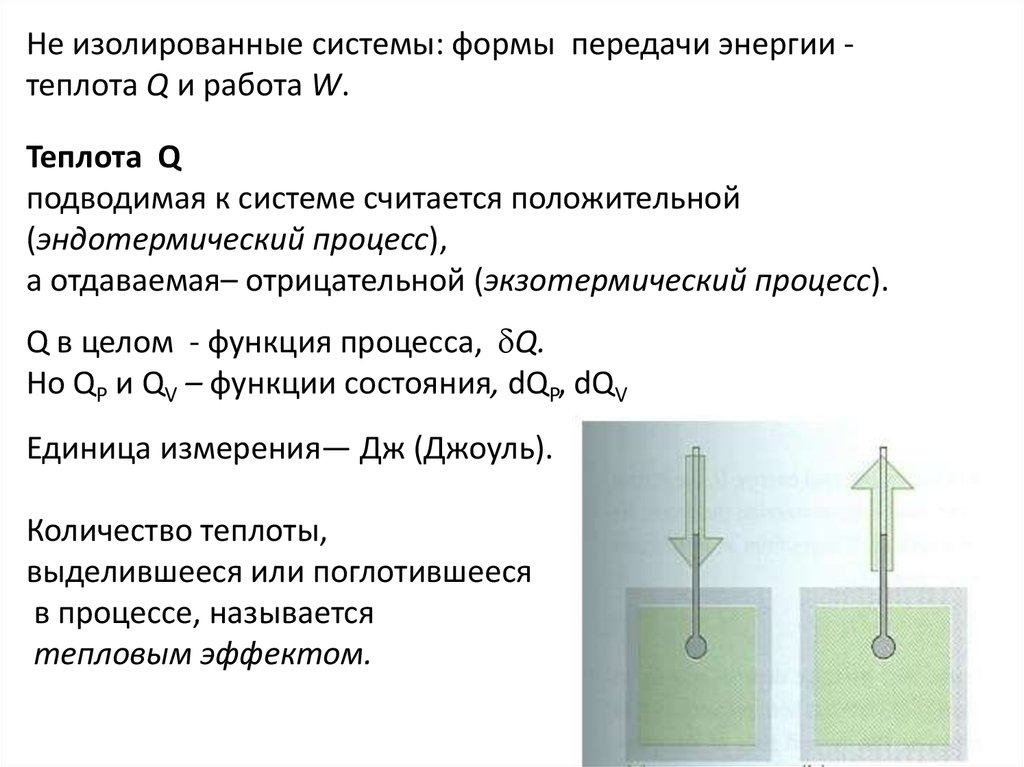
Не изолированные системы: формы передачи энергии теплота Q и работа W.Теплота Q
подводимая к системе считается положительной
(эндотермический процесс),
а отдаваемая– отрицательной (экзотермический процесс).
Q в целом - функция процесса, Q.
Но QP и QV – функции состояния, dQP, dQV
Единица измерения— Дж (Джоуль).
Количество теплоты,
выделившееся или поглотившееся
в процессе, называется
тепловым эффектом.
12
13.
Работа WВиды W: механическая (работа расширения газа), электрическая
(в гальваническом элементе), и т.д.
В целом W является функцией процесса, W.
Мы будем рассматривать хим. процессы, в которых совершается
только работа расширения газа (в случае образования газа в
результате реакции).
Тогда Wрасш= – P V, в этом случае W — функция состояния,
dWрасш= – PdV.
Знак минус отражает тот факт, что совершаемая системой работа
соответствует уменьшению энергии системы.
Единица измерения работы — Дж
13
14.
1415.
Формулировка 2 первого закона Т/Д (одна их нескольких):Внутренняя энергия системы расходуется на выделяемое
системой тепло Q и совершаемую работу W
U = Q + W
Для элементарных процессов в общем случае
dU = Q + W,
если совершается только работа расширения газа
U = Q – P V
dU = Q – PdV.
Формулировка 3 первого закона Т/Д (одна их нескольких)
Вечный двигатель первого рода невозможен.
Если система производит работу, то U убывает. Значит,
невозможно создать устройство, производящее работу без
затраты энергии (вечный двигатель первого рода).
15
16.
3. Теплота и работа в изобарном и изохорном процессах.* Энтальпия
Первое начало Т/Д
U = Q – P V
dU = Q – PdV.
В изохорном процессе (V = const)
объем системы не изменяется (dV = 0).
Работа
PdV = 0.
U = QV
dU = QV
Теплота QV затрачивается на изменение внутренней энергии.
QV — тепловой эффект процесса при постоянном объеме.
QV = U
16
17.
В изобарном процессе (P = const)Работа
dWрасш= – PdV
dWрасш= – PdV
Теплота QР
QР = U + P V = (U2 – U1) + р(V2 – V1) =
= (U2 + pV2) – (U1 + pV1) = Н2 – Н1 = Н
Энтальпия системы Н = (U + pV) - функция состояния.
Энтальпия — это та энергия, которая доступна для
преобразования в теплоту при определенном P.
Изменение энтальпии ΔН соответствует тепловому эффекту при
постоянном давлении.
QР - тепловой эффект при постоянном давлении
QР = Н.
17
18.
связь между QР и QV.QР = U + P V,
QV = U
тогда QV = QР – P V,
P V = nRT
Работа расширения для n моль газа
QV = QР – nRT
U = Н – nRT
18
19.
Зависимость теплоты от ТQр = n СP (T2 – T1)
QV = n СV (T2 – T1).
С [Дж/(моль∙К)] - молярная теплоемкость
СP (при P = const)
СV (при V = const)
n – число моль
В справочных таблицах С0P298.
19
20.
ПримерВычислим количество теплоты, необходимое для нагревания 2
моль водяного пара от 273 до 373 К при постоянном давлении.
С0P298 (Н2О г) = 33,56 Дж/(моль∙К)
Qр = n С0P298 (Н2О г) (T2 – T1) =
= 2 ∙ 33,56∙ (373 – 273) = 6 712 Дж = 6,712 кДж
20
21.
Значения С0V в справочниках не приводятсяС0V = C0P (для тв. и жидк.)
С0V = C0P – R (для газов!)
R = 8,31 Дж/(моль ∙ К)
QV = QP – nRT
Возвращаясь к примеру с нагреванием воды:
QV = n C0V298(Н2О г) (T2 – T1) =
=n (C0P298(Н2О г) – R) (T2 – T1) =
=2 ∙ (33,56 – 8,31)∙ (373 – 273 ) = 5 050 Дж.
21
22.
4. * Приложения первого началатермодинамики к химическим процессам.
Закон Гесса и следствия из него
Закон Гесса
Тепловой эффект процесса зависит только от
вида и состояния исходных веществ и
продуктов и не зависит от пути протекания.
22
23.
Практическое значение закона Гесса- позволяет рассчитывать тепловые эффекты химических
процессов и реакций.
Стандартный тепловой эффект реакции Нr0298 – тепловой
эффект реакции превращения исходных веществ при ст.
условиях в конечные вещества также при ст. условиях.
Стандартные условия – 1 атм, 298 К
23
24.
Стандартная теплота (энтальпия) образования Нf0298тепловой эффект реакции образования одного моль вещества
из простых веществ, находящихся в устойчивых состояния.
Пример
Нf0298 КСl
К(тв.) + 1/2Сl2= КСl(тв.).
Нf0298 простых веществ и их соединений - в справочниках.
Нf0298 простых веществ в устойчивых аллотропных
модификациях равны 0.
Единицы измерения кДж/моль.
24
25.
2526.
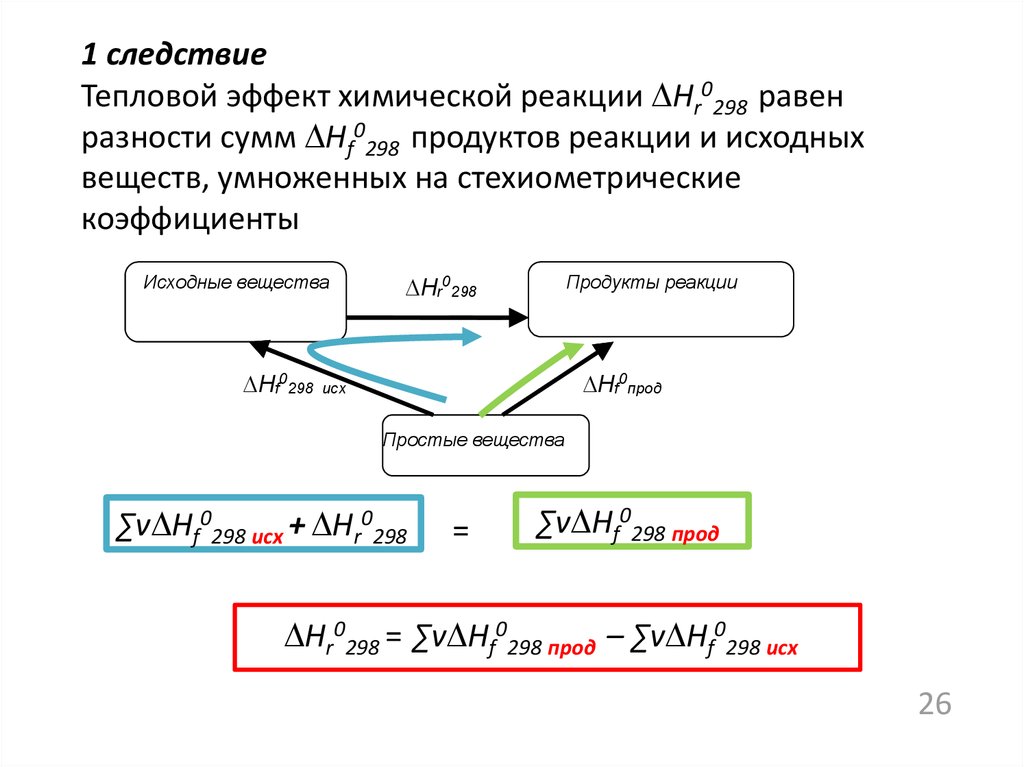
1 следствиеТепловой эффект химической реакции Нr0298 равен
разности сумм Нf0298 продуктов реакции и исходных
веществ, умноженных на стехиометрические
коэффициенты
Исходные вещества
Нf0298
Нr0298
Продукты реакции
Нf0прод
исх
Простые вещества
∑v Нf0298 исх + Нr0298
=
∑v Нf0298 прод
Нr0298 = ∑v Нf0298 прод – ∑v Нf0298 исх
26
27.
ПримерОпределим стандартный тепловой эффект реакции при постоянном
давлении и при постоянном объеме
Al 2O3 3 SO3 Al 2 (SO4 )3
Нf0298 кДж/моль
1675 395,2 3434,0
Учитывая стехиометрические коэффициенты
o
o
o
Qр = Нr0298 = H f 298 (Al 2 (SO 4 )3 ) – ( H f 298 (Al 2O3 ) + 3 H f 298 (SO3 ) )=
= 3434,0 ( 1675,0) 3 ( 395,2)=
= 573,4 кДж/моль= –573400 Дж/моль
Это экзотермическая реакция.
QV = Ur0298 = Нr0298 – nRT
Газом является только оксид серы:
n = ∑vпрод – ∑vисх = 0 – (0 + 3) = –3 (моль).
QV = 573400 – (–3)∙ 8,31∙298 = –565 970 Дж/моль = –566,0 кДж/моль.
27
28.
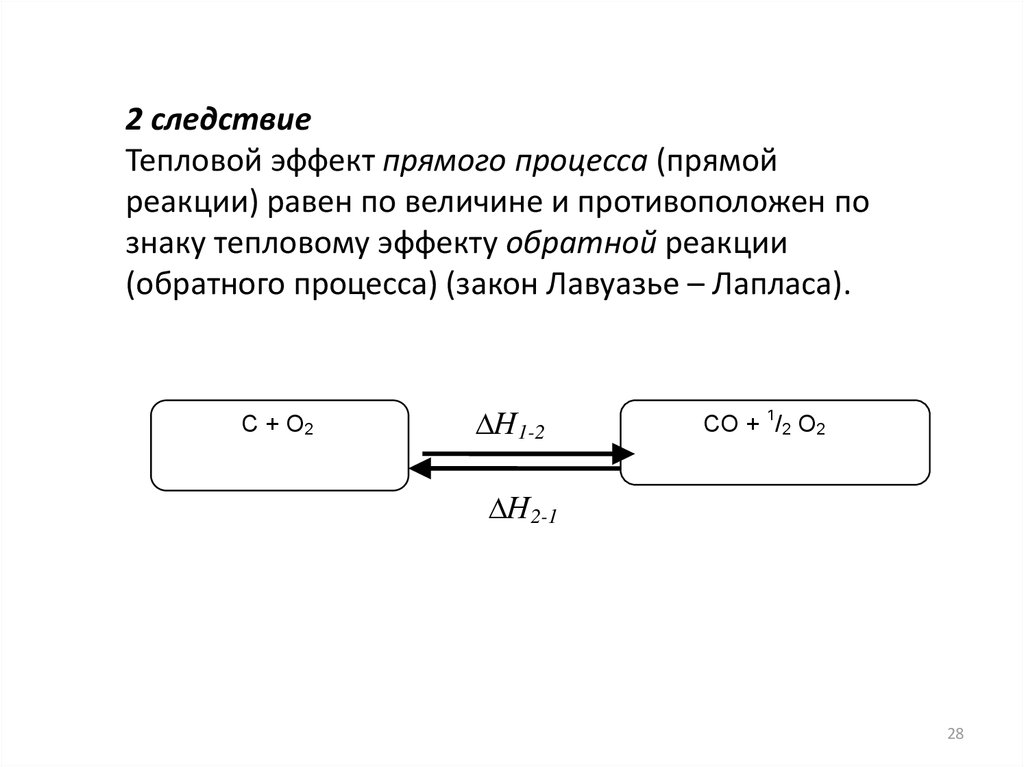
2 следствиеТепловой эффект прямого процесса (прямой
реакции) равен по величине и противоположен по
знаку тепловому эффекту обратной реакции
(обратного процесса) (закон Лавуазье – Лапласа).
С + О2
Н1-2
СО + 1/2 О2
Н2-1
28
29.
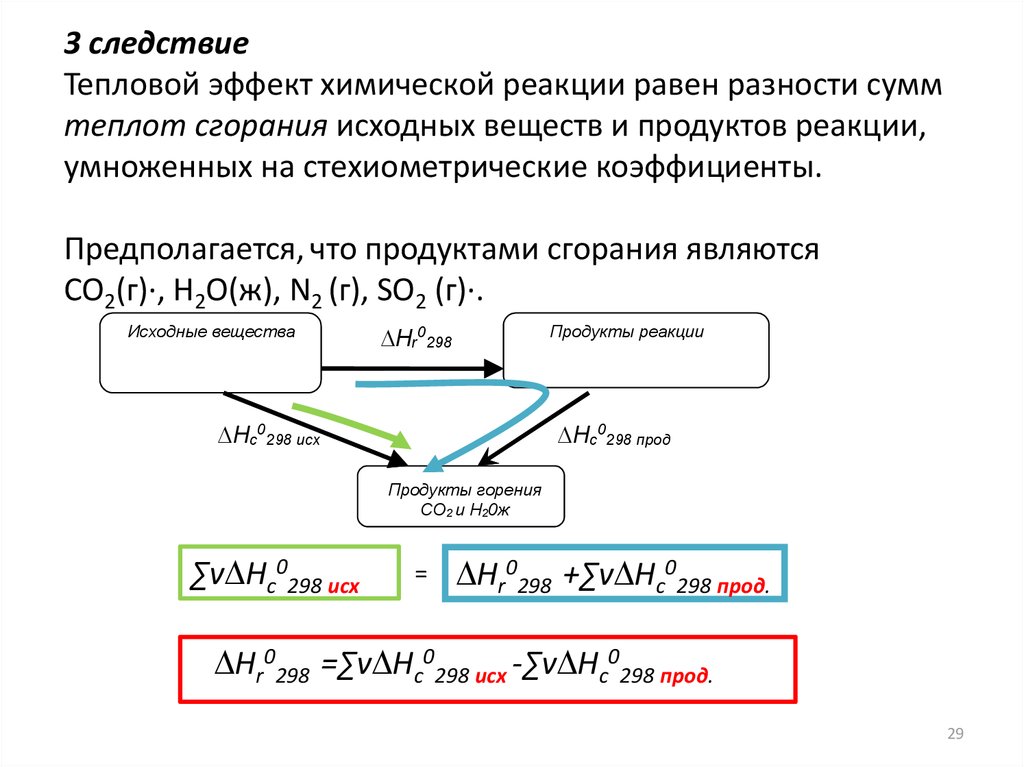
3 следствиеТепловой эффект химической реакции равен разности сумм
теплот сгорания исходных веществ и продуктов реакции,
умноженных на стехиометрические коэффициенты.
Предполагается, что продуктами сгорания являются
CO2(г)∙, H2O(ж), N2 (г), SO2 (г)∙.
Исходные вещества
Нr0298
Продукты реакции
Нc0298 исх
Нc0298 прод
Продукты горения
СО2 и H20ж
∑v Нc0298 исх
=
Нr0298 +∑v Нc0298 прод.
Нr0298 =∑v Нc0298 исх -∑v Нc0298 прод.
29
30.
ПримерОпределим тепловой эффект реакции по теплотам сгорания
С2H5ОН(ж) + СН3СООН (ж) = СН3СООС2H5(ж) + Н2О
Нc0298 –1366,7
– 871,5
–2254,2
0
кДж/моль
Нr0298 = Нc0298 исх – ∑v Нc0298 прод =
=(–1366,7 –871,5) – (–2254,2 + 0) = 16 кДж/моль
30
31.
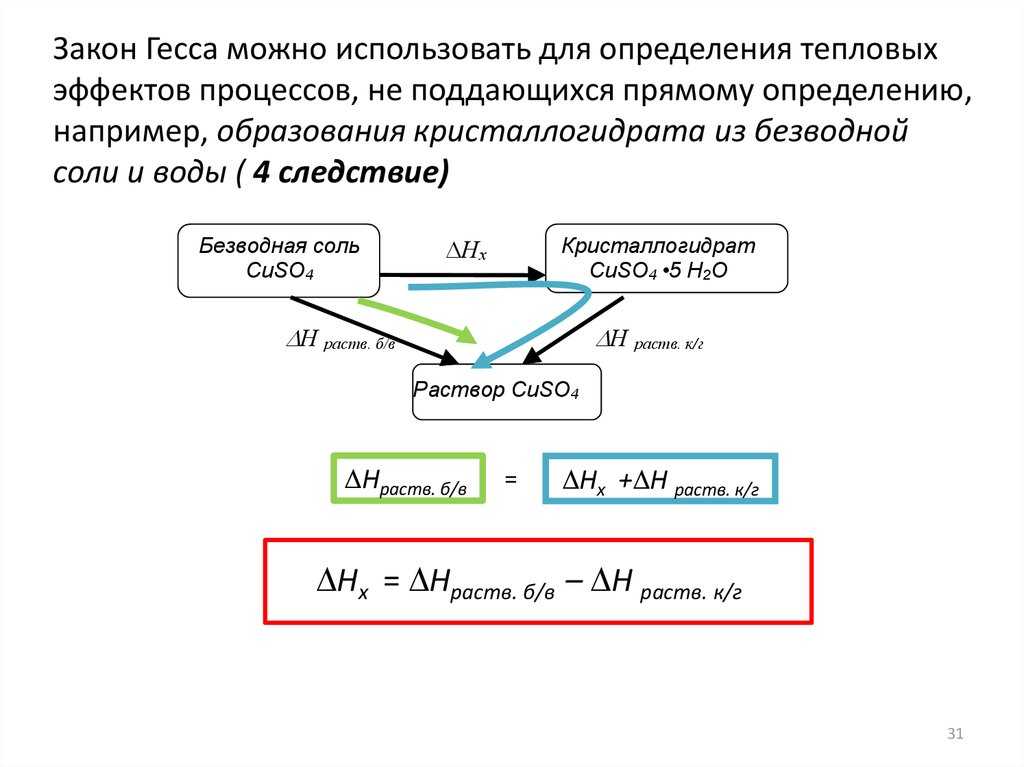
Закон Гесса можно использовать для определения тепловыхэффектов процессов, не поддающихся прямому определению,
например, образования кристаллогидрата из безводной
соли и воды ( 4 следствие)
Безводная соль
СuSO4
Нх
Кристаллогидрат
CuSO4 •5 H2O
Н раств. б/в
Н раств. к/г
Раствор СuSO4
Нраств. б/в
=
Нх + Н раств. к/г
Нх = Нраств. б/в – Н раств. к/г
31
32.
5. * Зависимость теплового эффекта реакцииот температуры. Закон Кирхгофа
В общем случае Н зависит от Т и P. Влиянием P обычно
пренебрегают. Влияние T описывает закон Кирхгофа:
dH T0
CP0
dT P
Дифференциальная форма
записи
Изменение теплового эффекта
при изменении температуры
(при постоянном давлении)
равно ∆С0P298
Считая ΔС0p не зависящим от Т можно вычислять :
тепловой эффект при температуре Т (не 298)
Нr0T = Нr0298 + ∆С0P298 (T – 298). Интегральная форма записи
32
33.
ПримерВычислим Нr реакции получения газообразного хлороформа
при 600 К.
CH4 (г) + 3Сl2(г) = CHCl3(г) + 3 HCl(г)
0 –100,4
–92,3
Нf0298, –74,9
кДж/моль
С0P298, 44,10 35,77
78,11
29,2
Дж/(моль∙К)
Решение
Нr0600 = Нr0298 + ∆Сp(600 – 298).
Нr0298=(3∙(–92,3)+(–100,4))–(3∙0 + (–74,9)) = –302,4 кДж/моль =
–302400 Дж/моль,
∆С0P298 = (3∙29,2 + 78,11) – (3∙35,77 + 44,10) = 14,3 Дж/(моль∙К),
Нr0600 = –302400 + 14,3∙(600 – 298) = –298080 Дж/моль = –298,1
33
кДж/моль
34.
dHdT
0
T
CP0
P
.
∆С0P - температурный коэффициент
реакции.
Если ∆С0P298 > 0 то Н с повышением температуры
алгебраически возрастает (становится более
положительным);
∆С0P298 < 0 то Н уменьшается с температурой
34


























 Химия
Химия








