Похожие презентации:
Химическая термодинамика
1. Химическая термодинамика
2.
Химическаятермодинамика
рассматривает
энергетические аспекты
различных процессов и
определяет условия их
самопроизвольного
протекания.
3.
4.
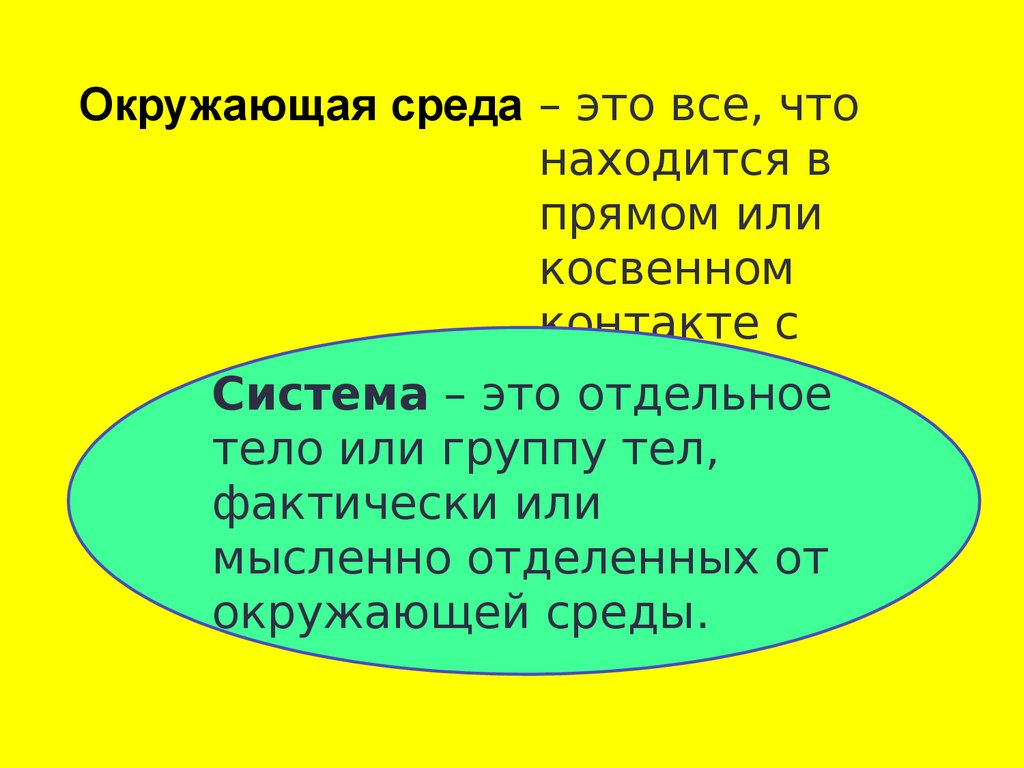
Окружающая среда – это все, чтонаходится в
прямом или
косвенном
контакте с
Система – этосистемой.
отдельное
тело или группу тел,
фактически или
мысленно отделенных от
окружающей среды.
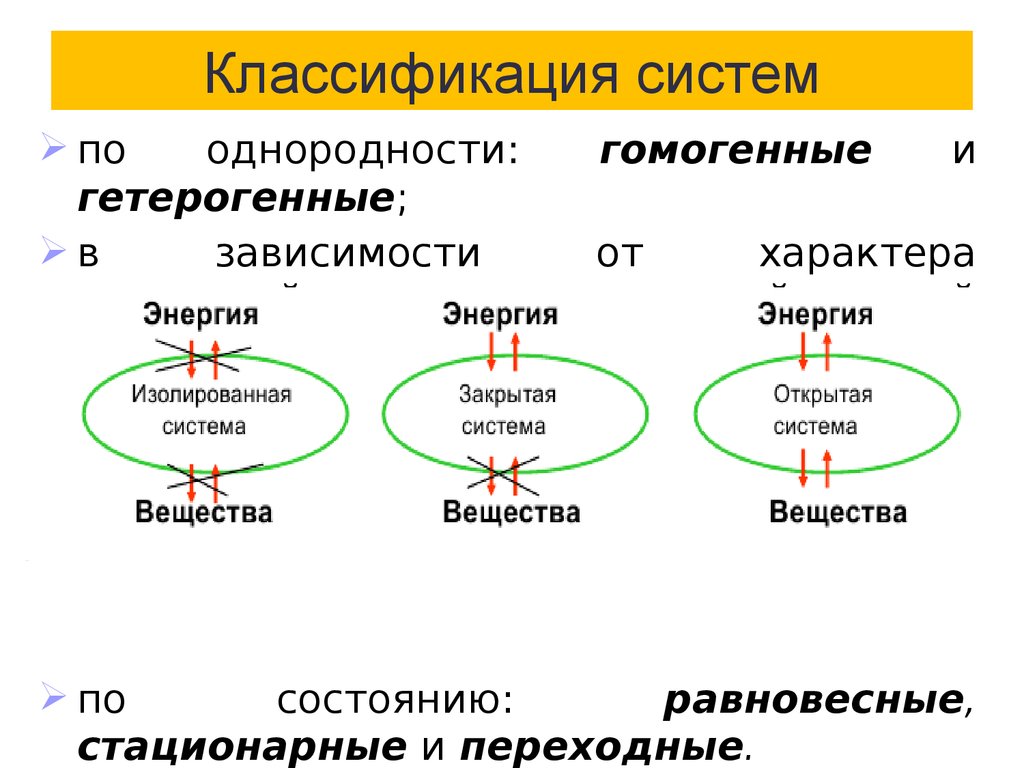
5. Классификация систем
пооднородности:
гомогенные
и
гетерогенные;
в
зависимости
от
характера
взаимодействия с окружающей средой
различают системы:
по
состоянию:
равновесные,
стационарные и переходные.
6.
Т/д равновесное состояние const всех свойств во времени иотсутствие потока вещества и
энергии в системе
Стационарное состояние const свойств во времени и
непрерывный обмен веществом и
энергией между системой и окружающей
средой
Переходное состояние изменение свойств системы во времени
7.
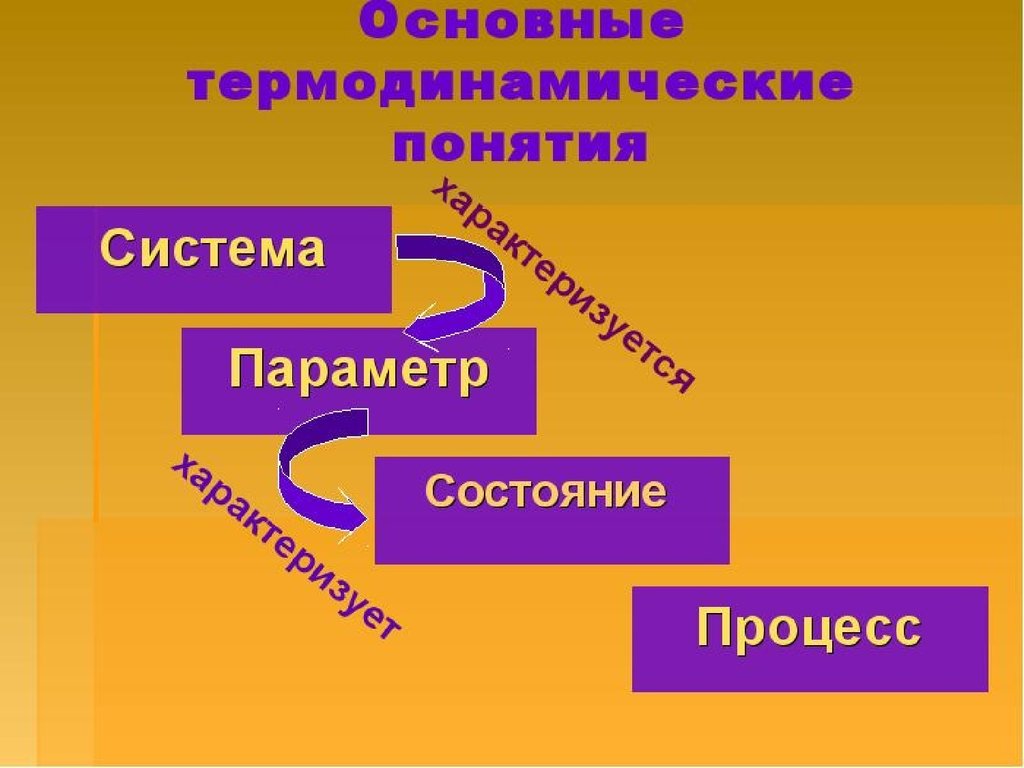
Совокупность всех физических ихимических свойств системы
называют состоянием системы.
Его характеризуют
термодинамическими
параметрами, которые бывают:
Интенсивные –которые не
зависят от массы (температура,
давление, плотность,
концентрация).
Экстенсивные - зависящие от
массы (объём, масса, внутренняя
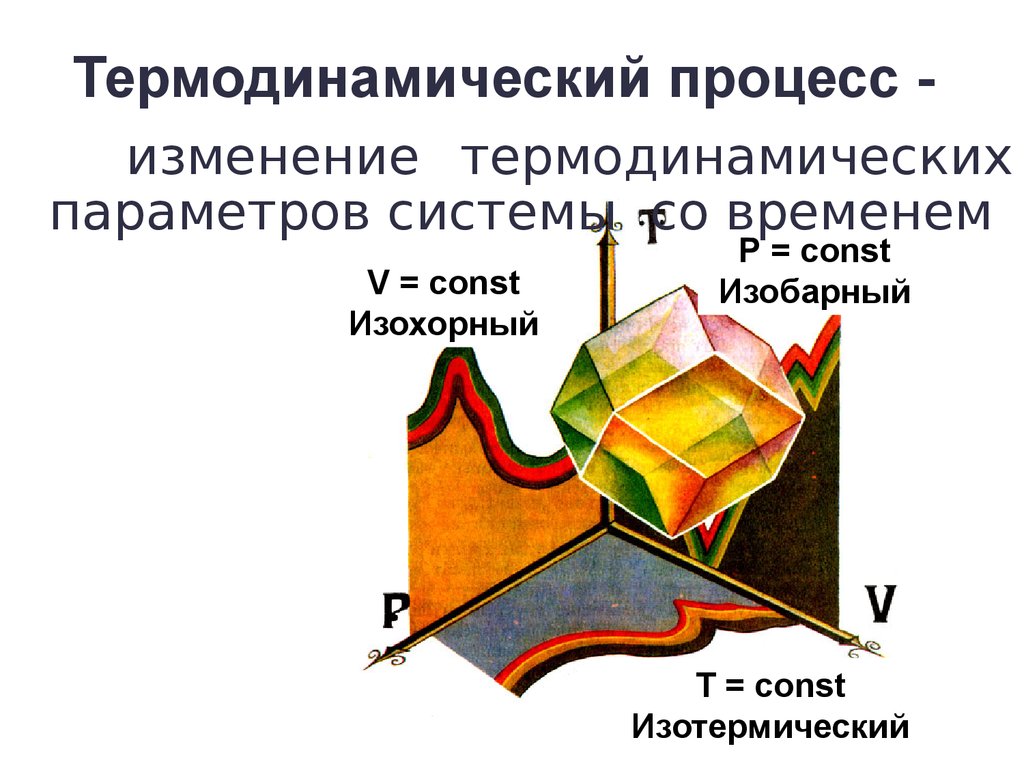
8. Термодинамический процесс -
Термодинамический процесс изменение термодинамическихпараметров системы со временем
V = const
Изохорный
Р = const
Изобарный
Т = const
Изотермический
9.
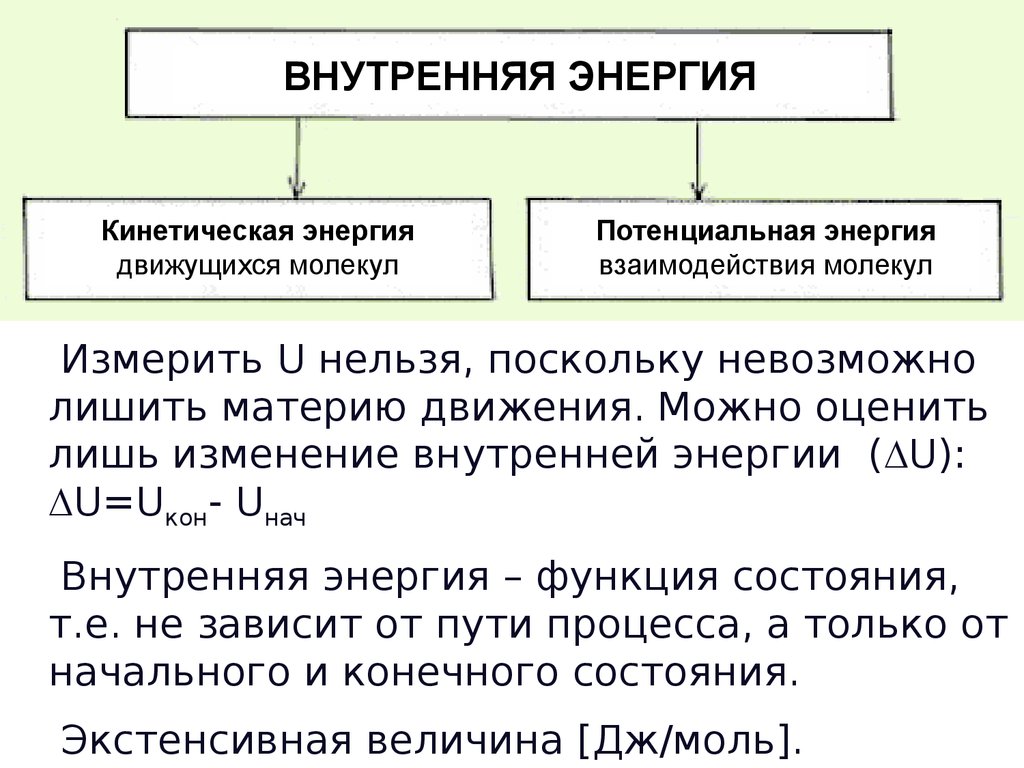
ВНУТРЕННЯЯ ЭНЕРГИЯКинетическая энергия
движущихся молекул
Потенциальная энергия
взаимодействия молекул
Измерить U нельзя, поскольку невозможно
лишить материю движения. Можно оценить
лишь изменение внутренней энергии ( U):
U=Uкон- Uнач
Внутренняя энергия – функция состояния,
т.е. не зависит от пути процесса, а только от
начального и конечного состояния.
Экстенсивная величина [Дж/моль].
10. Теплота и работа
Теплота (Q) - хаотический вид передачиэнергии
Работа (W) – направленный вид
передачи энергии
Экстенсивные параметры [Дж/моль].
Работа и теплота являются функциями
процесса, зависят от пути процесса.
11. Первое начало термодинамики
12. Формулировки
1.Энергия не возникает изничего и не исчезает, она
превращается из одного
вида в другой в строго
эквивалентных
количествах.
2.Энергия изолированной системы
постоянна.
3. Вечный двигатель I рода
невозможен, т.е. машина,
производящая работу без затраты
13.
Математический вид:Q= U + W= U + p V
Количество теплоты, подведенное к
системе,
идет
на
изменение
внутренней
энергии
и
на
совершение работы.
14. Первый закон термодинамики в применении к некоторым процессам
Q= U + W= U +p V
Изотермические процессы
(Т = const): U =
const, то U = 0.
QT = W
Изохорные процессы (V = const): V = const, то
V = 0.
QV =
U
Изобарные процессы (р = const):
QР = U + р V = Н
15.
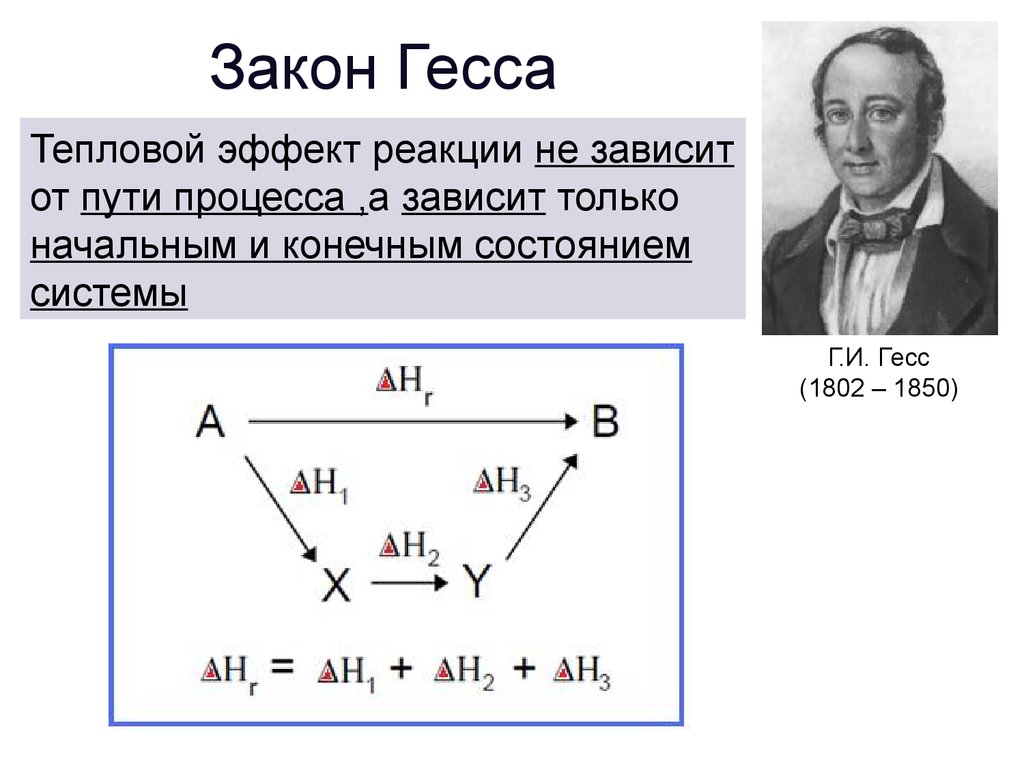
Закон ГессаТепловой эффект реакции не зависит
от пути процесса ,а зависит только
начальным и конечным состоянием
системы
Г.И. Гесс
(1802 – 1850)
16. Следствия из закона Гесса
Нр-ии = ν H0обр(прод) ν H0обр(исх)1.
Стандартной энтальпией образования
( H0обр ) - тепловой эффект (изменение
энтальпии ) реакции образования
1 моль
0
Са + С +вещества
3/2О2 = СаСО
3, H обр
данного
из простых
веществ в
стандартных
условиях.
(СаСО3)
Стандартные энтальпии образования
простых веществ в устойчивом агрегатном
состоянии
равны нулю.
0
0
0
H обр(N2) = 0; H
#0
(О2) = 0; H
обр
(О3)
обр
17.
2.Нр-ии= ν H0сгор(исх) - ν H0сгор
(прод)
Стандартная энтальпия сгорания
( H0сгор ) - тепловой эффект (изменение
энтальпии) реакции сгорания в атмосфере
Стандартные
энтальпии
сгорания
высших
кислорода
1 моля
вещества
до высших
оксидов равны нулю.
оксидов.
H0сгор(СО2) = 0; H0сгор(СО)
#0
18. Второе начало термодинамики
19.
I закон термодинамики дает данныелишь о тепловыделении и говорит о
превращении одной формы энергии в
другую.
II закон термодинамики дает
возможность определить
направление самопроизвольного
Cамопроизвольный
процесса и пределы его протекания.
– процесс, который
совершается без
внешних
воздействий на
систему.
20. Формулировки второго закона термодинамики
Теплота не может самопроизвольнопереходить от более холодного тела к
более горячему (Клаузиус).
Вечный двигатель II рода
невозможен, т.е. нельзя
изобрести тепловую
машину, превращающую
всю теплоту в работу, без
передачи части ее
холодильнику (В.Оствальд).
21.
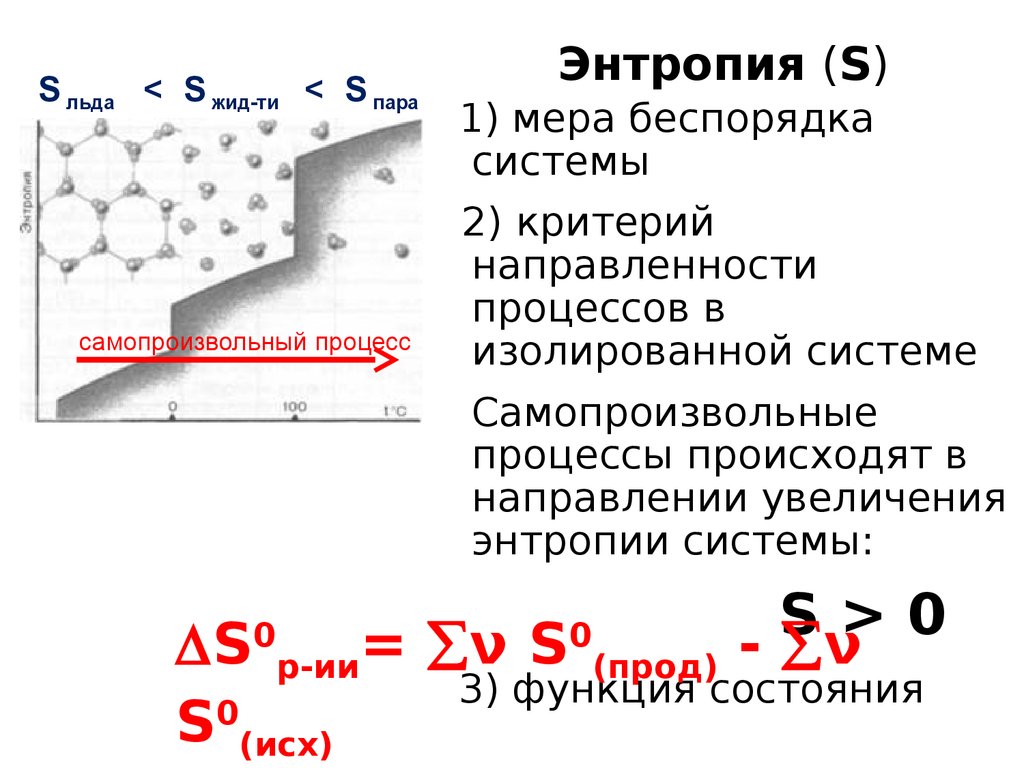
S льда < S жид-ти < S парасамопроизвольный процесс
Энтропия (S)
1) мера беспорядка
системы
2) критерий
направленности
процессов в
изолированной системе
Самопроизвольные
процессы происходят в
направлении увеличения
энтропии системы:
S>0
- ν
S
= ν S
3) функция состояния
S0(исх)
0
р-ии
0
(прод)
22. Термодинамические потенциалы
критерии направленности процессов в открытойи закрытой системах:
энергия Гиббса ( G
0)
энергия Гельмгольца
( AV0 ,Т 0)
0
Р ,Т
Расчет энергии Гиббса:
1)
0
G р ции
0
0
G
G
прод
исх
2) По уравнению Гиббса – Гельмгольца:
G р0 ии H р0 ии T S р0 ии
3) По уравнению изотермы:
G
0
р ии
R T ln K р
23.
Биохимические реакции,сопровождающиеся уменьшением
энергии Гиббса, называются
экзергоническими реакциями.
Биохимические реакции,
сопровождающиеся увеличением
энергии Гиббса, называются
эндергоническими, и они не
возможны без внешнего подвода
энергии.
В живых организмах
эндэргонические реакции
















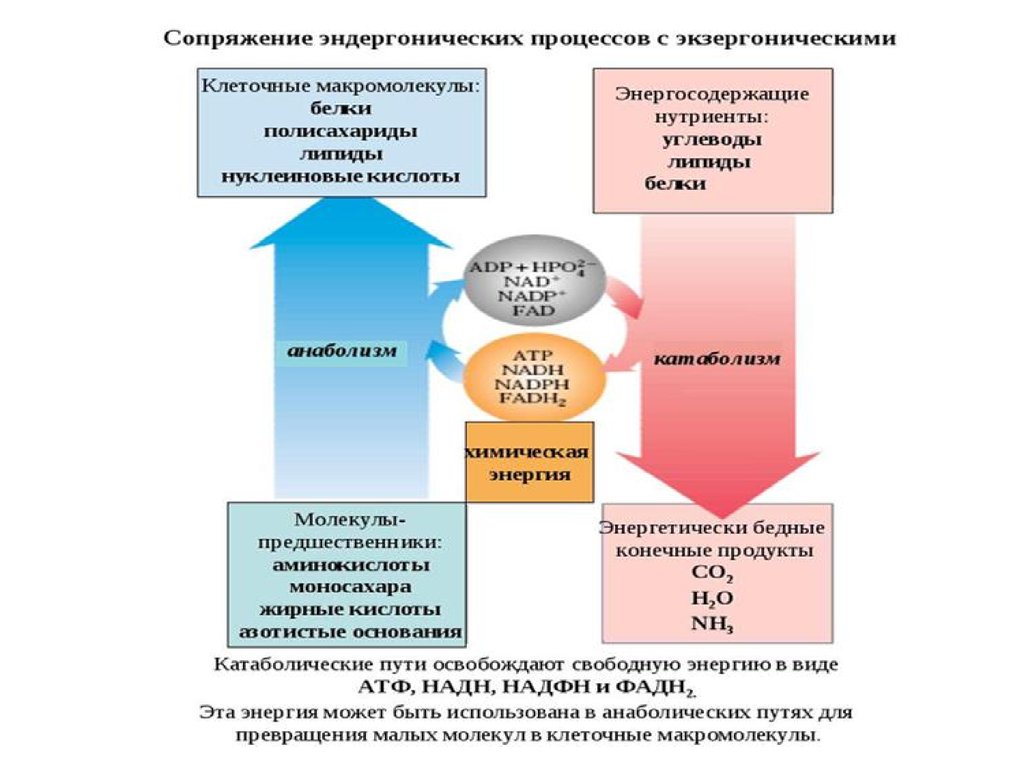
 Химия
Химия








