Похожие презентации:
Молекулярная биофизика. Пространственная организация биополимеров
1.
Раздел: Молекулярная биофизикаТема: Пространственная
организация биополимеров
2.
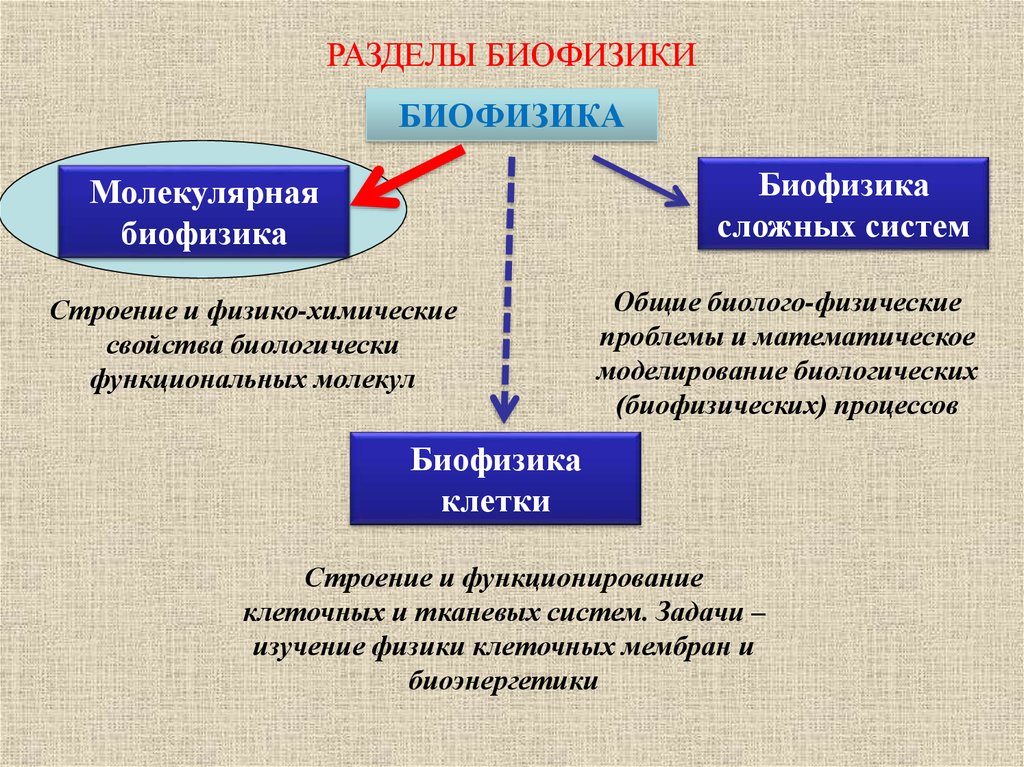
РАЗДЕЛЫ БИОФИЗИКИБИОФИЗИКА
Биофизика
сложных систем
Молекулярная
биофизика
Строение и физико-химические
свойства биологически
функциональных молекул
Общие биолого-физические
проблемы и математическое
моделирование биологических
(биофизических) процессов
Биофизика
клетки
Строение и функционирование
клеточных и тканевых систем. Задачи –
изучение физики клеточных мембран и
биоэнергетики
3. Молекулярная биология (развитие генетики и цитологии)
• Объекты исследования:биологические молекулы (белки,
нуклеиновые кислоты, углеводы), их
строение и свойства
• Методы исследования:
- Биологические
- Физические
- Химические
4. Молекулярная биофизика
Область молекулярнойбиологии
Область молекулярной
физики
Изучает:
Исследует:
Строение и функции
биологических объектов и
систем на основе физических
методов и подходов
Молекулярно-физические
основы важнейших
жизненных процессов
5.
Биополимеры–
это
класс
полимеров,
встречающихся в природе в естественном виде и
входящие в состав живых организмов. К
биополимерам относятся белки, нуклеиновые
кислоты, полисахариды. Биополимеры состоят из
одинаковых (или разных) звеньев – мономеров.
Мономеры белков – аминокислоты, нуклеиновых
кислот – нуклеотиды, в полисахаридах –
моносахариды.
Выделяют два типа биополимеров – регулярные
(некоторые полисахариды) и нерегулярные
(белки,
нуклеиновые
кислоты,
некоторые
полисахариды).
6.
Биополимеры обладают рядомособенностей:
1. Состоят из большого числа
атомов
2. Имеют большое число
функциональных групп
3. Значительное число степеней
свободы
7.
Подвижность полимеров может иметьстатистический и детерминированный
(механический) характер.
Статистическая подвижность биополимера это
варианты отдельных элементов структуры, повороты
вокруг одинарных связей. Форма и размеры
молекулы зависит от статистической подвижности
биополимера.
Детерминированный характер движения
обуславливает функциональные изменения в молекуле.
Задача молекулярной биофизики: исходя из характера
взаимодействия атомных групп, раскрыть природу
внутримолекулярной динамики макромолекул
8.
Двойственность свойств макромолекулСтатистические
Детерминистические
Большое число
внутримолекулярных
степеней свободы
вследствие теплового
движения, поворотов и
вращения вокруг
единичных связей
Химические связи,
ближние и дальние
взаимодействия
Задача молекулярной биофизики: исходя из характера
взаимодействия атомных групп, раскрыть природу
внутримолекулярной динамики макромолекул.
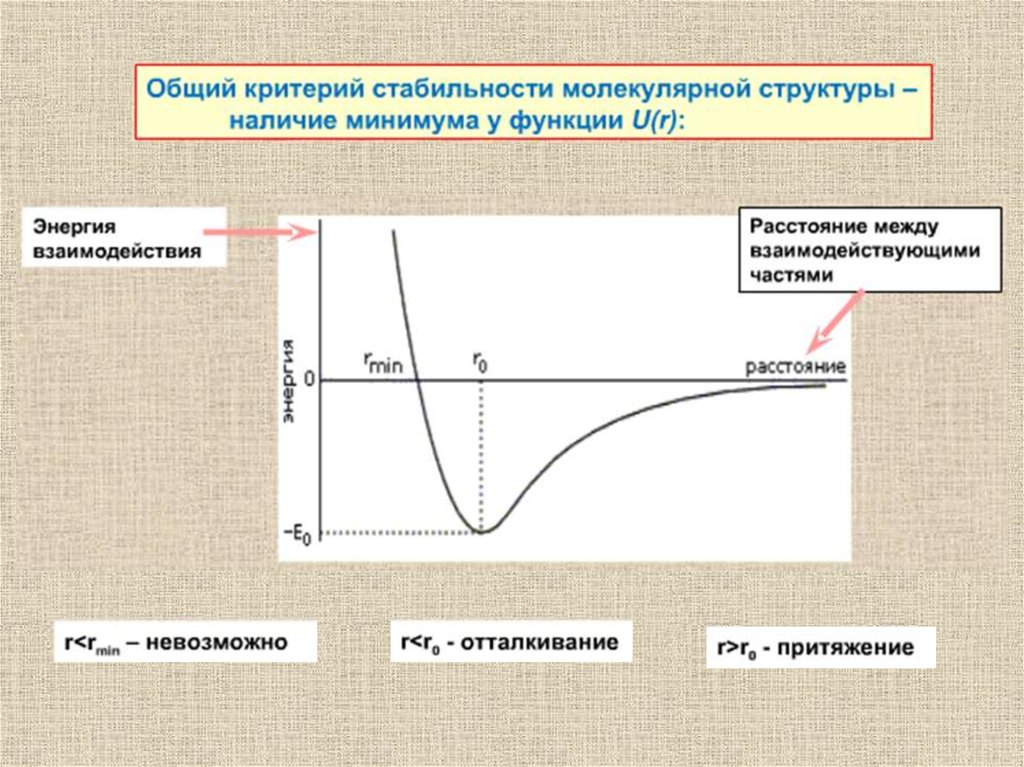
9. Гибкость полимерной цепи
Какова характерная форма молекулярной цепи в различныхполимерных веществах (какова конформация)?
Прямолинейная
конформация
Конформация
запутанного клубка
10. Модели гибкости полимерных цепей
• Персистентнаямодель
(червеобразная)
h=N*l
• Свободно сочлененная модель
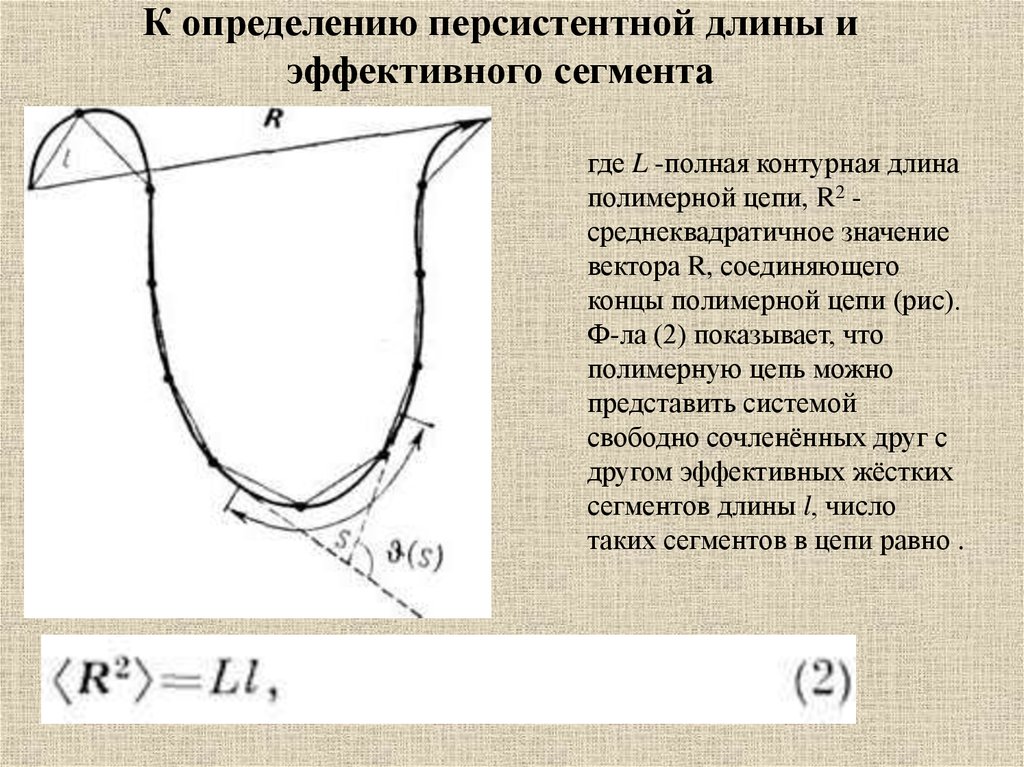
11.
К определению персистентной длины иэффективного сегмента
где L -полная контурная длина
полимерной цепи, R2 среднеквадратичное значение
вектора R, соединяющего
концы полимерной цепи (рис).
Ф-ла (2) показывает, что
полимерную цепь можно
представить системой
свободно сочленённых друг с
другом эффективных жёстких
сегментов длины l, число
таких сегментов в цепи равно .
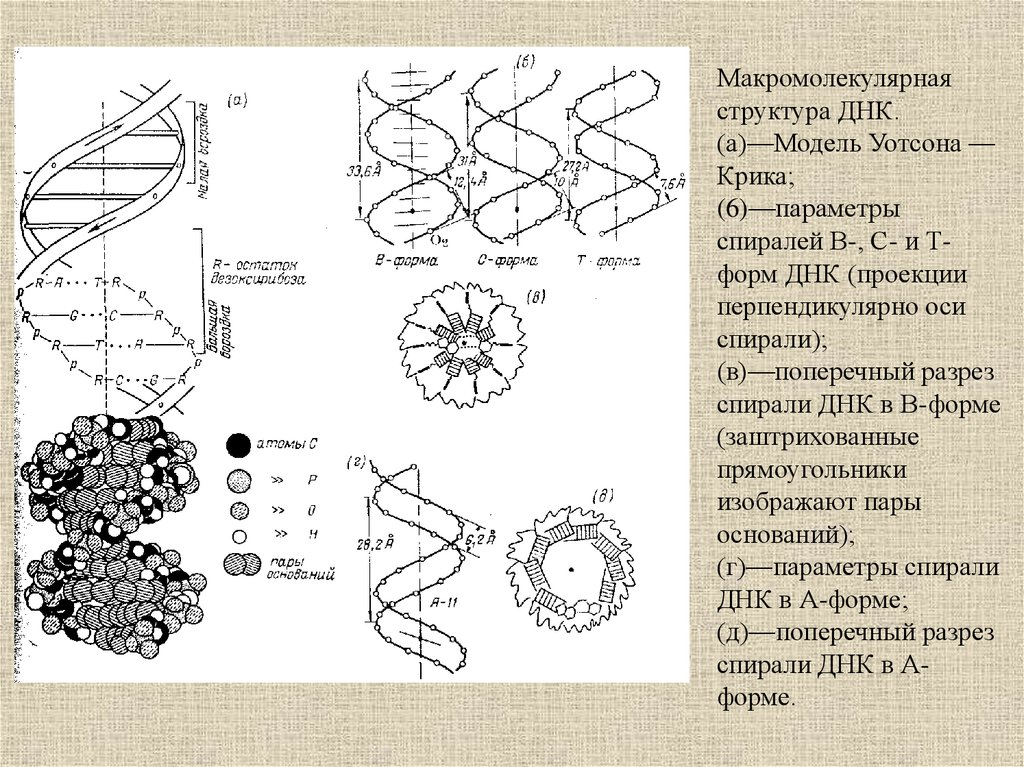
12.
Макромолекулярнаяструктура ДНК.
(а)—Модель Уотсона —
Крика;
(6)—параметры
спиралей В-, С- и Тформ ДНК (проекции
перпендикулярно оси
спирали);
(в)—поперечный разрез
спирали ДНК в В-форме
(заштрихованные
прямоугольники
изображают пары
оснований);
(г)—параметры спирали
ДНК в А-форме;
(д)—поперечный разрез
спирали ДНК в Аформе.
13.
14.
Полимерная цепь, гдевзаимодействуют только
соседние звенья
Клубок
Свойства клубка
Переход между конформациями в результате
микроброуновского движения частей цепи.
He обладает внутренней структурой, все время «дышит» с
амплитудой порядка размера клубка.
Взаимное положение отдельных частей подчиняется
статистическим закономерностям.
15.
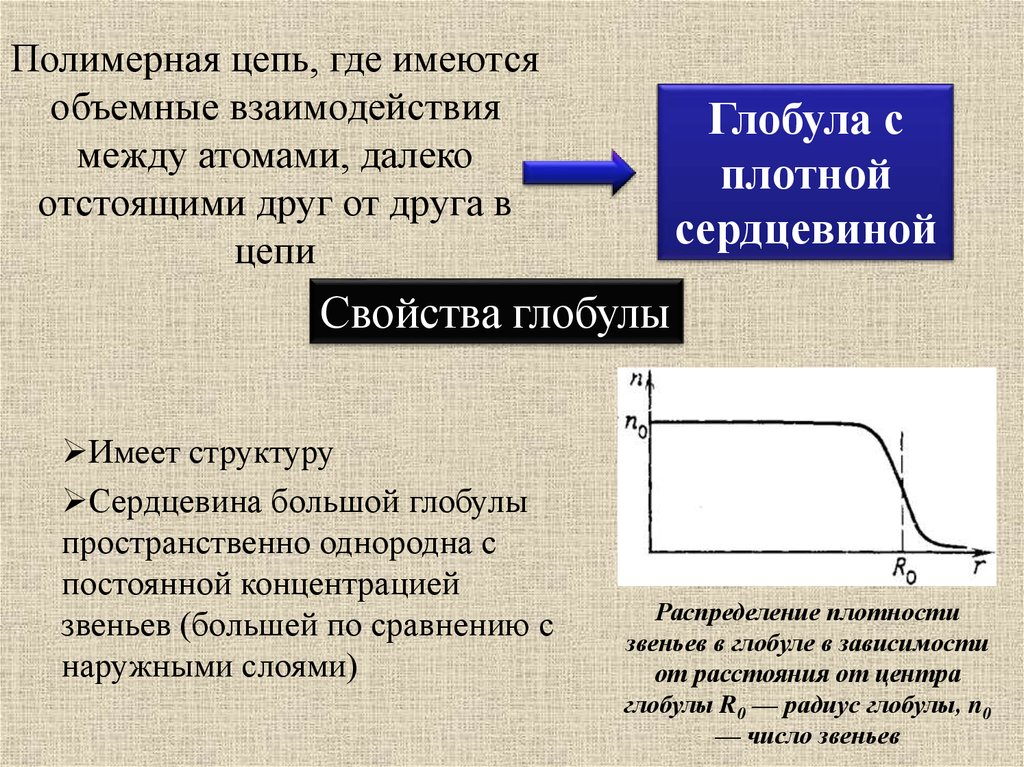
Полимерная цепь, где имеютсяобъемные взаимодействия
между атомами, далеко
отстоящими друг от друга в
цепи
Глобула с
плотной
сердцевиной
Свойства глобулы
Имеет структуру
Сердцевина большой глобулы
пространственно однородна с
постоянной концентрацией
звеньев (большей по сравнению с
наружными слоями)
Распределение плотности
звеньев в глобуле в зависимости
от расстояния от центра
глобулы R0 — радиус глобулы, n0
— число звеньев
16.
17.
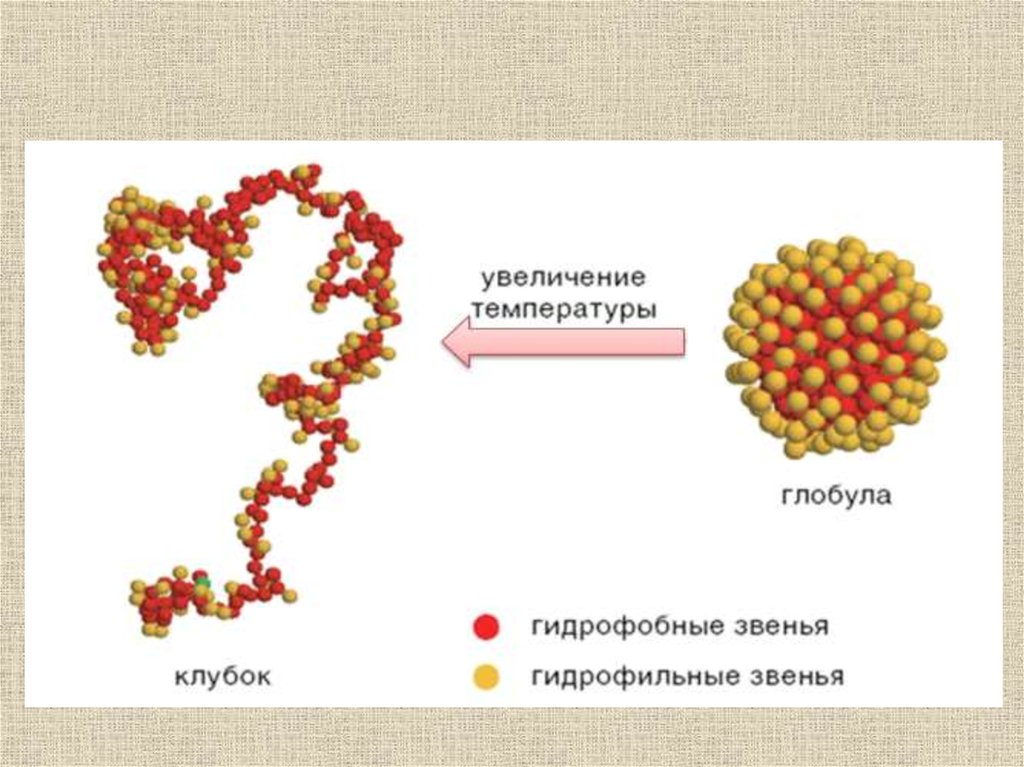
Переходы глобула-клубок(порядок-беспорядок)
Происходят в относительно малом интервале
температур – подобны фазовым переходам 1-го
рода (напр. лед-вода)
Сопровождаются значительным изменением
теплоемкости макромолекулы – структурные
перестройки
18.
Объёмные взаимодействия19.
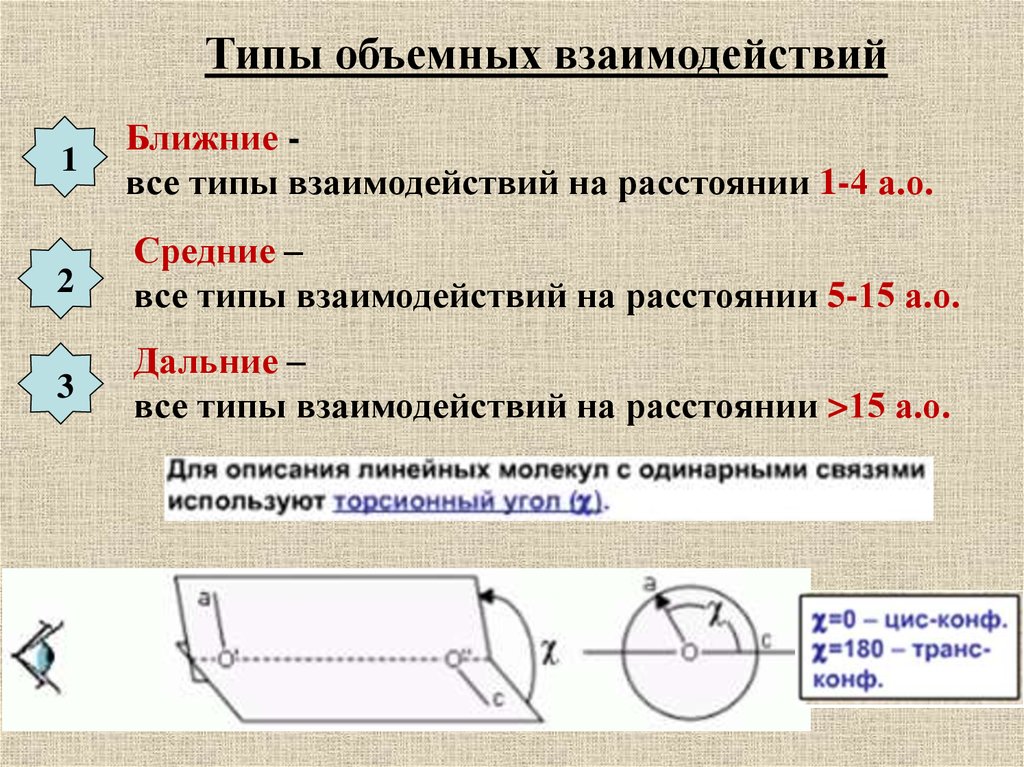
Типы объемных взаимодействий1
Ближние все типы взаимодействий на расстоянии 1-4 а.о.
2
Средние –
все типы взаимодействий на расстоянии 5-15 а.о.
3
Дальние –
все типы взаимодействий на расстоянии >15 а.о.
20.
21.
4.Гидрофобные взаимодействия
22.
23.
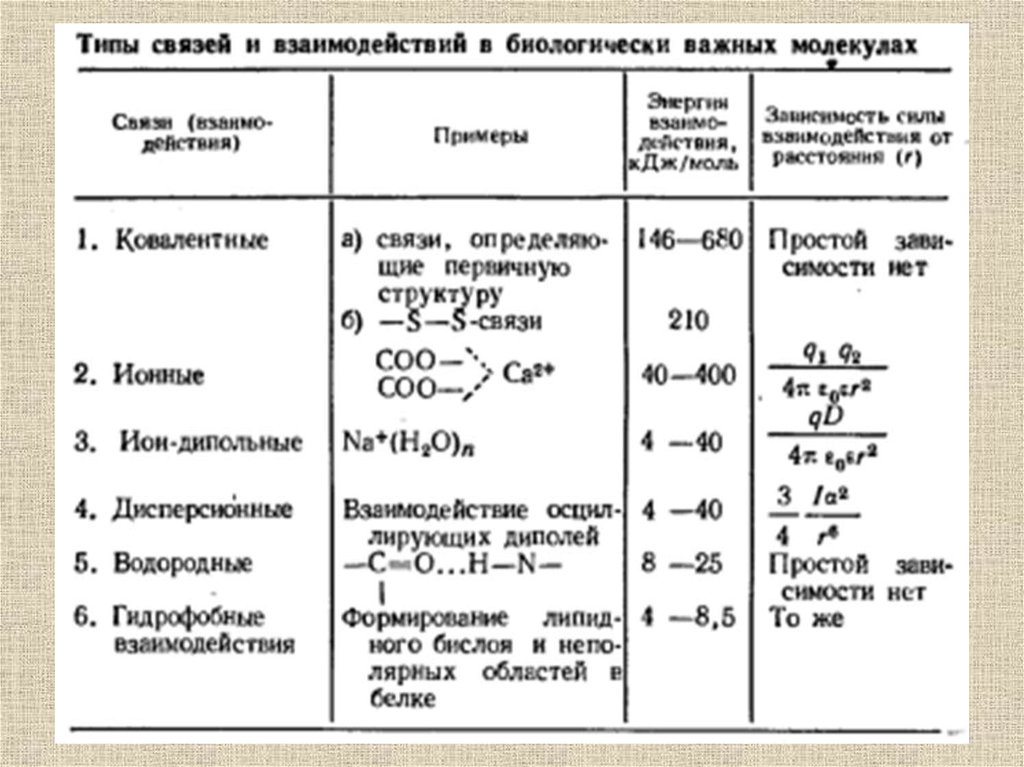
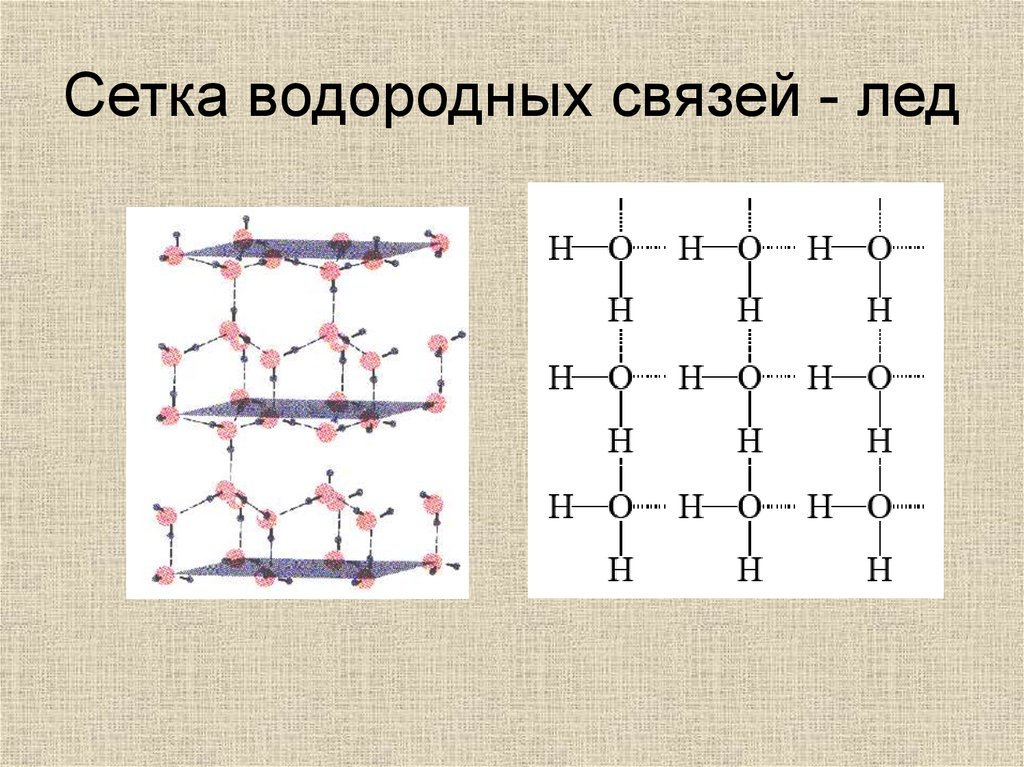
Водородная связь - разновидность донорноакцепторной связи, невалентное взаимодействиемежду атомом водорода Н, ковалентно связанным
с атомом А группы А-Н (О-H, N-H, F-H, Cl-H)
молекулы RA-H и электроотрицательным атомом
В (O, N, F, Cl) другой молекулы (или
функциональной группы той же молекулы) BR‘ за
счет электростатических и ван-дер-ваальсовых
взаимодействий). Результатом таких
взаимодействий являются комплексы RA-H ***
BR' различной степени стабильности, в которых
атом водорода выступает в роли «моста»,
связывающего фрагменты RA и BR'.
24.
Особенностями водородной связи, по которым еевыделяют в отдельный вид, является:
1. Не очень высокая прочность (энергия составляет
от 4 до 30 кДж/моль).
2. Высокая распространенность и важность в
органических соединениях.
3. Малые размеры
4. Отсутствие дополнительных электронов у
водорода
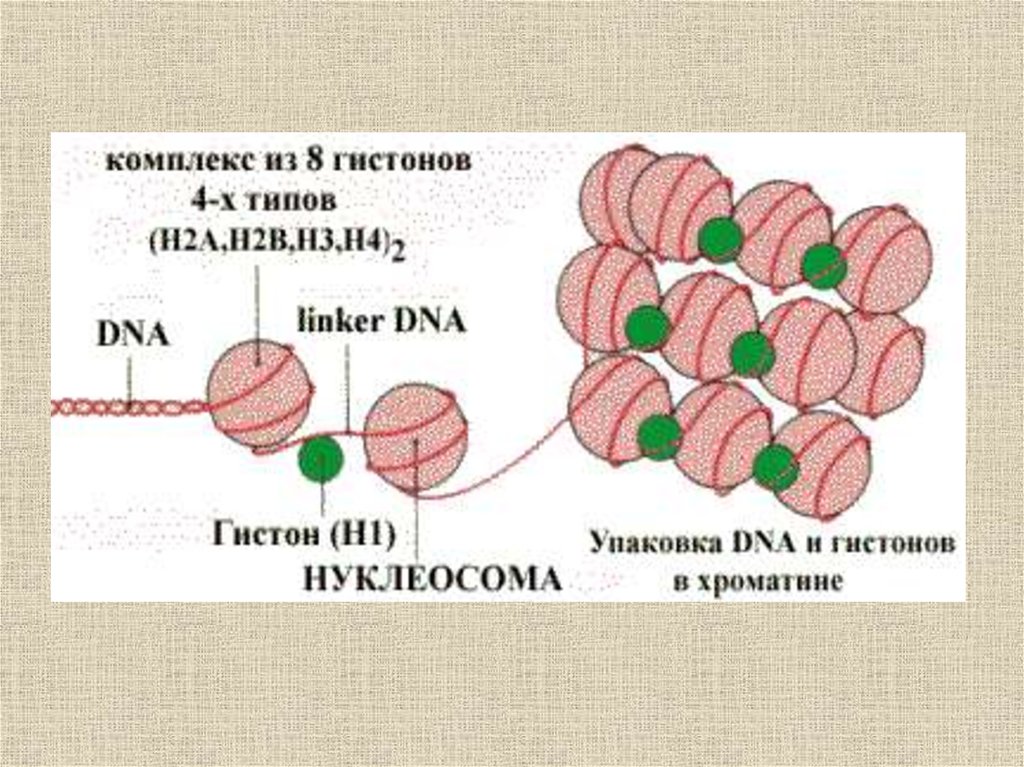
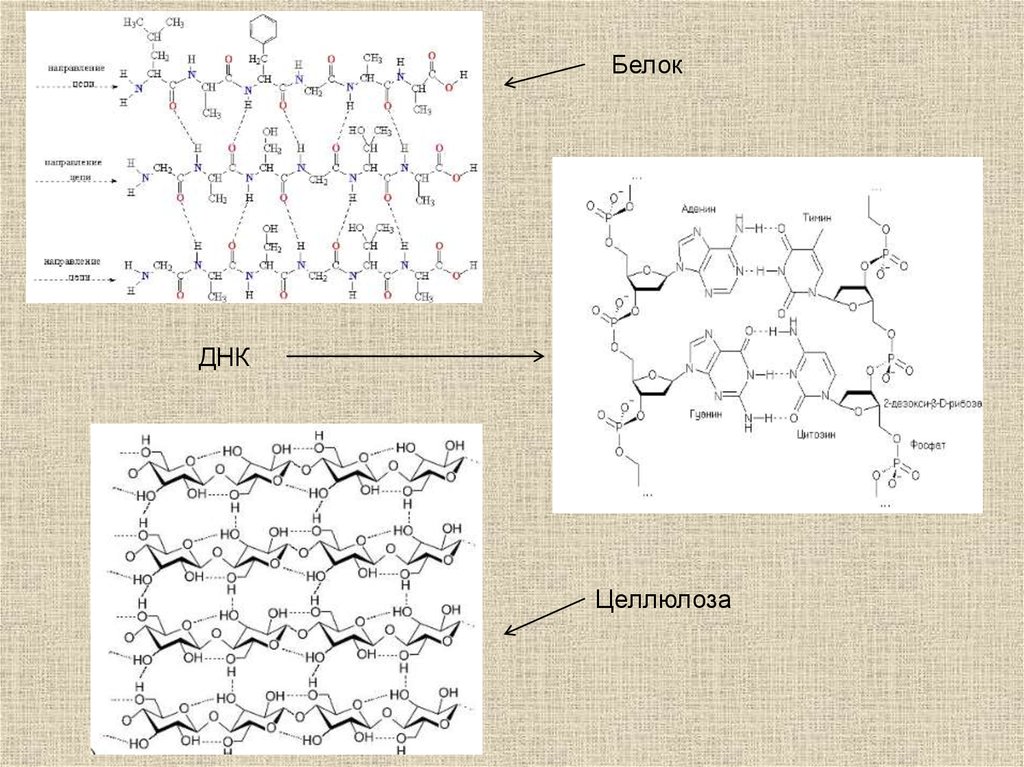
Водородные связи во многом определяют строение и
свойства воды, играют важнейшую роль в
формировании структуры белков и ДНК.
25.
БелокДНК
Целлюлоза
26.
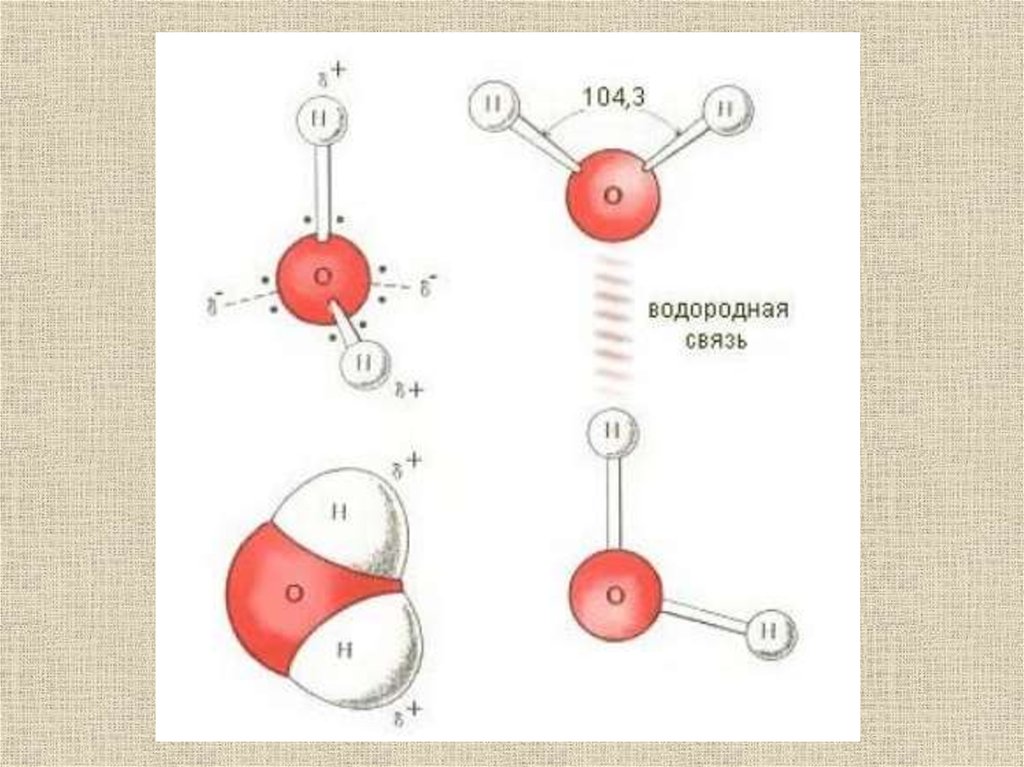
Молекула водыА . Кислород имеет р.электронные орбитами, оси которых
перпендикулярны друг другу.
Б . В силу отталкивания электронных облаков, угол между осями
р.орбиталей увеличивается от 90о до почти 120о. В результате молекула
воды приобретает структуру тетраэдра, в центре которого
расположетнатом кислорода, по двум углам . атомы водорода, а по двум
другим . вакансии, где электронные орбитали кислорода могут
взаимодействовать с атомами водорода соседних молекул воды, образуя
с ними водородные связи
27.
28.
Свойства молекулы воды1. Полярная жидкость: значительный
дипольный момент р 0,6*10-29 Клм;
высокая диэлектрическая
проницаемость 81
2. Между молекулами воды могут
образовываться водородные связи
Uтепловая (0,03эВ)<UН(0,1эВ)<Uковал(1-10эВ)
3. Свойства растворителя
29.
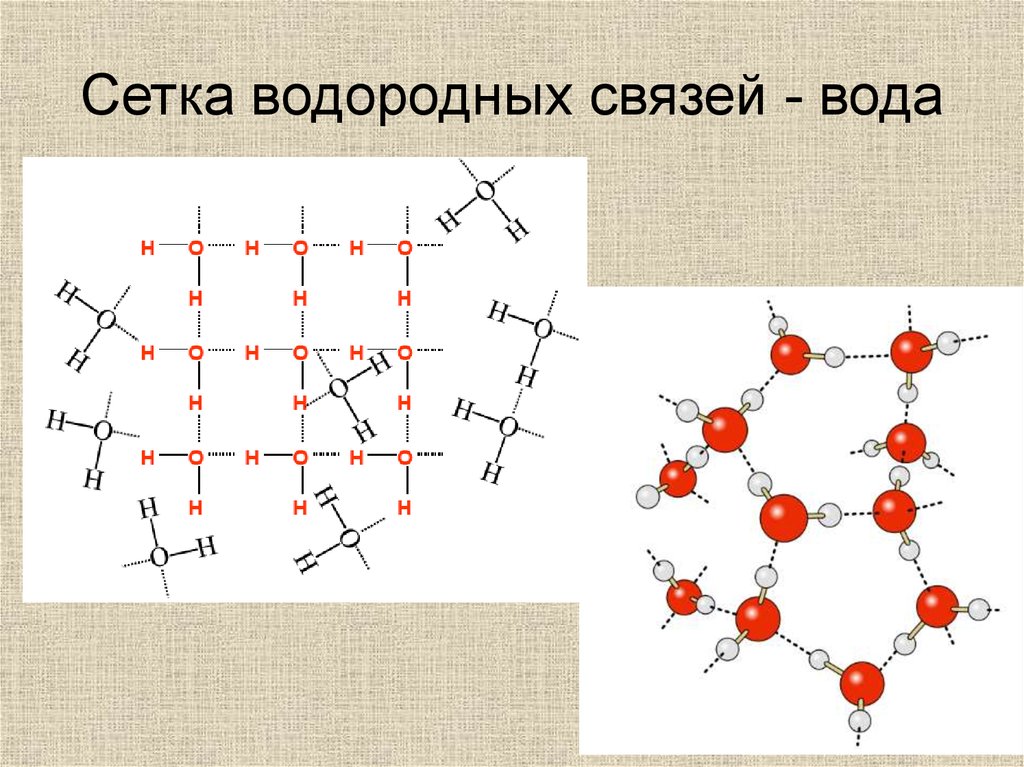
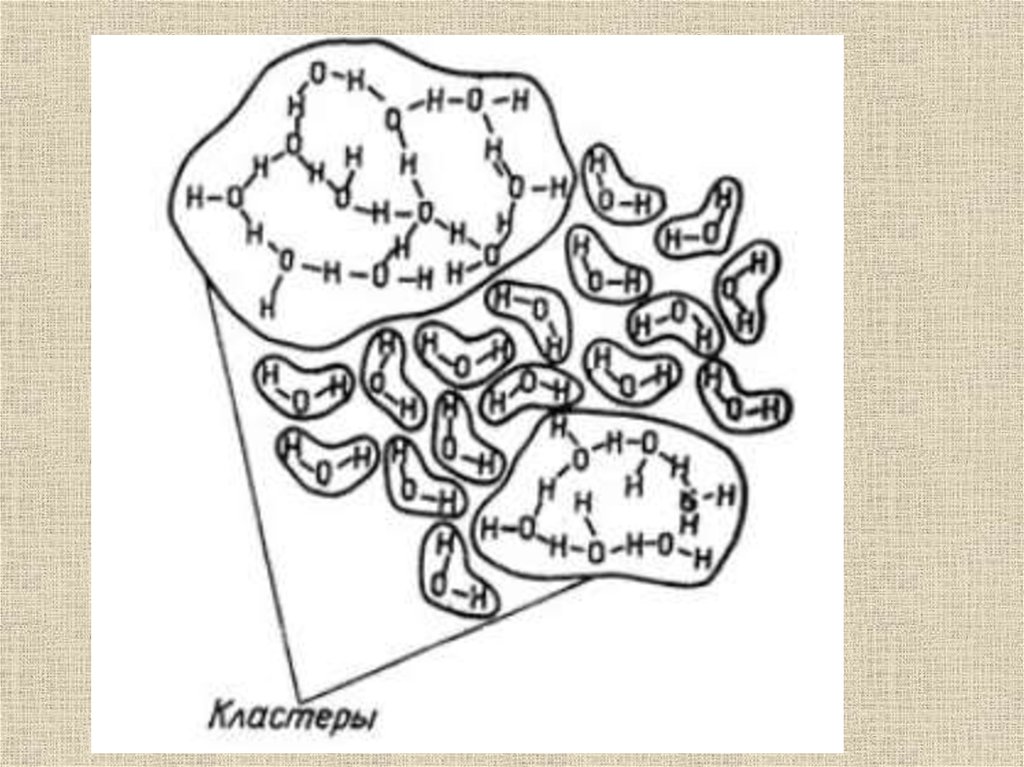
Сетка водородных связей - вода30.
Сетка водородных связей - лед31.
32.
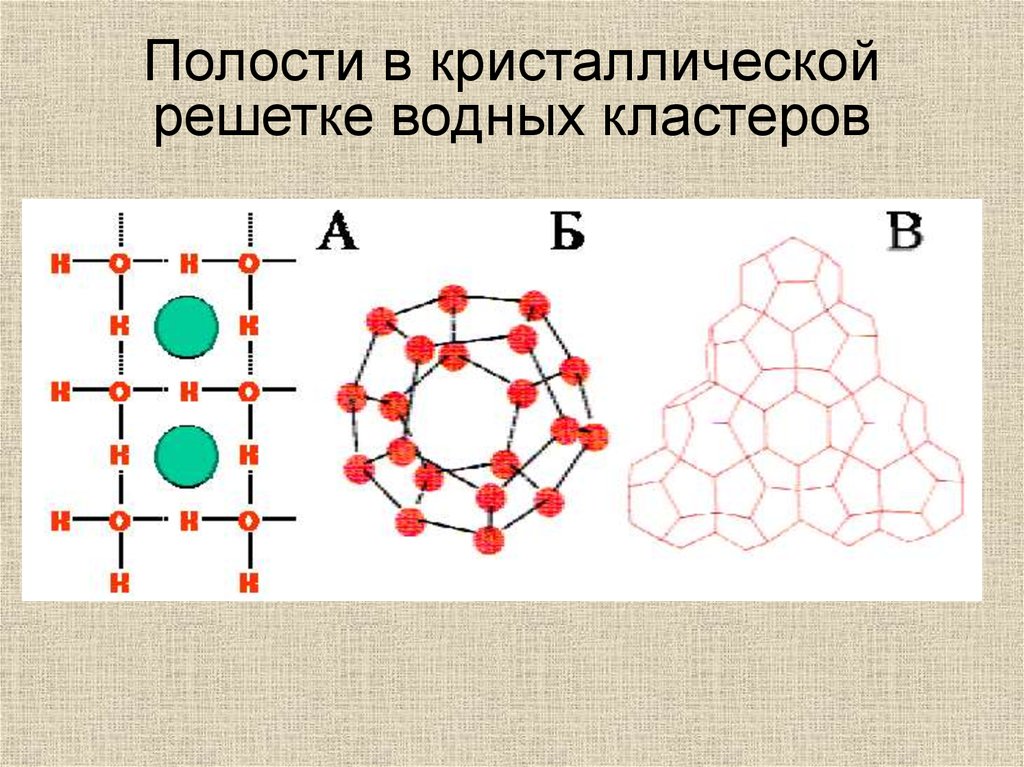
Полости в кристаллическойрешетке водных кластеров
33.
Гидрофобные взаимодействияспособствуют отталкиванию друг
от друга неполярных незаряженных
групп и молекул воды. Эти силы
определяют формирование
структуры биологических мембран
и глобулярных белков, а также
растворимость различных веществ
в воде
34.
35.
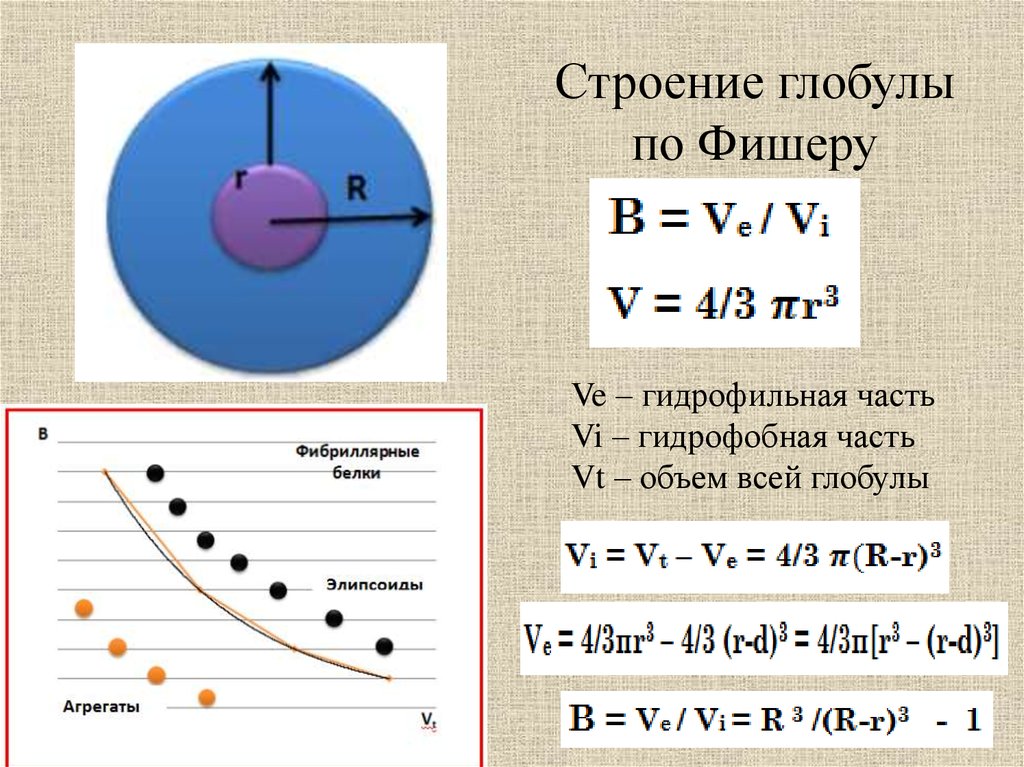
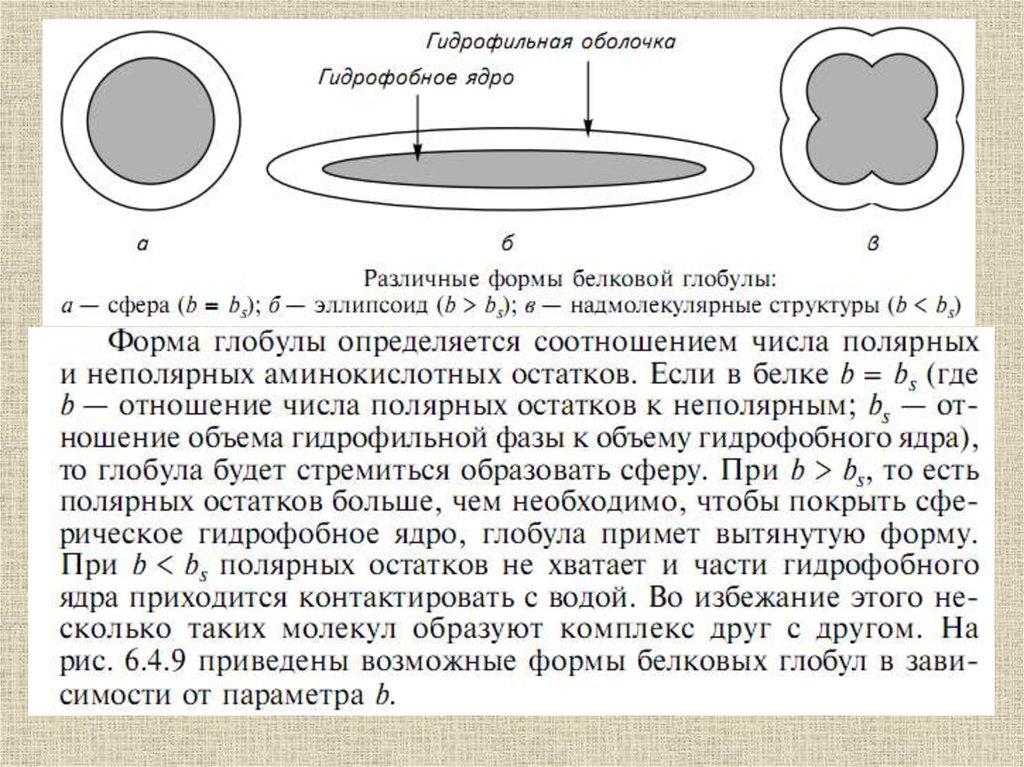
Строение глобулыпо Фишеру
Ve – гидрофильная часть
Vi – гидрофобная часть
Vt – объем всей глобулы
36.
37.
вещества• Полярные=
гидрофильные
• Неполярные =
гидрофобные
• Амфифильные
полярная «голова»+ неполярный «хвост»
38.
вода-растворительПолярное вещество
→притяжение
(диполь - дипольное
взаимодействие)
• Неполярное вещество
→ отталкивание
(искажения, разрыв Нсвязей)
• Амфифильное
вещество
39.
Вода + амфифильное веществовоздух
жир
вода
жир
вода
40.
Сферические мицеллы41.
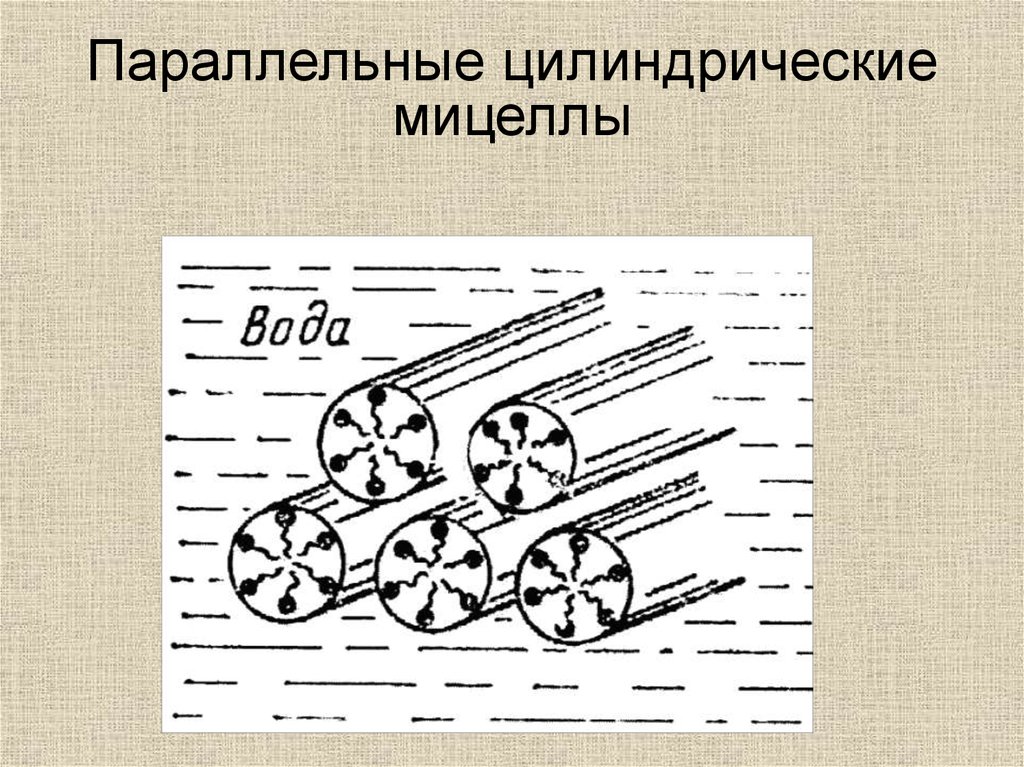
Параллельные цилиндрическиемицеллы
42.
Ламелли (параллельные слои)43.
Цилиндрические обращенныемицеллы
44.
Сферические мицеллы45.
Липосома46.
Электростатические силы(разновидность – ионные взаимодействия)
Электростатические взаимодействия образуются за счёт
взаимодействия электростатически - заряженных групп в
молекуле биополимера. В молекулах белков роль
электростатически- заряженных центров играют
положительно (аргинин, лизин, гистидин) и отрицательно
заряженные (глутаминовая и аспарагиновая кислота)
радикалы аминокислот. В молекуле ДНК
электростатически - Заряжены остатки фосфорной кислоты.
Энергия электростатических взаимодействий (U эл.стат)
составляет от 40 до 400 кДж/моль и вычисляется по формуле
где qi и qk – заряды на атомах (i и k), е – диэлектрическая постоянная (для
белков 3,5), rik– расстояние между атомами
47.
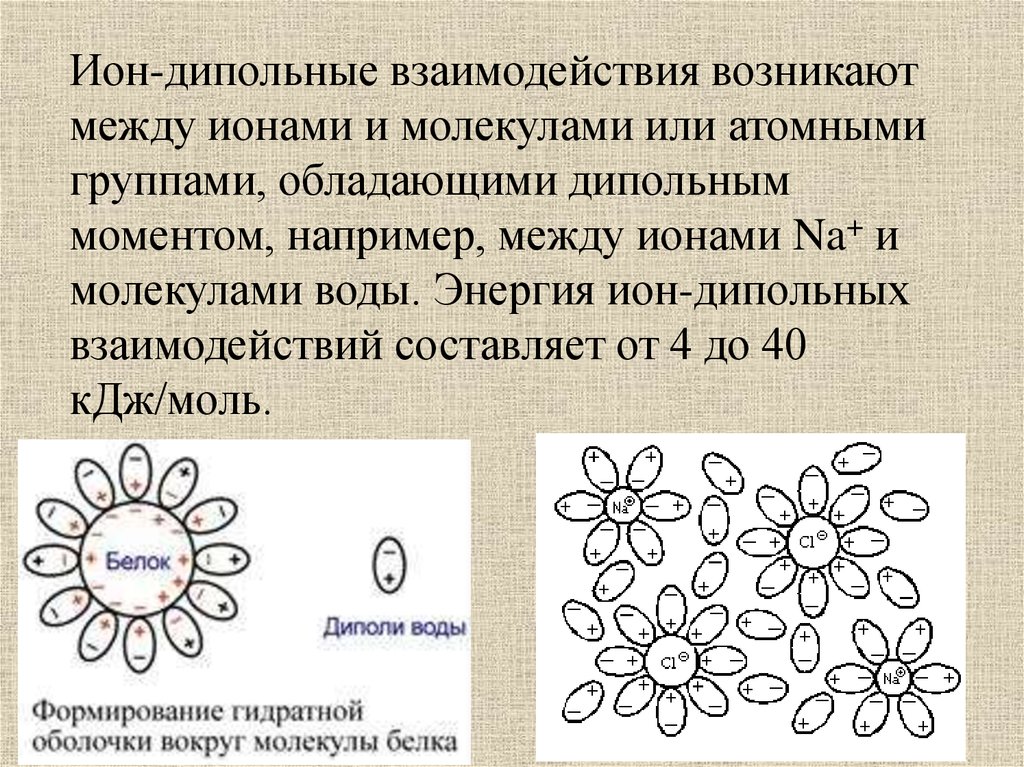
Ион-дипольные взаимодействия возникаютмежду ионами и молекулами или атомными
группами, обладающими дипольным
моментом, например, между ионами Na+ и
молекулами воды. Энергия ион-дипольных
взаимодействий составляет от 4 до 40
кДж/моль.
48.
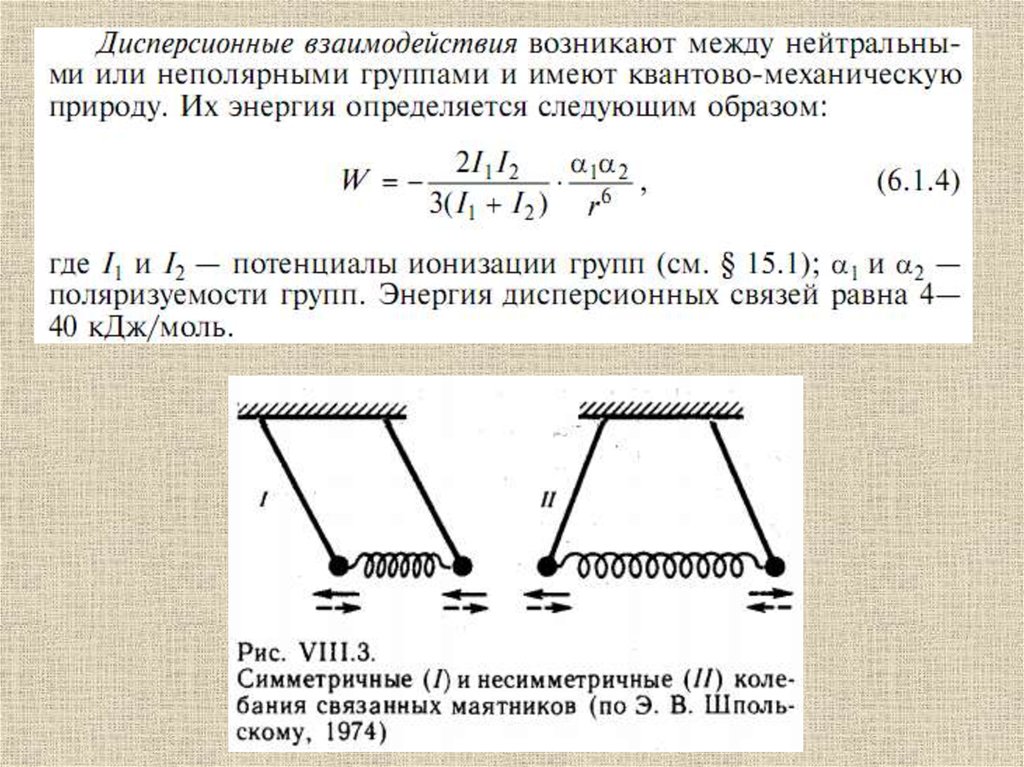
Атомы, находящиеся на небольшом расстояниидруг от друга, взаимодействуют за счет ван-дерваальсовых взаимодействий:
49.
Ориентационные (диполь-дипольные)связи возникают между молекулами,
обладающими дипольным моментом.
Энергия диполь-дипольного
взаимодействия равна:
50.
Молекула, имеющая постоянный дипольныймомент, способна индуцировать его в соседней
молекуле. Энергия индукционного
взаимодействия равна:
Энергия ориентационных и индукционных связей
составляет 0,4-4 кДж/моль (формулы справедливы для
точечных диполей).
51.
52.
53.
Конформация - такое распределениеатомов в пространстве, которое можно
изменить вращением вокруг одинарных
связей (возможен разрыв и образование
водородных связей).
Конфигурация - такое распределение
атомов в пространстве, которое можно
изменить только за счет разрыва и
образования химических связей.
54.
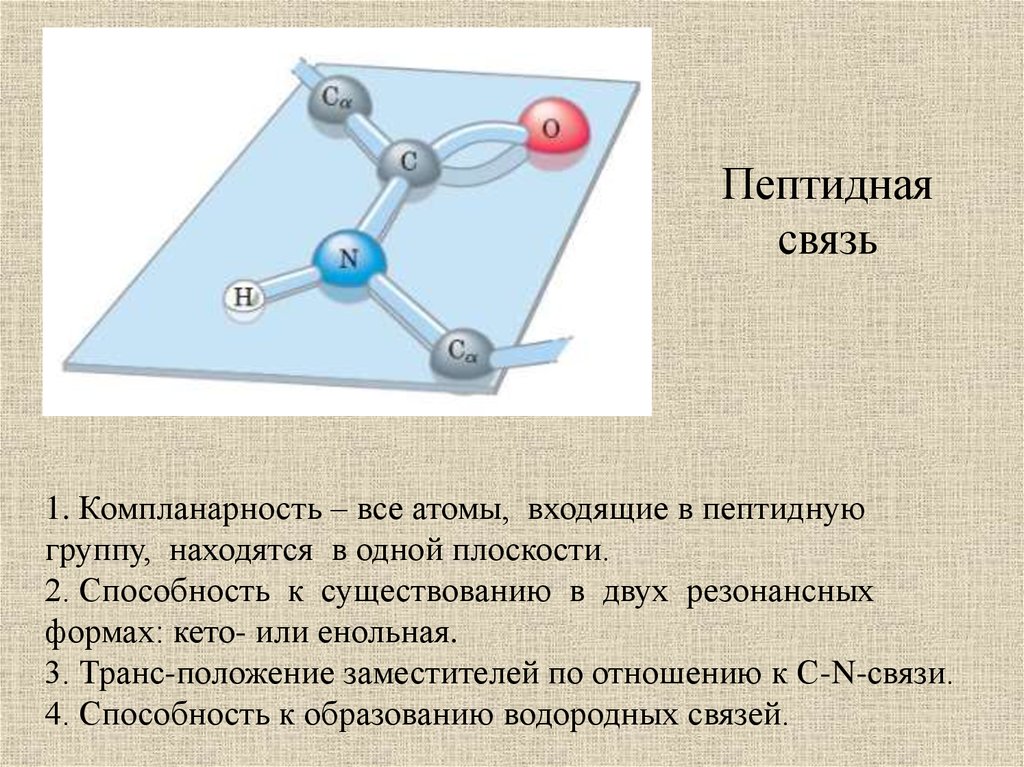
Пептиднаясвязь
1. Компланарность – все атомы, входящие в пептидную
группу, находятся в одной плоскости.
2. Способность к существованию в двух резонансных
формах: кето- или енольная.
3. Транс-положение заместителей по отношению к С-N-связи.
4. Способность к образованию водородных связей.
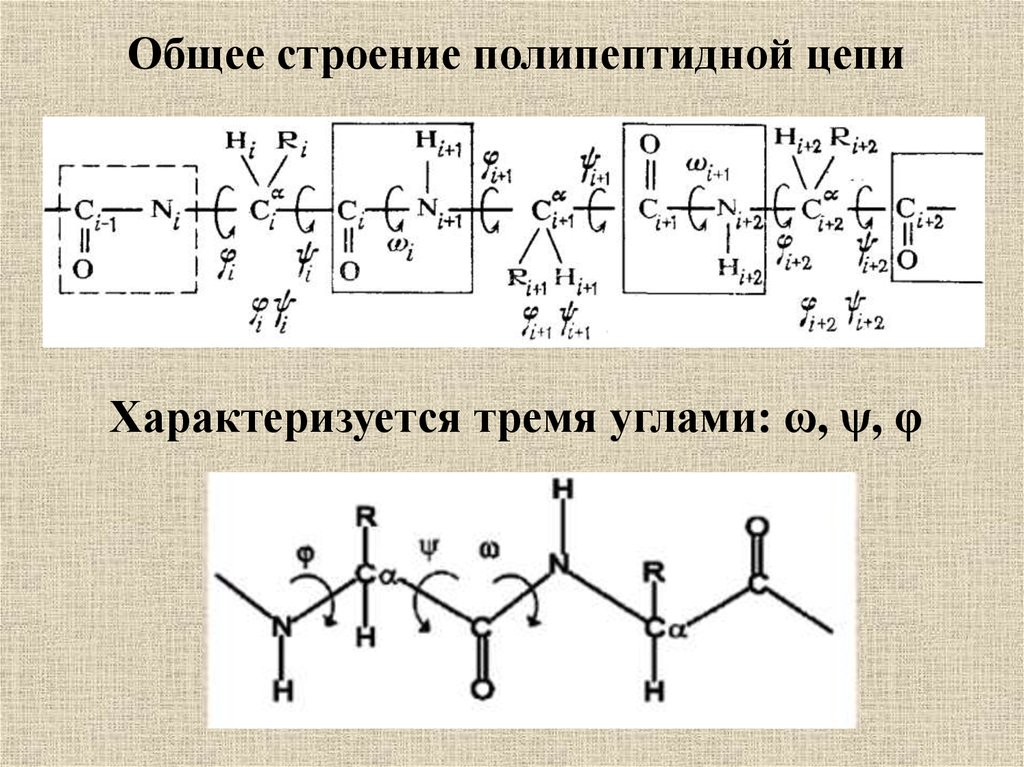
55.
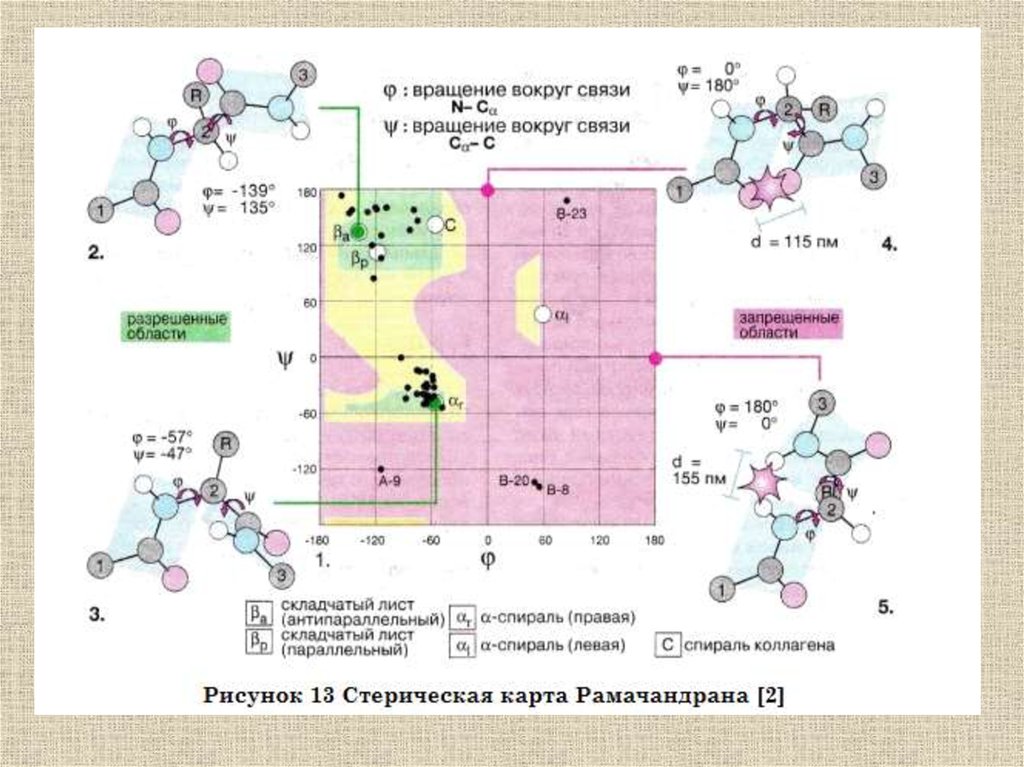
Общее строение полипептидной цепиХарактеризуется тремя углами: ω, ψ, φ
56.
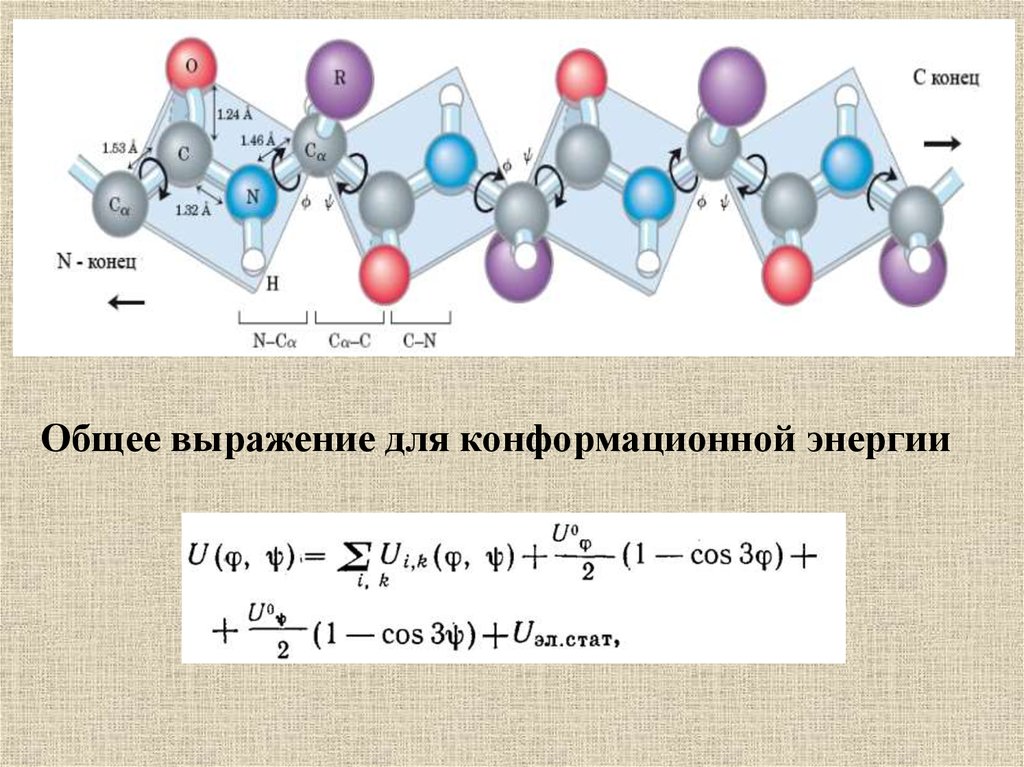
Общее выражение для конформационной энергии57.
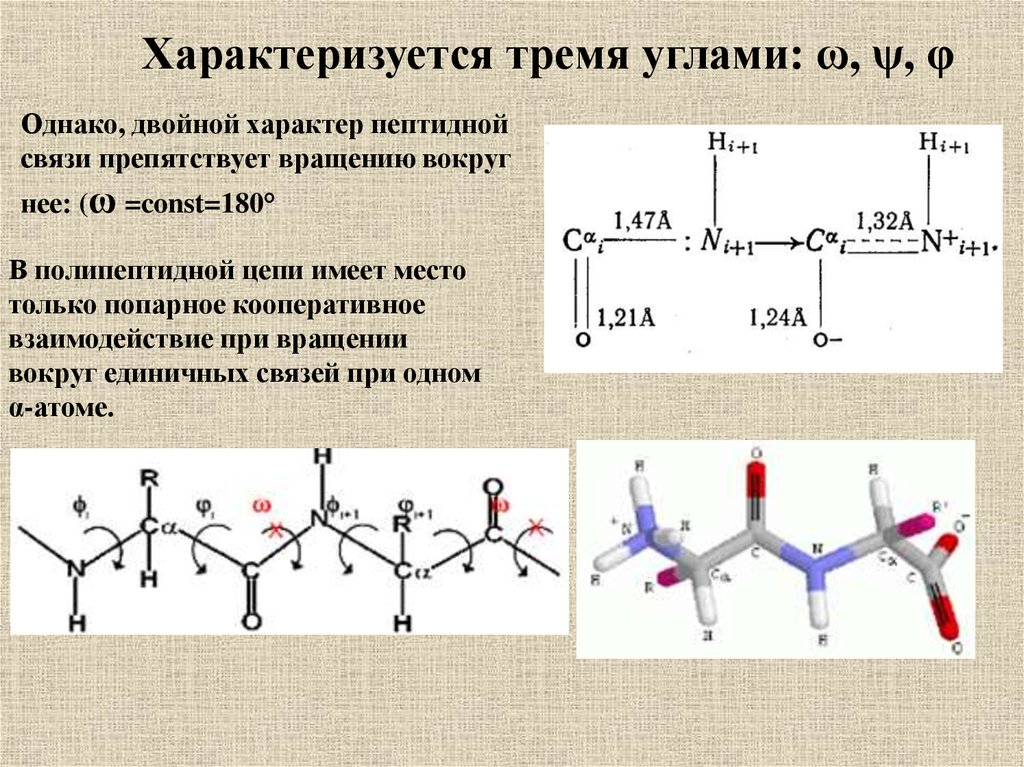
Характеризуется тремя углами: ω, ψ, φОднако, двойной характер пептидной
связи препятствует вращению вокруг
нее: (ω =const=180°
В полипептидной цепи имеет место
только попарное кооперативное
взаимодействие при вращении
вокруг единичных связей при одном
α-атоме.
58.
59.
Вопросы для самоконтроля1. Чем отличаются свойства биополимера в состоянии клубка
от свойств в состоянии глобулы?
2. Какими взаимодействиями удерживается первичная
структура биополимеров? Вторичная? Третичная?
3. Какие взаимодействия являются причиной появления сил
Ван-дер-Ваальса? Между какими группами они возникают?
4. Что такое конформация биополимера? Конфигурация?
5. Вращение вокруг каких связей определяет
конформационную энергию полипептидной цепи?


































 Биология
Биология








