Похожие презентации:
Теплоёмкость идеального газа. Уравнение Майера
1.
2. Теплоёмкость идеального газа. УравнениеМайера
Теплоёмкость тела характеризуется количеством
теплоты, необходимой для нагревания этого тела на один
градус
Q
C
dT
(22.8)
Размерность теплоемкости: [C] = Дж/К.
Однако, теплоёмкость – величина неопределённая,
поэтому пользуются понятиями: удельная и молярная
теплоёмкости.
Удельная теплоёмкость (Суд) – есть количество
теплоты, необходимое для нагревания единицы массы
вещества на один градус [Cуд]=Дж/(кг∙К).
2.
Для газов удобно пользоваться молярной теплоемкостью Сμ количество теплоты необходимое длянагревания 1 моля газа на 1 градус
Сμ= Судμ
(22.9)
[Cμ] = Дж/(моль К).
Напомню, что молярная масса – масса одного моля:
μ = А mед NА
(22.10)
где А – атомная масса; mед атомная единица массы; NА
число Авогадро; μ (моль) – количество вещества, в
котором содержится число молекул, равное числу атомов
в 12 г изотопа углерода С12.
Теплоёмкость
термодинамической
системы
зависит от того, как изменяется состояние системы при
нагревании.
3.
Рис.22.2Если газ нагревать при постоянном объёме, то всё подводимое тепло
идёт на нагревание газа, то есть изменение его внутренней энергии. Теплоёмкость обозначается СV.
Если нагревать газ при постоянном давлении (Ср) в сосуде с поршнем, то поршень поднимется на некоторую высоту h, то есть газ совершит
работу (рис. 22.2). Следовательно
проводимое тепло затрачивается и на
нагревание и на совершение работы.
Отсюда ясно, что Ср > CV.
4.
Итак, подводимое тепло и теплоёмкость зависят оттого, каким путём осуществляется передача тепла.
Следовательно Q и С не являются функциями состояния.
Величины Ср и СV оказываются связаны простыми
соотношениями. Найдём их.
Пусть мы нагреваем один моль идеального газа при
постоянном объёме, то первое начало термодинамики.
δQ = dUμ (δА = 0)
(22.11)
т.е. δQ – бесконечно малое приращения количества
теплоты равное приращению внутренней энергии dU.
Теплота при постоянном объёме:
(22.12)
CV
Q
dT
dU
dT
.
Модель: Закон Дебая
5.
В общем случаеU
CV
(22.13)
T V
так как U может зависеть не только от температуры. Но
в случае идеального газа справедлива формула (22.12).
Из (22.12) следует, что dUμ= CV dT.
T
U CV dT CV T
(22.21)
0
Uμ = CV T
(22.22)
Внутренняя энергия идеального газа является
только функцией Т (и не зависит от V, р и тому
подобным), поэтому формула (22.22) справедлива для
любого процесса.
6.
Для произвольной массы идеального газа:(22.16)
m
U CV T
μ
При изобарическом процессе кроме увеличения
внутренней энергии происходит совершение работы
газом:
δQр = dUμ + рdVμ
(22.17)
В этом выражении индекс р при δQ указывает на то, что тепло
сообщается газу в условиях, когда р постоянно. Разделив (22.17) dT
Q p
dU
p
dV
Cp
(22.18)
dT
dT
dT
из основного уравнения молекулярно-кинетической
теории рVμ = RT, так как при изобарическом процессе
р = const.
7.
Подставим полученный результат в уравнение (22.18)Сp = СV + R
(22.19)
это уравнение Майера для одного моля газа. Из него
следует физический смысл универсальной газовой
постоянной R – численно равной работе, совершаемой
одним молем газа при нагревании на один градус при
изобарическом процессе.
Используя это соотношение Роберт Майер в 1842г.
вычислил механический эквивалент теплоты:
1 кал = 4,19 Дж. Полезно знать формулу Майера для
удельных теплоёмкостей:
СР СV R
(22.21)
μ
μ μ
или
R
СРуд СVуд .
Содержание
μ
(22.21)
8.
3. Теплоёмкости одноатомных имногоатомных газов
Напомню, что в одном моле содержится NА =
6,02 1023 молекул. Один моль – количество вещества в
котором содержится число молекул равное числу атомов содержащихся в 12-ти граммах углерода С12.
Так как энергия одной молекулы идеального газа
3/2(kT), то внутренняя энергия одного моля идеального
газа равна
(22.22)
3
3
U μ N A kT RT ,
т.е.
2
2
(22.23)
3
U μ RT .
2
9.
Внутренняя энергия произвольного количества газа:Её изменение:
m3
U
RT .
μ2
(22.24)
m3
dU
RdT .
μ2
(22.25)
Теплоёмкости одноатомных газов СV и СР:
dU 3
кДж
CV
R 12,5
,
dT 2
кмольК
(22.26)
где СV теплоемкость при постоянном объеме – величина постоянная, от температуры не зависит.
10.
Учитывая физический смысл R для изобарических процессов можно записать:dQP = dUμ + RdT (для одного моля).
(22.27)
Тогда
3
5
кДж
Cp R R
C p R 20,8
. (22.28)
или
2
2
кмольК
Полезно знать отношение:
СР
γ,
(22.29)
СV
где γ коэффициент Пуассона,
Так как
20,8 5
γ
1,67.
12,5 3
С Р CV R
R
γ
1
.
СV
CV
CV
11.
ТогдаR
γ 1
и из этого следует, что
CV
R
CV
Кроме того
γ 1
.
(22.30)
i 2
.
i
Подставив в выражение для внутренней энергии:
U
m
m R
CV T
T,
μ
μ γ 1
m
pV RT , то
μ
а так как
Итак, численно
pV
U
.
γ 1
(22.31)
кДж
CV 12,5
.
кмольК
Это хорошо подтверждается на опыте с Ne, He, Ar, Kr,
парами одноатомных металлов.
12.
Теплоемкости многоатомных газовОднако опыты с азотом и кислородом и другими
двухатомными газами дали C 20,8 кДж .
V
кмольК
А для водяного пара, воды и
многоатомных газов (СН3, СН4, и так далее)
СV 25
других
кДж
.
кмольК
То есть многоатомные газы нельзя рассматривать
как материальные точки. Необходимо учитывать
вращательное движение.
Числом степени свободы называется число
независимых переменных, определяющих положение
тела в пространстве, и обозначается как i.
13.
Ранее было введено понятие числа степеней свободы — числанезависимых переменных (координат), полностью определяющих
положение системы в пространстве. В ряде задач молекулу
одноатомного газа (рис. 22.3,а) рассматривают как материальную
точку, которой приписывают три степени свободы поступательного
движения. При этом энергию вращательного движения можно не
учитывать (r → 0, J = mr2 → 0, Tвр = Jω2/2 → 0).
В классической механике молекула двухатомного газа в первом
приближении рассматривается как совокупность двух материальных
точек – атомов, жестко связанных
недеформируемой связью (рис. 22.3,б). Эта
система кроме трех степеней свободы
поступательного движения имеет еще две
степени свободы вращательного движения.
Вращение вокруг третьей оси (оси,
проходящей через оба атома) лишено
Рис. 22.3
смысла. Таким образом, двухатомный газ
обладает пятью степенями свободы (i = 5).
14.
Трехатомная (рис. 22.3, в) и многоатомная нелинейные молекулыимеют шесть степеней свободы — три поступательных и три
вращательных. Естественно, что жесткой связи между атомами не
существует. Поэтому для реальных молекул необходимо учитывать
также степени свободы колебательного движения.
Независимо от общего числа степеней свободы молекул три степени
свободы всегда поступательные. Ни одна из поступательных
степеней свободы не имеет преимущества перед другими, поэтому
на каждую из них приходится в среднем одинаковая энергия, равная
1/3 значения (3/2)kT:
< ε1 > = < ε0 >/3 = ½kT.
В классической статистической физике выводится закон Больцмана
о равномерном распределении энергии по степеням свободы
молекул: для статистической системы, находящейся в состоянии
термодинамического равновесия, на каждую поступательную и
вращательную степени свободы приходится в среднем кинетическая
энергия кТ/2, а на каждую колебательную степень свободы — в
среднем энергия кТ. Колебательная степень обладает вдвое большей
энергией потому, что на нее приходится не только кинетическая
энергия (как в случае поступательного и
15.
вращательного движений), но и потенциальная энергия, причемсредние значения кинетической и потенциальной энергий
одинаковы.
Таким образом, средняя кинетическая энергия молекулы
i
< ε > = kТ ,
2
где i — сумма числа поступательных, числа вращательных и
удвоенного числа колебательных степеней свободы молекулы
i = iпост + iвращ + 2iколеб .
Так как в идеальном газе взаимная потенциальная энергия молекул
равна нулю (молекулы между собой не взаимодействуют), то
внутренняя энергия, отнесенная к одному молю газа, будет равна
сумме кинетических энергий NA молекул:
i
i
U N A kT RT .
2
2
16.
4. Закон о равномерном распределении энергиипо степеням свободы
Итак, средняя энергия приходящаяся на одну
степень свободы равна
1
E к kT .
(22.31)
2
Но у одноатомной молекулы i = 3, тогда для
одноатомных молекул
3
E к kT ,
2
(22.32)
5
kT ,
для двухатомных молекул Ек =
(22.33)
2
для трёхатомных молекул
Eк
6
kT .
2
(22.34)
17.
Но на среднюю кинетическую энергию молекулы,имеющей i-степеней свободы приходится
i
E kT ,
2
(22.35)
Это и есть закон Больцмана о равномерном
распределении средней кинетической энергии по
степеням свободы.
При этом: для двухатомных молекул:
5
кДж
CV R 20,8
,
2
кмольК
для трехатомных молекул:
6
кДж
CV R 25
.
2
кмольК
18.
В общем случае, для молярной массы газаi
CV R
2
i
i 2
C p CV R R R
R
2
2
i 2
Cp
R
2
(22.36)
(22.37)
(22.38)
Для произвольного количества газов:
mi
CV
R
μ2
m i 2
Cp
R
μ 2
(22.39)
(22.40)
19.
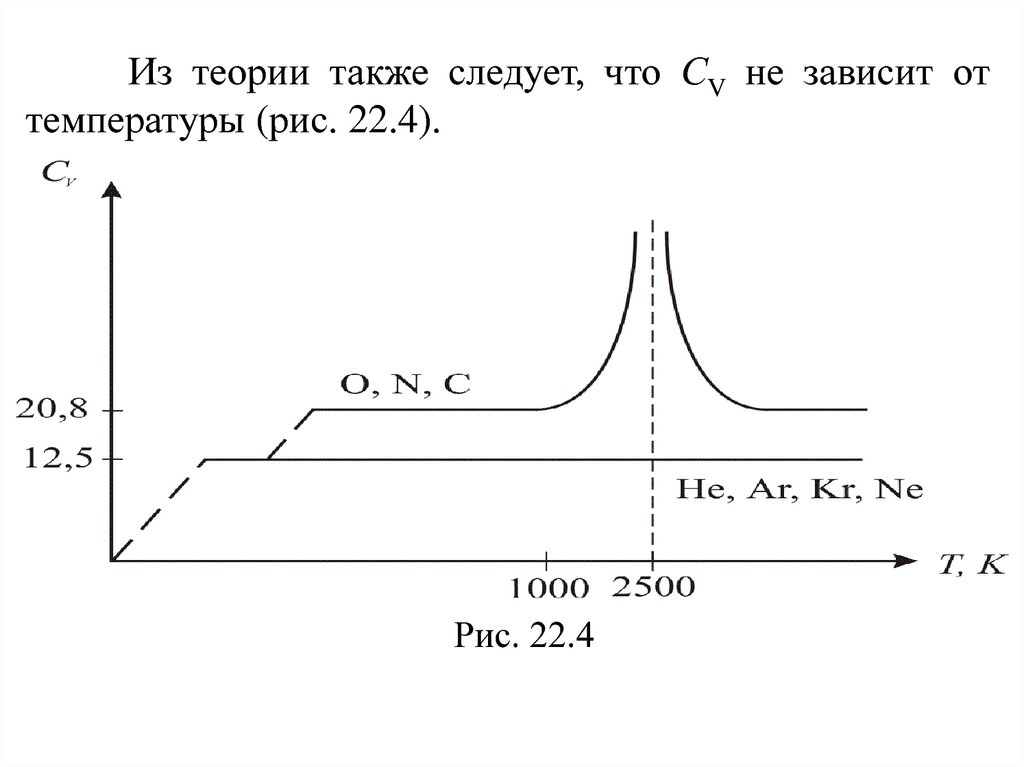
Из теории также следует, что СV не зависит оттемпературы (рис. 22.4).
Рис. 22.4
20.
Для одноатомных газов это выполняется в оченьшироких пределах, а для двухатомных газов только в
интервале от 100 1000 К. Отличие связано с проявлением квантовых законов. При низких температурах вращательное движение как бы «вымерзает» и двухатомные молекулы движутся поступательно, как одноатомные. При увеличении температуры, когда Т > 1000 К,
начинают сказываться колебания атомов молекулы
вдоль оси z (атомы в молекуле связаны не жёстко, а как
бы на пружине).
21.
1kT ,так
2
Одна колебательная степень свободы несёт
как при этом есть и кинетическая и потенциальная
энергия, то есть появляется шестая степень свободы колебательная. При температуре равной 2500 К молекулы диссоциируют. На диссоциацию молекул тратится
энергия раз в десять превышающая среднюю энергию
поступательного движения. Это объясняет сравнительно низкую температуру пламени. Кроме того, атом
– сложная система, и при высоких температурах начинает сказываться движение электронов внутри его.
Содержание
22.
5. Применение первого началатермодинамики к изопроцессам идеальных
газов
В таблице (22.1) приводятся сводные данные о
характеристиках изопроцессов в газах. Здесь используются известные нам формулы:
δQ = dU + δA – I начало термодинамики или закон
сохранения энергии в термодинамики;
i m
- внутренняя энергия идеального газа;
dU
RdT
2 μ
V2
A pdV - работа идеального газа;
V1
δQ = mCdT - приращение теплоты;
23.
CQ
- удельная теплоемкость;
mdT
m Q - молярная теплоемкость;
C
dT
Ср= СV + R - уравнение Майера;
Cp
γ - показатель адиабаты
CV
Пуассона.
или
Таблица из 5 -ти столбцов и 8 -ми строк.
коэффициент
24.
Название процессаИзохорически
й
Изобарически
й
Условие
протекания
процесса
V=const
p=const
T=const
δQ=0
Cp i 2
CV
i
Связь между
параметрами
состояния
р
const
T
V
const
T
pV=const
рVx=const γ
pdV
m
RdT
μ
Изотермически Адиабатически
й
й
p2 V1
p1 V2
T2 V1
T1 V2
γ 1
T2 p2
T1 p1
γ 1
γ
25.
Работа впроцессе
Изохорический
Изобарически
й
δA = 0
A=0
δA = рdV
А = р(V2 V1)
m
A RdT
μ
Изотермически Адиабатически
й
й
δA = рdV
A
V2
pdV
V1
A
V
m
RT ln 2
μ
V1
δA = рdU = dU
A
mi
RdT
2
А = − ∆U =
=CV(T1 T2)
p V (T T )
A 1 1 1 2
(γ 1)T1
Количество
теплоты,
сообщённое в
процессе
δQ = СVdT
Q = СV(T2 T1)
δQ = CpdT
Q = Cp(T2 – T1)
m
i
Q RΔT 1
μ
2
δQ = A
Q=A
δQ = 0
Q=0
Измерение
внутренней
энергии
dU = δQ
U=Q
dU = СVdT
U = СV(T2 T1)
dU = 0
U=0
dU = δA =
= СVdT
U=A=
= СV(T2 T1)
p1V1
ΔU
T1 (γ 1)
ΔU
i m
RΔT
2μ
26.
ТеплоёмкостьИзохорический
Изобарически
й
m
m R
Cp
( 1)
R
CV
( 1)
CV
dU i
R
dT 2
Cp
Изотермически Адиабатически
й
й
CТ =
Сад. = 0
m dQ
μ dT
Здесь уместно рассмотреть еще и политропный
процесс – такой процесс, при котором изменяются все
основные параметры системы, кроме теплоемкости, т.е.
С = const, С СV .
Уравнение политропы pVn = const
(22.41)
или
TVn–1=const,
(22.42)
Здесь n – показатель политропы, n
C Cp
C CV
.
27.
С помощью этого показателя можно легкоописать любой изопроцесс:
1. Изобарный процесс р = const, n = 0
γR
C
γCV C p .
γ 1
(22.43)
2. Изотермический процесс Т = const, n = 1, СТ = .
3. Изохорный процесс V = const, n =
R
CV
.
γ 1
(22.44)
4. Адиабатический процесс Q = 0, n = γ, Сад. = 0.
Во всех этих процессах работу можно вычислить по
одной формуле:
n 1
p1V1 V1
1
A
n 1 V2
(22.45)



























 Физика
Физика