Похожие презентации:
Обмін складних білків
1. Обмін складних білків
2.
До складних відносяться білки, що складаються збілкової частини та небілкового компоненту
(простетична група).
За хімічним складом простетичної групи складні білки
можна розділити на декілька класів:
Нуклеопротеїни
Хромопротеїни
Ліпопротеїни
Фосфопротеїни
Глікопротеїни
Металопротеїни
3. Обмін нуклеопротеїнів. Ентеральний обмін.
У шлунку:нуклеопротеїни (ДНП, РНП) + HCl → простий білок
+ нуклеїнова кислота (ДНК, РНК)
В 12-типалій кишці:
ДНК-аза
ДНК + НОН
РНК + НОН
РНК-аза
олігонуклеотиди + мононуклеотиди
олігонуклеотиди + мононуклеотиди
4.
Інші відділи тонкого кишечнику:мононуклеотиди + НОН
нуклеозиди + НОН
нуклеотидази
нуклеозидази
нуклеозиди + Н3РО4
азотисті основи (пуринові або
піримідинові) + пентоза
Всмоктування:
- ДНК: Аденін (А), Гуанін (Г), Цитозин (Ц), Тимін (Т),
дезоксирибоза і фосфатна кислота
- РНК: Аденін (А), Гуанін (Г), Цитозин (Ц), Урацил (У),
рибоза і фосфатна кислота
5.
6. Катаболізм нуклеопротеїнів
Втканинах
розпад
нуклеопротеїнів
відбувається аналогічно їх розпаду в шлунковокишковому
тракті,
тільки
здійснюється
специфічними
тканинними
ферментами,
локалізованими, в основному, в лізосомах:
ДНК-аза, РНК-аза, нуклеотидази, нуклеозидази.
7.
Пентози, які в результаті катаболізмунуклеїнових кислот, окиснюються до СО2 і Н2О,
а також використовуються для синтезу нових
нуклеотидів.
Фосфатна кислота застосовується для
фосфорилування органічних сполук або
виводиться з організму нирками і товстим
відділом кишечнику.
8.
Азотисті основи (пуринові і піримідинові)перетворюються в кінцеві продукти обміну, які
виділяються з сечею.
Піримідинові азотисті основи підлягають
остаточному розпаду до СО2, Н2О і NH3.
Пуринові азотисті основи зберігають циклічну
структуру пурину. Кінцевий продукт у людини,
людиноподібних мавп, свиней і птиці – сечова
кислота, а у коней, собак і кролів вона окиснюється з
розривом пуринового кільця і утворенням алантоїну.
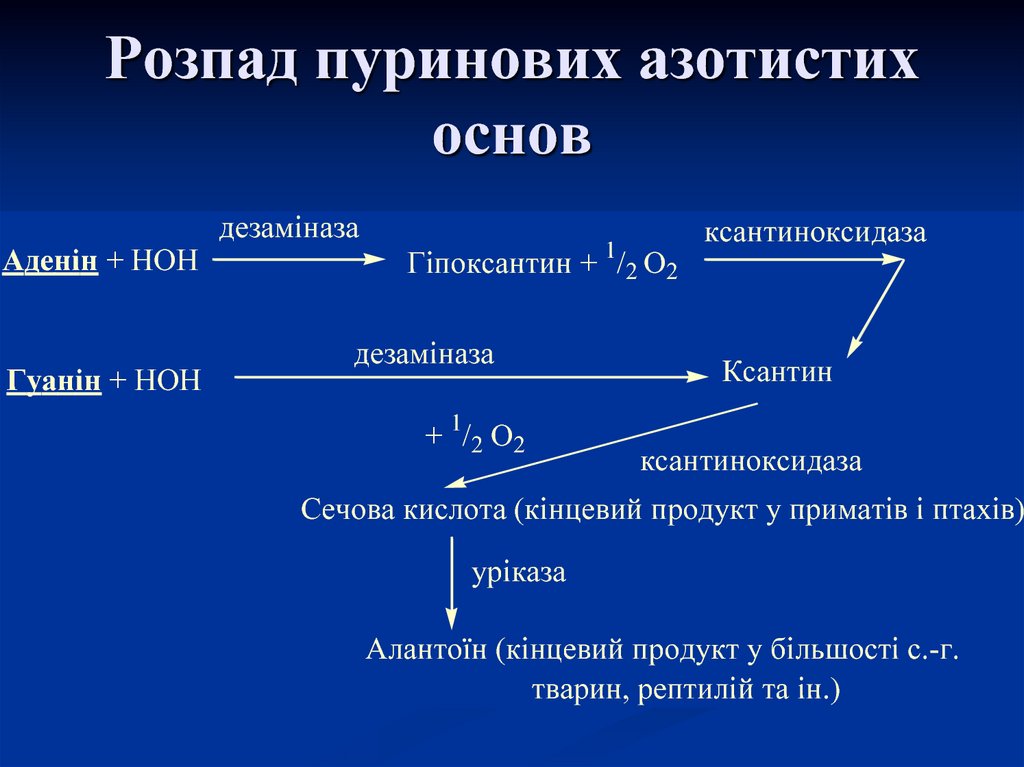
9. Розпад пуринових азотистих основ
Аденін + НОНГуанін + НОН
дезаміназа
1
Гіпоксантин + /2 О2
дезаміназа
+ 1/ 2 О 2
ксантиноксидаза
Ксантин
ксантиноксидаза
Сечова кислота (кінцевий продукт у приматів і птахів)
уріказа
Алантоїн (кінцевий продукт у більшості с.-г.
тварин, рептилій та ін.)
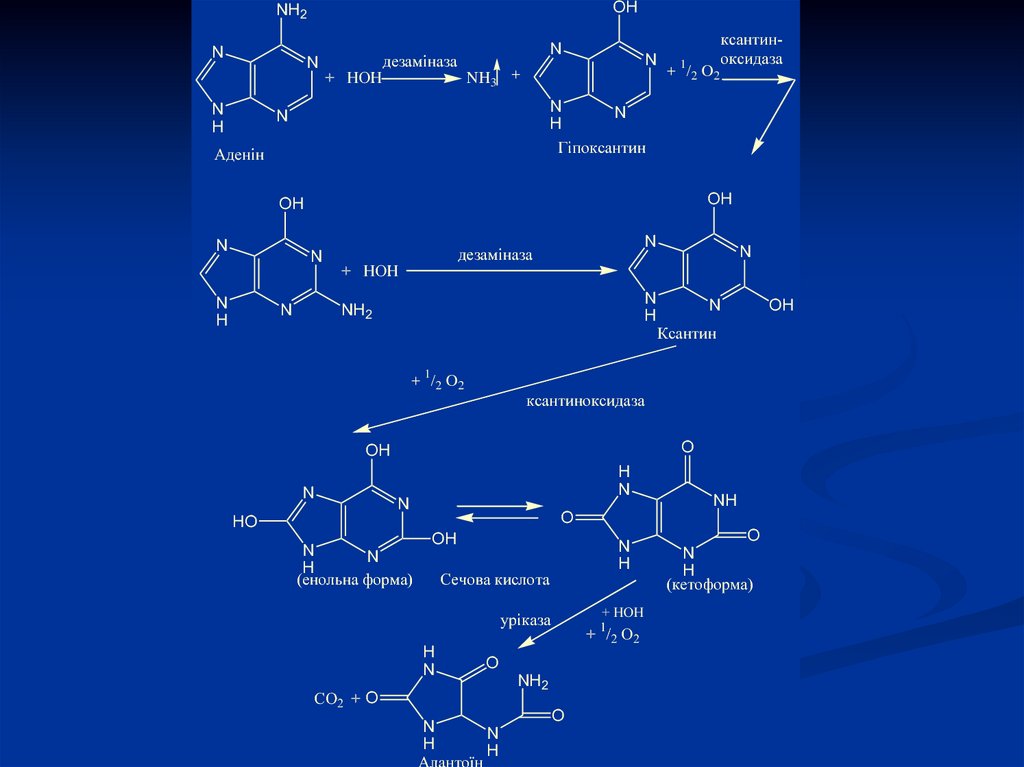
10.
OHNH2
N
N
N
H
+ НОН
N
дезаміназа
N
NH3 +
+ 1/ 2 O 2
N
N
H
Гіпоксантин
N
Аденін
OH
OH
N
N
N
H
ксантиноксидаза
N
N
дезаміназа
+ НОН
N
H
NH2
+ 1/ 2 O 2
N
Ксантин
ксантиноксидаза
O
OH
N
N
H
N
N
HO
N
N
H
(енольна форма)
NH
O
OH
N
H
Сечова кислота
+ HOH
уріказа
H
N
1
+ /2 O2
O
СО2 + O
N
N
H
H
Алантоїн
NH2
O
O
N
H
(кетоформа)
OH
11.
Сечова кислота є одним із нормальних компонентівсечі. За добу в організмі утворюється приблизно 1 грам
сечової кислоти.
Сечова кислота виводиться з організму з сечею - це
звичайний її компонент, але в нирках організму людини
відбувається її інтенсивна реабсорбція.
Концентрація сечової кислоти в крові підтримується на
постійному рівні (0,12-0,30 ммоль/л).
12. Функції сечової кислоти:
1. Є потужним стимулятором центральноїнервової
системи,
бо
інгібує
фосфодиестеразу, яка є посередником дії
гормонів адреналіну і норадреналіну.
Сечова кислота пролонгує (подовжує) дію
цих гормонів на ЦНС.
2. Має антиоксидантні властивості – здатна
взаємодіяти з вільними радикалами.
13.
Сечова кислота дуже погано розчиняється у воді. Принадлишковій кількості або порушенні катаболізму
підвищується концентрація сечової кислоти в крові
(гіперурікемія) і відкладення її у вигляді кристалів в
органах. Відкладення сечової кислоти в суглобах є
причиною сильної болі при подагрі.
Інше захворювання, при якому кристали уратів
відкладаються в нирковій лоханці або в сечовому
міхурі, відоме як сечокам'яна хвороба.
У більшості випадків гіперурікемія пов'язана з
порушенням виведення сечової кислоти нирками.
Несприятливим фактором є високий вміст пуринів у
їжі (наприклад, м'ясна дієта, кава).
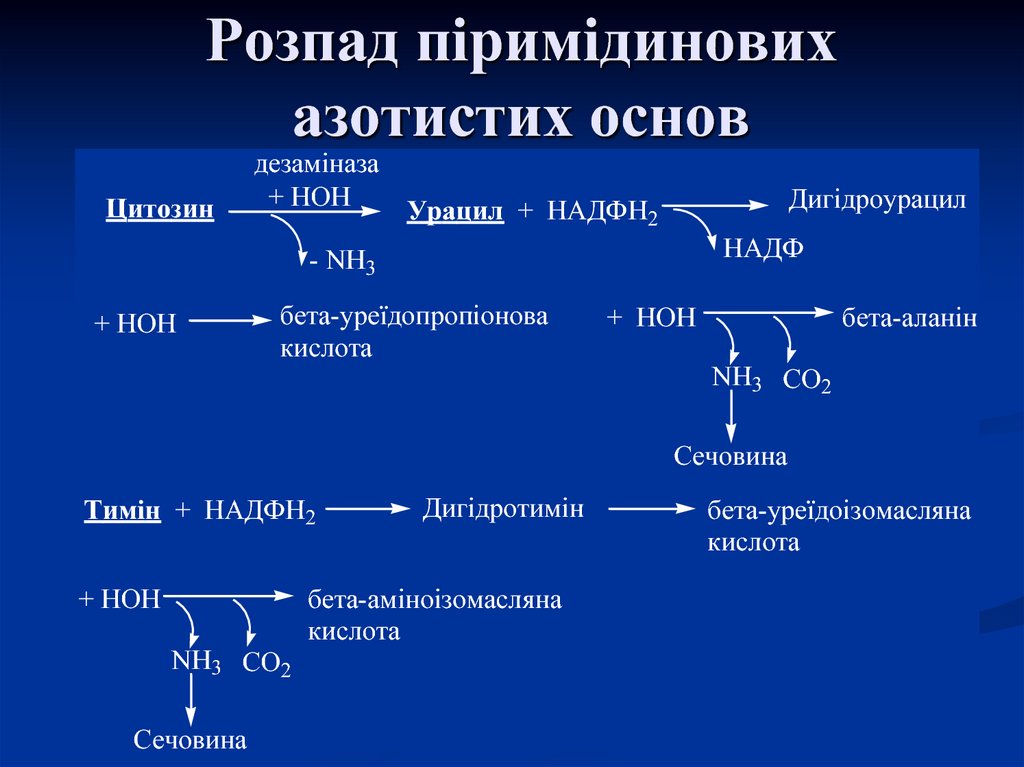
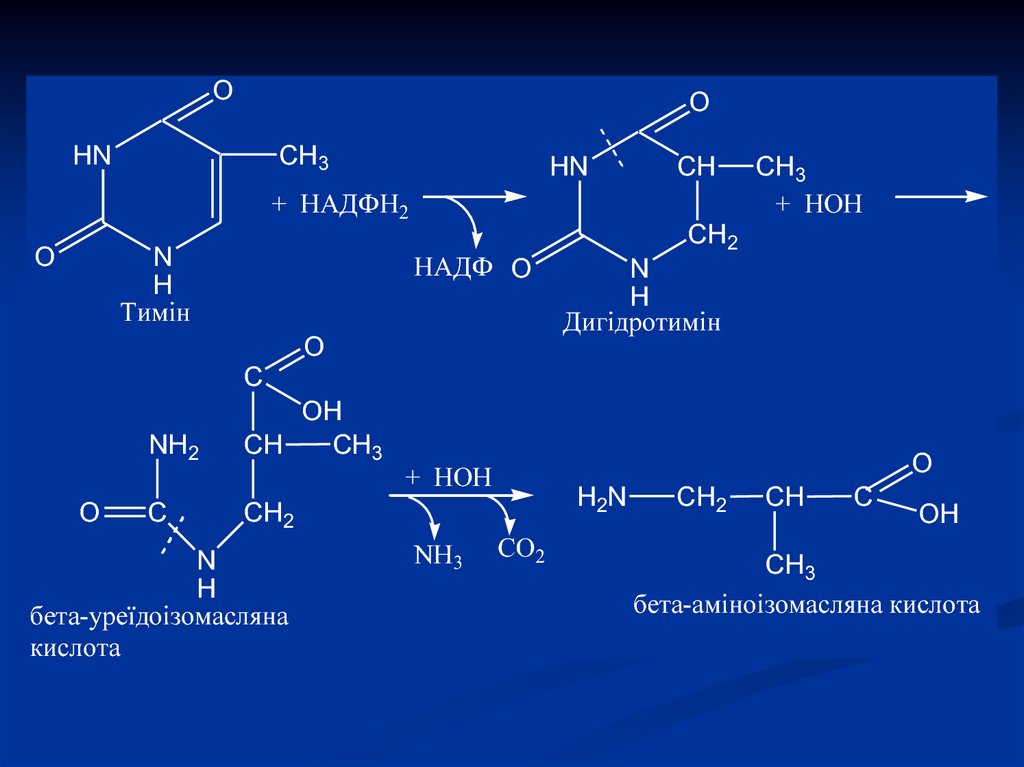
14. Розпад піримідинових азотистих основ
Цитозиндезаміназа
+ НОН
Урацил + НАДФН2
Дигідроурацил
НАДФ
- NH3
+ НОН
бета-уреїдопропіонова
кислота
+ НОН
бета-аланін
NH3 СО2
Сечовина
Тимін + НАДФН2
+ НОН
NH3 СО2
Сечовина
Дигідротимін
бета-аміноізомасляна
кислота
бета-уреїдоізомасляна
кислота
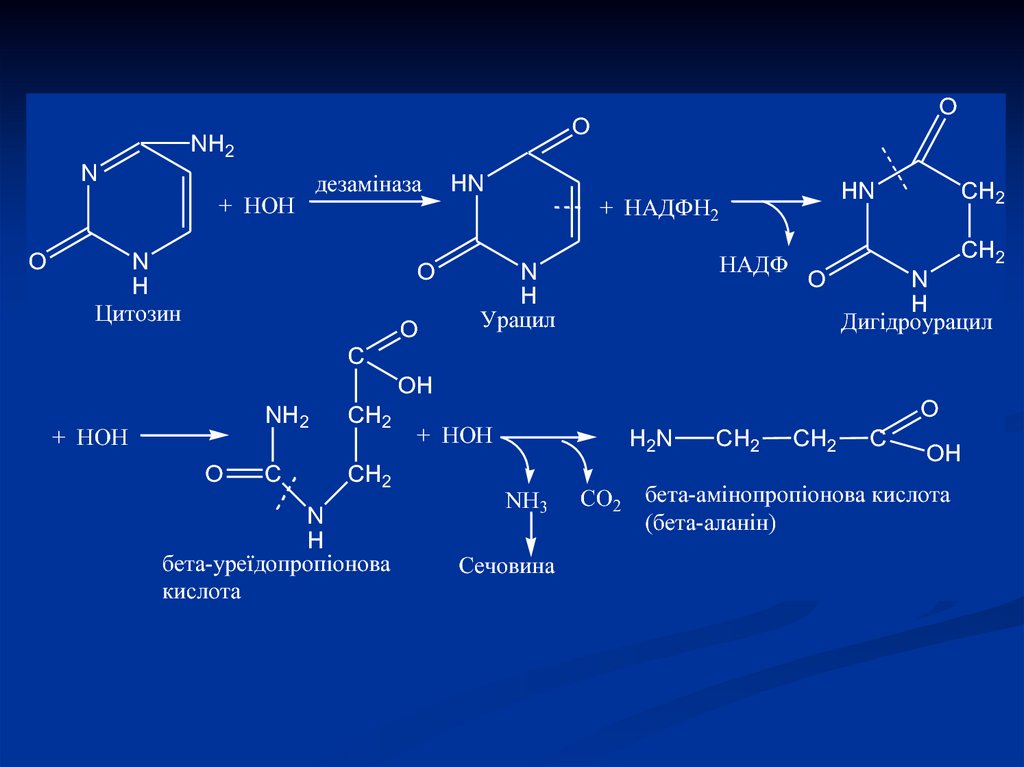
15.
NH2N
+ HOH
O
O
O
дезаміназа
N
H
Цитозин
O
O
HN
HN
+ НАДФН2
НАДФ
N
H
Урацил
CH2
CH2
O
N
H
Дигідроурацил
C
OH
+ HOH
O
NH2
CH2
C
CH2
N
H
бета-уреїдопропіонова
кислота
O
+ HOH
H2N
NH3
Сечовина
СО2
CH2
CH2
C
OH
бета-амінопропіонова кислота
(бета-аланін)
16.
-аланін зазвичай розпадається до CO2, H2O іNH3, але іноді може використовуватися для
синтезу пептидів карнозину і ансерину в
м'язовій тканині.
У мікроорганізмів -аланін використовується і
для синтезу HS-КоА.
Кінцевим продуктом розпаду піримідинових
азотистих основ можна вважати і сечовину, яка
утворюється з амоніаку згідно відомого
механізму.
17.
OO
CH3
HN
HN
CH
+ НАДФН2
N
H
Тимін
O
НАДФ O
CH3
+ HOH
CH2
N
H
Дигідротимін
O
C
O
NH2
OH
CH3
CH
C
CH2
N
H
бета-уреїдоізомасляна
кислота
O
+ HOH
NH3
H2N
СО2
CH2
CH
C
OH
CH3
бета-аміноізомасляна кислота
18.
Тимін розпадається подібно урацилу, алезберігається CH3-група і замість -аланіну
утворюється -аміноізобутират ( -метил- аланін). Оскільки тимін зустрічається тільки в
ДНК, то за рівнем -аміноізобутирату в сечі
оцінюють інтенсивність розпаду ДНК.
19. СИНТЕЗ МОНОНУКЛЕОТИДОВ
Для синтезу мононуклеотидів de novo необхідними є простіречовини: CO2 і рибозо-5-фосфат (продукт 1-го етапу ГМФшляху). Синтез відбувається з витратою АТФ. Окрім того,
необхідні замінні амінокислоти, які синтезуються в організмі,
тому навіть при повному голодуванні синтез нуклеїнових кислот
відбувається.
РОЛЬ АМІНОКИСЛОТ У СИНТЕЗІ МОНОНУКЛЕОТИДІВ:
Аспарагін. Є донором амідної групи.
Аспарагінова кислота.
а) Є донором аміногрупи
б) Приймає участь в синтезі всією молекулою.
Гліцин
а) Є донором активного С1.
б) Бере участь в синтезі всією молекулою.
Серин. Є донором активного С1.
20. ВІДМІННОСТІ В СИНТЕЗІ ПУРИНОВИХ І ПІРИМІДИНОВИХ МОНОНУКЛЕОТИДІВ:
Особливістю синтезу пуринових нуклеотидів єте, що
циклічна структура пуринової азотистої
основи поступово добудовується на активній формі
рибозо-фосфату (5-фосфорибозил-1-пірофосфат), як
на матриці. При циклізації утворюється вже готовий
пуриновий мононуклеотид.
При синтезі піримідинових мононуклеотидів
спочатку
утворюється
циклічна
структура
піримідинової азотистої основи, яка в готовому
вигляді переноситься на рибозу – на місце
пірофосфату.
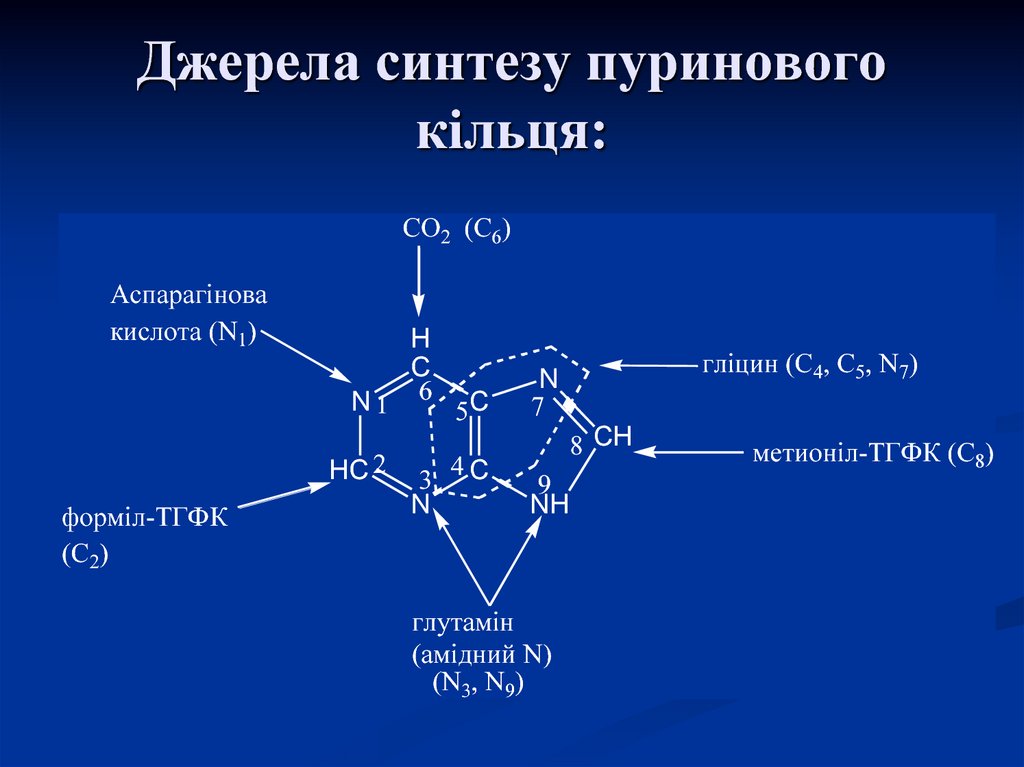
21. Джерела синтезу пуринового кільця:
СО2 (С6)Аспарагінова
кислота (N1)
N1
HC 2
форміл-ТГФК
(С2)
H
C
6
3
N
5C
4C
гліцин (С4, С5, N7)
N
7
8 CH
9
NH
глутамін
(амідний N)
(N3, N9)
метионіл-ТГФК (С8)
22.
Існує 10 загальних і 2 специфічних стадії.В результаті загальних реакцій утворюється
пуриновий мононуклеотид, який є спільним
попередником майбутніх АМФ і ГМФ –
інозинмонофосфат (ІМФ).
ІМФ в якості азотистої основи містить
гіпоксантин.
23.
Пуринове кільце будується з СО2, аспарагіновоїкислоти, глутаміну, гліцину і серину.
Ці речовини або повністю включаються в
пуринову структуру, або передають для її
побудови окремі групи.
Утворюється готовий ІМФ.
Потім відбуваються специфічні реакції, в
результаті яких ІМФ перетворюється або в
АМФ, або в ГМФ. При такому перетворенні в
молекулі з'являється аміногрупа, причому у
випадку перетворення в АМФ - на місці ОНгрупи. При утворенні АМФ джерелом Нітрогену
є аспарагінова кислота, а для утворення ГМФ
необхідним є глутамін.
24.
25.
Даліз
НМФ
(нуклеотидмонофосфат)
утворюються НДФ і НТФ за допомогою АТФ.
Витрати АТФ на синтез нуклеотидів de novo
дуже великі. Цей спосіб синтезу є енергетично
невигідним.
В деяких тканинах є альтернативний спосіб
синтезу – реутилізація (повторне використання)
пуринових азотистих основ, які утворилися при
розпаді нуклеотидів.
26.
Ферменти, що каталізують реакції реутилізації, єнайбільш активними у клітинах, які швидко діляться
(ембріональні тканини, червоний кістковий мозок,
ракові клітини), а також у тканинах головного мозку.
У людини зустрічається генетичний дефект цього
ферменту - “синдром Леша-Ніхана”.
Для таких хворих характерними є виражені
морфологічні зміни в головному і кістковому мозку,
розумова і фізична відсталість, агресія, аутоагресія.
У досліді на тваринах синдром аутоагресії моделюється
шляхом згодовування їм кофеїну (пурину) у великих
дозах, який пригнічує процес реутилізації гуаніну.
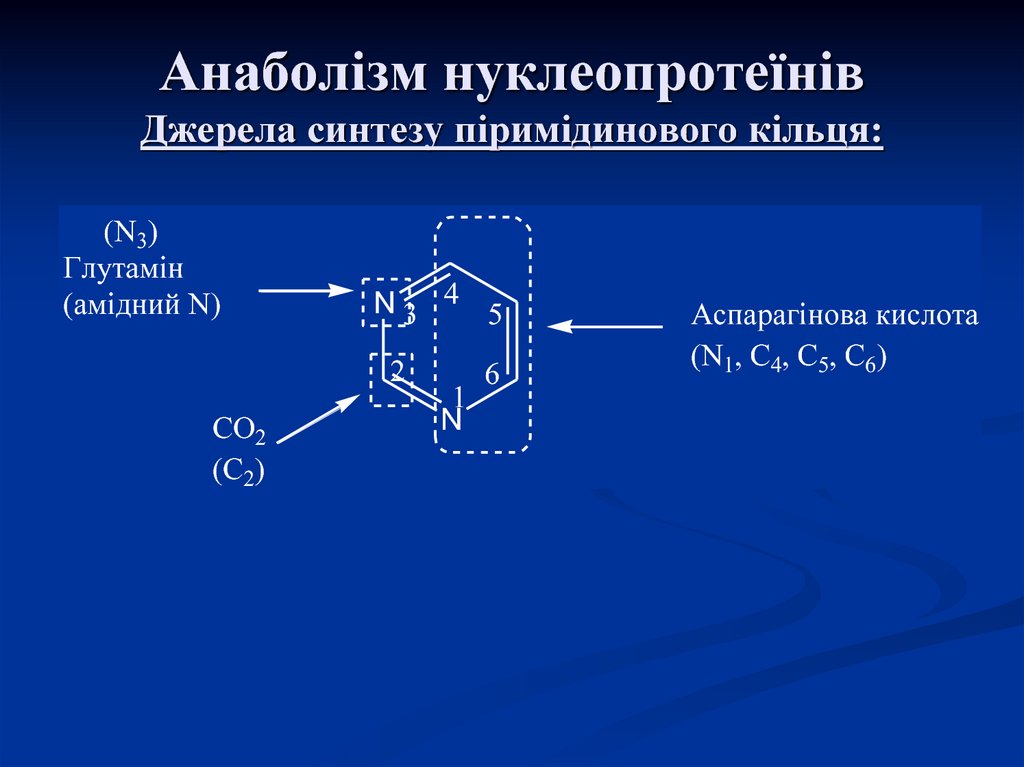
27. Анаболізм нуклеопротеїнів Джерела синтезу піримідинового кільця:
(N3)Глутамін
(амідний N)
N3 4 5
2
СО2
(С2)
1
N
6
Аспарагінова кислота
(N1, C4, C5, C6)
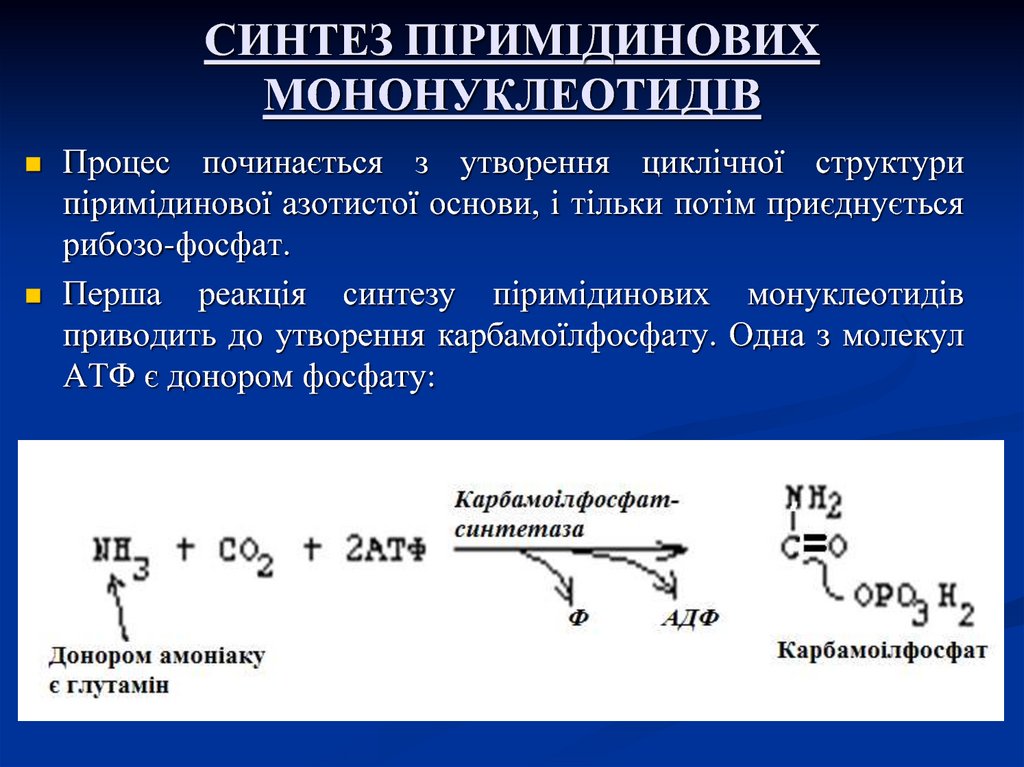
28. СИНТЕЗ ПІРИМІДИНОВИХ МОНОНУКЛЕОТИДІВ
Процес починається з утворення циклічної структурипіримідинової азотистої основи, і тільки потім приєднується
рибозо-фосфат.
Перша реакція синтезу піримідинових монуклеотидів
приводить до утворення карбамоїлфосфату. Одна з молекул
АТФ є донором фосфату:
29.
30.
Оротова кислота – перша азотиста основа нашляху синтезу піримідинів – загальний
попередник інших піримідинів.
Цитидинові нуклеотиди утворюються тільки на
основі трифосфатної форми.
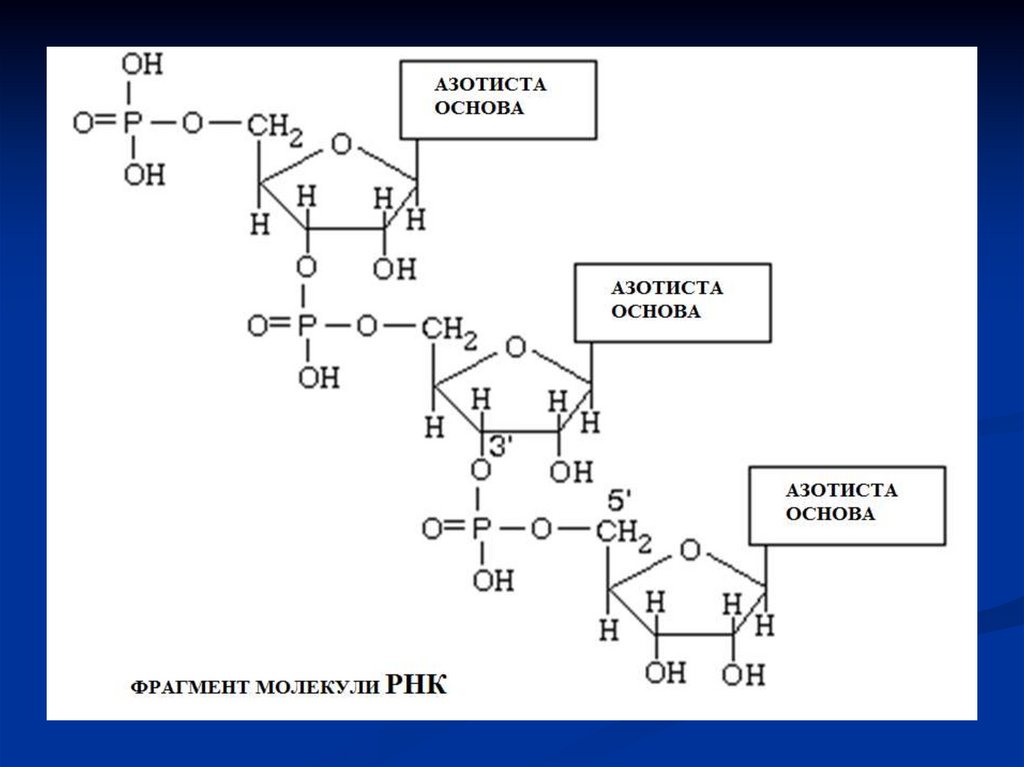
31. СИНТЕЗ НУКЛЕЇНОВИХ КИСЛОТ З МОНОНУКЛЕОТИДІВ
Нуклеїнові кислоти є полімерами. Тому їх синтезпредставляє собою ланцюг реакцій полімеризації
мононуклеотидів. В результаті цих реакцій
відбувається
поступове
подовження
полінуклеотидного ланцюгу.
Субстратами для синтезу є мононуклеотиди у
трифосфатній формі, вони ж є і джерелами енергії
(містять макроергічні зв'язки). В процесі синтезу
відщеплюється ФФ і відбувається вивільнення
енергії.
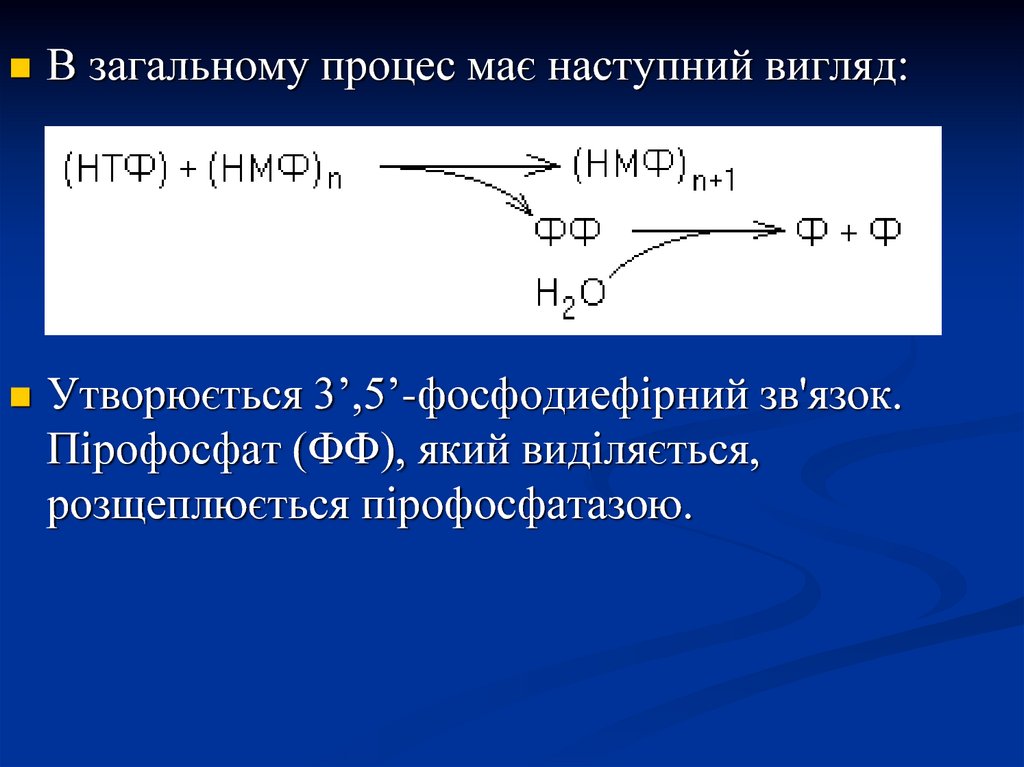
32.
В загальному процес має наступний вигляд:Утворюється 3’,5’-фосфодиефірний зв'язок.
Пірофосфат (ФФ), який виділяється,
розщеплюється пірофосфатазою.
33.
34. Обмін хромопротеїнів
Ентеральний обмін:У шлунку: гемоглобін + НСl → глобін + гем
Гем + НСl → гематин (Fe3+)
В кишечнику: гематин → стеркобіліноген →
стеркобілін (з каловими масами виводиться з
організму)
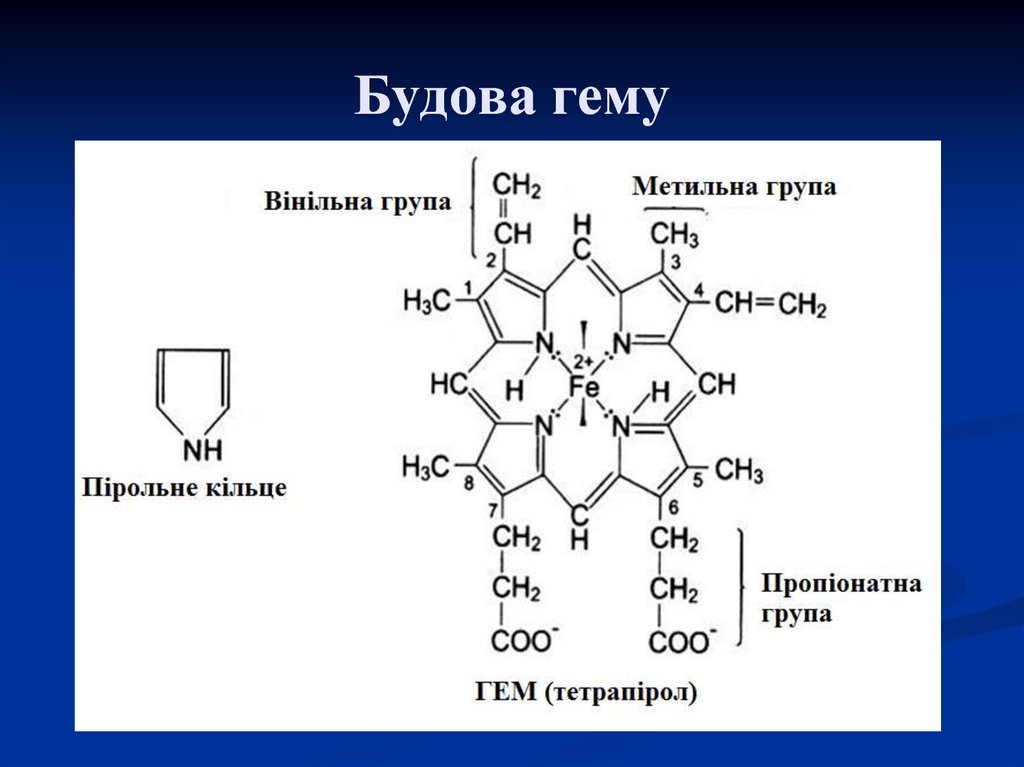
35. Будова гему
36. Будова гемоглобіну
37. Деградація гемоглобіну
В організмі людини протягом 1 год. руйнуєтьсяблизько 100-200 млн еритроцитів. Розпад
починається в мікросомальній фракції ретикулоендотеліальної системи [РЕС] клітин печінки,
селезінки та кісткового мозку.
Після відділення білкової частини (глобіну)
червоний гем розщеплюється гем-оксигеназою за
допомогою кисню і НАДФН на іони Fe2+, СО
(оксид Карбону!) і зелений білівердін.
Далі Ферум утилізується.
38.
В подальшому білівердін відновлюєтьсябілівердінредуктазою до помаранчевого
білірубіну. Ці зміни кольору легко можна
спостерігати in vivo у вигляді синяків (при
гематомах).
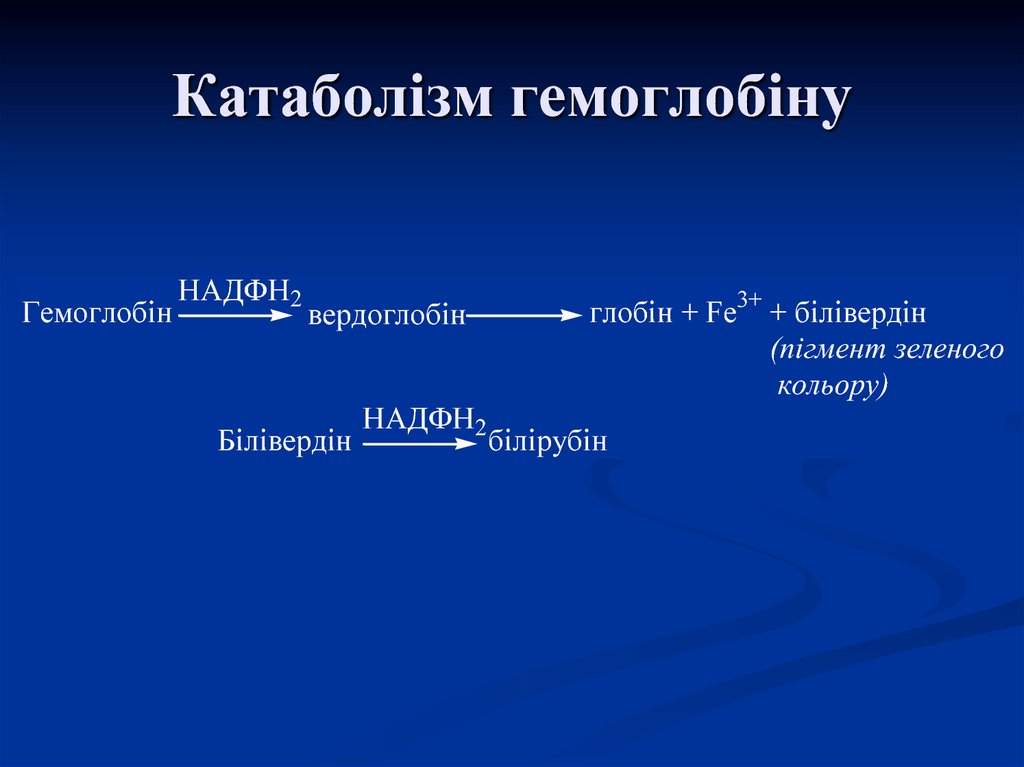
39. Катаболізм гемоглобіну
ГемоглобінНАДФН2
вердоглобін
Білівердін
НАДФН2
глобін + Fe3+ + білівердін
(пігмент зеленого
кольору)
білірубін
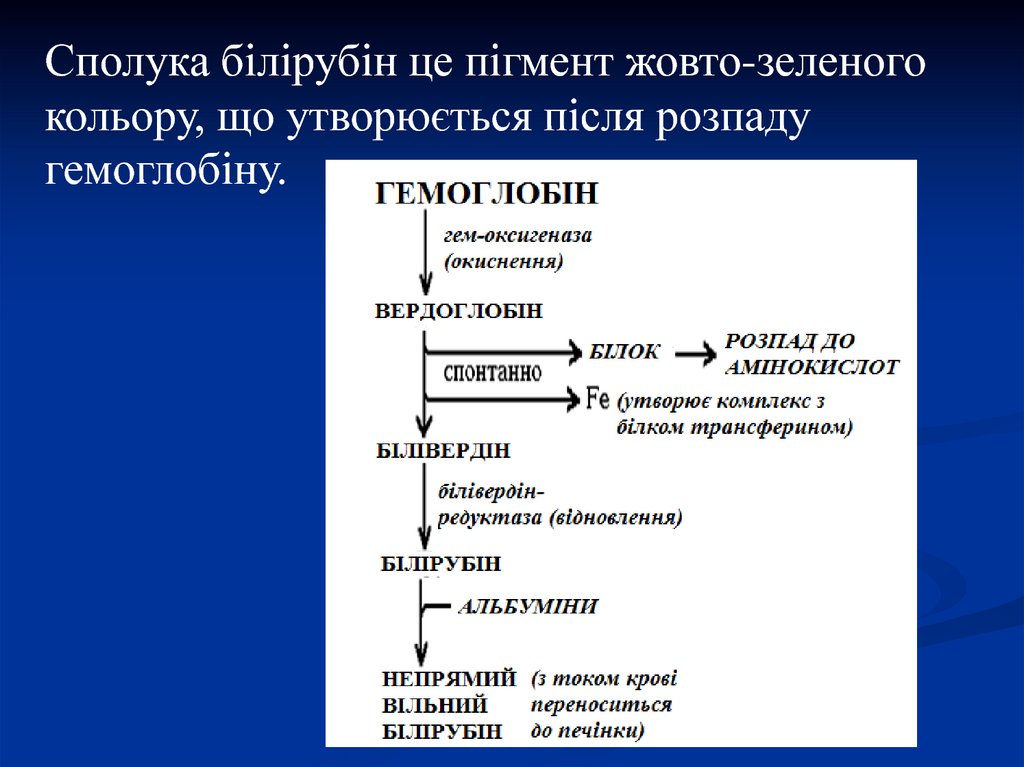
40.
Сполука білірубін це пігмент жовто-зеленогокольору, що утворюється після розпаду
гемоглобіну.
41. Метаболізм білірубіну
1. Транспорт білірубіну кров'ю і надходженняв паренхімальні клітини печінки.
Так як він погано розчинний в плазмі, то
транспорт здійснюється в комплексі з
альбумінами.
42.
2. Детоксикація білірубіну в клітинахпечінки.
Після того як білірубін в печінці двічі
кон’югується з активованою глюкуроновою
кислотою, підвищується його водорозчинність.
Утворення кон’югату каталізується УДФглюкуронозілтрансферазою — ферментом, який
знаходиться в ЕР печінки, а також у незначній
кількості в нирках і слизовій кишечнику.
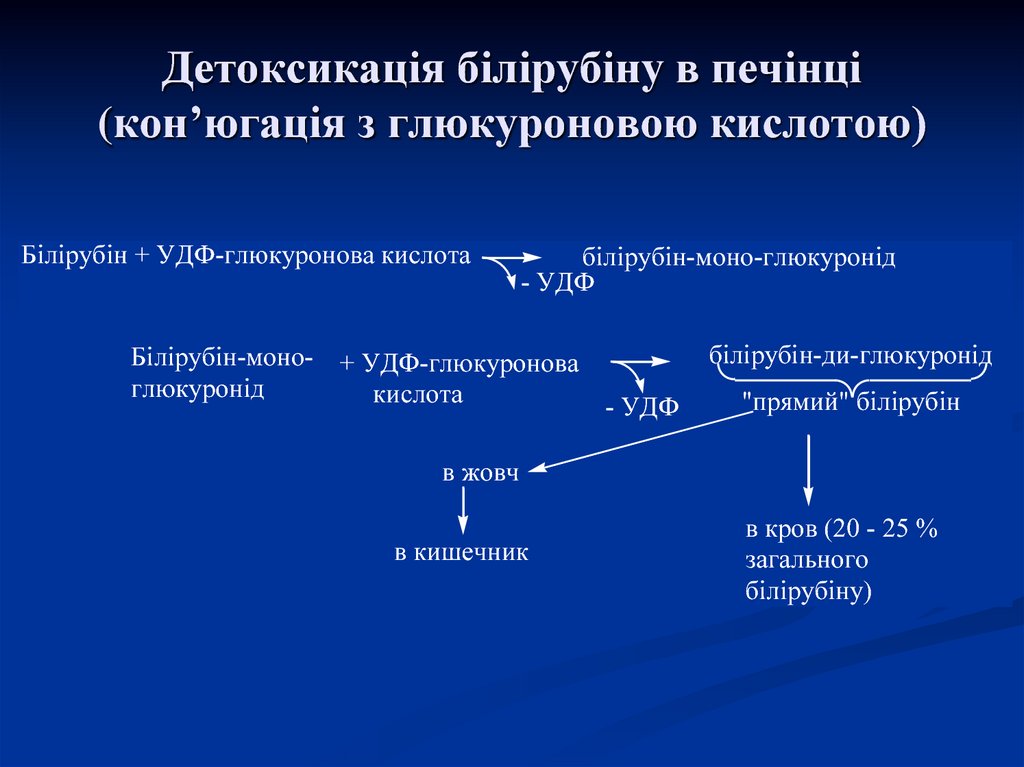
43. Детоксикація білірубіну в печінці (кон’югація з глюкуроновою кислотою)
Білірубін + УДФ-глюкуронова кислотабілірубін-моно-глюкуронід
- УДФ
Білірубін-моно- + УДФ-глюкуронова
глюкуронід
кислота
- УДФ
білірубін-ди-глюкуронід
"прямий" білірубін
в жовч
в кишечник
в кров (20 - 25 %
загального
білірубіну)
44.
3. Секреція білірубіну в жовч і виведення зорганізму.
В кишечнику кон’югат білірубіну знову частково
розщеплюється бактеріальною β-глюкуронідазою.
Вільний білірубін поступово відновлюється до
безбарвного уробіліногену та стеркобіліногену, які
далі окиснюються киснем повітря до уробіліну та
стеркобіліну. Ці кінцеві продукти метаболічної
трансформації жовчних пігментів у кишечнику
забарвлені в кольори від помаранчевого до жовтого.
Вони виділяються в основному з калом, а менша
частина резорбується (ентерогепатична циркуляція).
При інтенсивному процесі розпаду гему в сечі раптово
з'являється уробіліноген, де він при окисненні киснем
повітря
темніє,
перетворюючись
в
уробілін.
45. Секреція білірубіну та виведення з організму
бакт.глюкуронова кислота + білірубін
ферм.
кишечника
стеркобіліноген
стеркобілін
уробіліноген
(калові маси)
пігменти
в сечу
Білірубін-диглюкуронід
Білірубін + 2Н
уробіліноген
(пігмент сечі)
46.
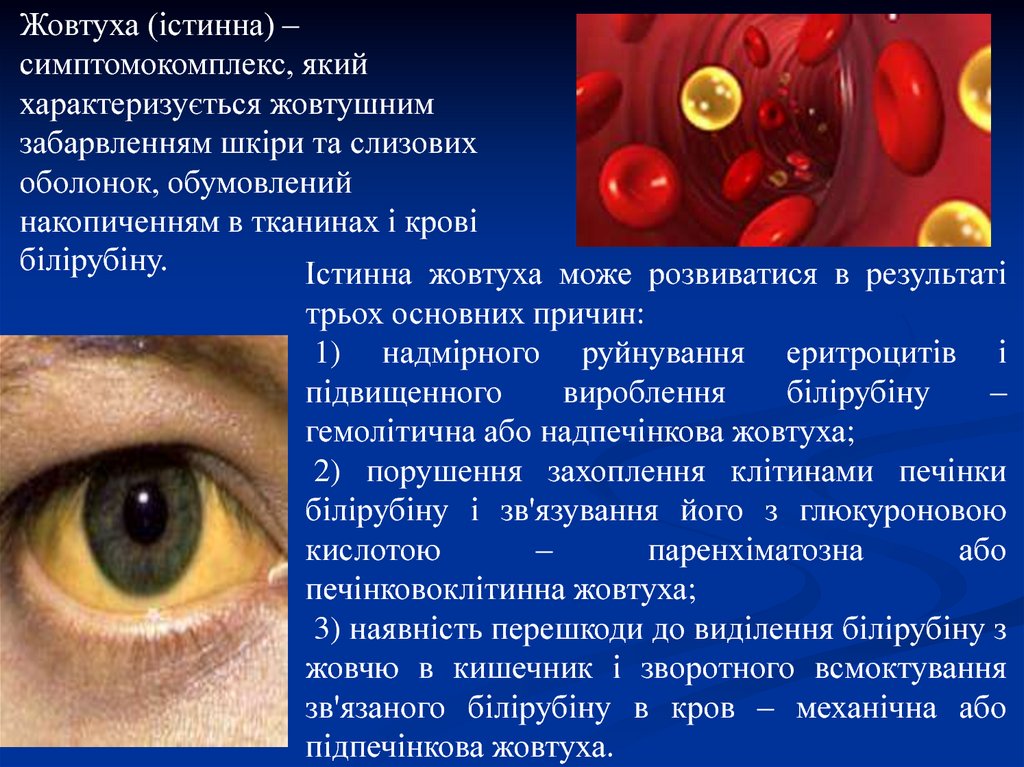
Жовтуха (істинна) –симптомокомплекс, який
характеризується жовтушним
забарвленням шкіри та слизових
оболонок, обумовлений
накопиченням в тканинах і крові
білірубіну.
Істинна жовтуха може розвиватися в результаті
трьох основних причин:
1) надмірного руйнування еритроцитів і
підвищенного
вироблення
білірубіну
–
гемолітична або надпечінкова жовтуха;
2) порушення захоплення клітинами печінки
білірубіну і зв'язування його з глюкуроновою
кислотою
–
паренхіматозна
або
печінковоклітинна жовтуха;
3) наявність перешкоди до виділення білірубіну з
жовчю в кишечник і зворотного всмоктування
зв'язаного білірубіну в кров – механічна або
підпечінкова жовтуха.
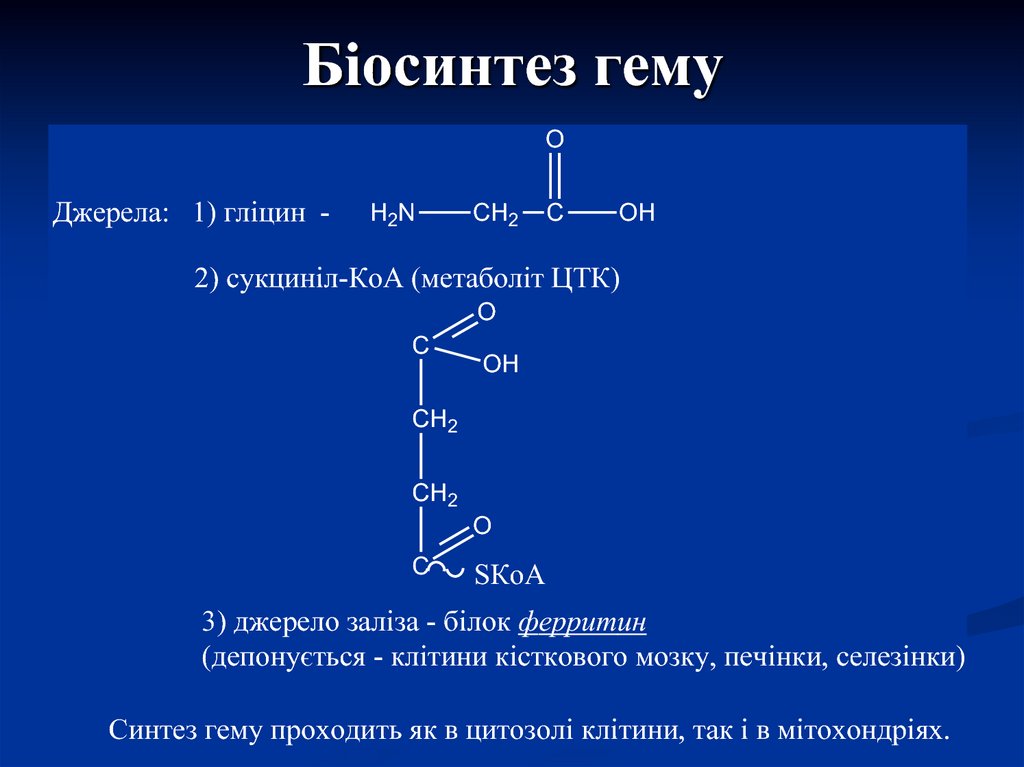
47. Біосинтез гему
OДжерела: 1) гліцин -
H2N
CH2
C
OH
2) сукциніл-КоА (метаболіт ЦТК)
O
C
OH
CH2
CH2
O
C
SКоА
3) джерело заліза - білок ферритин
(депонується - клітини кісткового мозку, печінки, селезінки)
Синтез гему проходить як в цитозолі клітини, так і в мітохондріях.
48.
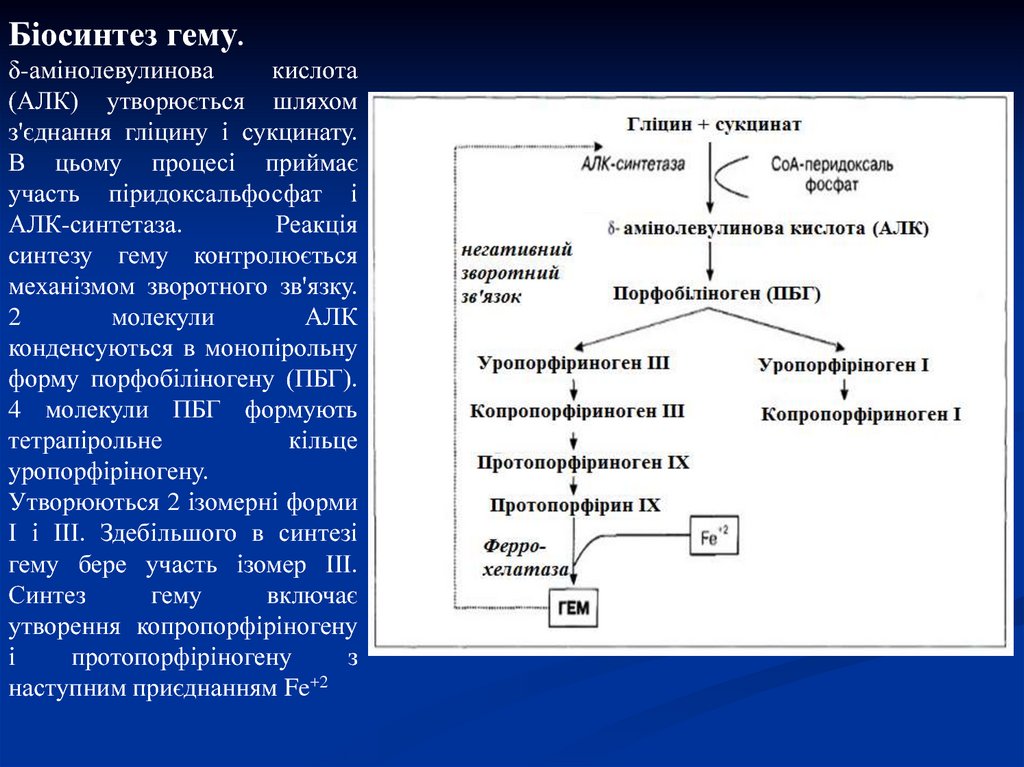
Біосинтез гему.δ-амінолевулинова
кислота
(АЛК) утворюється шляхом
з'єднання гліцину і сукцинату.
В цьому процесі приймає
участь піридоксальфосфат і
АЛК-синтетаза.
Реакція
синтезу гему контролюється
механізмом зворотного зв'язку.
2
молекули
АЛК
конденсуються в монопірольну
форму порфобіліногену (ПБГ).
4 молекули ПБГ формують
тетрапірольне
кільце
уропорфіріногену.
Утворюються 2 ізомерні форми
І і ІІІ. Здебільшого в синтезі
гему бере участь ізомер ІІІ.
Синтез
гему
включає
утворення копропорфіріногену
і
протопорфіріногену
з
наступним приєднанням Fe+2
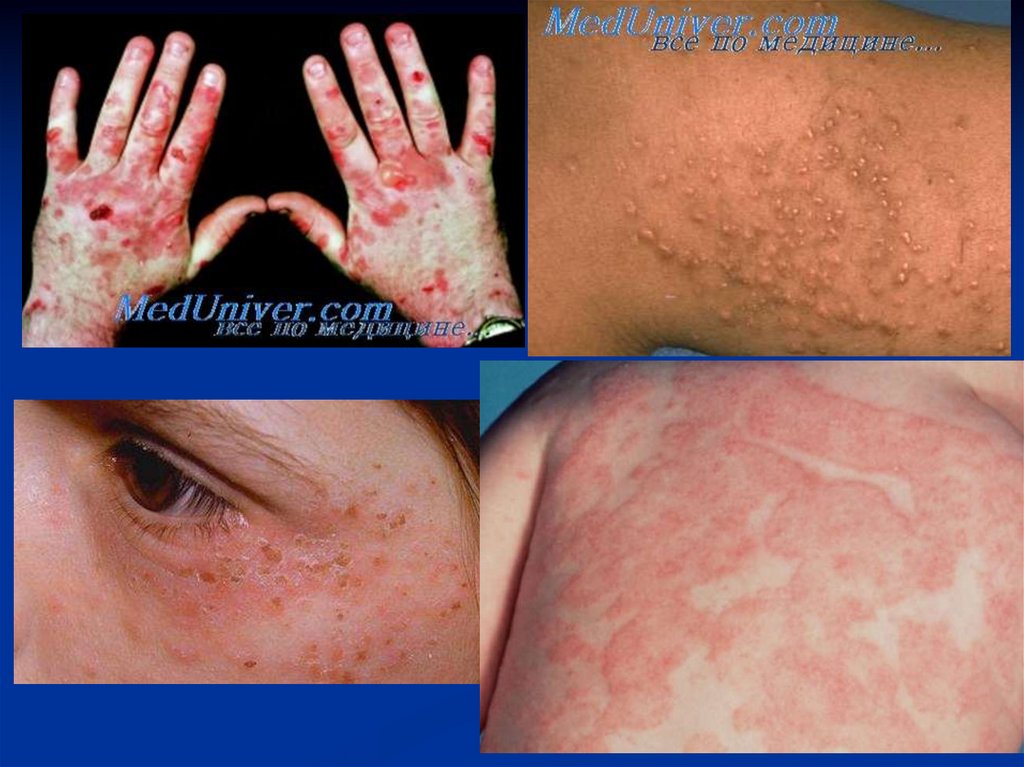
49. Патології
Відомо ряд захворювань, причинами яких єспадкові
або
набуті
порушення
порфіринового синтезу, так звані порфірії.
Більшість цих захворювань приводять до
виділення попередників гему з калом або
сечею, яка внаслідок цього може бути
забарвлена в темно-червоний колір.
Також
спостерігається
відкладення
порфіринів у шкірі. При дії світла це
приводить до утворення важковиліковних
пухирів.
50.
При порфіріях частими є також неврологічніпорушення. Можливо, що в основі
середньовічних легенд про людей-вампірів
(дракул) є дивна поведінка хворих порфіріями
(світлобоязнь, незвична зовнішність та
поведінка, вживання крові в їжу, що компенсує
дефіцит гему і часто поліпшує стан при деяких
формах порфірій).

































 Химия
Химия








