Похожие презентации:
Образование раствора
1.
2.
Образование раствора:• Физическая теория
• Химическая
Взаимодействие частиц:
Силы Ван-дер-Ваальса
Ион-дипольное
Специфичное
2
3.
Растворы газов в газах:Общее давление газовой смеси равно сумме парциальных
давлений всех входящих в неё газов.
3
4.
Растворимость газов в жидкостяхРастворимость газа в жидкости прямо пропорциональна его
давлению над жидкостью
Закон Генри – Дальтона справедлив только для разбавленных
растворов при малых давлениях, когда газы можно считать
идеальными.
Растворимость газов в жидкостях существенно зависит от температуры;
количественно данная зависимость определяется уравнением Клапейрона –
Клаузиуса (X – мольная доля газа в растворе, λ – тепловой эффект растворения 1
моля газа в его насыщенном растворе):
4
5.
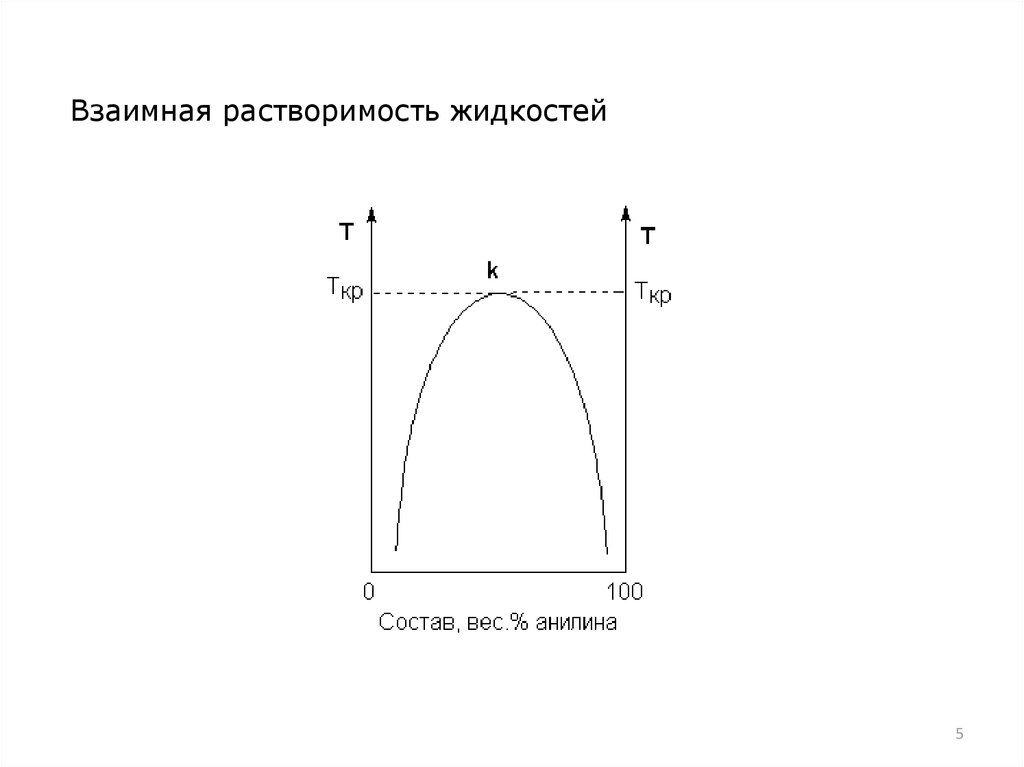
Взаимная растворимость жидкостей5
6.
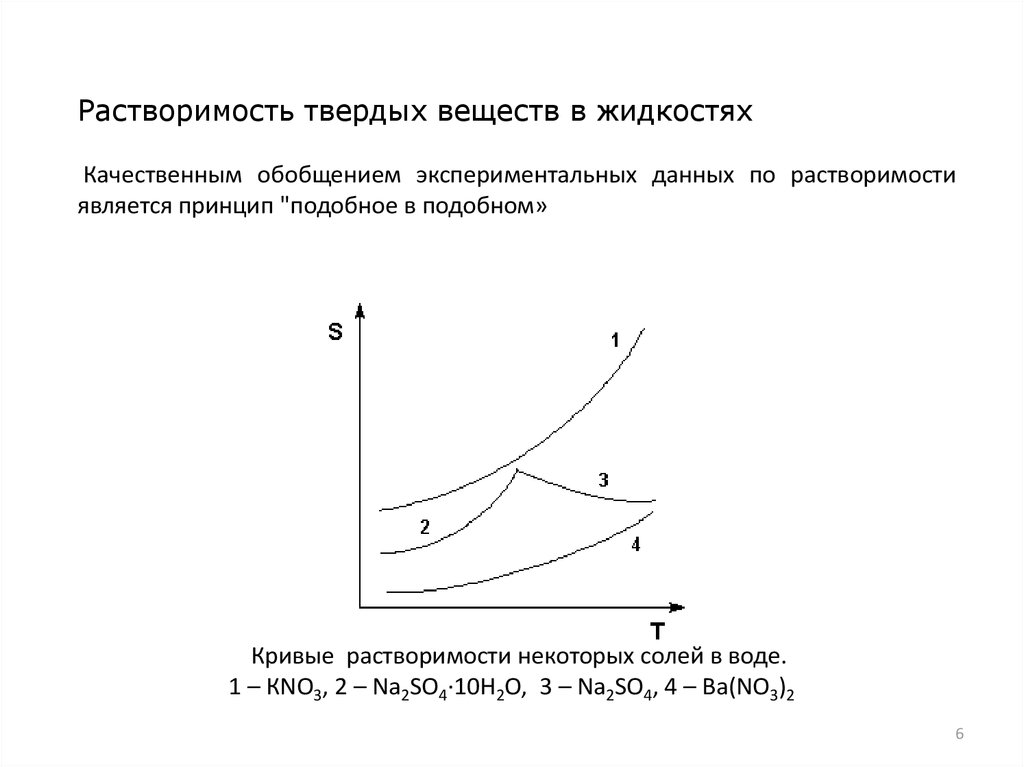
Растворимость твердых веществ в жидкостяхКачественным обобщением экспериментальных данных по растворимости
является принцип "подобное в подобном»
Кривые растворимости некоторых солей в воде.
1 – КNО3, 2 – Nа2SО4·10Н2О, 3 – Nа2SО4, 4 – Ва(NО3)2
6
7.
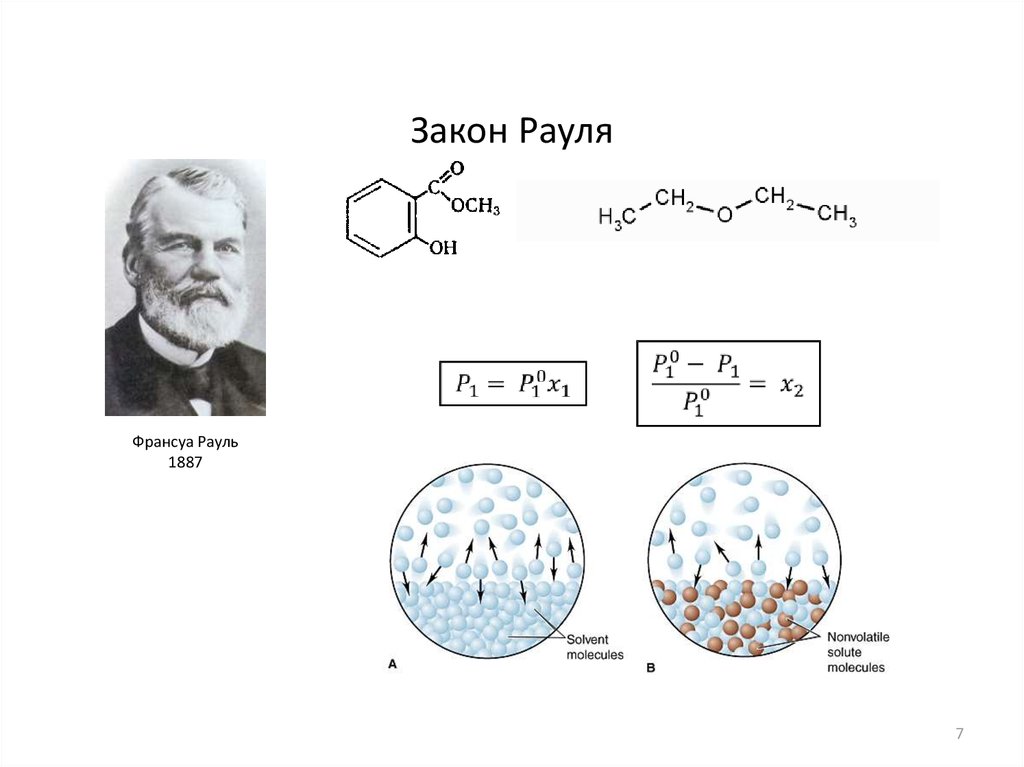
Закон РауляФрансуа Рауль
1887
7
8.
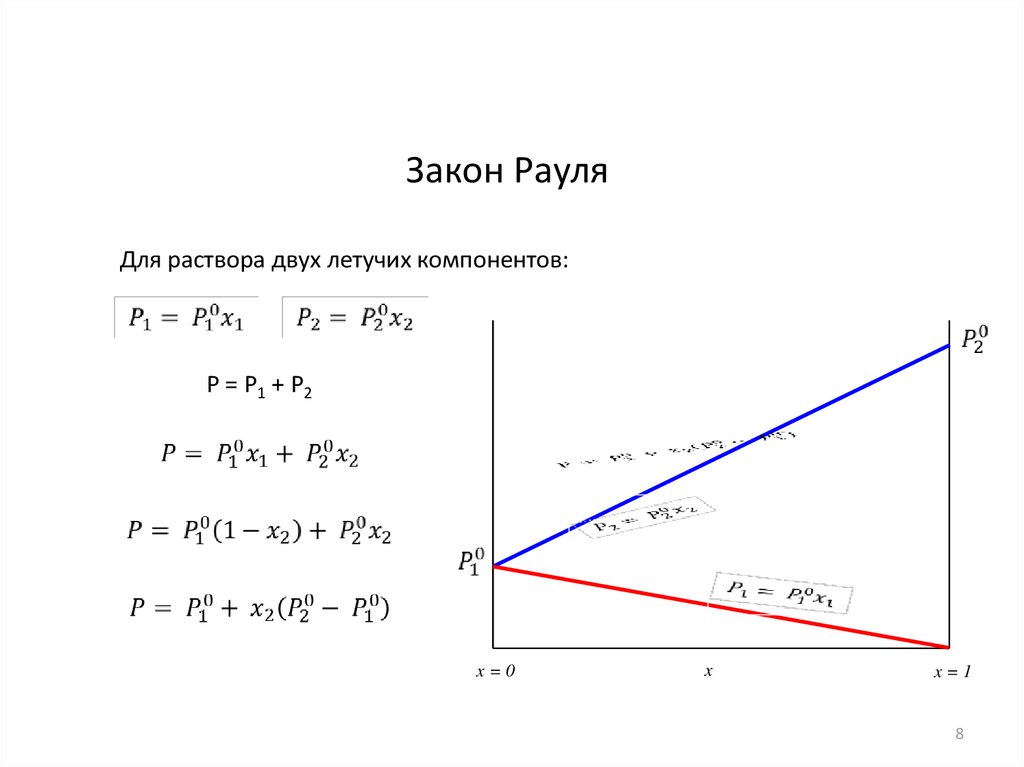
Закон РауляДля раствора двух летучих компонентов:
P = P1 + P2
x=0
x
x=1
8
9.
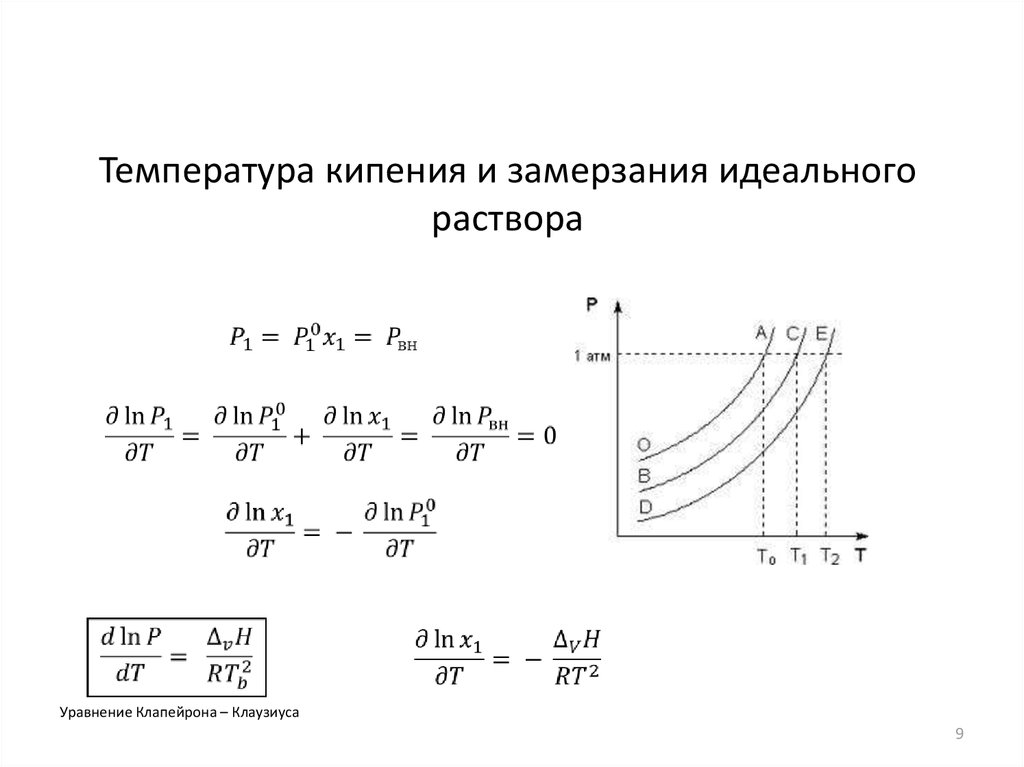
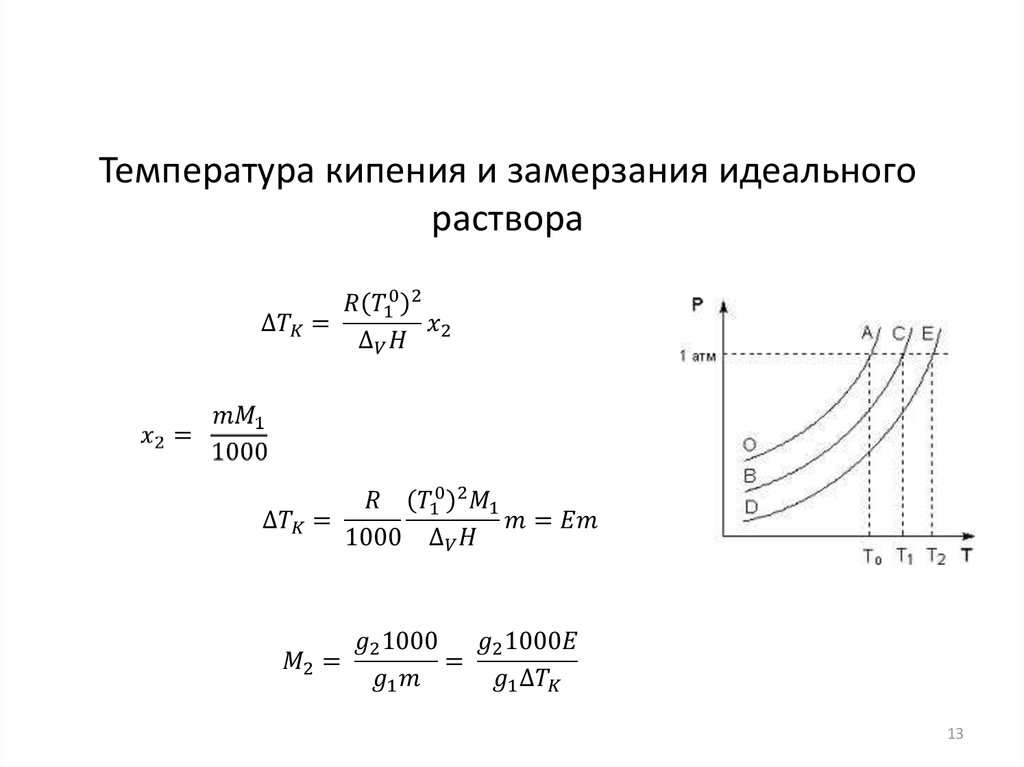
Температура кипения и замерзания идеальногораствора
Уравнение Клапейрона – Клаузиуса
9
10.
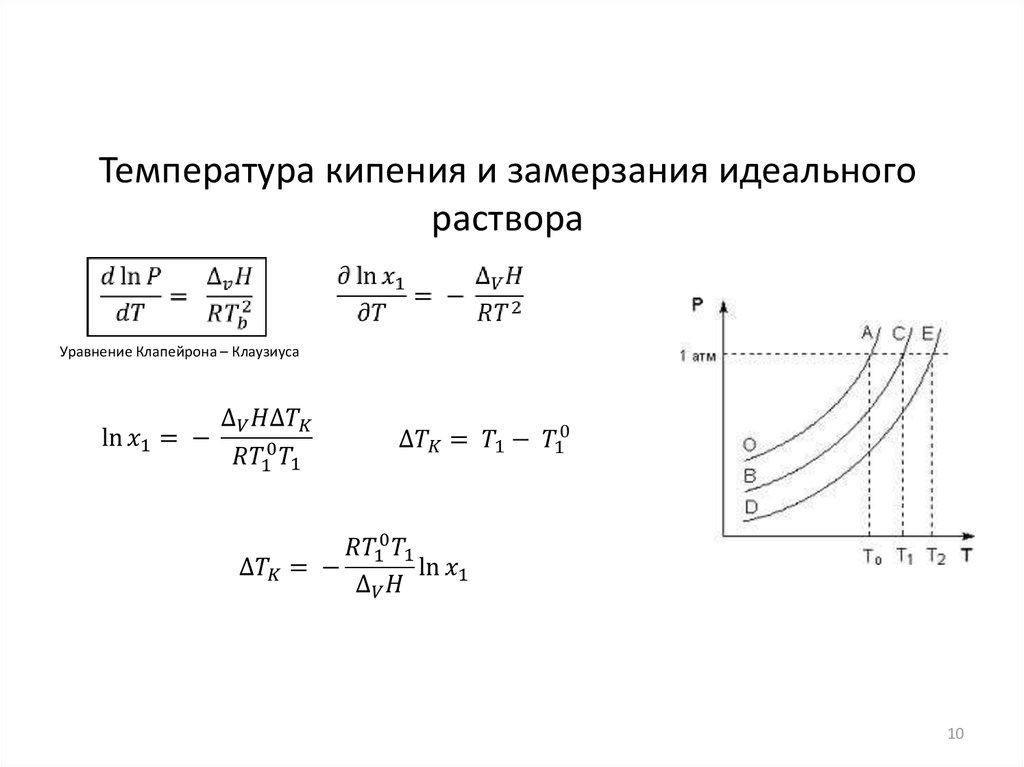
Температура кипения и замерзания идеальногораствора
Уравнение Клапейрона – Клаузиуса
10
11.
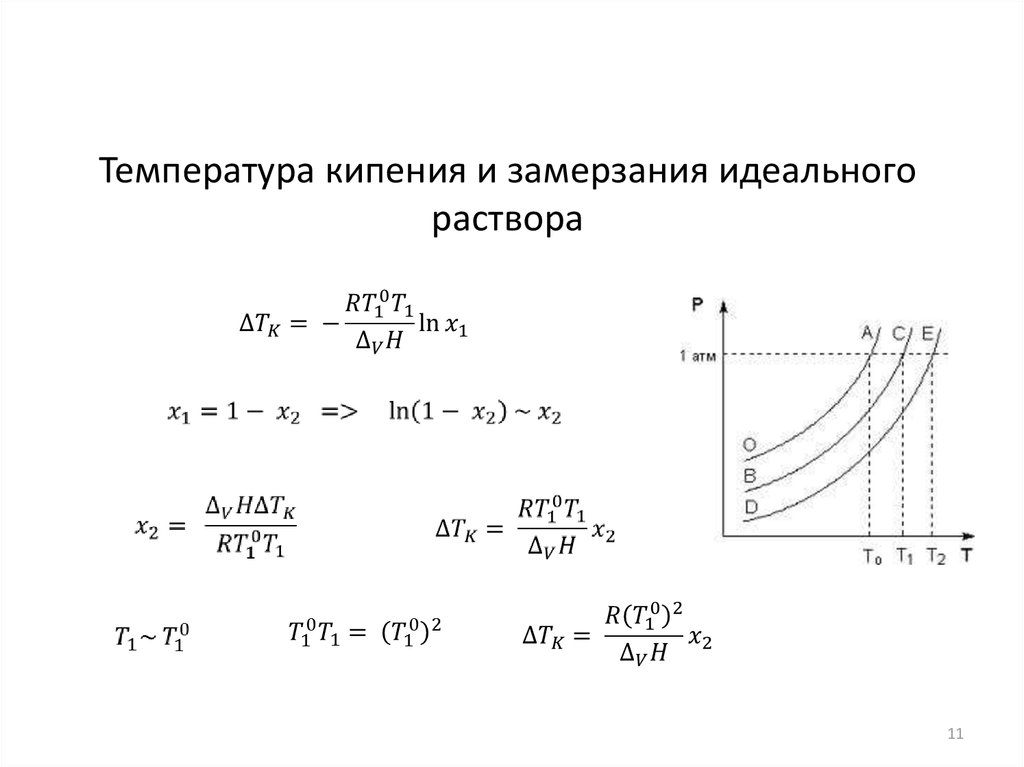
Температура кипения и замерзания идеальногораствора
11
12.
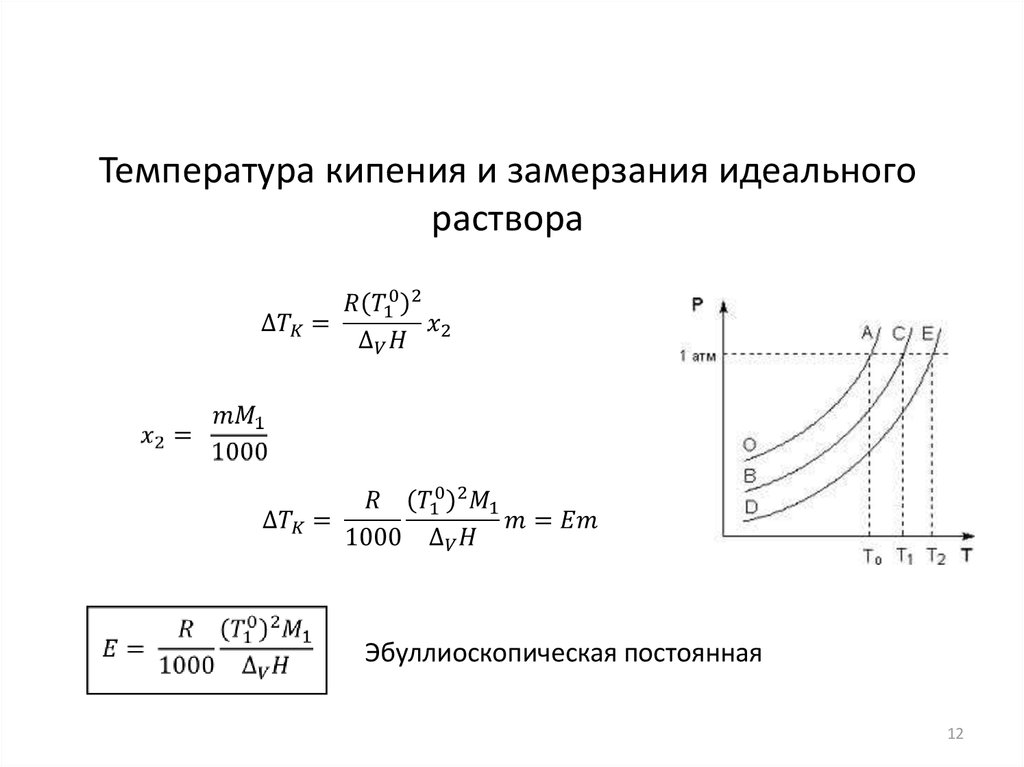
Температура кипения и замерзания идеальногораствора
Эбуллиоскопическая постоянная
12
13.
Температура кипения и замерзания идеальногораствора
13
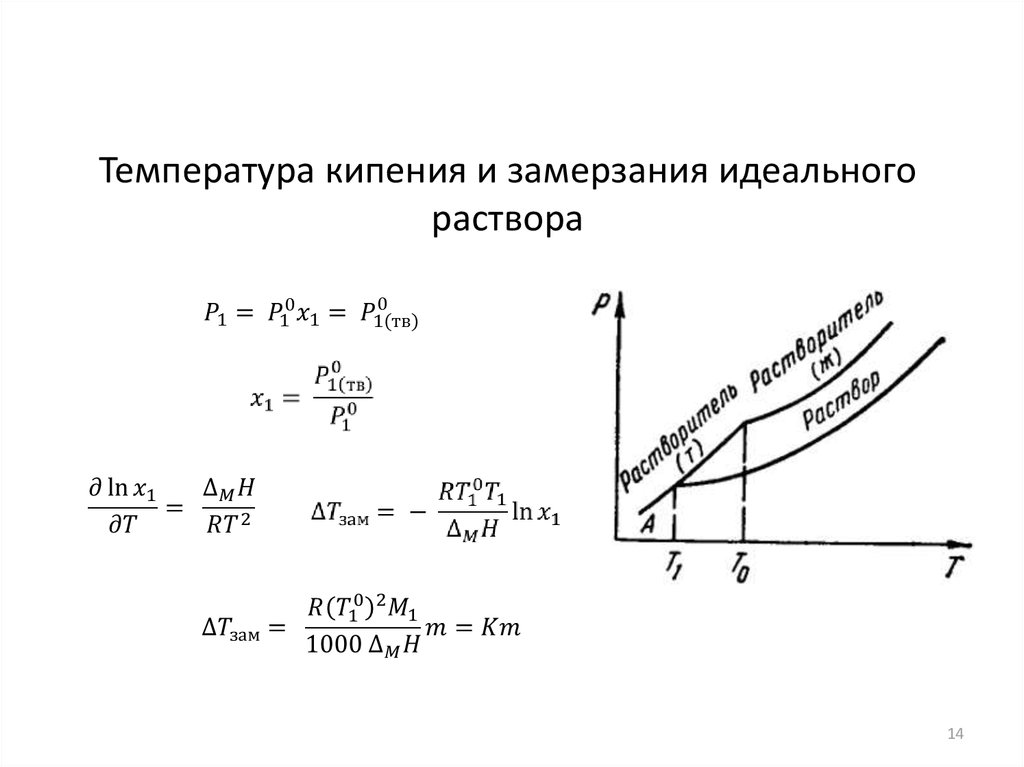
14.
Температура кипения и замерзания идеальногораствора
14
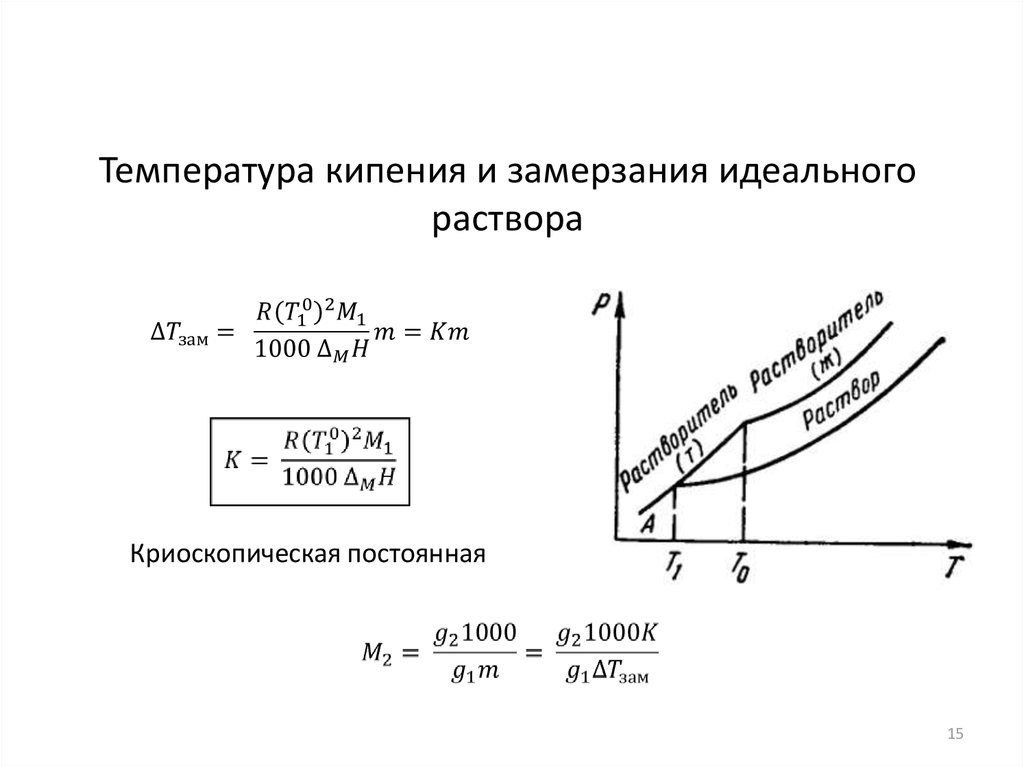
15.
Температура кипения и замерзания идеальногораствора
Криоскопическая постоянная
15
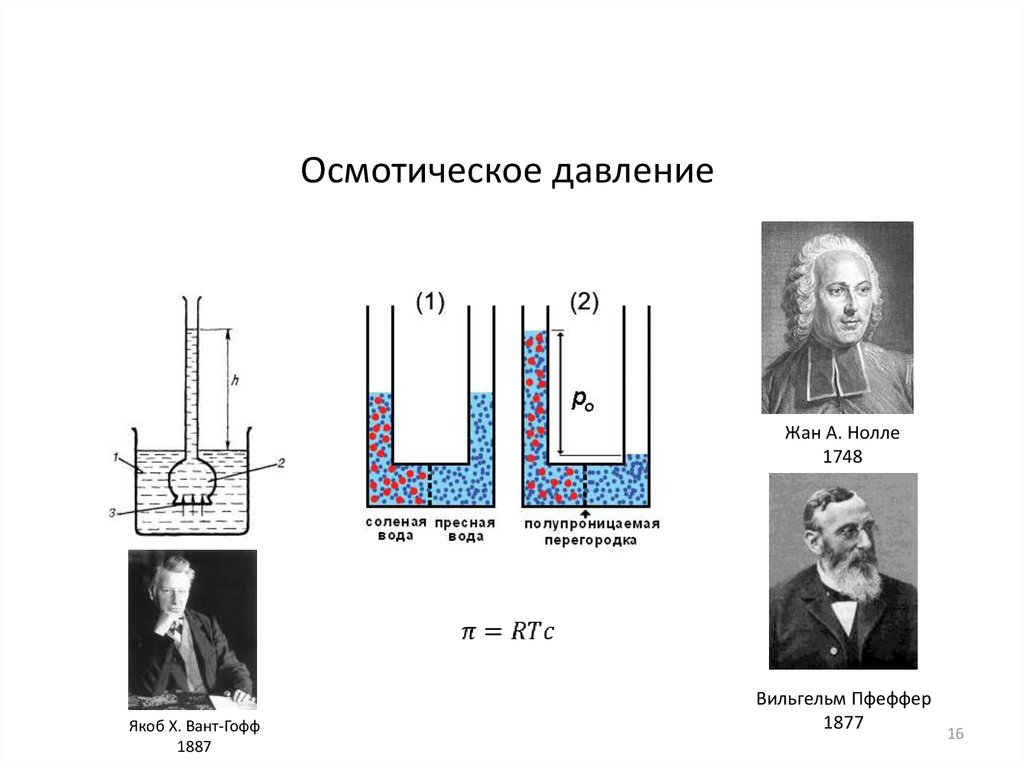
16.
Осмотическое давлениеЖан А. Нолле
1748
Якоб Х. Вант-Гофф
1887
Вильгельм Пфеффер
1877
16
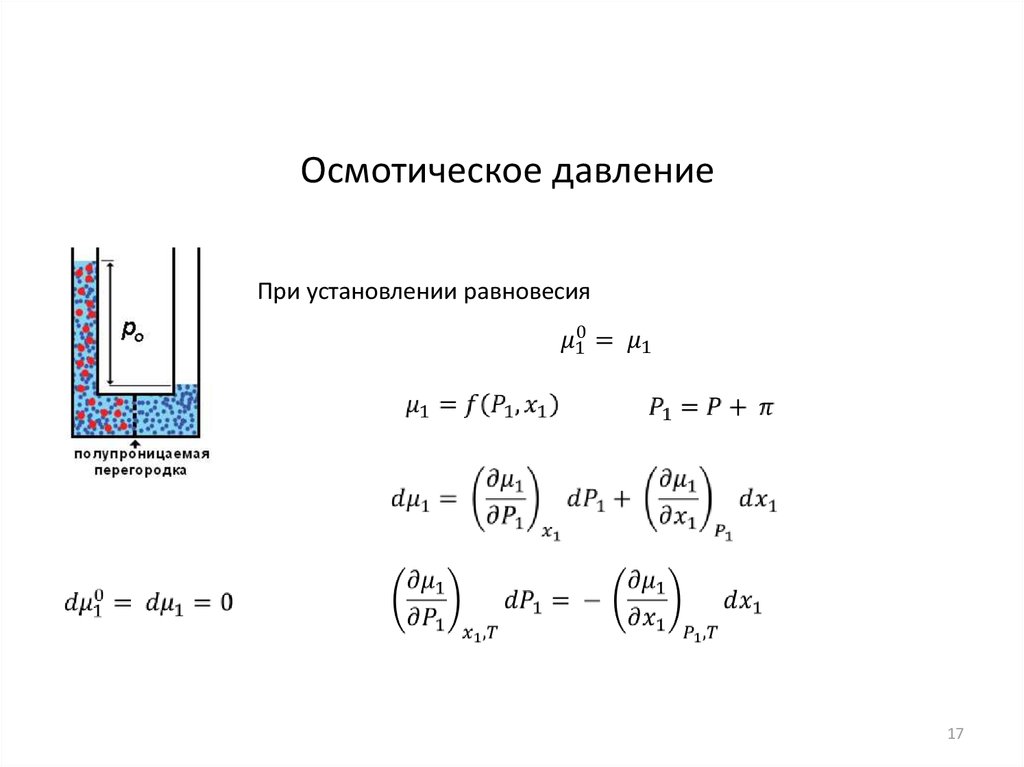
17.
Осмотическое давлениеПри установлении равновесия
17
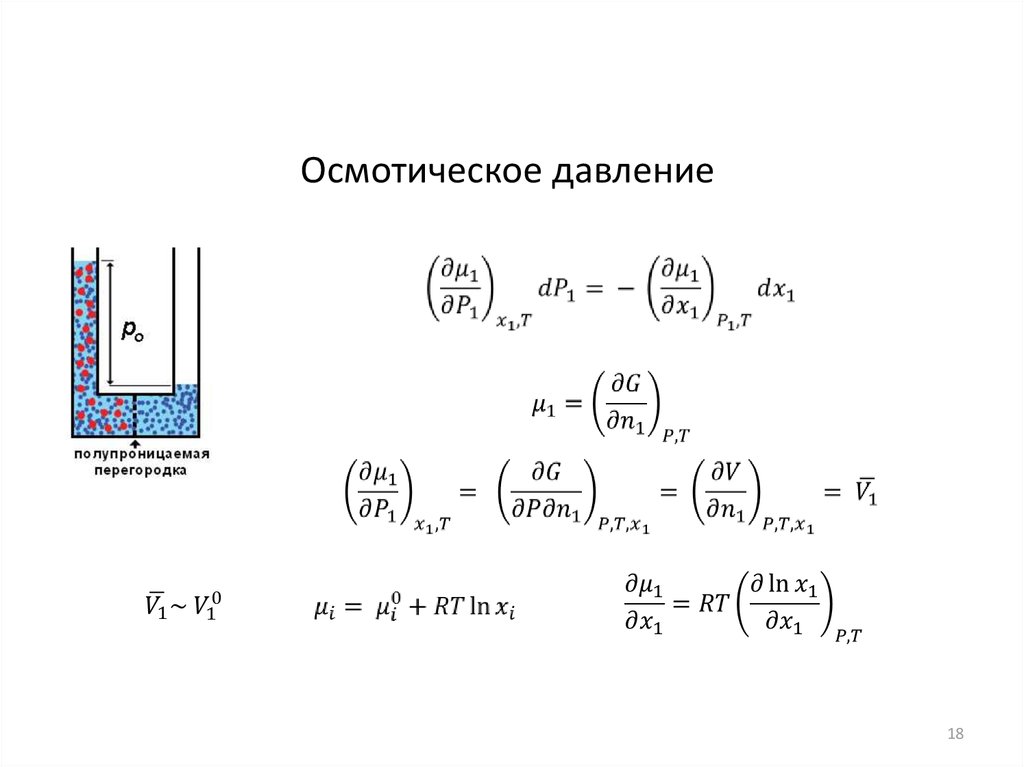
18.
Осмотическое давление18
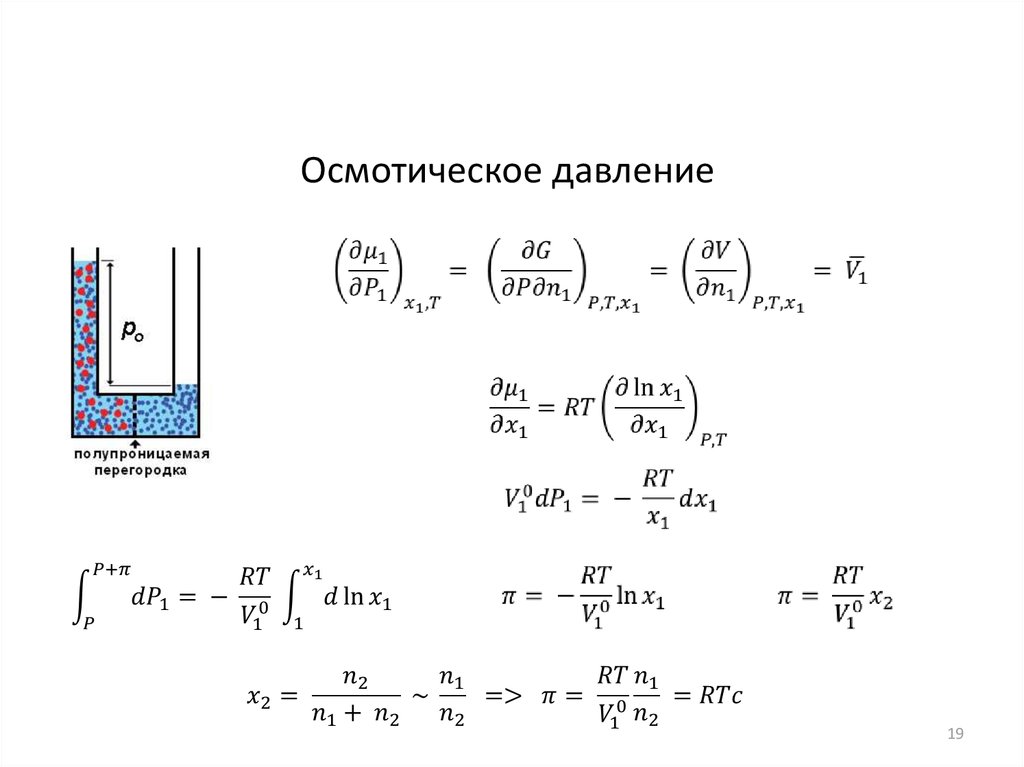
19.
Осмотическое давление19
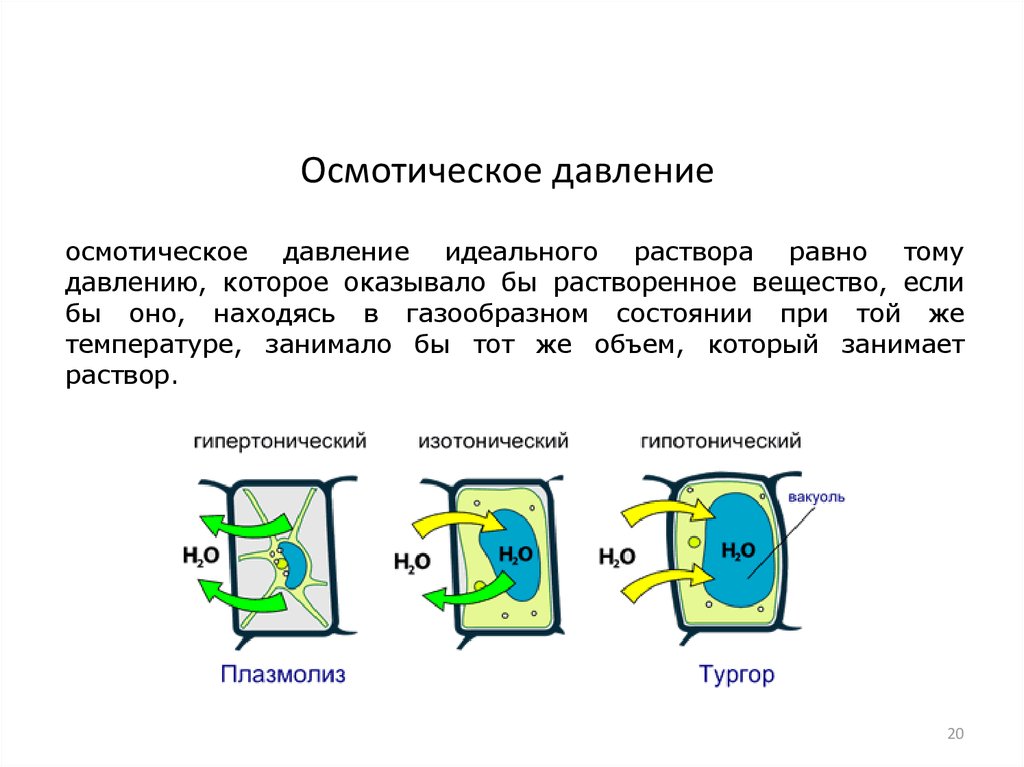
20.
Осмотическое давлениеосмотическое давление идеального раствора равно тому
давлению, которое оказывало бы растворенное вещество, если
бы оно, находясь в газообразном состоянии при той же
температуре, занимало бы тот же объем, который занимает
раствор.
20
21.
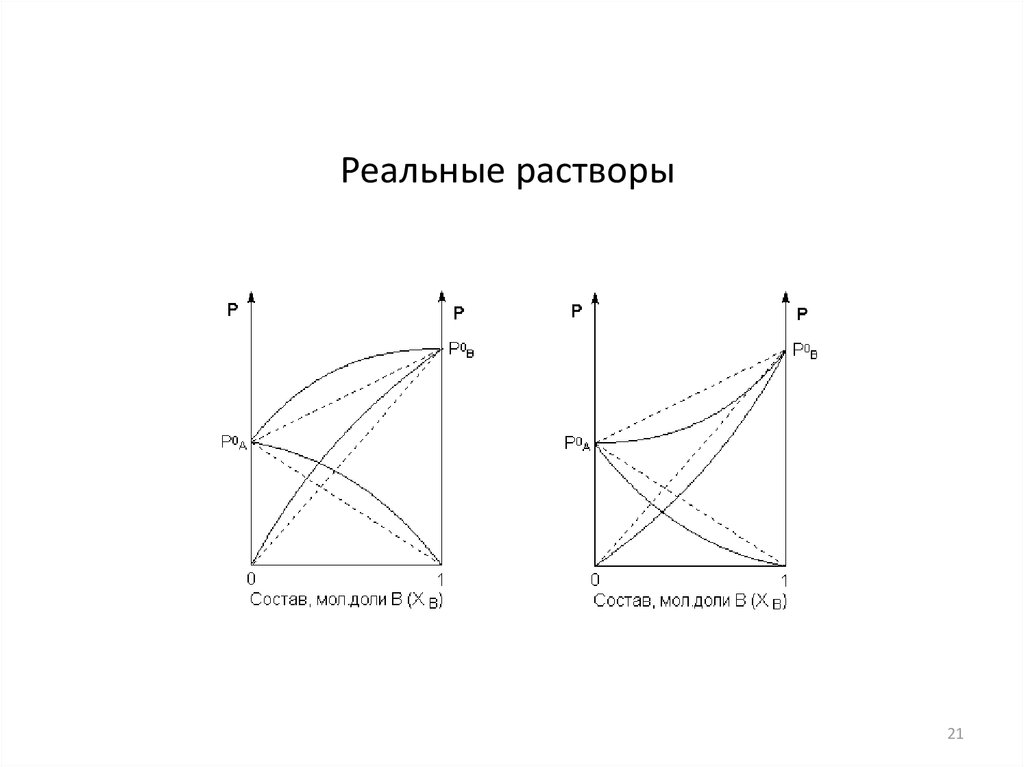
Реальные растворы21
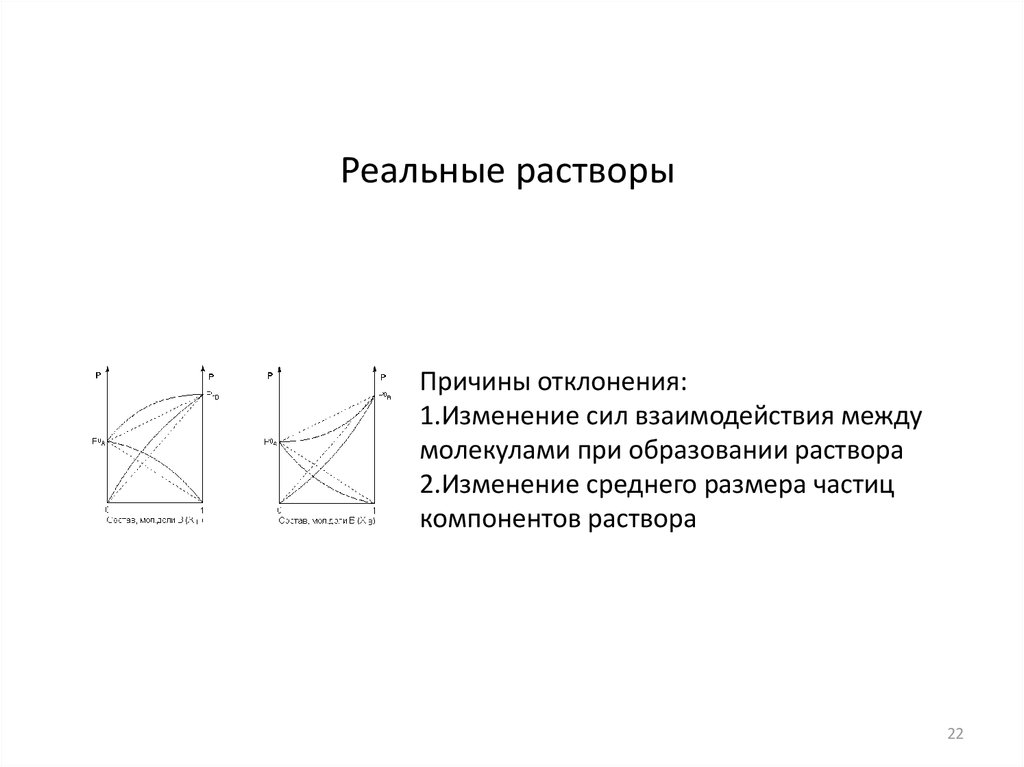
22.
Реальные растворыПричины отклонения:
1.Изменение сил взаимодействия между
молекулами при образовании раствора
2.Изменение среднего размера частиц
компонентов раствора
22
23.
РАСТВОРЫ ЭЛЕКТРОЛИТОВС. Аррениус предложил теорию электролитической
диссоциации, основывающуюся на следующих постулатах:
1.
Электролиты в растворах распадаются на ионы –
диссоциируют;
2.
Диссоциация
процессом;
является
обратимым
равновесным
3. Силы взаимодействия ионов с молекулами растворителя
и друг с другом малы (т.е. растворы являются
идеальными).
23
24.
РАСТВОРЫ ЭЛЕКТРОЛИТОВАaВb <––> aАx- + bВy+
Для бинарного (распадающегося на два иона) электролита
24
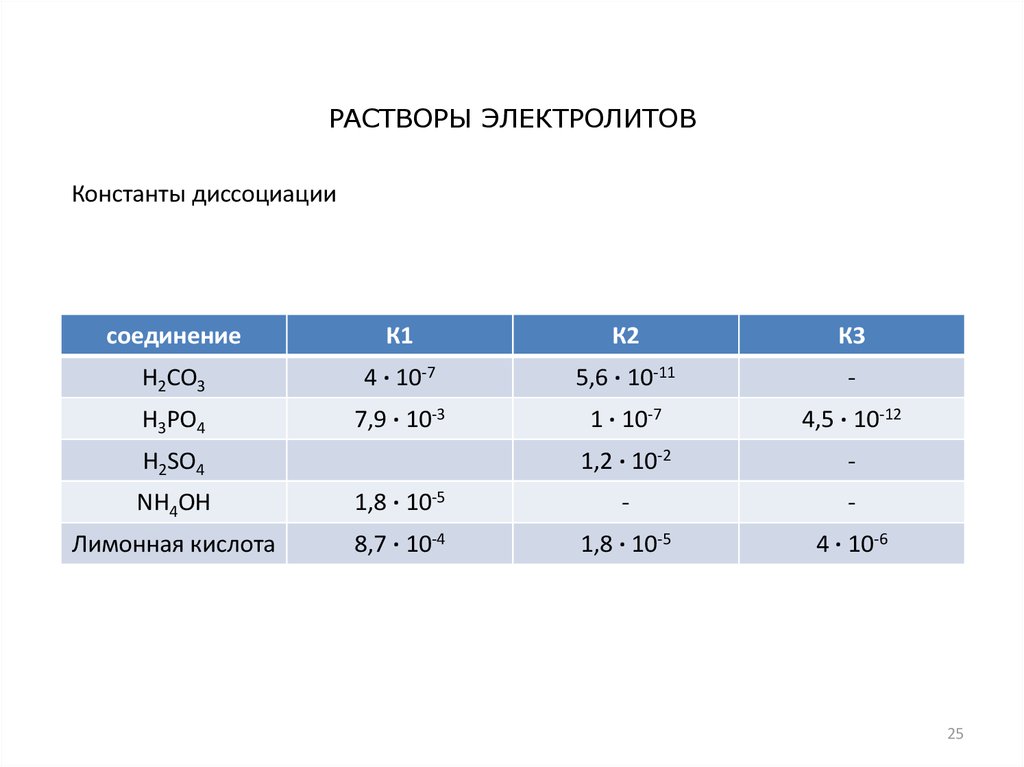
25.
РАСТВОРЫ ЭЛЕКТРОЛИТОВКонстанты диссоциации
соединение
К1
К2
К3
H2CO3
4 · 10-7
5,6 · 10-11
-
H3PO4
7,9 · 10-3
1 · 10-7
4,5 · 10-12
1,2 · 10-2
-
H2SO4
NH4OH
1,8 · 10-5
-
-
Лимонная кислота
8,7 · 10-4
1,8 · 10-5
4 · 10-6
25
26.
РАСТВОРЫ ЭЛЕКТРОЛИТОВДля разбавленных растворов можно считать, что (1 – α) = 1.
закон разбавления Оствальда.
изотонический коэффициент показывает, во сколько раз общее число молекул и
ионов в растворе больше числа молекул до диссоциации
26
27.
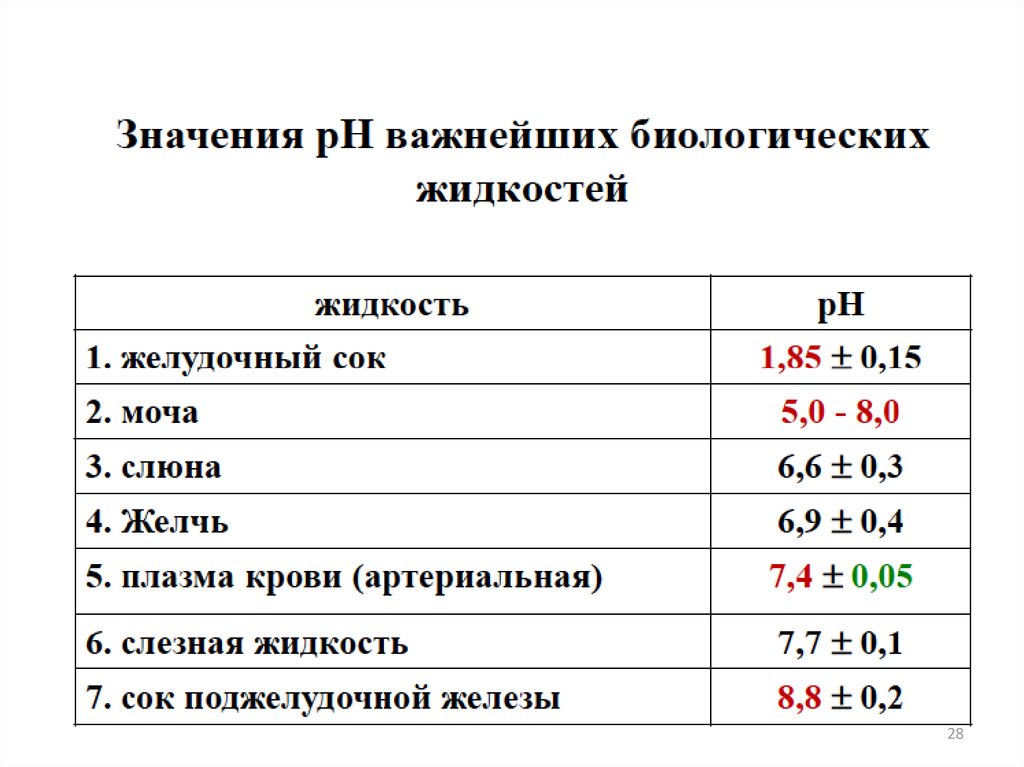
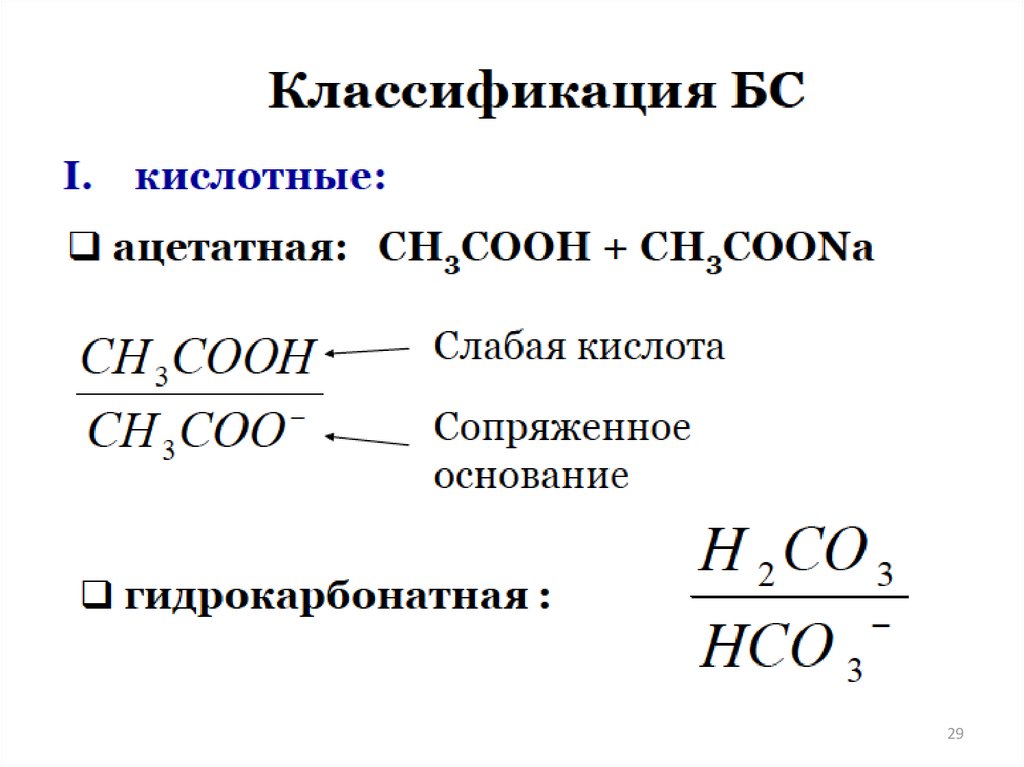
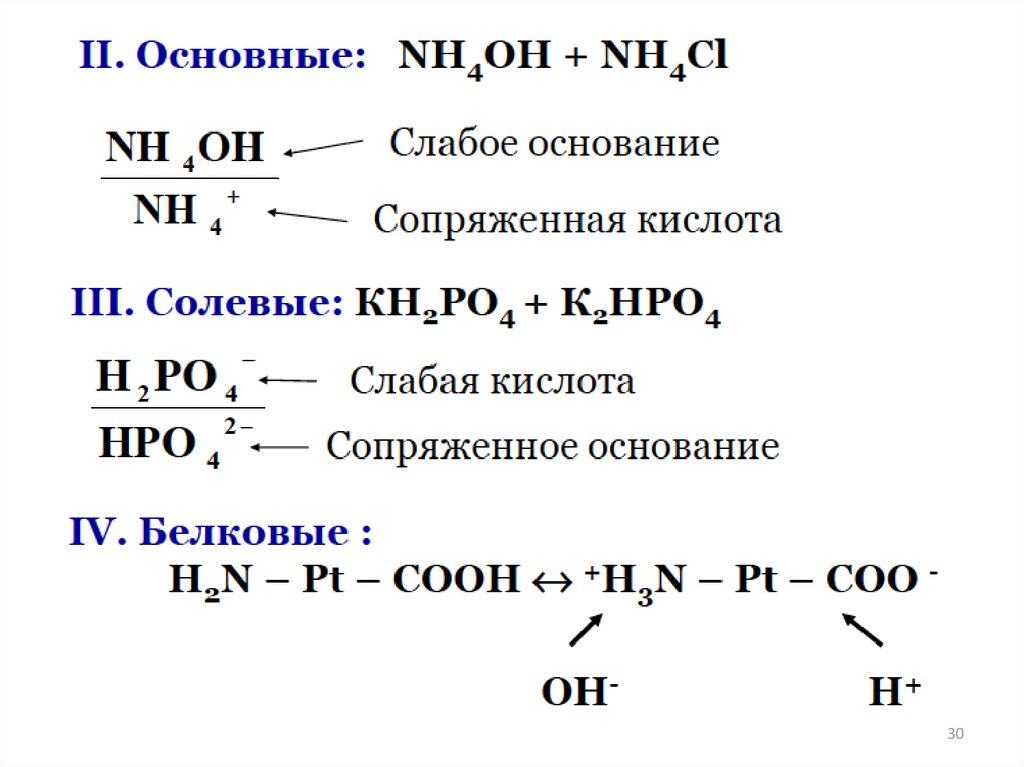
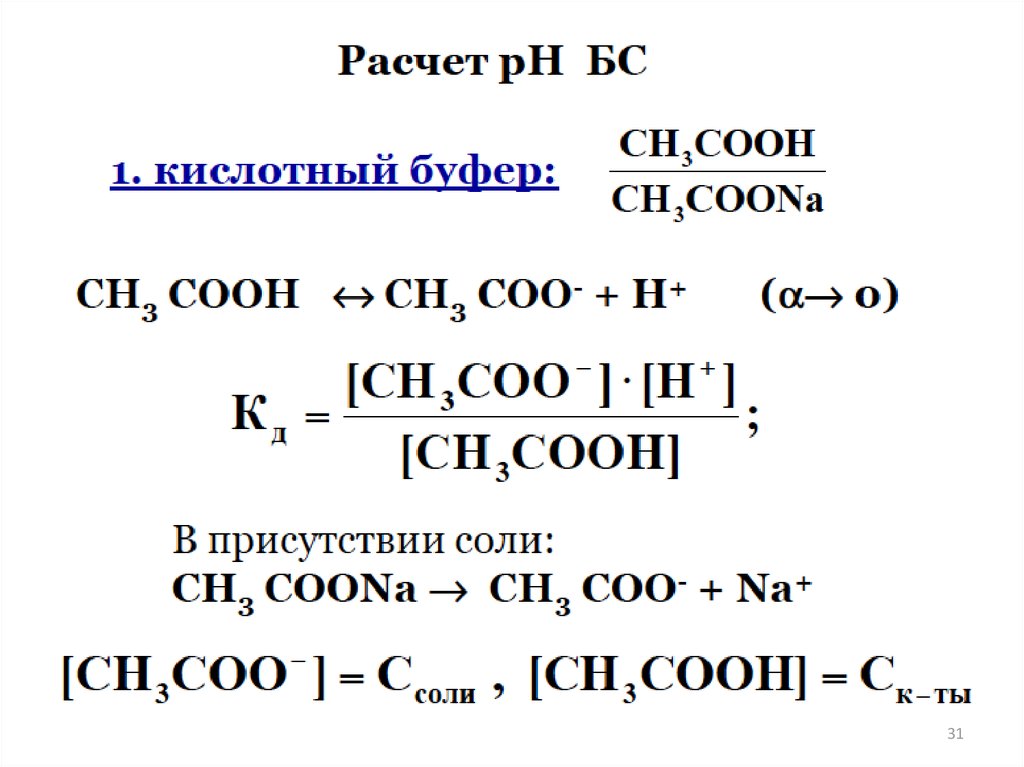
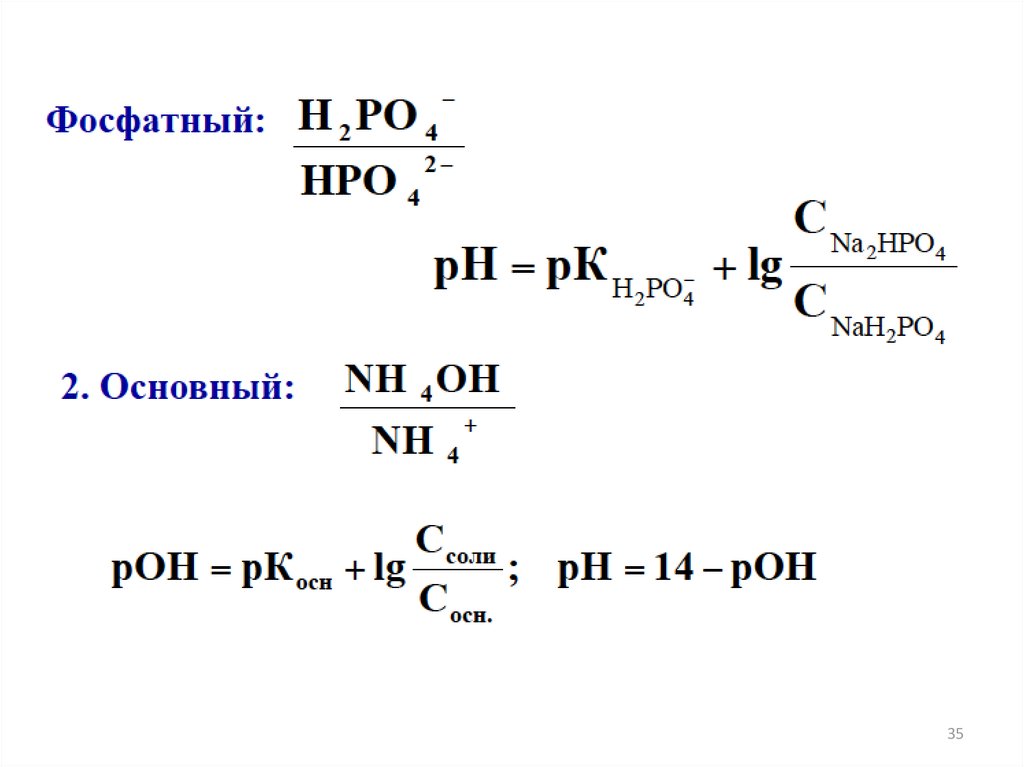
БУФЕРНЫЕ РАСТВОРЫ27















 Химия
Химия








