Похожие презентации:
Растворы. Общие свойства растворов
1.
Федеральное агенство по образованиюМосковская государственная академия тонкой химической
технологии имени М.В. Ломоносова
Кафедра неорганической химии
Савинкина Е.В.
Лекции по общей и неорганической химии
Растворы
Учебное пособие
Москва
МИТХТ им. М.В. Ломоносова
2010
1
2. УДК 546.04 ББК 24.1
Рецензент: д.х.н. Киселев Ю.М. (химический факультет МГУ)Рекомендовано к изданию кафедрой неорганической химии МИТХТ
(протокол № 3 от 10.11.2010)
Е.В. Савинкина 2010
МИТХТ им. М.В. Ломоносова 2010
Утверждено Библиотечно-издательской комиссией МИТХТ им. М.В.Ломоносова
в качестве учебного пособия для студентов 1 курса бакалавриата по
направлениям 020100 62 (Химия), 240100 62 (Химическая технология и
биотехнология), 150600 62 (Материаловедение и технология новых
материалов), 280200 (Защита окружающей среды), 200500 62 (Метрология,
стандартизация и сертификация), 080500 (Менеджмент).
Один оптический диск
2
Объем данных 0,9 Мб
3. Растворы
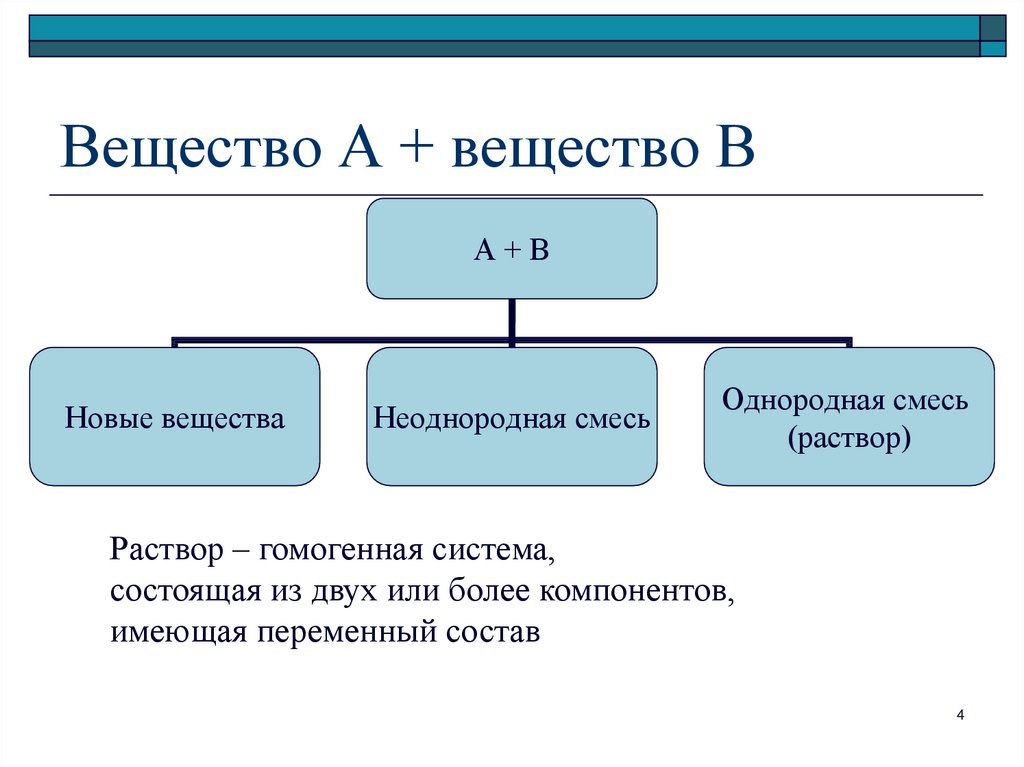
Общие свойства растворов4. Вещество А + вещество В
А+ВНовые вещества
Неоднородная смесь
Однородная смесь
(раствор)
Раствор – гомогенная система,
состоящая из двух или более компонентов,
имеющая переменный состав
4
5. Смеси веществ
СмесиГрубодисперсные
системы (взвеси)
Тонкодисперсные
системы (коллоидные
системы)
Истинные растворы
Размеры частиц
более 100 нм
1 – 100 нм
менее 1 нм
5
6. Грубодисперсные системы
Дисперсионная среда – газообразнаяДисперсная фаза:
Дисперсионная среда – жидкая
Дисперсионная фаза:
твердая – пыль, дым, порошок
жидкая – смог, облако, туман
твердая – суспензия, паста
жидкая – эмульсия
газообразная – пена, газированная вода
Дисперсионная среда – твердая
Дисперсная фаза:
твердая – горные породы, цветные стекла, композиты
жидкая – твердые эмульсии
газообразная – твердые пены
6
7. Истинные растворы
Агрегатное состояние: газообразные,жидкие, твердые растворы
Состав раствора: растворитель +
растворенное вещество
Параметры раствора: температура,
давление, содержание растворенного
вещества
7
8. Количественный состав раствора
Массовая доляМолярная концентрация
(молярность)
Эквивалентная
концентрация
(нормальность)
Коэффициент
растворимости
Мольная доля
Массовая концентрация
Моляльная концентрация
(моляльность)
m( B)
m( p)
n( B )
c( B)
V ( p)
w( B)
ceq ( B)
neq ( B)
V ( p)
m( B )
ks
m( s)
n( B )
n ( B ) n( s )
m( B)
( B)
V ( p)
n( B )
c m ( B)
m( s)
x( B)
8
9. Растворы
ИдеальныеΔV = 0; ΔQ = 0
Реальные
ΔV ≠ 0
1 л H2O + 1 л C2H5OH → 1,93 л раствора
ΔQ ≠ 0
Qрастворение = – Qразрыв связей + Qобразование связей
9
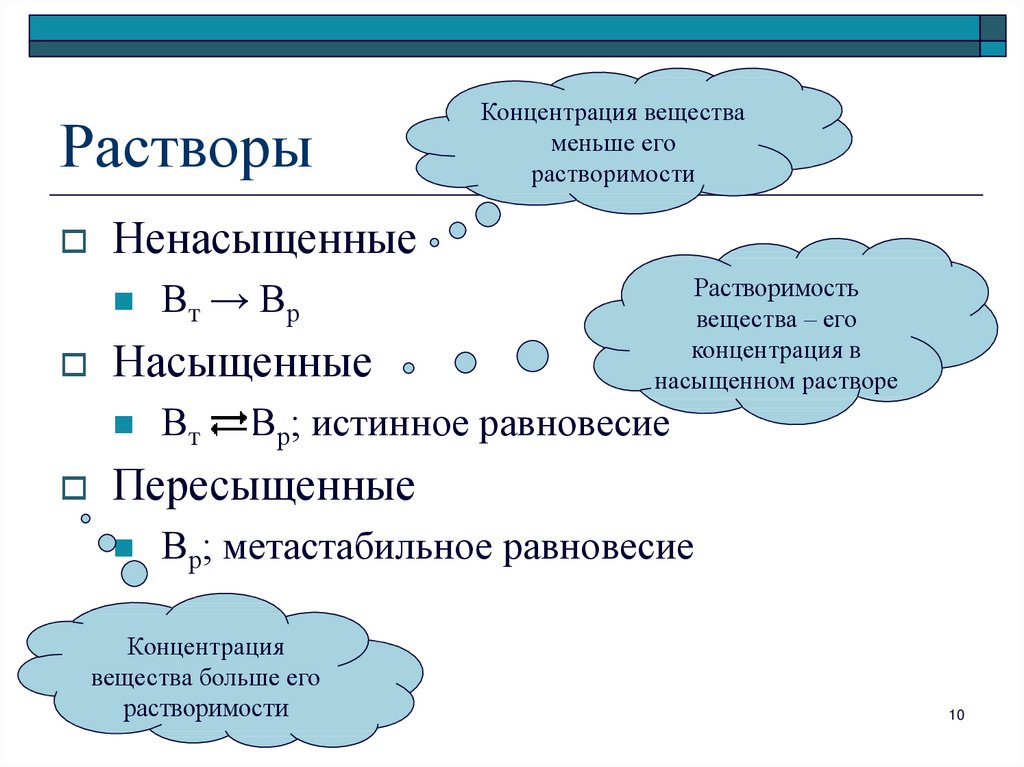
10. Растворы
НенасыщенныеВт → Вр
Насыщенные
Концентрация вещества
меньше его
растворимости
Вт
Растворимость
вещества – его
концентрация в
насыщенном растворе
Вр; истинное равновесие
Пересыщенные
Вр; метастабильное равновесие
Концентрация
вещества больше его
растворимости
10
11. Растворимость газов в жидкостях
Если нет химического взаимодействияAr(г)
Ar(р)
Влияние давления
= 1 0 (принцип Ле Шателье)
Увеличение давления →
(растворимость увеличивается)
Уменьшение давления ←
(растворимость уменьшается)
11
12. Растворимость газов в жидкостях
Влияние температурыQразрыв связей ≈ 0
Qрастворение > 0
Qобразование связей > 0
Процесс экзотермический (принцип Ле Шателье)
Уменьшение температуры →
(растворимость увеличивается)
Увеличение температуры ←
(растворимость уменьшается)
12
13. Растворимость газов в жидкостях
Если есть химическое взаимодействиеCl2(г) Cl2(р)
Cl2(р) + 2Н2О
НClО + Н2О
Н3О+ + Cl + НClО
Н3О+ + ClО
13
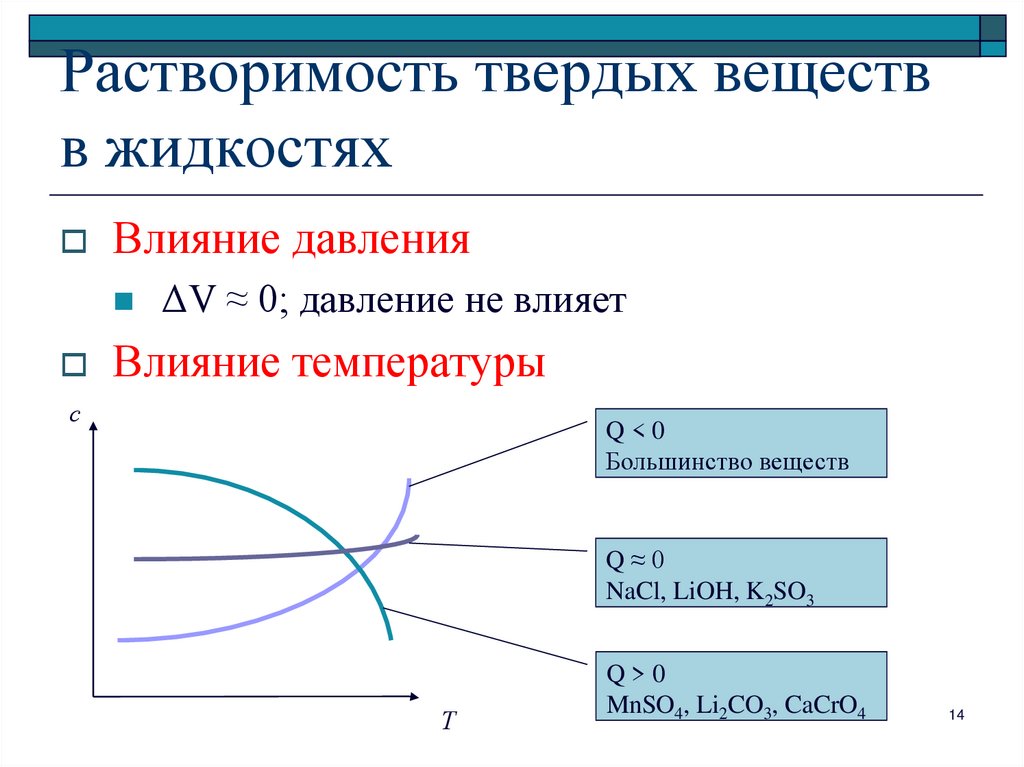
14. Растворимость твердых веществ в жидкостях
Влияние давленияΔV ≈ 0; давление не влияет
Влияние температуры
с
Q<0
Большинство веществ
Q≈0
NaCl, LiOH, K2SO3
Т
Q>0
MnSO4, Li2CO3, CaCrO4
14
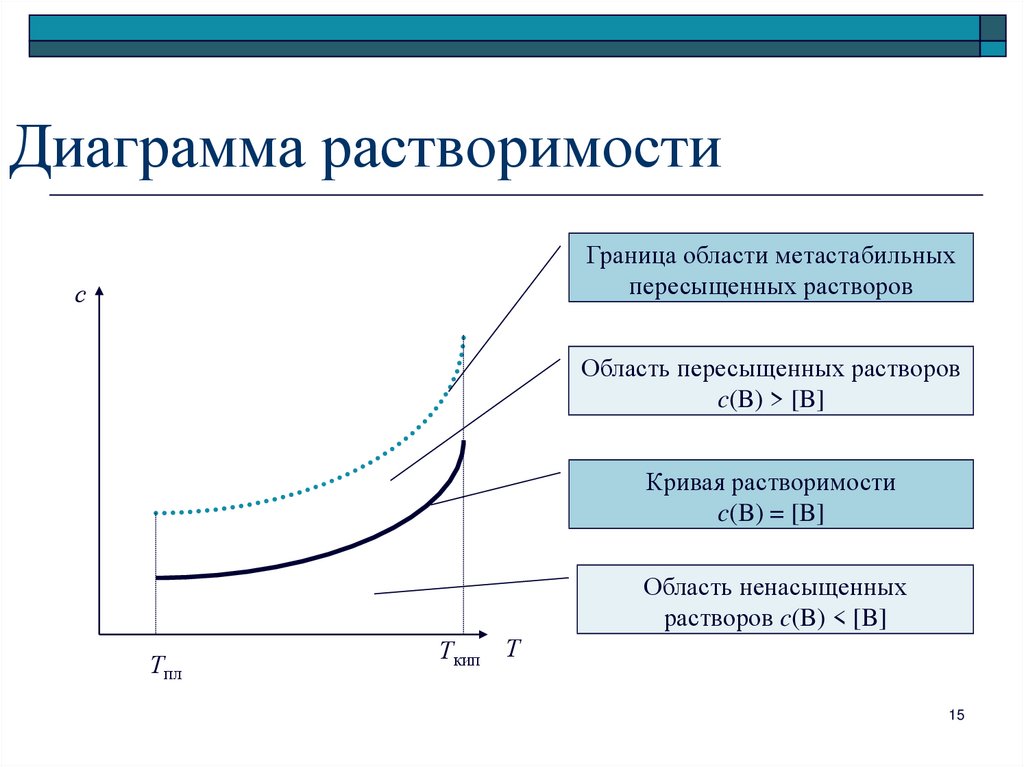
15. Диаграмма растворимости
Граница области метастабильныхпересыщенных растворов
с
Область пересыщенных растворов
c(B) > [B]
Кривая растворимости
c(B) = [B]
Область ненасыщенных
растворов c(B) < [B]
Тпл
Ткип
Т
15
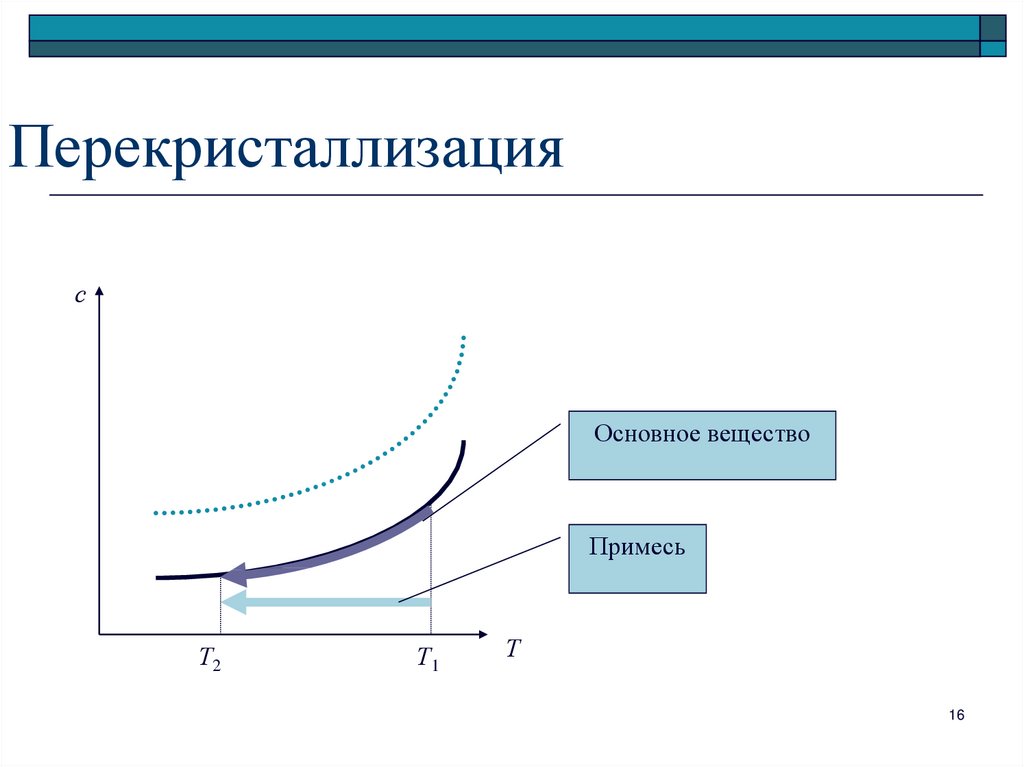
16. Перекристаллизация
сОсновное вещество
Примесь
Т2
Т1
Т
16
17. Растворы электролитов
Электролитическая диссоциация18. Сильные электролиты
MA M+(р) + A–(р)[MA] = 0, [M+] = [A–] = c0
Степень диссоциации:
nдисс. ( MA) n( M ) [ M ]
1
n0 ( MA)
n0 ( MA)
c0
18
19. Слабые электролиты
MA MA(р) + M+(р) + A–(р)[MA] > 0, [M+] = [A–] < c0
Степень диссоциации:
nдисс. ( MA) n( M ) [ M ]
1
n0 ( MA)
n0 ( MA)
c0
19
20. Слабые электролиты
MxAy(р)x Ma+(р) + y Ab–(р)
Константа диссоциации KD
KD
[M
a x
b y
] [A ]
[ M x Ay ]
20
21. Закон разбавления Оствальда
МАМ+ + А–
[M+] [A–]
KD = –––––––––
[MA]
[M+] = [A–] = c0
[MA] = (1 – ) c0
если << 1 ( < 0,05)
KD = 2 c0
KD = 2 c0 / (1 – )
KD
c0
α
1
c0
21
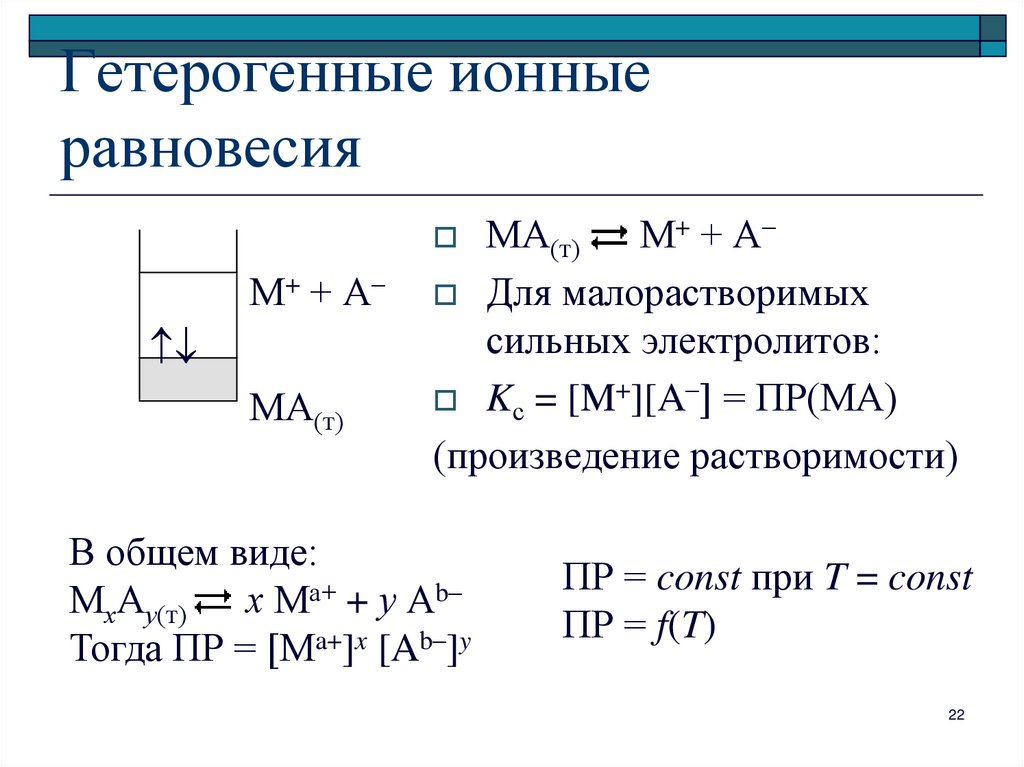
22. Гетерогенные ионные равновесия
МА(т)М+ + А–
Для малорастворимых
сильных электролитов:
Kс = [M+][A–] = ПР(МА)
(произведение растворимости)
М+ + А–
МА(т)
В общем виде:
МхАу(т) х Ма+ + у Аb–
Тогда ПР = [Ma+]x [Ab–]y
ПР = const при T = const
ПР = f(T)
22
23. Растворимость (L), моль/л
МхАу(т)х Ма+ + у Аb–
[Ma+] = x L; [Ab–] = y L
ПР(МхАу) = (x L)x (y L)y = xx yy Lx+y
L x y
ПР(M x Ay )
x
x y
y
23
24. Задача
Рассчитать растворимость сульфатасеребра, если ПР(Ag2SO4) = 1,2 . 10–5
Ag2SO4(т) 2Ag+ + SO42–
L
2L
L
ПР = [Ag+ ]2 [SO42–] = (2L)2L = 4L3
L
3
ПР
2
1,3 10 моль / л
4
24
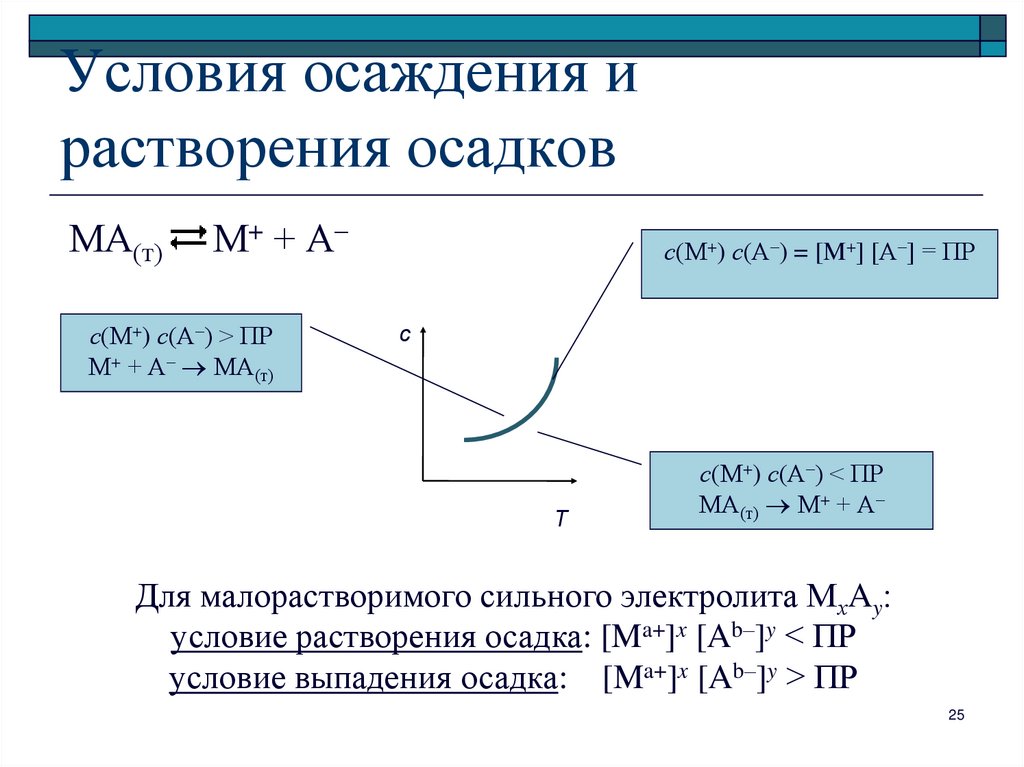
25. Условия осаждения и растворения осадков
МА(т)М+ + А–
с(М+) с(А–) > ПР
М+ + А– МА(т)
с(М+) с(А–) = [M+] [А–] = ПР
с
Т
с(М+) с(А–) < ПР
МА(т) М+ + А–
Для малорастворимого сильного электролита МхAy
условие растворения осадка: [Ma+]x [Ab–]y < ПР
условие выпадения осадка: [Ma+]x [Ab–]y > ПР
25
26. Введение одноименного иона
МхАу(т)х Ма+ + у Аb–
Увеличение с(Ма+) или с(Аb–)
Сдвиг равновесия в сторону образования
осадка
26
27. Удаление одноименного иона
МхАу(т)х Ма+ + у Аb–
Уменьшение с(Ма+) или с(Аb–)
Сдвиг равновесия в сторону растворения
осадка
27
28. Удаление одноименного иона
Связывание в виде менее растворимогоI
вещества (осадок AgCl
осадок AgI)
Связывание в виде комплексного иона
OH
[Pb(OH)4]2–)
(осадок PbSO4
Перевод в другую форму
H
(осадок BaCrO4
Cr2O72–)
28
29. Переосаждение
Ag2SO4(т)PO43–
Ag3PO4(т)
SO42–
3 Ag2SO4(т) + 2 PO43–
2 Ag3PO4(т) + 3 SO42– (1)
KС = [SO42–]3 / [ PO43–]2
Ag2SO4(т)
2Ag+ + SO42– (2)
ПР1 = [Ag+]2[SO42–]
ПР2 = [Ag+]3[ PO43–]
Ag3PO4(т)
3Ag+ + PO43– (3)
(1) = 3(2) – 2(3)
KС = (ПР1)3 / (ПР2)2 ~ (10–5)3/(10–18)2 > 1
29
30. В каком минимальном объеме воды можно растворить 1 г гипса?
Условие задачиV(H2O) = ?
m(CaSO4.2H2O) = 1 г
ПР(CaSO4) = 4.10–5
M(CaSO4.2H2O) = 172 г/моль
Уравнение фазового
равновесия
Са2+ + SО42–
CaSO4(т)
ПР(CaSO4) = [Ca2+] [SO42–] = c2
__
V(H2O) = n / c = m / (M c) = m / (M ПР) ~ 0,920 л
30
31. Выпадет ли осадок при сливании равных объемов миллимолярных растворов нитрата серебра(I) и хлорида натрия?
c0(AgNO3) = c0(NaCl) = 1.10–3 моль/лV(p.AgNO3) = V(p.NaCl)
ПР(AgCl) = 1,78 10–10
Для малорастворимого сильного электролита МхAy
условие выпадения осадка: [Ma+]x [Ab–]y > ПР
После смешивания растворов:
c(Ag+) = c0(Ag+) V(p.AgNO3) / (V(p.AgNO3) + V(p.NaCl)) =
= 1/2c0(Ag+) = 1/2c0(AgNO3)
c(Cl–) = 1/2c0(Cl–) = 1/2c0(NaCl)
1 2 c0(AgNO3) 1/2 c0(NaCl) = 2,5 10–7 > ПР(AgCl)
Осадок выпадет
31
32. Протолитическая теория кислот и оснований
1923 г.Йоханес Брёнстед
Томас Лаури
33. Протолитическая теория
кислотные или основные свойства частицобусловлены их способностью отдавать
или присоединять катион водорода
(протон Н+)
Н+
Н+
NH4+ + S2–
NH3 + HS–
Кт
Ос
Ос
Кт
Пары "сопряженная кислота / сопряженное основание":
NH4+/NH3 и HS –/ S2–
33
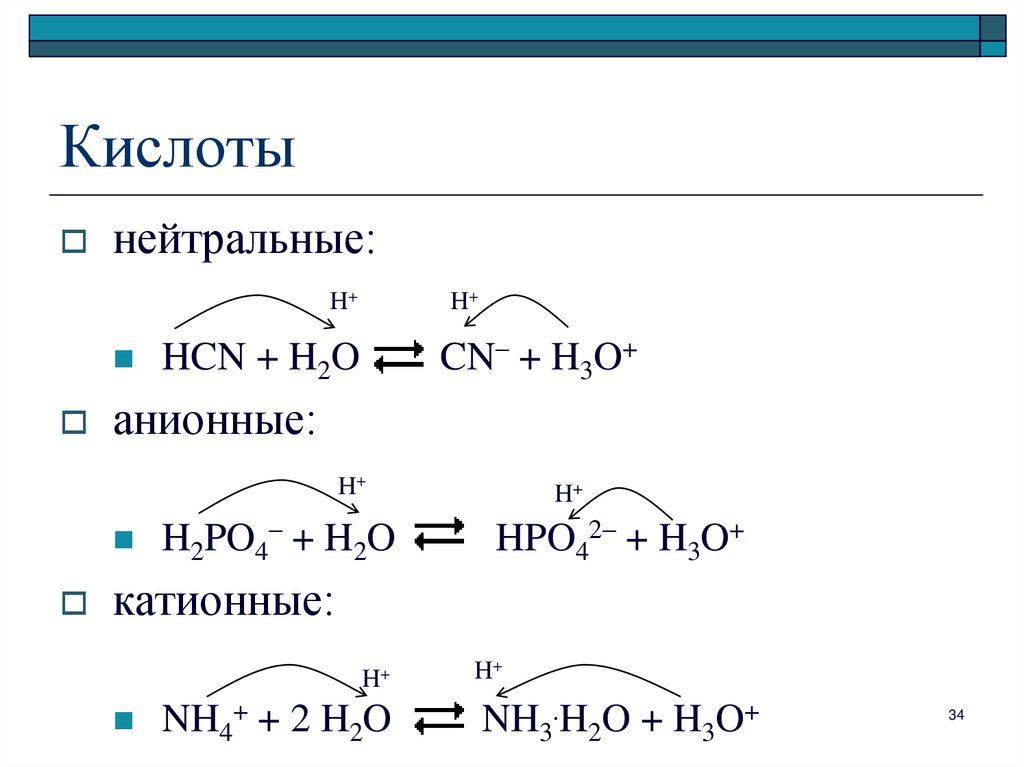
34. Кислоты
нейтральные:H+
H+
CN– + H3O+
HCN + H2O
анионные:
H+
H2PO4– + H2O
H+
HPO42– + H3O+
катионные:
H+
NH4+ + 2 H2O
H+
NH3.H2O + H3O+
34
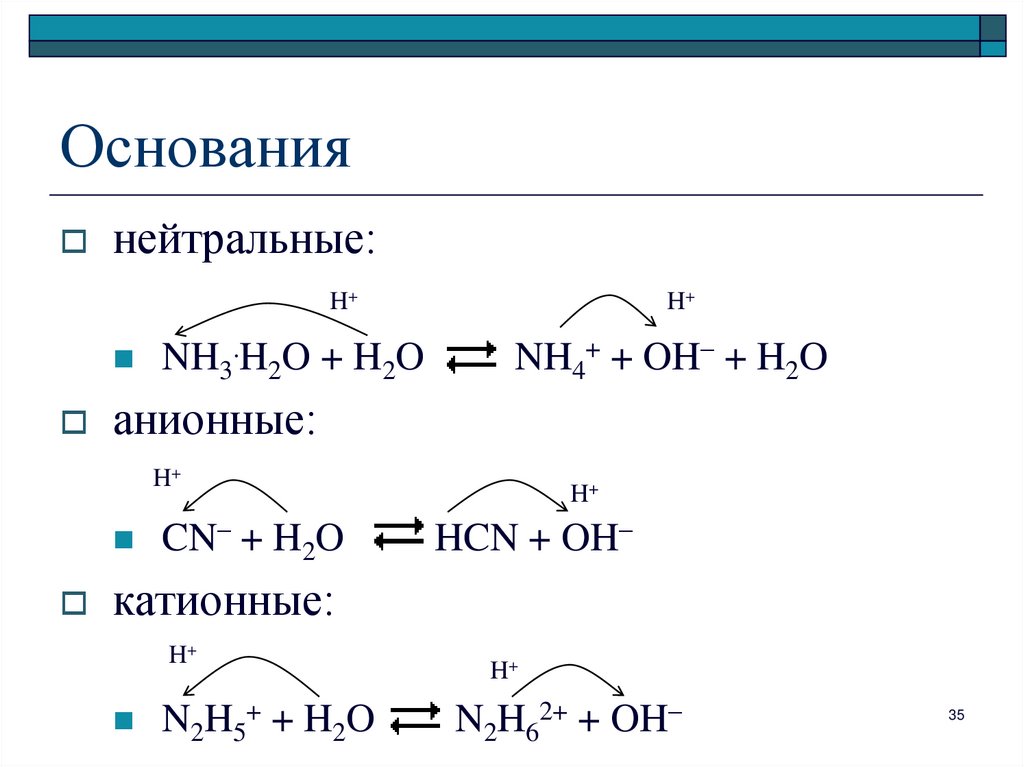
35. Основания
нейтральные:H+
NH3.H2O + H2O
H+
NH4+ + OH– + H2O
анионные:
H+
CN– + H2O
H+
HCN + OH–
катионные:
H+
N2H5+ + H2O
H+
N2H62+ + OH–
35
36. Амфолиты
Н+HCO3– + H2O
Кт
Н+
HCO3– + H2O
Ос
Н+
CO32– + H3O+
Н+
H2CO3 + OH–
36
37. Растворители
Апротонные:C6H6, CS2, CCl4
Протонные
H2O, NH3, C2H5OH
(амфолиты)
Автопротолиз:
H+
H+
HL + HL
H2L+ + L–
Константа
автопротолиза
(ионное
произведение):
KS = [H2L+] [L–]
37
38. Ионное произведение воды
H+H+
H2O + H2O
H3O+ + OH–
При стандартной температуре 298 К (25 С):
KB (Kw) = [H3O+] [OH–] = 1.10–14
В чистой воде при 25 С
[H3O+] = [OH–] = KB = 10–7 моль/л
38
39. Водородный показатель (рН)
рН = –lg[H3O+][H3O+] = 10–рН
Гидроксидный показатель (рОН)
pOH = –lg[OH–]
[OH–] = 10–рОН
рН + рОН = –lgKB = 14
39
40. Водородный показатель (рН)
В чистой воде при 25 СЕсли [H3O+] > 1.10–7, то рН < 7
рН = рОН = 7
Среда нейтральная
Среда кислотная
Если [OH–] > 1.10–7, то рОН < 7 и pH > 7
Среда щелочная
40
41. Шкала рН
При [H3O+] = 0,1 моль/л(например, в 0,1 М растворе HCl)
pH = 1 (нижний предел).
При [OH–] = 0,1 моль/л
(например, в 0,1 М растворе KOH)
рН = 13 (верхний предел).
41
42. Константа кислотности
H+H+
HA + H2O
A– + H3O+
[ H 3O ][ A ]
K K (Ka )
[ HA]
42
43. Слабые кислоты
Сопряженная параСН3СООН / СН3СОО–
Al3+.H2O / AlOH2+
H2S / HS–
B(OH)3.H2O/[B(OH)4]–
СН3СООН + Н2О
СН3СОО– + H3O+
Al3+.H2O + H2O
H2S + H2O
AlOH2+ + H3O+
HS– + H3O+
B(OH)3.H2O + H2O
KК
1,7.10–5
9,6.10–6
1,1.10–7
5,8.10–10
[B(OH)4]– + H3O+
Сила кислоты
Слабые кислоты
43
44. Сильные кислоты
H+HA + H2O = A– + H3O+
Бескилородные кислоты: HCl, HBr, HI
Кислородсодержащие кислоты состава
НхЭОу, если у – х 2 (правило Полинга)
Протолиз сильных кислот необратим
Анионы сильных кислот являются
непротолитами и не участвуют в
реакциях протолиза
44
45. Сила кислот в неводных растворителях
Уравнение реакции протолизаH+
HClO4 + CH3COOH
H+
HNO3 + CH3COOH
Сопряженная пара
KК
H+
ClO4– + CH3COOH2+
HClO4/ ClO4–
1.10–6
HNO3/ NO3–
1.10–7
H+
NO3– + CH3COOH2+
45
46. Константа основности
H+H+
A– + H2O
HA + ОН–
[OH ][ HA]
KO ( Kb )
[A ]
46
47. Слабые основания
Уравнение реакции протолизаСопряженная пара
KО
NH3·H2O + H2O
NH4+ + OH– + H2O
NH4+/ NH3·H2O
H+
H+
SO32– + H2O
H+
HSO3– + OH–
HSO3– / SO32–
H+
HSO3– + H2O
SO2∙H2O + OH–
SO2∙H2O / HSO3–
Сила основания
H+
H+
1,8 ·10–5
1,6.10–7
6,0.10–13
47
48. Сильные основания
Анионы:амид-ион NH2–
метилат-ион CH3O– и другие алкоголят-ионы
гидроксид-ион ОН–
Соединения, дающие эти ионы при
диссоциации
MOH,
M(OH)2,
и др.
где М – щелочной элемент или Tl(I)
где М – Ba, Ra
Катионы – непротолиты!
48
49. Малорастворимые гидроксиды
Ni(OH)2(т)Ni2+ + 2OH—
Слабое основание?
Сильное основание?
ПР = [Ni2+][OH—]2
49
50. Связь Kк и Ko для пары НА/А–
[H3O+] [A–] [HA] [OH–]KК KO = –––––––––– –––––––––– = [H3O+] [OH–] = KB
[HA]
[A–]
KO = KB / KК
50
51. Степень протолиза ()
Степень протолиза ( )– отношение числа частиц, подвергшихся
протолизу, к исходному числу частиц
Для реакции протолиза слабой кислоты:
H+
HA + H2O
H+
A– + H3O+
[ H 3O ]
[A ]
c0 ( HA) c0 ( HA)
([H3O+] = [A–] при отсутствии в растворе
других протолитов)
51
52. Закон разбавления Оствальда
[ H 3O ][ A ] c0 c02c0
KK
2c0
[ HA]
(1 )c0 1
При << 1 ( < 0,05):
_____
= Kк / c0
52
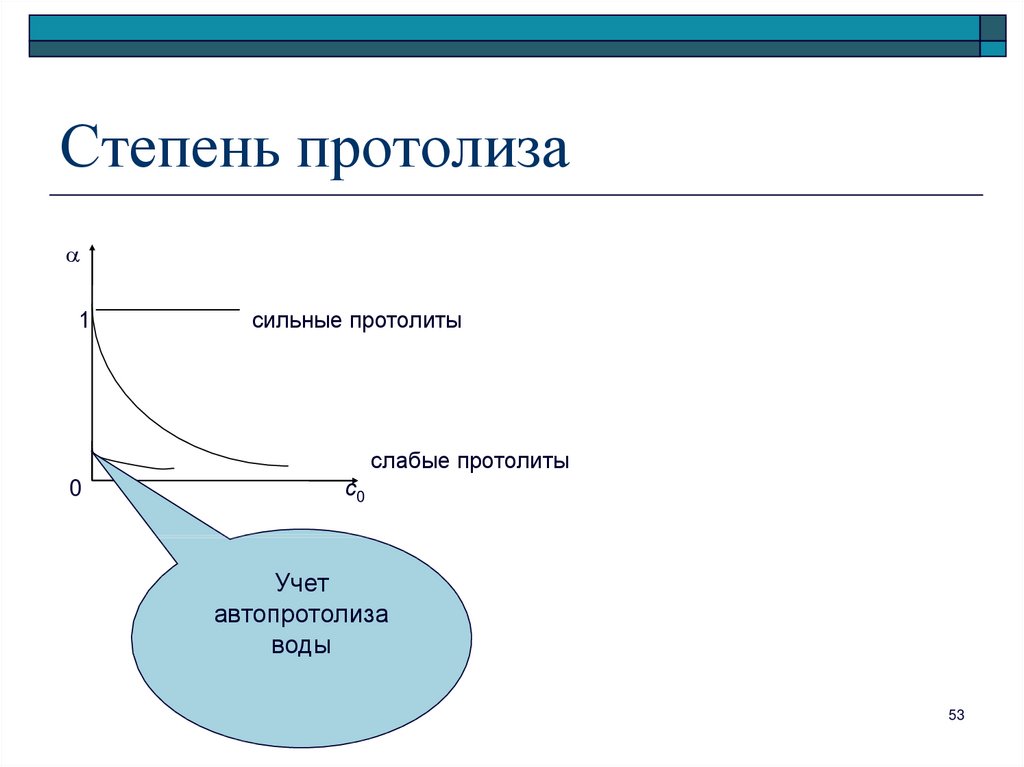
53. Степень протолиза
1сильные протолиты
слабые протолиты
0
с0
Учет
автопротолиза
воды
53
54. Учет автопротолиза воды
H+H+
HA + H2O
A– + H3O+
H+
H+
H2O + H2O
OH– + H3O+
[ A ] [ H 3O ]
(
)
c0
c0
[ A ][ H 3O ] [ A ][ H 3O ]
Kк
[ HA]
c0 [ A ]
54
55. Учет автопротолиза воды
Kкc0 – Kк[A–] = [A–][H3O+]K к c0
[A ]
K к [ H 3O ]
Kк
K к [ H 3O ]
55
56. Учет автопротолиза воды
При бесконечном разбавлении:с0 → 0; [H3O+] → 10–7 моль/л
Kк
7
K к 10
при Kк ≥ 10–5 α → 1
при Kк = 10–7 α → 0,5
56
57. Сдвиг протолитических равновесий
Изменение концентрации слабого протолитазакон разбавления Оствальда
разбавление
Изменение температуры
протолиз – эндотермический процесс
нагревание
Изменение концентрации одноименных ионов
принцип Ле Шателье
введение одноименных ионов
57
58. Сдвиг протолитических равновесий
Протолиз слабой кислоты в присутствиисильной кислоты:
H+
HA + H2O
H+
A– + H3O+
[ A ]
'
c0 ( HA)
[ H 3O ][ A ] ' c0 [ H 3O ] ' c0 [ H 3O ]
Kк
'[ H 3O ]
[ HA]
(1 )c0
c0
= Kк / [H3O+]
58
59. Определите рН в 0,001 М растворе серной кислоты.
2H+H2SO4 + 2H2O = SO42 + 2H3O+
с0(H2SO4) = 0,001 моль л
pH = –lg [H3O+] = – lg(2c0) = – lg (2.10–3) = 2,7
59
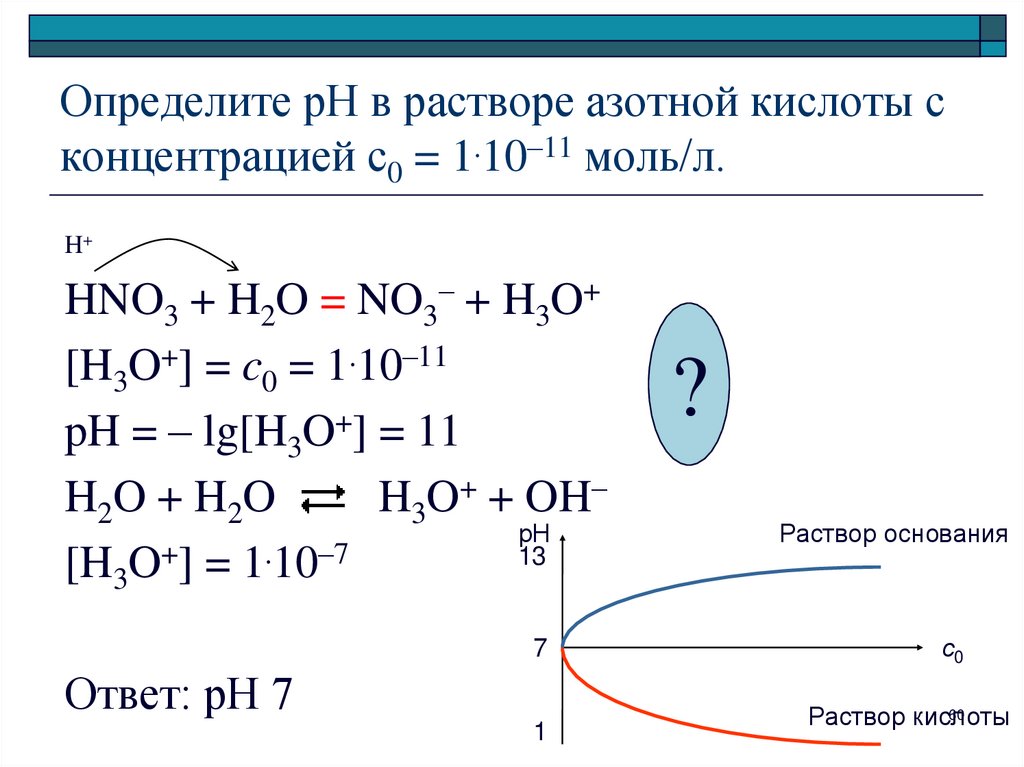
60. Определите рН в растворе азотной кислоты с концентрацией с0 = 1.10–11 моль/л.
H+HNO3 + H2O = NO3– + H3O+
[H3O+] = c0 = 1.10–11
pH = – lg[H3O+] = 11
H2O + H2O
H3O+ + OH–
рН
13
[H3O+] = 1.10–7
7
Ответ: рН 7
1
?
Раствор основания
с0
60
Раствор кислоты
61. Определите рН в 0,002М растворе хлорноватистой кислоты при 25 °C.
H+H+
HClO + H2O
ClO– + Н3O+; Kк = 2,82 . 10–8
[ClO–] = [H3O+]; [HClO] = c0
[ClO ][ H 3O ] [ H 3O ]2
KK
[ HClO ]
c0
pH lg[ H 3O ] lg K K c0 lg 2,82 10 8 0,002 5,12
61
62. Определите pH в 0,002М растворе аммиака при 25 °С.
H+H+
NH4+ + OH– + H2O
NH3·H2O + H2O
KK = 5,75 . 10–10
KB = 1 . 10–14
[NH4+] = [OH–]; [NH3 . H2O] = c0
K B [ NH 4 ][OH ] [OH ]2
KO
KK
[ NH 3 H 2O]
c0
pH 14 pOH 14 lg[ OH ] 14 lg
KB
1 10 14 0,002
c0 14 lg
10,27
10
KK
5,75 10
62
63. Обратимый гидролиз солей
1. Диссоциация2. Протолиз
64. Гидролиз солей
KCl = K+ + Cl–непротолиты
Нет гидролиза, нейтральная среда, рН 7
NH4NO3 = NH4+ + NO3–
Кт
H+
NH4+ + 2H2O
непротолит
H+
NH3.H2O + H3O+
Гидролиз по катиону, кислотная среда, pH < 7
64
65. Гидролиз солей
ZnSO4 = Zn2+ + SO42–H+
H+
Zn2+.H2O + H2O
ZnOH+ + H3O+
Гидролиз по катиону, кислотная среда, рН < 7
KNO2 = K+ + NO2–
H+
NO2– + H2O
H+
HNO2 + OH–
Гидролиз по аниону, щелочная среда, pH > 7
65
66. Гидролиз солей
NH4CN = NH4+ + CN–H+
NH4+ + 2H2O
H+
CN–
H+
NH3.H2O + H3O+
Kк = 6.10–10
H+
OH–
+ H2O
HCN +
Гидролиз по катиону и аниону, рН ?
Ko > Kк
Слабощелочная среда, pH > 7
Ko = 2.10–3
66
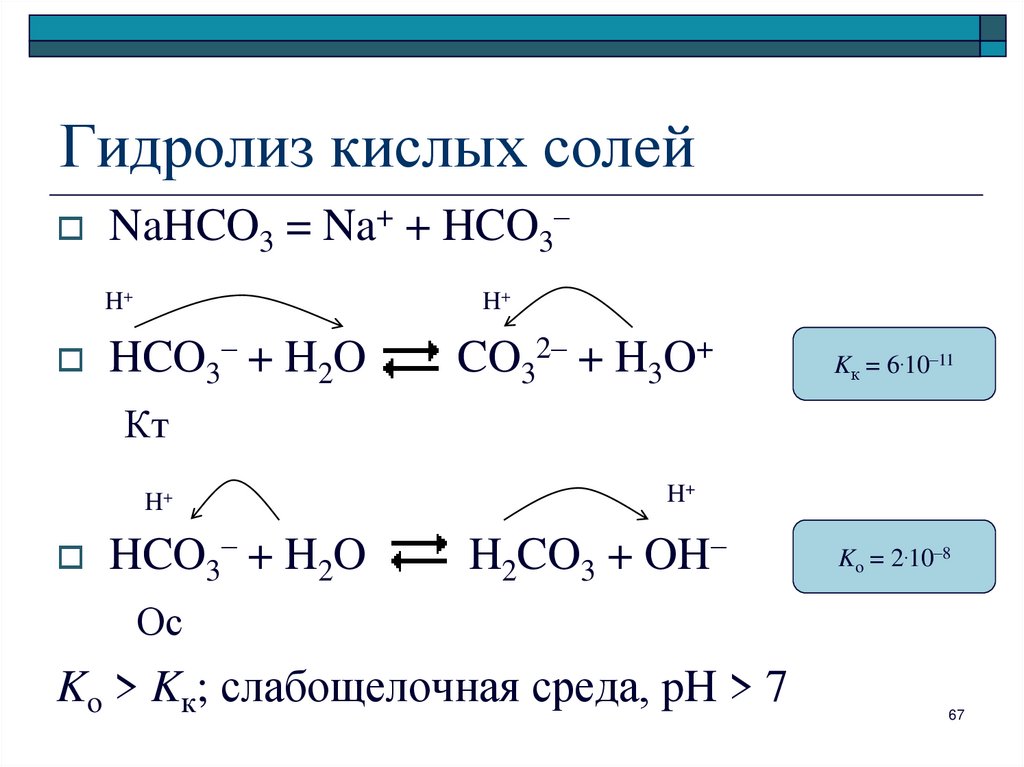
67. Гидролиз кислых солей
NaHCO3 = Na+ + HCO3–H+
H+
HCO3– + H2O
CO32– + H3O+
Kк = 6.10–11
Кт
H+
HCO3– + H2O
H+
H2CO3 + OH–
Ko = 2.10–8
Ос
Ko > Kк; слабощелочная среда, pH > 7
67
68. Гидролиз солей
Усиление (α↑)Повышение
температуры
Понижение
концентрации
Связывание
одноименных ионов
Ослабление (α↓)
Понижение
температуры
Повышение
концентрации
Введение
одноименных ионов
68
69. Необратимый гидролиз
PIIICl–I3(ж) + 3H2Oизб. = H2[PHO3](p) + 3HCl(p)H+
H2[PHO3] + H2O
H+
H[PHO3]– + H3O+
H+
HCl + H2O = Cl– + H3O+
pH < 7
69
70. Необратимый гидролиз
Mg3N + 8H2O = 2NH3.H2O + Mg(OH)2H+
NH4+ + OH– + H2O
Если Mg(OH)2 в осадке:
NH3·H2O + H2O
H+
Mg(OH)2(т)
Mg2+ + 2OH–
Если Mg(OH)2 в растворе:
Mg(OH)2 = Mg2+ + 2OH–
pH > 7
70
71. Необратимый гидролиз
Al2S3(т) + 6H2O = 2Al(OH)3↓ + 3H2S↑Совместный гидролиз:
2Al3+ +3S2– + 6H2O = 2Al(OH)3↓ + 3H2S↑
71
72. Определите рН 0,1 М раствора хлорида железа(III).
FeCl3 = Fe3+ + 3 Cl–H+
Fe3+.H2O + H2O
H+
[Fe(H2O)6]3+ + H2O
H+
FeOH2+ + H3O+
H+
[Fe(H2O)5(OH)]2+ + H3O+
[H3O+] [FeOH2+]
[H3O+]2
Kк = –––––––––––––– = –––––––––– (если считать [Fe3+] = с0)
[Fe3+]
с0
_____
________
pH = – lg[H3O+] = –lg Kк c0 = – lg 7.10–3.10–1 = 1,6
72
73. Определите рН 0,1 М раствора хлорида железа(III).
Более строгий подход:если считать [Fe3+] = с0(1 – α)
2с0
Kк = –––––––––
(1 – )
73
74. Определите рН 0,1 М раствора хлорида железа(III).
При с0 = 0,1 моль /л и Kк = 7 10 3 = 0,007:0,007 = 2 0,1 {1 }
0,1 2 + 0,007 0,007 = 0
= 0,23; второй корень отрицательный
рH = lg[H3O+] = lg с0 = lg 0,23 0,1 = 1,6
74
75. FeCl3 + H2O + Zn = ?
FeCl3 = Fe3+ + 3 Cl–H+
H+
Fe3+.H2O + H2O
FeOH2+ + H3O+
Zn + 2H3O+ = Zn2+ + H2 + 2H2O
75
76. Определите рН в 0,1 М растворе ортофосфата натрия.
Na3PO4 = 3 Na+ + PO43–H+
H+
PO43– + H2O
HPO42– + OH–
K в [ HPO42 ][OH ] [OH ]2
Ko
3
Kк
c0
[ PO4 ]
K в c0
10 1410 1
pH lg[ H 3O ] 14 lg[ OH ] 14 lg K o c0 14 lg
14 lg
12,7
13
Kк
5 10
76
77. Na3PO4 + H2O + Zn = ?
Na3PO4 (т) = 3 Na+ + PO43–H+
H+
HPO42– + OH–
PO43– + H2O
Zn + 2H2O + 2OH– = [Zn(OH)4]2– + H2
77
78. Определите рН раствора, содержащего 0,001 моль/л уксусной кислоты и 0,1 моль/л ацетата натрия.
CH3COONa = Na+ + CH3COO–c1
H+
CH3COOH + H2O
c0
H+
CH3COO– + Н3О+
x
[CH3COOH] = c0 – x
[CH3COO–] = c1 + x
78
79. Определите рН раствора, содержащего 0,001 моль/л уксусной кислоты и 0,1 моль/л ацетата натрия.
[ H 3O ][CH 3COO ] x(c1 x) c1 xKк
[CH 3COOH ]
c0 x
c0
pH = – lg[H3O+] = – lg x = –lg(Kк c0 /c1) =
= – lg 1,8 10–5 10–3/10–1 = 6,7
При разбавлении раствора рН не меняется!
Буферный раствор
79
80. Определите pH в водном растворе NaHA
HA– – амфолит(HCO3–, HS–, H2PO4–, HPO42– и т.д.)
Диссоциация:
NaHA = Na+ + HA–
Протолиз иона-амфолита HA– как основания:
H+
H+
HA– + H2O
H2A + OH–;
Kо(H2A/HA–) = Kв/Kк(H2A/HA–)
Протолиз иона-амфолита HA– как кислоты:
H+
HA– + H2O
H+
A2– + H3O+;
Kк(HA–/A2–)
80
81. Определите pH в водном растворе NaHA
Без вывода:2
[H 3O ] K к (H 2 A/HA ) K к (HA /A )
2
pH lg K к (H 2 A/HA ) K к (HA /A )
рН не зависит от концентрации амфолита
Буферный раствор
81
82. Определите pH в водном растворе NaHA
12
pH pK к (H 2 A/HA ) pK к (HA /A )
2
HA–
HCO3–
HSO3–
HS–
H2PO4–
HPO42–
pK = –lgK
pKк(H2A/HA–)
6,37
1,78
6,98
2,14
7,21
pKк(HA–/A2–)
10,33
7,20
12,91
7,21
12,34
pH
8,35
4,49
9,94
4,68
9,78
82
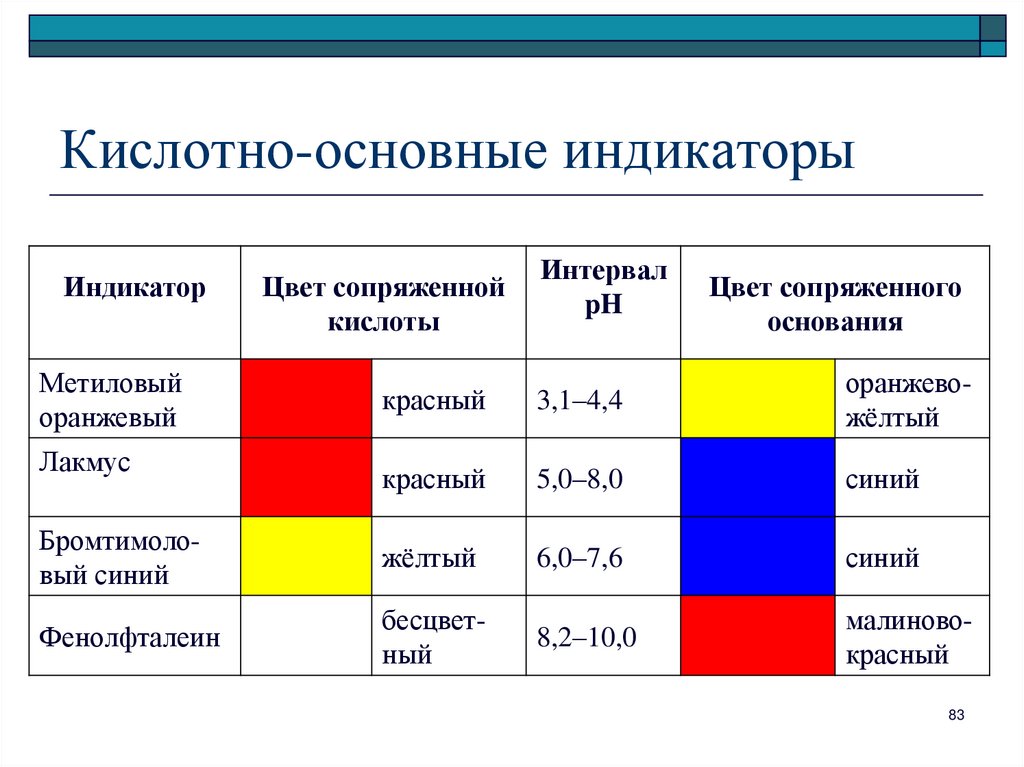
83. Кислотно-основные индикаторы
ИндикаторМетиловый
оранжевый
Цвет сопряженной
кислоты
Интервал
pH
Цвет сопряженного
основания
красный
3,1–4,4
оранжевожёлтый
красный
5,0–8,0
синий
Бромтимоловый синий
жёлтый
6,0–7,6
синий
Фенолфталеин
бесцветный
8,2–10,0
малиновокрасный
Лакмус
83
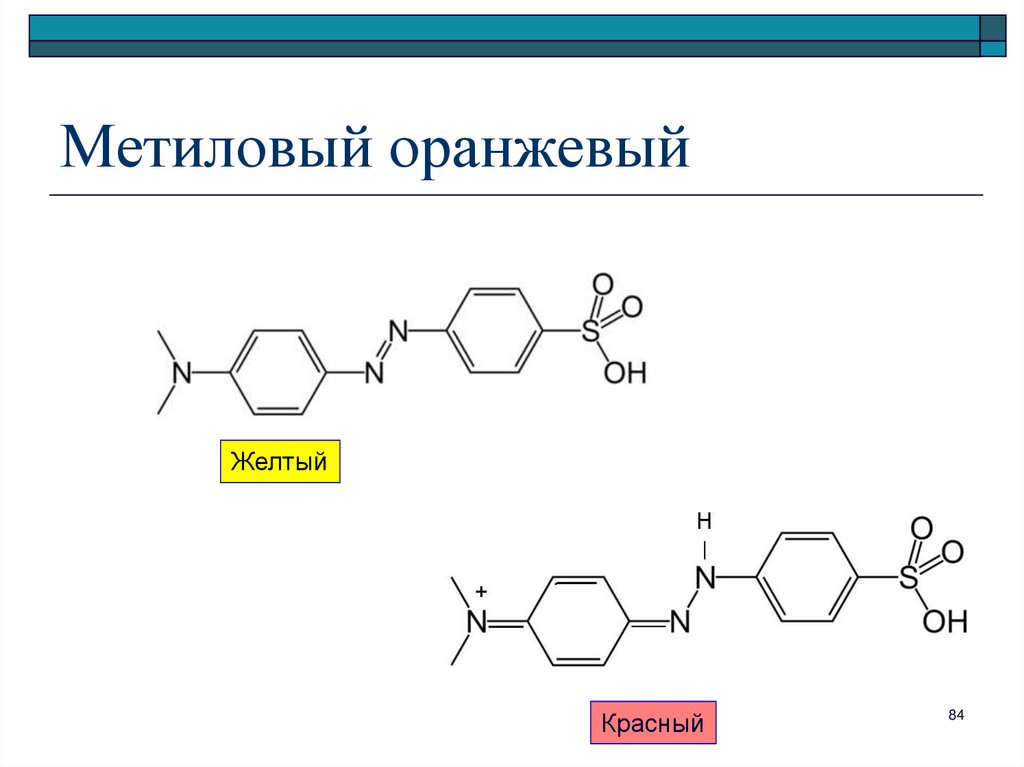
84. Метиловый оранжевый
ЖелтыйКрасный
84






































































 Химия
Химия








