Похожие презентации:
Ионные равновесия в растворах электролитов
1.
ИОННЫЕ РАВНОВЕСИЯ В РАСТВОРАХЭЛЕКТРОЛИТОВ
Схема Н. А. Измайлова
K дис
KA + (n + m)S
K нест
KASn+ mS
+xS
Kпр
aKAaSn
;
K нест
aKAS
n
1 aK + aA
K ас
a
+
K A
_
;
aKA
*
Kнест
;
aKAS
n
K пр
K c A c-
aK + a A
aKAS
n
;
K c A c- yS
K дис
Kас
aK + aA
aKAS
n
1
K acc
K дис
K пр
;
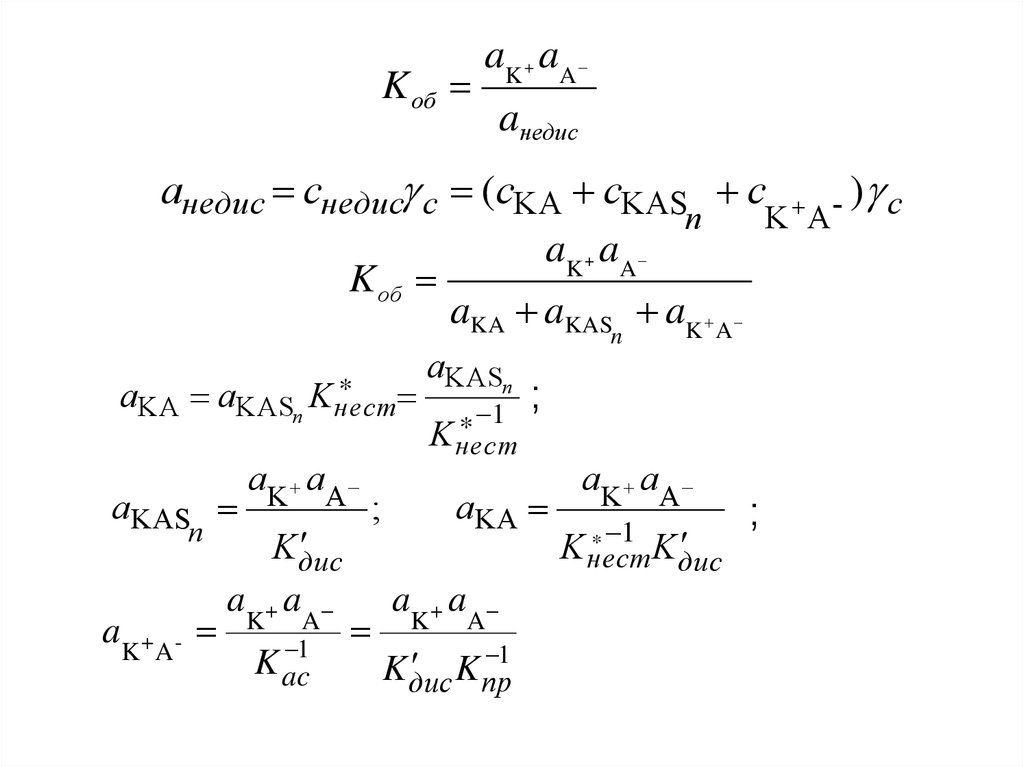
2.
K обaK + aA
aнедис
анедис снедис с (cKA cKAS c - ) с
K A
n
aK + a A
K об
aKA aKAS aK A
*
aKA aKASn K нест
aKAS
n
aK + A -
aK aA
K дис
aK aA
1
K ac
;
aKASn
1
*
K нест
n
;
aKA
aK aA
1
K пр
K дис
aK aA
* 1 K
K нест
дис
;
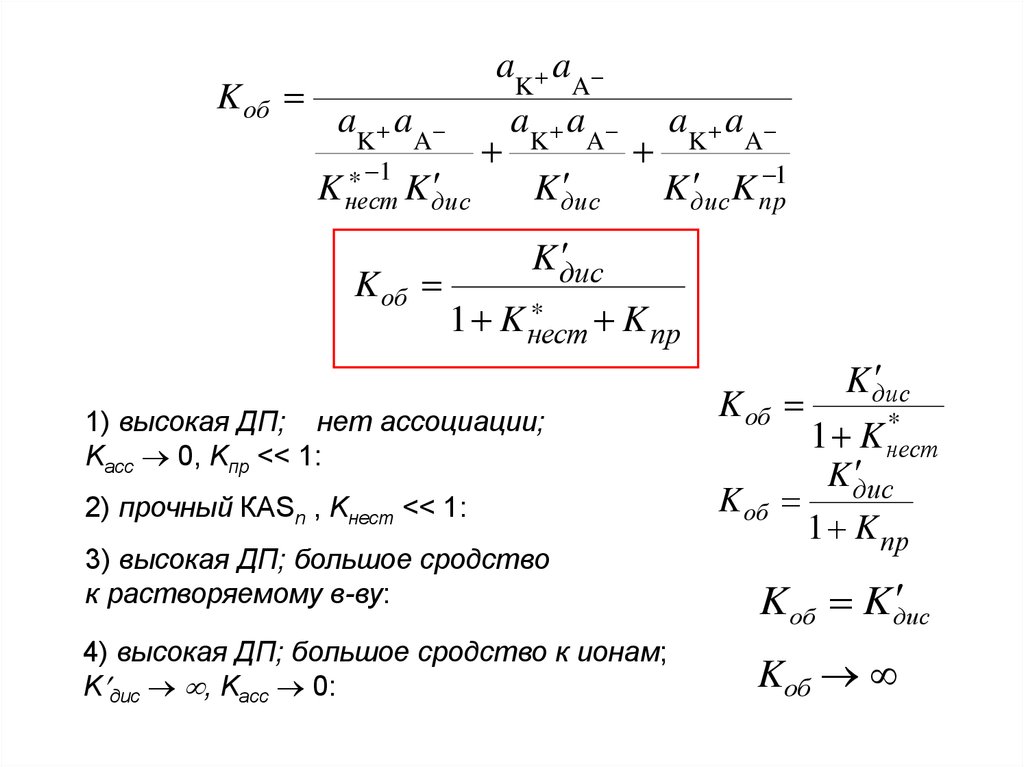
3.
K обaK aA
aK aA
aK aA aK aA
1
1
*
K np
K нест
K дис
K дис
K дис
K об
K дис
*
1 K нест
K пр
1) высокая ДП; нет ассоциации;
Kасс 0, Kпр << 1:
2) прочный КАSn , Kнест << 1:
3) высокая ДП; большое сродство
к растворяемому в-ву:
4) высокая ДП; большое сродство к ионам;
K дис , Kасс 0:
K об
K об
K дис
1 K *нест
K дис
1 K пр
Kоб Kдис
Kоб
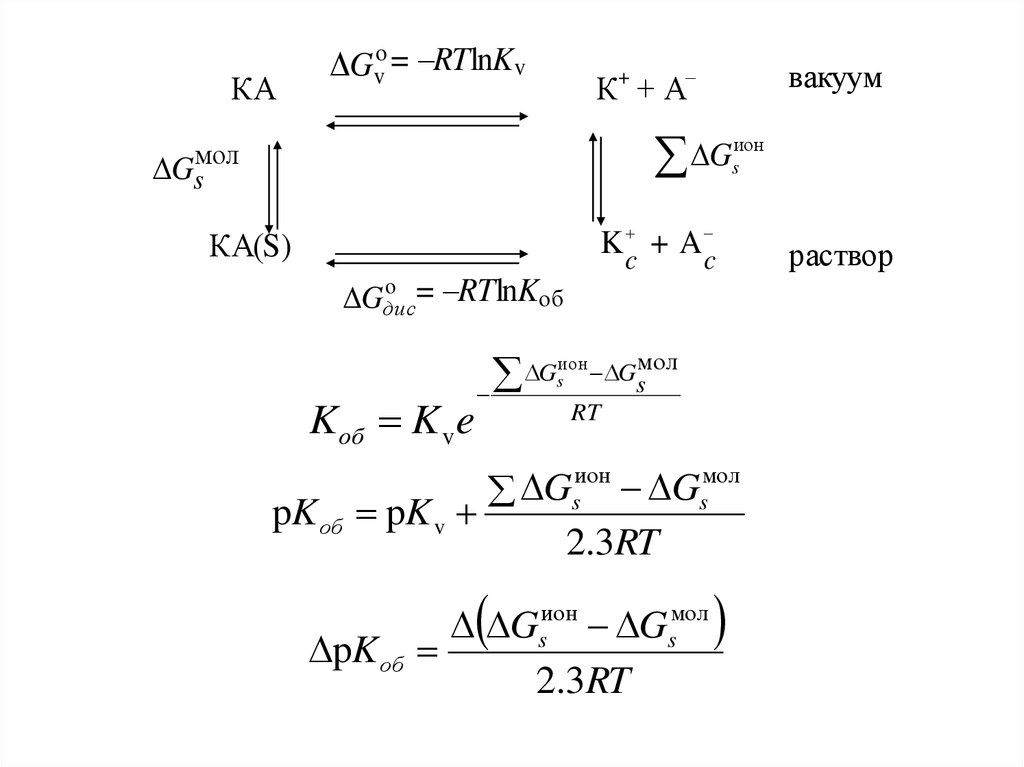
4.
КАGvo = –RTlnKv
вакуум
К+ + А–
ион
G
s
Gsмол
K c + A c
КА(S)
o = –RTlnK
об
Gдис
Kоб K v e
Gsион Gsмол
RT
ион
мол
G
G
s
s
pK об pK v
2.3RT
Gsион Gsмол
pK об
2.3RT
раствор
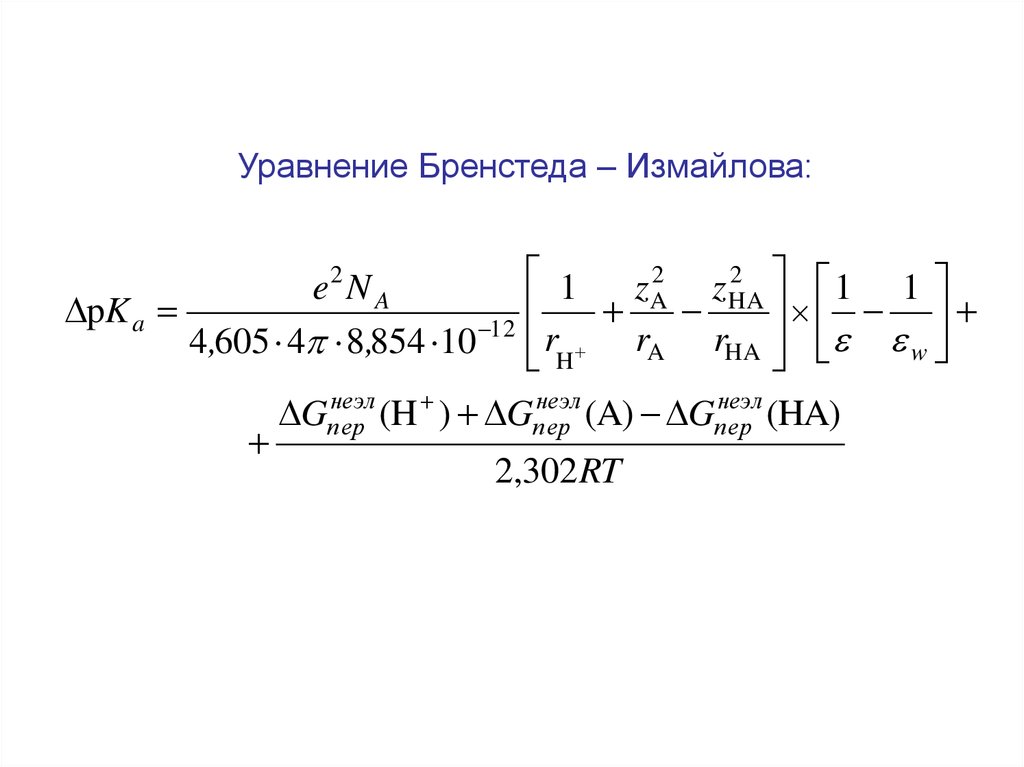
5.
Уравнение Бренстеда – Измайлова:2
1
1 1
e2 N A
zA2 zHA
pK a
12
4 ,605 4 8,854 10 rH rA rHA w
неэл
неэл
неэл
Gпер
(H ) Gпер
(A) Gпер
(HA)
2,302 RT
6.
Другие виды ионных равновесий•Ступенчатая диссоциация электролитов
•Более сложные варианты ионной ассоциации
Образование ионных тройников, квадруполей и т.д.
Гомосопряжение (гомоконъюгация) в растворах кислот
•Ионные равновесия с образованием очень слабых электролитов
Образование малодиссоциирующих соединений
Образование труднорастворимых соединений
Образование комплексных соединений
•Сочетание нескольких типов ионных равновесий
•Специфический тип – кислотно-основные равновесия
•Специфический тип – ионные равновесия в гетерогенных
системах и на границах раздела фаз
7. ДИССОЦИАЦИЯ СЛАБЫХ ЭЛЕКТРОЛИТОВ
НА + Н2О L Н3О+ + А–Термодинамическая и концентрационная константы диссоциации
Ka
aH
a
O
A
3
K d K a aH 2O
aHAaH 2O
Kd
cH
3O
fH
3O
cA f A
cHA f HA
cH
3O
cA f 2
cHA f HA
aH
aHA
f 2
Kc
f HA
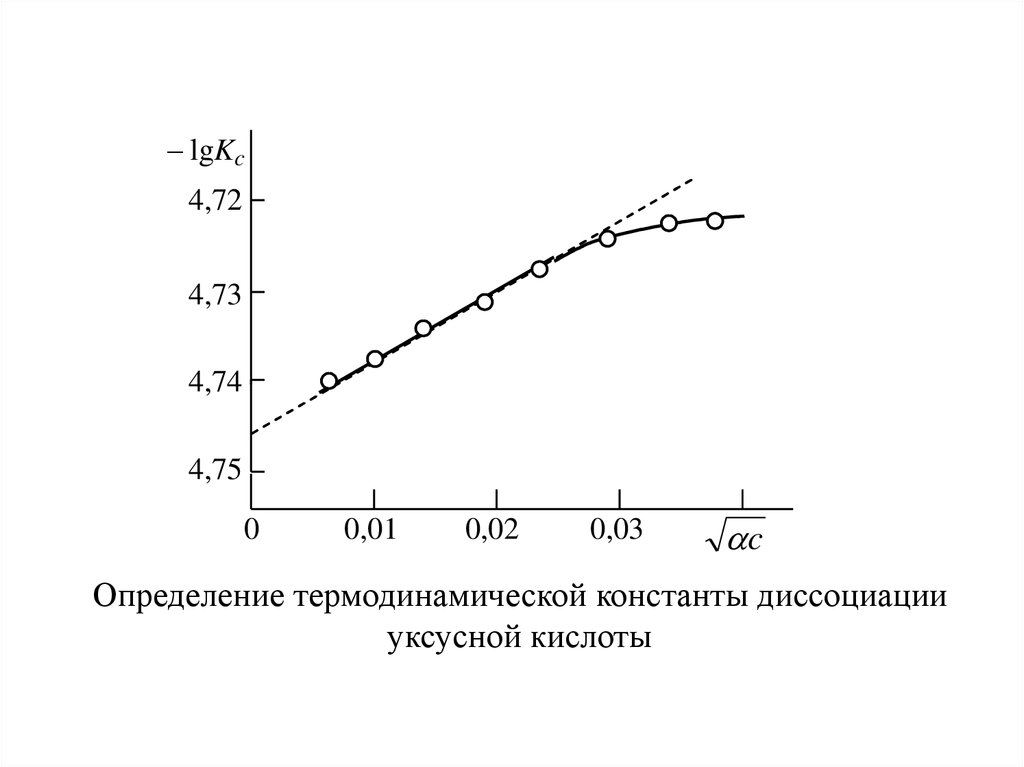
lgKd = lgKc +2lgf± = lgKc – 2A I
lgKс = lgKd + 2A c
a
O
A
3
8.
– lgKc4,72
4,73
4,74
4,75
0
0,01
0,02
0,03
c
Определение термодинамической константы диссоциации
уксусной кислоты
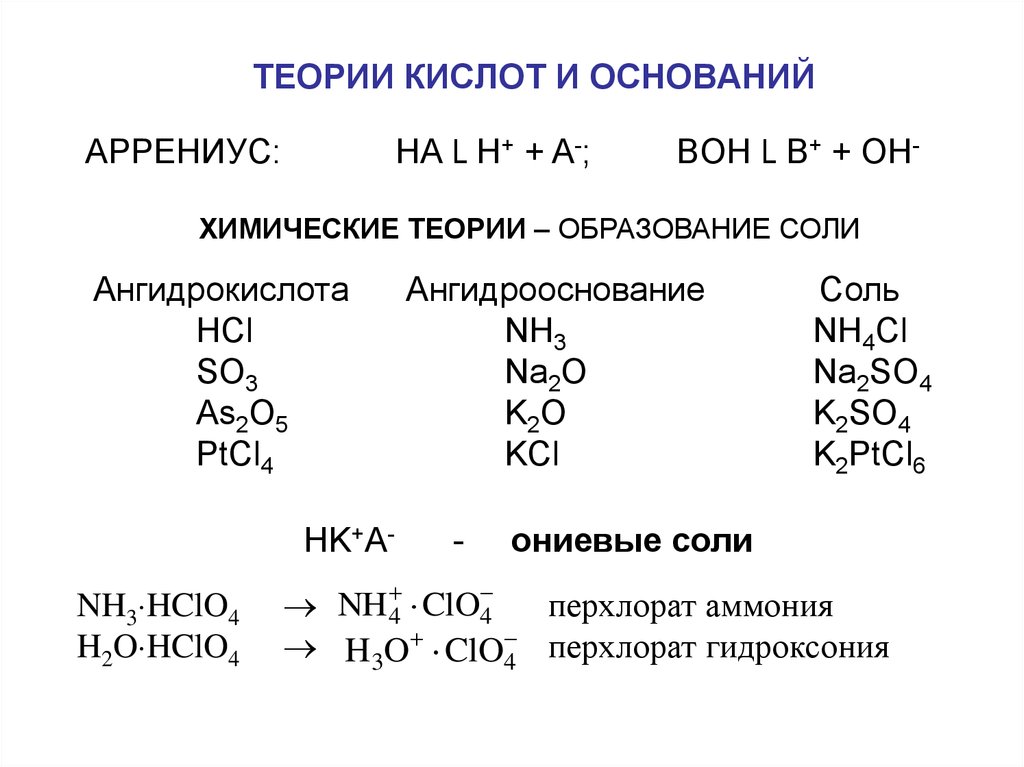
9. ТЕОРИИ КИСЛОТ И ОСНОВАНИЙ
HA L H+ + A-;АРРЕНИУС:
BOH L B+ + OH-
ХИМИЧЕСКИЕ ТЕОРИИ – ОБРАЗОВАНИЕ СОЛИ
Ангидрокислота
HCl
SO3
As2O5
PtCl4
HK+ANH3 HClO4
H2O HClO4
Ангидрооснование
NH3
Na2O
K2O
KCl
-
Соль
NH4Cl
Na2SO4
K2SO4
K2PtCl6
ониевые соли
NH 4 ClO 4
перхлорат аммония
H3O ClO 4 перхлорат гидроксония
10.
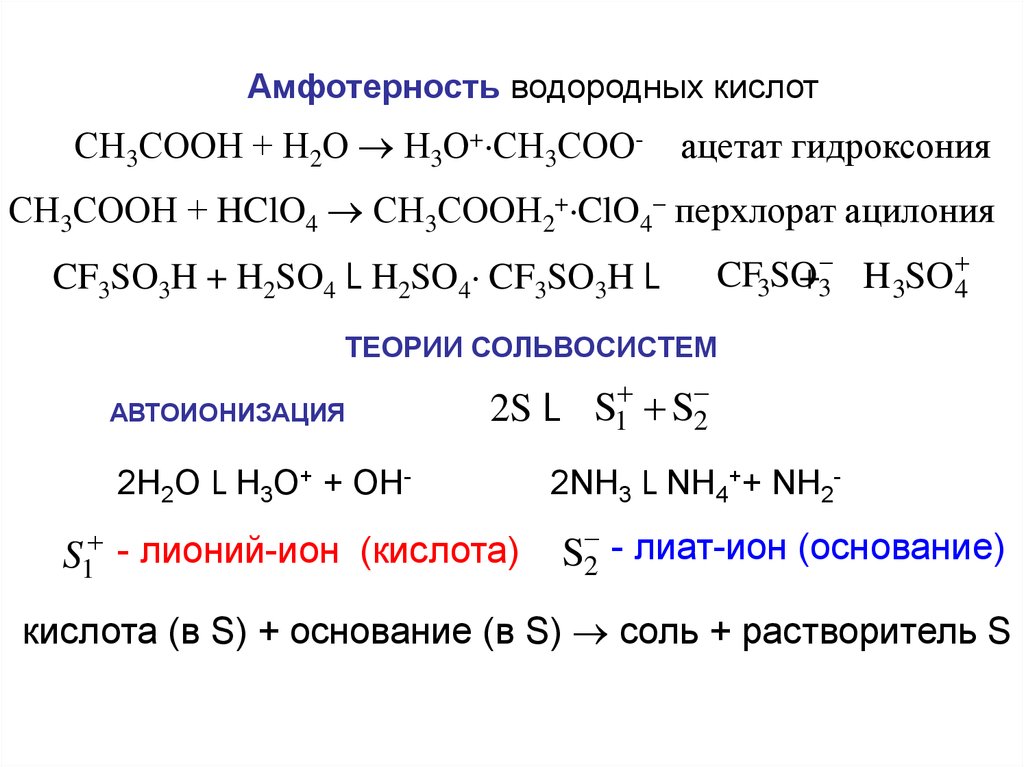
Амфотерность водородных кислотСН3СООН + Н2О Н3О+ СН3СОО- ацетат гидроксония
СН3СООН + HClO4 СН3СООН2+ ClO4 перхлорат ацилония
CF3SO3H + H2SO4 L H2SO4 CF3SO3H L
CF3SO+3 H 3SO 4
ТЕОРИИ СОЛЬВОСИСТЕМ
АВТОИОНИЗАЦИЯ
S
S
2S L 1
2
2H2O L H3O+ + OH-
S1 - лионий-ион (кислота)
2NH3 L NH4++ NH2-
S 2 - лиат-ион (основание)
кислота (в S) + основание (в S) соль + растворитель S
11.
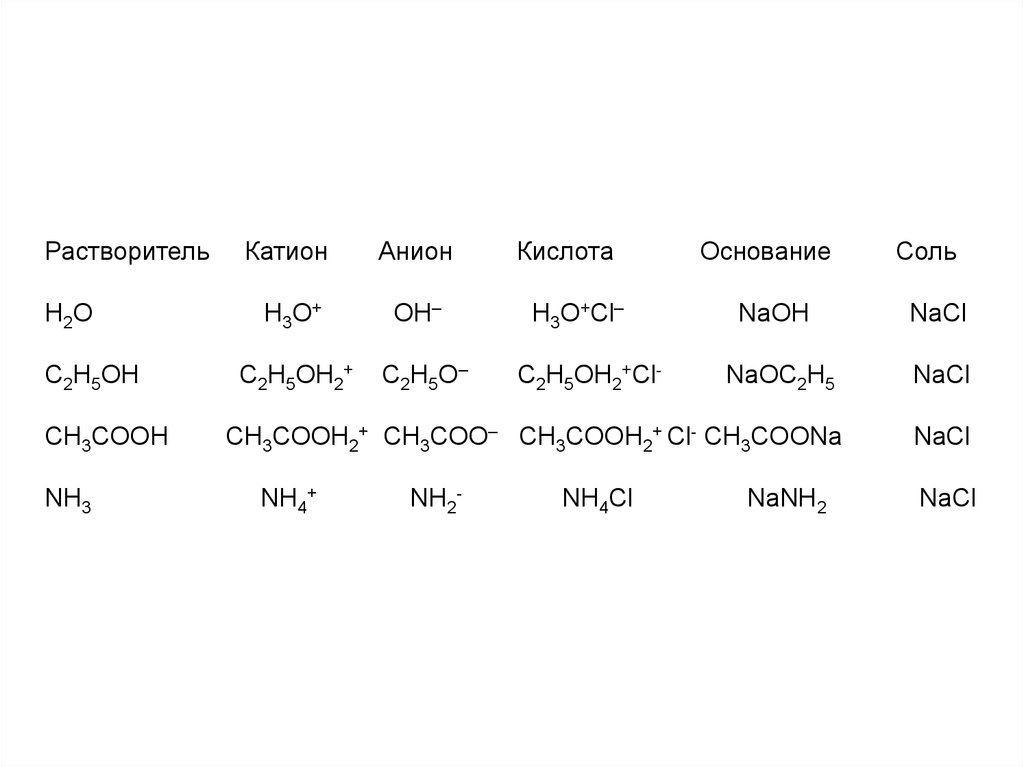
РастворительН2О
C2H5OH
CH3COOH
NH3
Катион
Анион
Н3О+
ОН–
C2H5OH2+
C2H5O–
Кислота
Н3О+Сl–
Основание
Соль
NaOH
NaCl
NaOC2H5
NaCl
CH3COOH2+ CH3COO– CH3COOH2+ Cl- CH3COONa
NaCl
NH4+
NH2-
C2H5OH2+Cl-
NH4Cl
NaNH2
NaCl
12. ТЕОРИЯ ЛЬЮИСА
КИСЛОТА – акцептор свободной пары электронов (L-кислота)ОСНОВАНИЕ - донор свободной пары электронов (L-основание)
O
..
O : ..
S
O
H
..
+ :O
.. :
H
Br
..
Br : Al
.. + :NC5H5
Br
O H
.. ..
O : S.. : O
.. :
O H
Br
..
Br : Al
.. : NC5H5
Br
13. Протолитическая теория кислот и оснований Бренстеда
АIкислота I
А Н+ + В,
+
ВII
основание II
кисл. АI основ. ВII основ. ВI
HCl
+
NH3
L Cl–
+
HCl
+
H2 O
L
Cl–
+
H2O
+
NH3
L
OH–
+
H2O
+
H2O
L
OH–
+
+
H2O
L
NH3
+
NH 4
H2 O
+ CH3COO– L
OH–
+
HSO4– + OH–
L SO42–
+
В + Н+ А
L
BI
+
основание I
кисл. АII
NH 4
H3 O+
NH 4
H3O+
H3O+
CH3COOH
H2O
АII
кислота II
реакция
cолеобразование
диссоц. кислоты
диссоц. основания
автоионизация
гидролиз катиона
гидролиз аниона
нейтрализация
14.
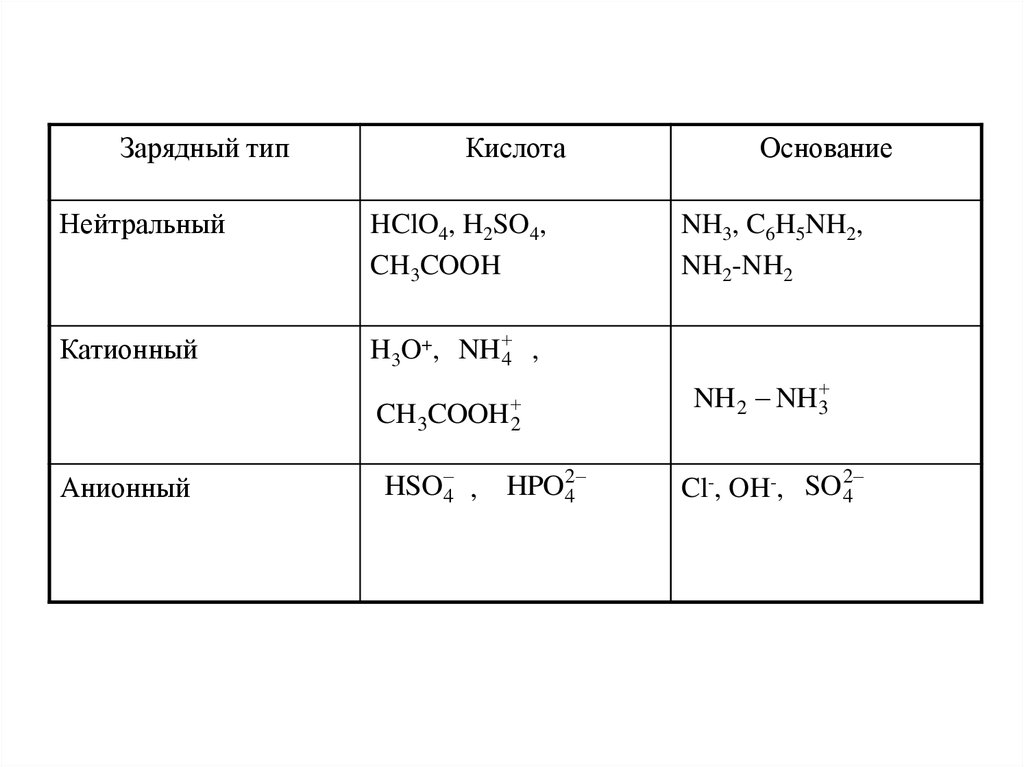
Зарядный типКислота
Нейтральный
HClO4, H2SO4,
CH3COOH
Катионный
H3O+, NH 4 ,
CH3COOH 2
Анионный
HSO 4 ,
HPO 24
Основание
NH3, C6H5NH2,
NH2-NH2
NH 2 NH3
2
Cl-, OH-, SO 4
15. РАСТВОРИТЕЛИ
• Апротонные растворители не способны кавтопротолизу. Они или не участвуют в
протолитических реакциях (бензол, четыреххлористый углерод) или проявляют основные
свойства (диметилсульфоксид, диметилформамид).
• Протогенные, или кислые растворители
способны отщеплять протон (уксусная, серная
кислоты).
• Протофильные, или основные растворители
способны связывать протон (жидкий аммиак).
• Амфотерные растворители проявляют как
кислотные, так и основные свойства (вода,
спирты).
16. СИЛА КИСЛОТ И ОСНОВАНИЙ
A L H+ + ВВ + Н+ L А
Ka
aH aB
aA
aA
Kb
aH + aB
для сопряженной пары KaKb = 1.
AI + BII L BI + AII
константа протолиза
кажущаяся константа протолиза
K I,II
K I, II
aBI aA II
aA I aBII
[BI ][A II ]
[A I ][BII ]
17.
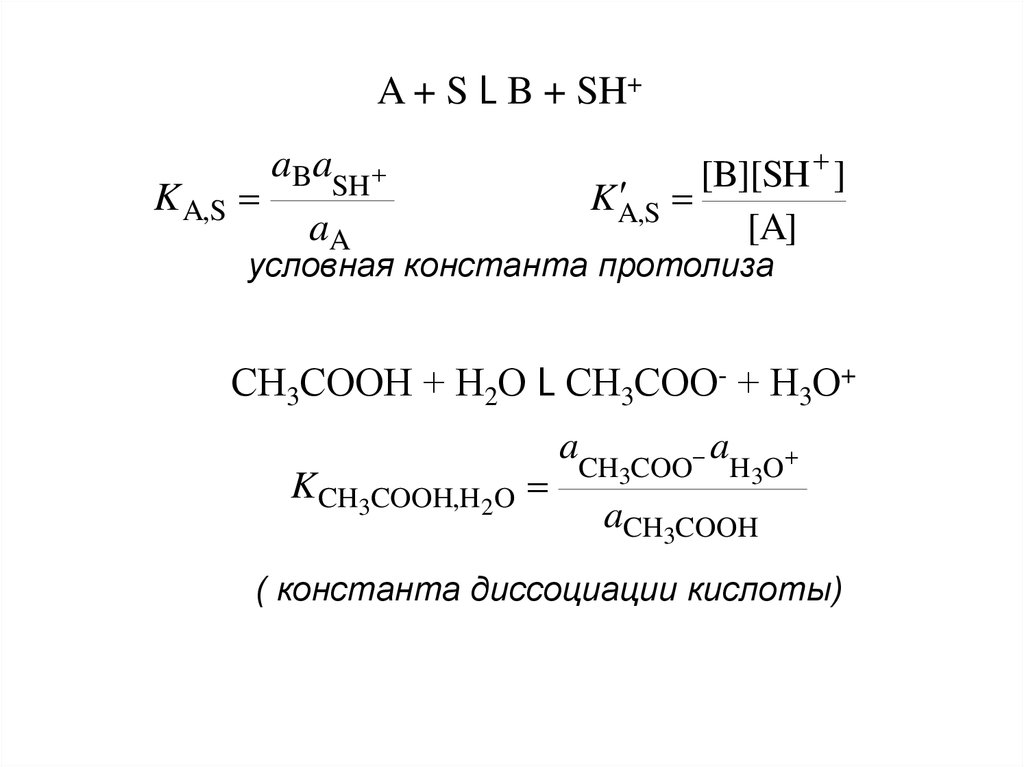
A + S L B + SH+K A,S
aBaSH
aA
S
K A,
[B][SH ]
[A]
условная константа протолиза
СН3СООН + Н2О L СН3СОО- + Н3О+
K CH3COOH,H 2O
aCH
a
COO
H
O
3
3
aCH3COOH
( константа диссоциации кислоты)
18.
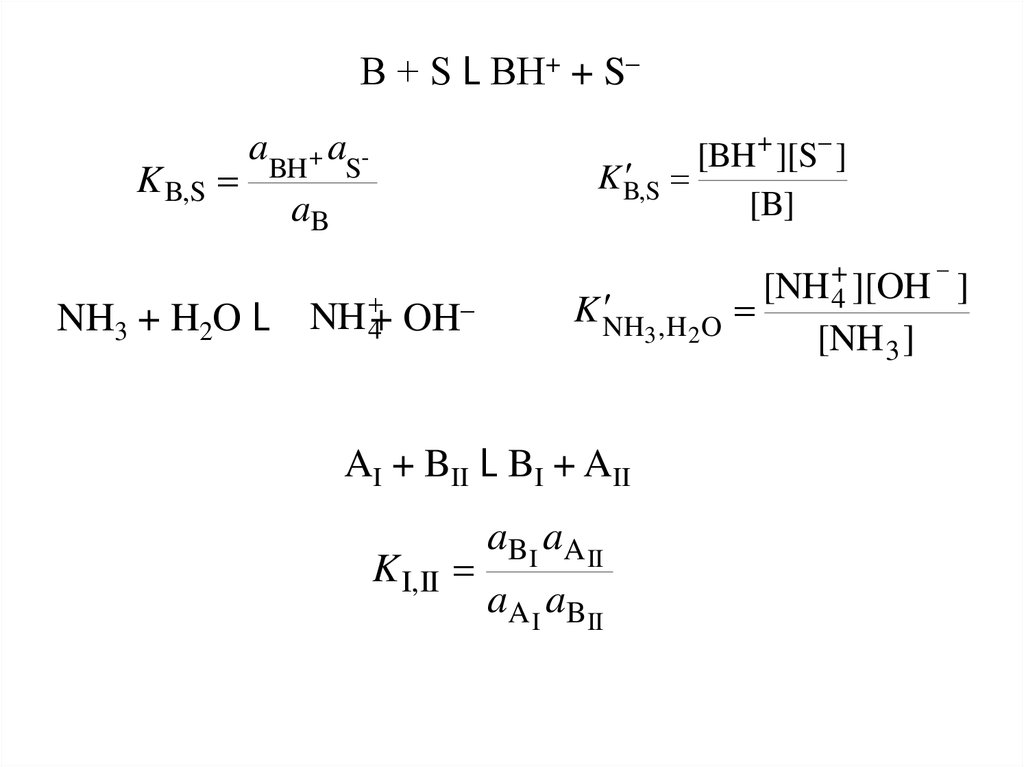
В + S L ВН+ + S–K B,S
[BH + ][S ]
S
K B,
[B]
aBH + aS-
NH3 + H2O L
aB
NH 4+ OH–
K NH
3 , H 2O
AI + BII L BI + AII
K I,II
aBI aA II
aA I aBII
_
+
[NH 4 ][OH ]
[NH 3 ]
19.
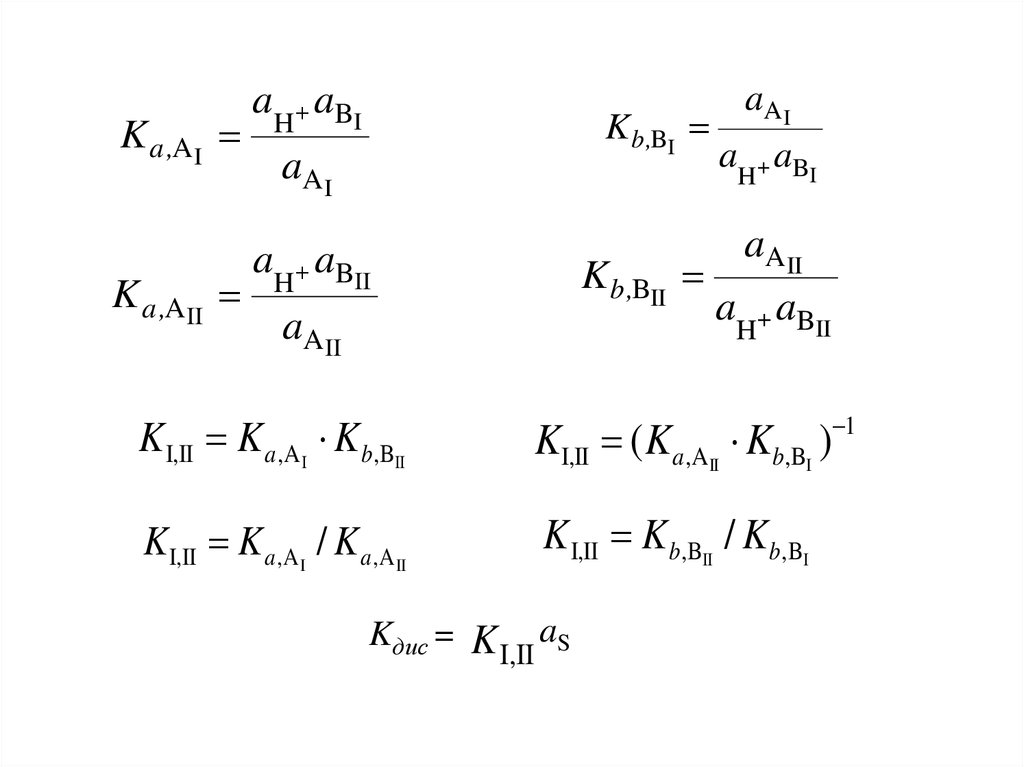
K a ,A IK a ,AII
aH a BI
Kb ,BI
aA I
aH aBII
Kb ,BII
aAII
aAI
aH+ aBI
aAII
aH+ aBII
K I,II K a ,A I Kb,BII
KI,II ( Ka ,AII Kb,BI ) 1
K I,II K a ,A I / K a ,A II
K I,II Kb,BII / Kb,BI
Kдис = K aS
I,II
20. ДИССОЦИАЦИЯ ВОДЫ
2Н2О L Н3О+ + ОН–ионное произведение воды
KW aH
a
;
O OH
3
K S aS aS
KW [H3O ][OH ]
2S L S+ + S–,
ионное произведение среды
рН = – lg [Н3О+]
pH lg aH O ( pH a , paH )
рOН = – lg [ОН–]
pOH lg aOH
3
рKW = – lg KW = pH + pOH
21.
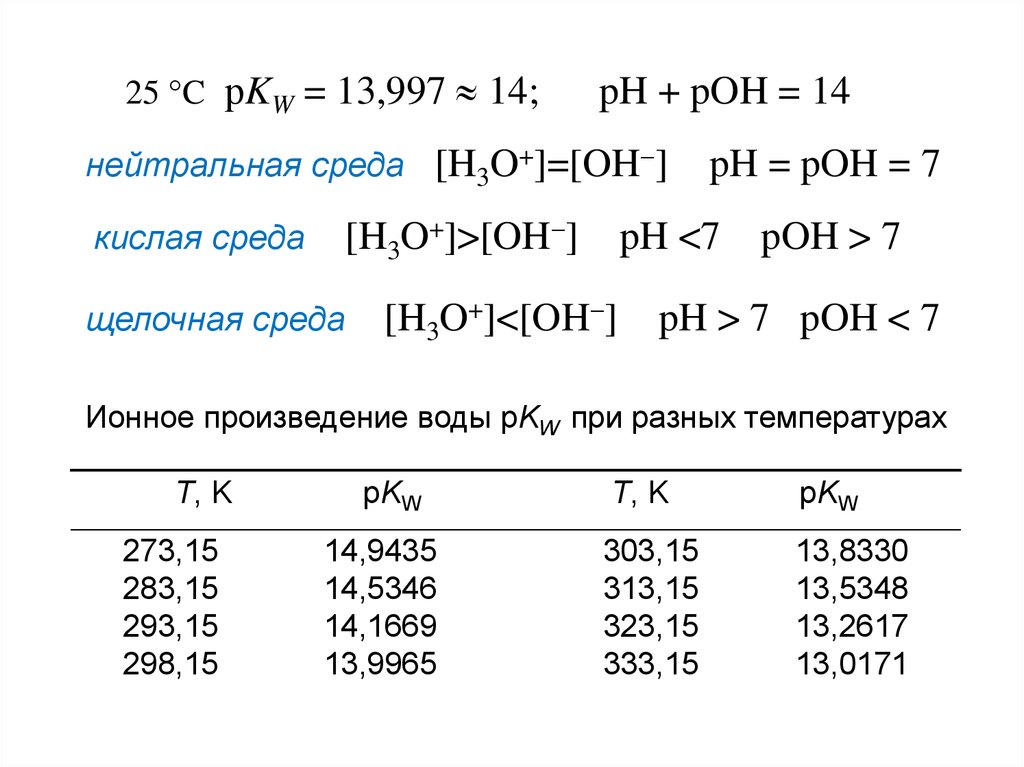
25 C рKW = 13,997 14;pH + pOH = 14
нейтральная среда [H3O+]=[OH ]
кислая среда
[H3O+]>[OH ]
щелочная среда
pH = pOH = 7
pH <7
[H3O+]<[OH ]
pOH > 7
pH > 7 pOH < 7
Ионное произведение воды pKW при разных температурах
___________________________________________________
T, K
pKW
T, K
pKW
______________________________________________________________________________________________
273,15
283,15
293,15
298,15
14,9435
14,5346
14,1669
13,9965
303,15
313,15
323,15
333,15
13,8330
13,5348
13,2617
13,0171
22. Водные растворы слабых кислот и оснований
НА + Н2О L Н3О+ + А–'
K HA
[H3O ][A ] 2c
[HA]
1
1
K HA
2 4 K HA
c
[H 3O ] c K HA
2
если
c
<< 1 то [НА] c ; [H3O ] K HA
1
lgc
pH pK HA
2
23.
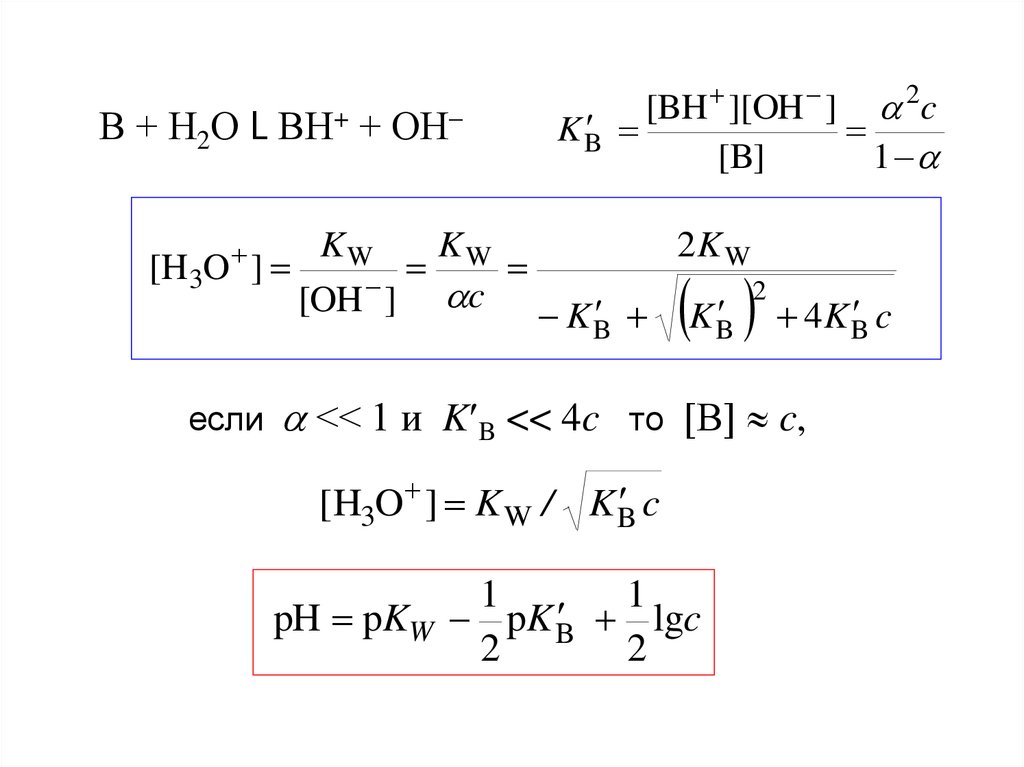
В + Н2О L ВН+ + ОН–[BH ][OH ] 2c
K B
[B]
1
KW
KW
2K W
[H3O ]
[OH ] c K K 2 4 K c
B
B
B
если
<< 1 и K B << 4c то [В] c,
[H3O ] K W / K B c
pH pKW
1
1
pK B lgc
2
2
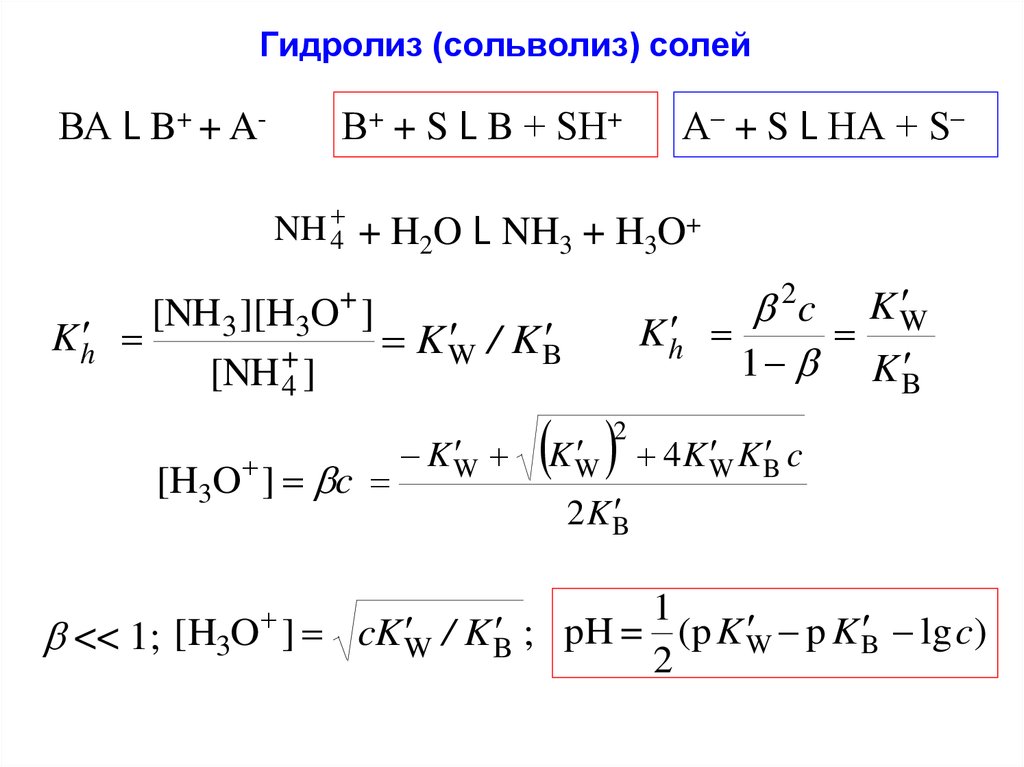
24. Гидролиз (сольволиз) солей
ВА L B+ + A-В+ + S L B + SН+
А– + S L НА + S–
NH 4 + H2O L NH3 + H3O+
2c K W
K h
1 K B
+
[NH 3 ][H3O ]
K h
/ K B
KW
+
[NH 4 ]
[H3O ] c
KW
K 4K K c
2
W
W
B
2 K B
1
p K B lg c)
/ K B ; pH = (p K W
<< 1; [H3O ] cK W
2
25.
А– + Н2О L НА + ОН–_
K h
[HA][OH ]
_
[A ]
KW
[H3O ] =
[OH ] c
2c K W
1 K
A
KW
2KA
KW
<< 1
KW
K
W
2
KA
c
4K W
K A / c
[H 3O ] = K W
+ pK A + lg c)
pH = 2 (pK W
1
26.
А– + ВН+ L НА + ВCH3COO– + NH 4 L CH3COOH + NH3
A – степень гидролиза аниона ; B – степень гидролиза катиона
[B] = Bc;
[HA] = Ac;
[A–] = (1 – A )c;
[BH+] = (1 – B)c,
[HA][B]
A B
KW
K h _
+
[A ][BH ] 1 A 1 B K A K B
K A [HA] K A A
[H3O ]
_
1 A
[A ]
если ( A B) n 1, то
pH
K h A B
1
pK A
(p K W
2
K A / K B
[H3O ] = K W
)
pK B
27. БУФЕРНЫЕ РАСТВОРЫ
БУФЕРНЫЙ РАСТВОРСОДЕРЖИТ СОПРЯЖЕННЫЕ КИСЛОТУ И
ОСНОВАНИЕ
НА + МеА
(СН3СООН + CH3COONa)
СН3СООН
NH 4
CH3COO-
H 2 PO 4
NH3
HCO3
HPO 24
HHbO2
HHb
H 2CO3
28.
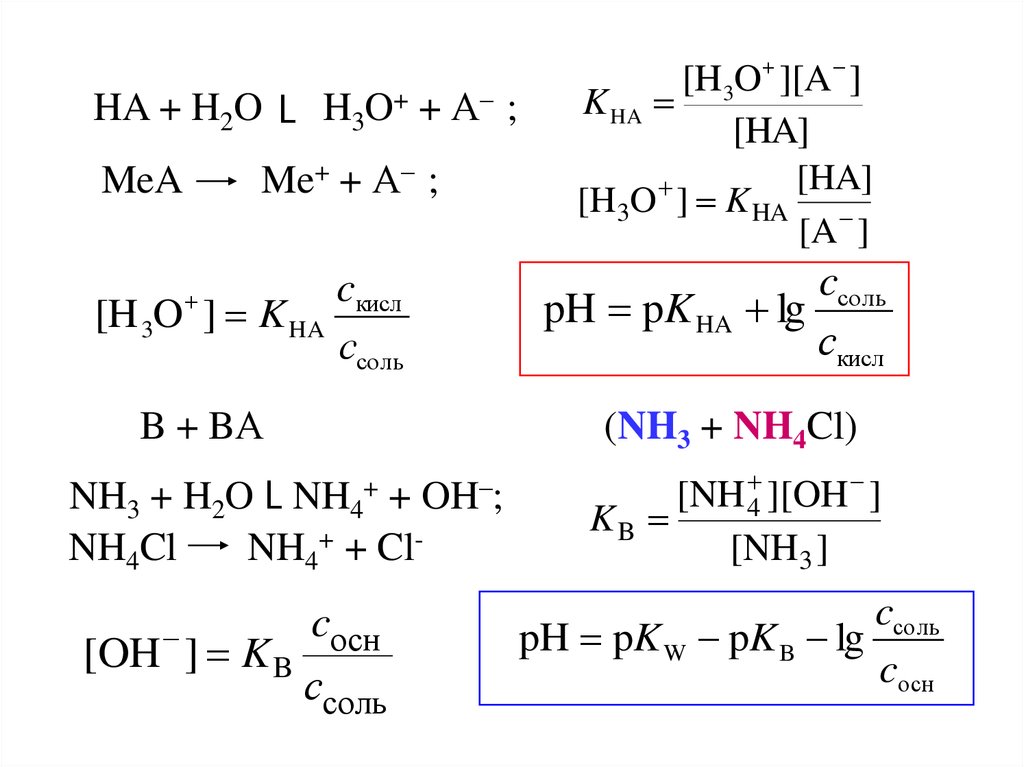
HA + H2O L H3O+ + А– ;Me+ + А– ;
MeA
cкисл
[H 3O ] K HA
ссоль
B + BА
NH3 + H2O L NH4+ + OH–;
NH4Cl
NH4+ + Cl-
cосн
[OH ] K B
ссоль
[H 3O ][A ]
K HA
[HA]
[HA]
[H3O ] K HA
[A ]
cсоль
pH pK HA lg
скисл
(NH3 + NH4Cl)
[NH 4 ][OH ]
KB
[NH 3 ]
cсоль
pH pK W pK B lg
cосн
29.
Буферное действиекислый р-р
H3O+ + A- = HA + H2O
OH- + HA = H2O + A-
щелочной р-р H3O+ + B = BH+ + H2O
OH- + BH+ = H2O + B
Пример
В 1 л раствора содержится 1 моль СН3СООН и 1 моль
СН3СООNa. В раствор добавлено 0,9 моль НСl.
Определить изменение рН.
30.
cсольpH pK HA lg
скисл
рН = 4,756 + lg1 – lg1 = 4,756
СН3СООNa + НСl = СН3СООН + NaСl
рН = 4,756 + lg0,1 – lg1,9 = 3,478
ΔpH = 1,278
Небуферный раствор:
10 3,478 10 4,756 0,00031
моль НСl
Буферная емкость
db
dpH
или
da
dpH
31.
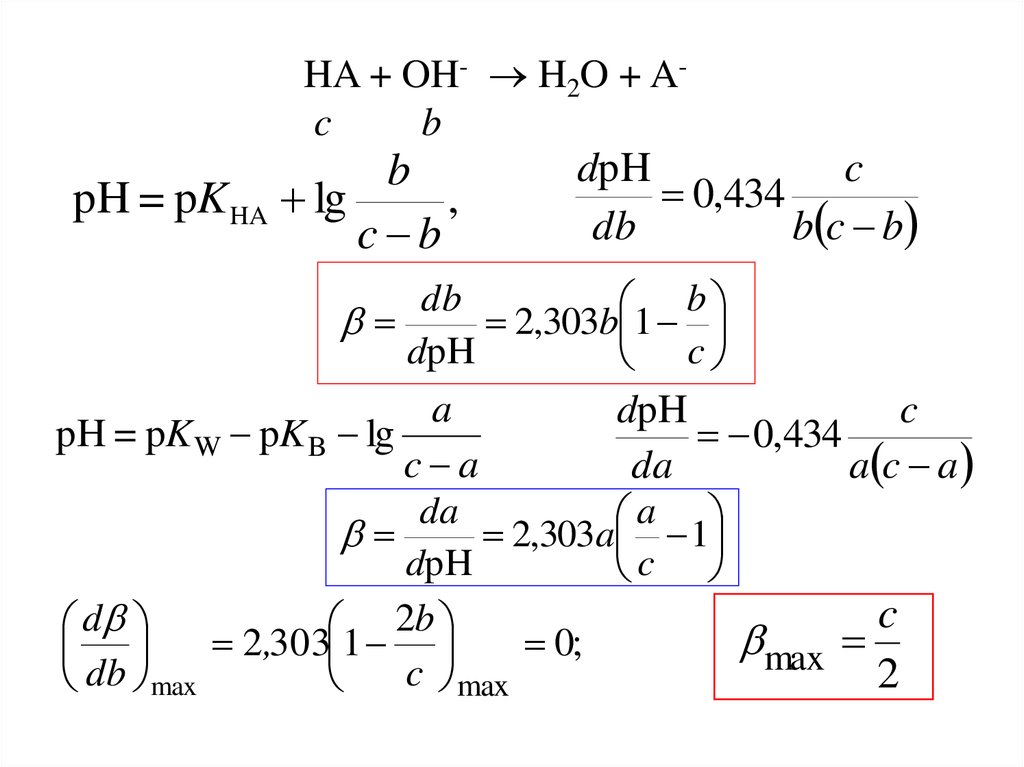
HA + OH- H2O + Acb
b
pH = pK HA lg
,
c b
dpH
c
0,434
db
b c b
db
b
2,303b 1
dpH
c
a
dpH
c
pH = pK W pK B lg
0,434
c a
da
a c a
da
a
2,303a 1
dpH
c
c
d
2b
max
2,303 1
0;
c max
2
db max
32.
0.10a или b,
моль/л
2
1
0.08
0.06
0.04
14 – pKB
pKA
0.02
0
2
4
6
pH
8
10
12
14
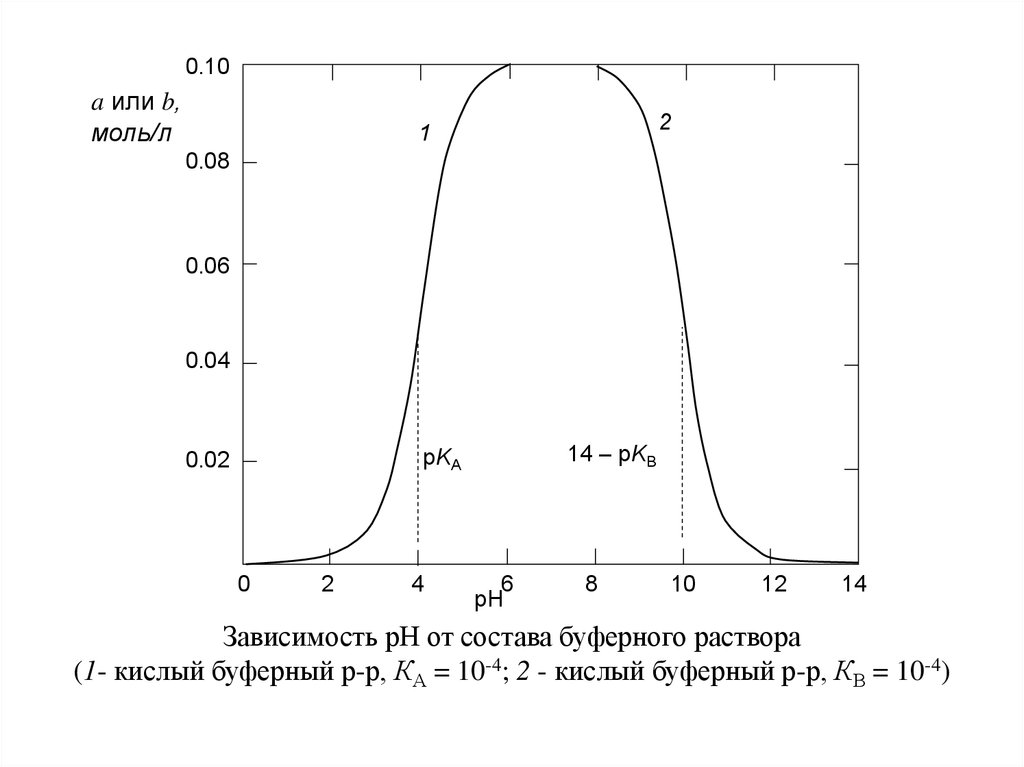
Зависимость рН от состава буферного раствора
(1- кислый буферный р-р, КА = 10-4; 2 - кислый буферный р-р, КВ = 10-4)
33.
102,моль/л
2
10 ,
моль/л
5
5
4
4
3
3
2
2
b=s/2
1
0,00
0,05
b, моль/л
1
0,10
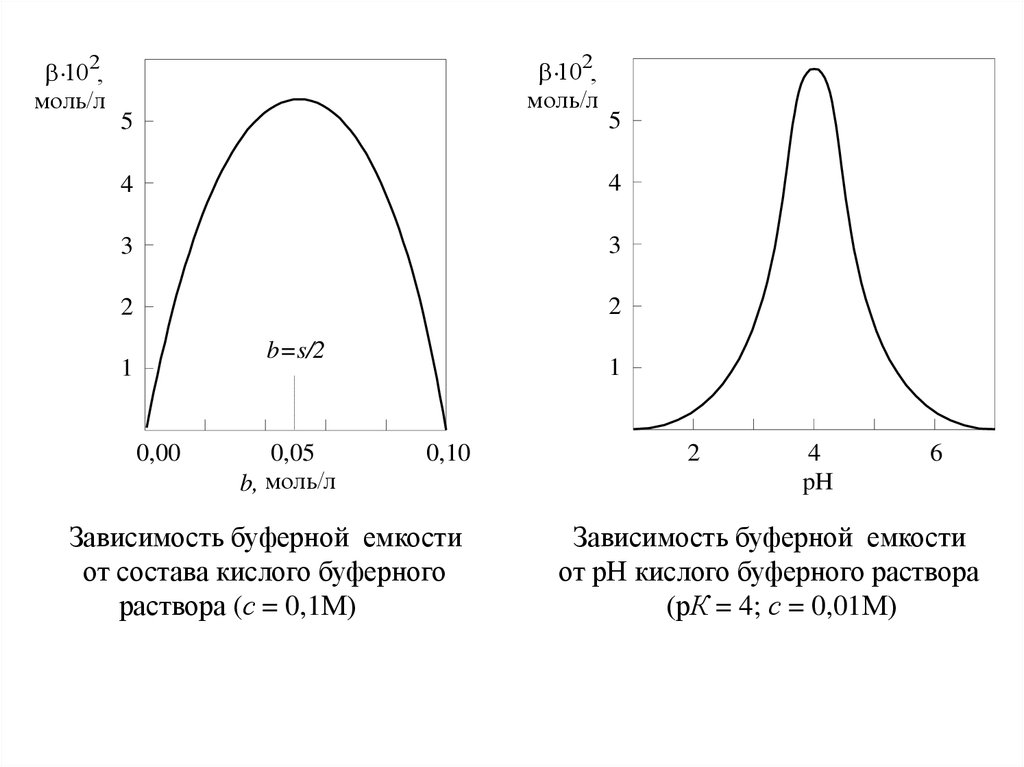
Зависимость буферной емкости
от состава кислого буферного
раствора (с = 0,1М)
2
4
pH
6
Зависимость буферной емкости
от рН кислого буферного раствора
(рК = 4; с = 0,01М)
34. ИНДИКАТОРЫ
Кислотно-основным индикатором называютвещество, для которого в некоторой доступной
области спектра светопоглощение сопряженной
кислоты значительно отличается от
светопоглощения сопряженного основания.
[Гаммет Л.П. Основы физической органической
химии. М.: Мир, 1972. 535 с.]
35.
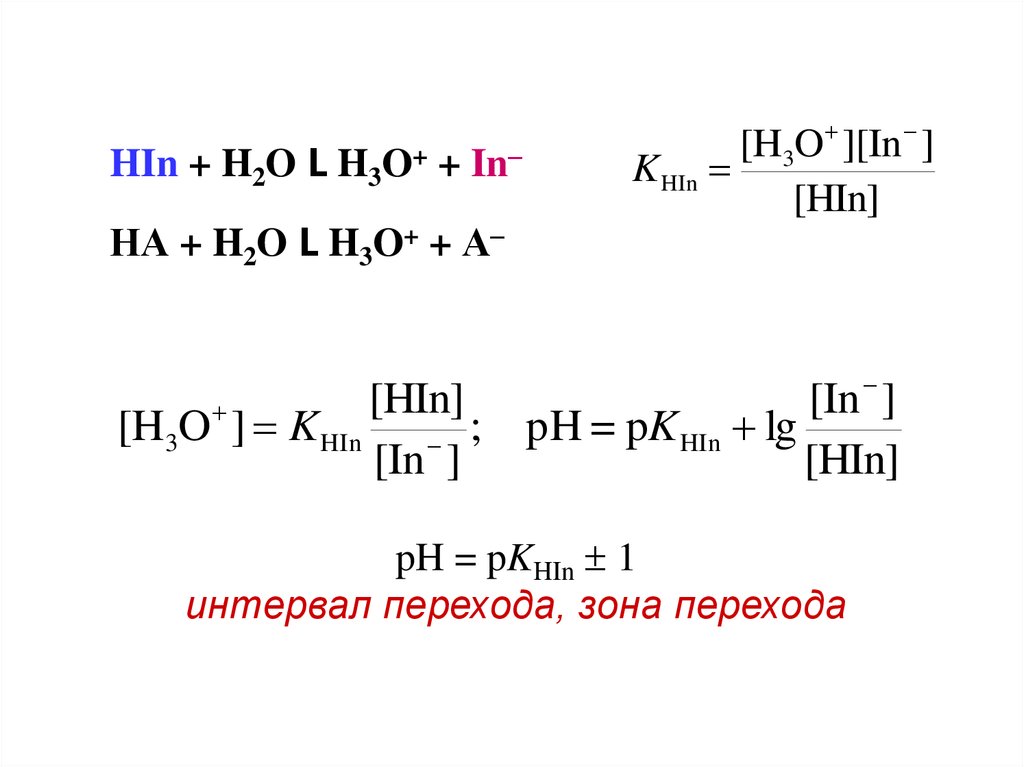
HIn + H2O L H3O+ + In–НА + H2O L H3O+ + А–
[H3O ][In ]
K HIn
[HIn]
[HIn]
[In
]
[H3O ] K HIn ; pH = pK HIn lg
[In ]
[HIn]
pH = pKHIn 1
интервал перехода, зона перехода
36.
_O
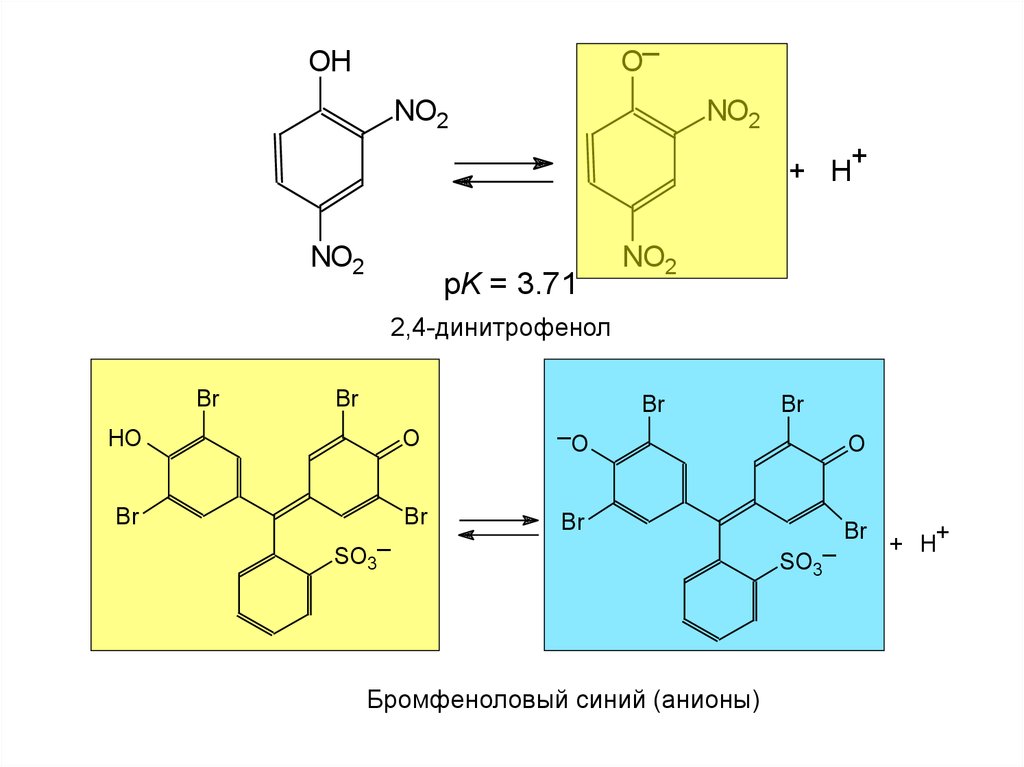
OH
NO2
NO2
+ H+
NO2
pK = 3.71
NO2
2,4-динитрофенол
Br
Br
Br
HO
O
Br
Br
SO3
_
_
Br
O
O
Br
Бромфеноловый синий (анионы)
SO3
_
Br
+ H+
37.
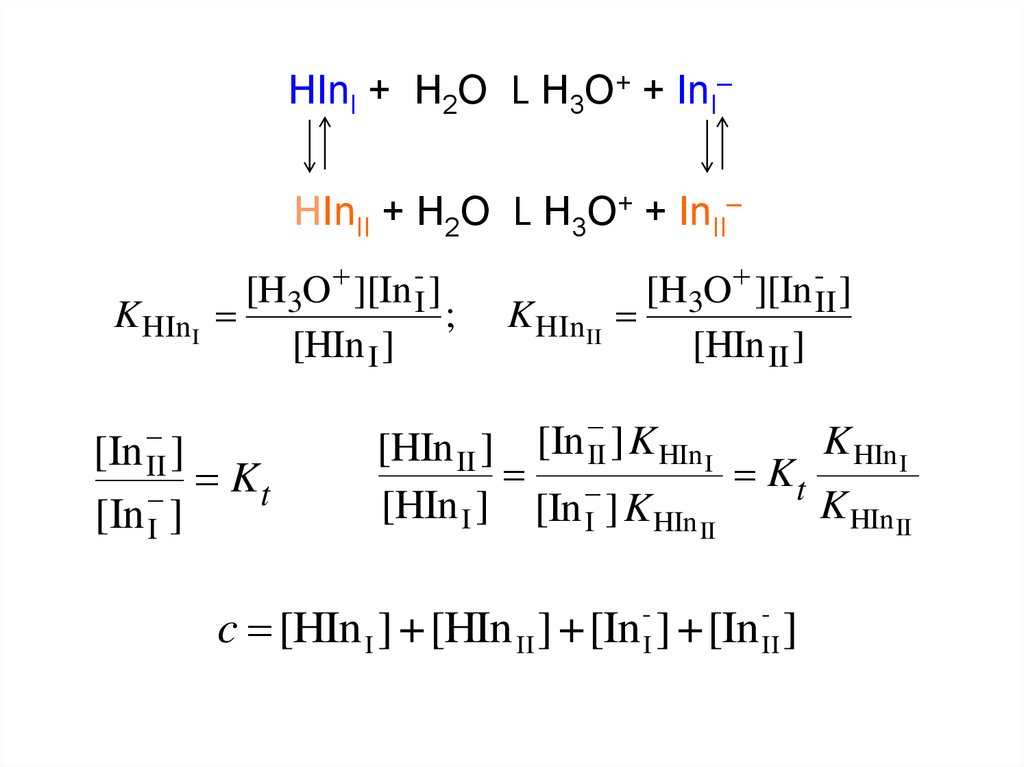
HInI + H2O L H3O+ + InI–HInII + H2O L H3O+ + InII–
K HInI
[In II ]
[In I ]
[H3O ][In -I ]
;
[HIn I ]
Kt
K HInII
[H3O ][In -II ]
[HIn II ]
[In II ] K HIn I
K HIn I
[HIn II ]
Kt
[HIn I ] [In I ] K HIn
K HIn II
II
c [HIn I ] + [HIn II ] + [In -I ] + [In -II ]
38.
[HIn I ]cK HIn II [H3O ]
[In I ]
b
cK HIn I K HIn II
b
;
[HIn II ]
;
[In II ]
cK HIn I Kt [H3O ]
b
cK HIn I K HIn II K t
b
b K HIn I K HIn II 1 Kt [H3O ] K HIn I Kt K HIn II
K 1 и
t
K 1 и
t
K
K
K HIn I
t K HIn
II
K HIn I
t K HIn
II
1;
K HIn I K HIn II
1;
K HIn I K HIn II
;
39.
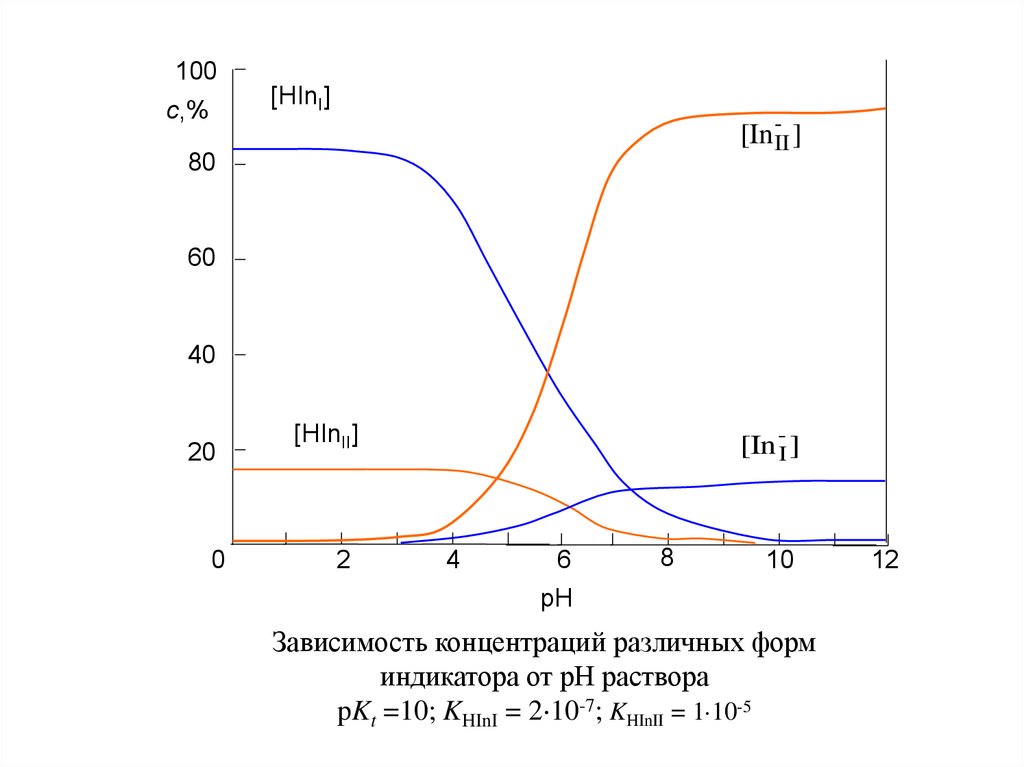
100[HInI]
c,%
[In -II ]
80
60
40
20
0
[HInII]
2
[In -I ]
4
6
pH
8
10
Зависимость концентраций различных форм
индикатора от рН раствора
pKt =10; KHInI = 2 10-7; KHInII = 1 10-5
12
40.
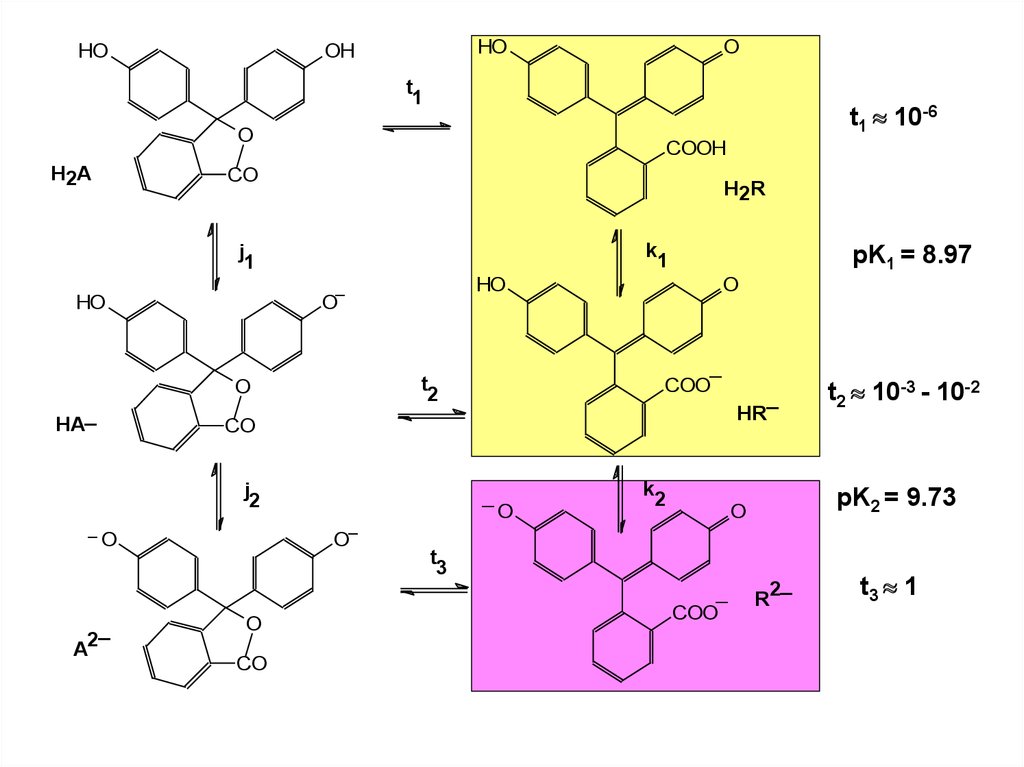
HOHO
OH
O
t
1
t1 10-6
O
H 2A
COOH
CO
H 2R
k
j
1
O
O
_
HA
A2
_
COO
t
2
HR
CO
j
2
_
O
HO
_
HO
pK1 = 8.97
1
_
O
_
_
O
O
CO
k
O
2
t2 10-3 - 10-2
_
pK2 = 9.73
O
t
3
_
COO
R2
_
t3 1
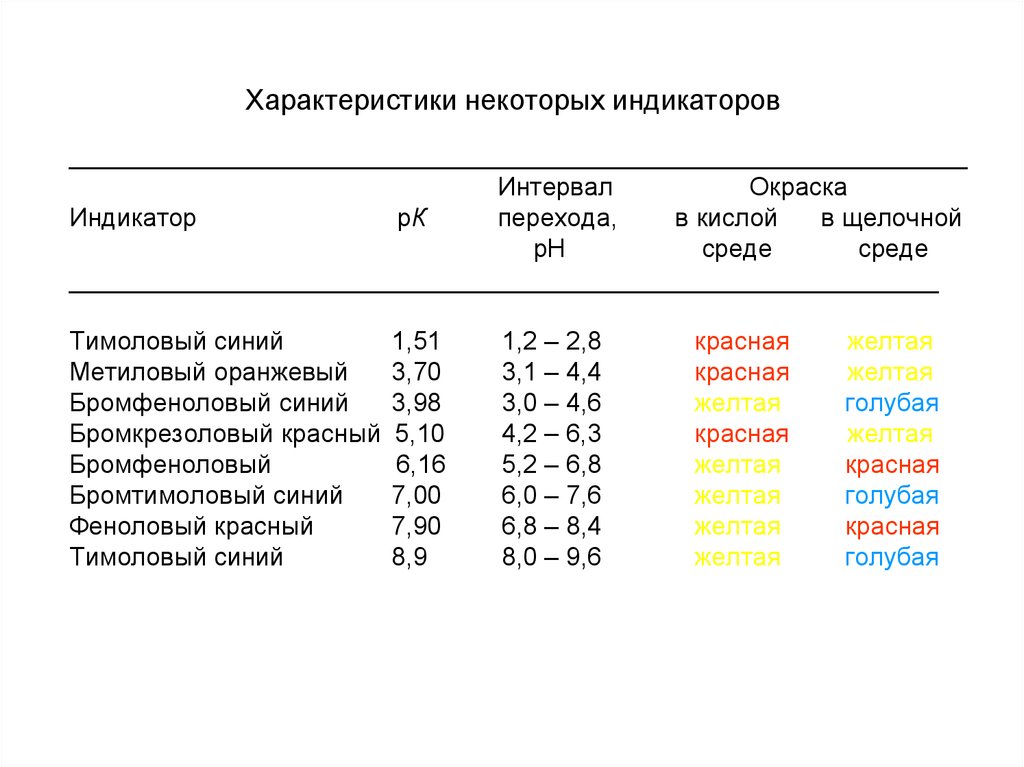
41. Характеристики некоторых индикаторов
_______________________________________________________________Интервал
Окраска
Индикатор
рК
перехода,
в кислой
в щелочной
рН
среде
среде
_____________________________________________________________
Тимоловый синий
Метиловый оранжевый
Бромфеноловый синий
Бромкрезоловый красный
Бромфеноловый
Бромтимоловый синий
Феноловый красный
Тимоловый синий
1,51
3,70
3,98
5,10
6,16
7,00
7,90
8,9
1,2 – 2,8
3,1 – 4,4
3,0 – 4,6
4,2 – 6,3
5,2 – 6,8
6,0 – 7,6
6,8 – 8,4
8,0 – 9,6
красная
красная
желтая
красная
желтая
желтая
желтая
желтая
желтая
желтая
голубая
желтая
красная
голубая
красная
голубая
42.
Кислотно-основное титрованиеcI
pH lg cH ;
pH lg
c ;
pH lg
c b
c
10 ;
c b
если
если
c II
pH 1
bnc
c
1 pH 0
c b
b c
c
pH ∞
c b
43.
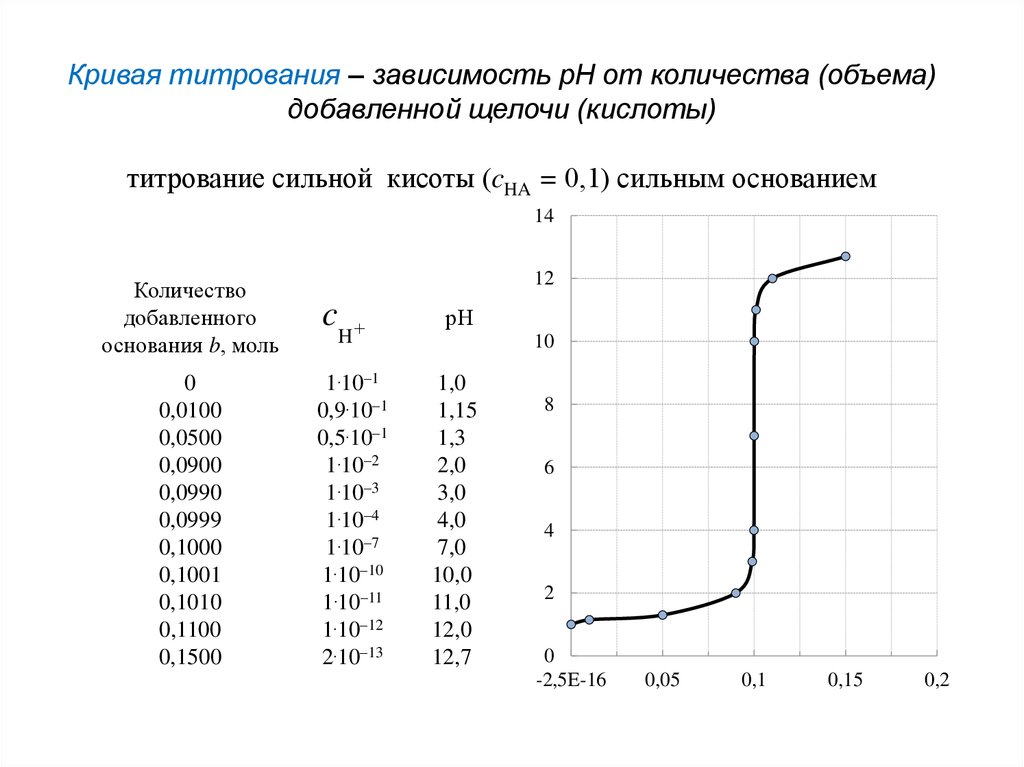
Кривая титрования – зависимость рН от количества (объема)добавленной щелочи (кислоты)
титрование сильной кисоты (cHA = 0,1) сильным основанием
14
Количество
добавленного
основания b, моль
0
0,0100
0,0500
0,0900
0,0990
0,0999
0,1000
0,1001
0,1010
0,1100
0,1500
12
c
H
рН
1.10–1
0,9.10–1
0,5.10–1
1.10–2
1.10–3
1.10–4
1.10–7
1.10–10
1.10–11
1.10–12
2.10–13
1,0
1,15
1,3
2,0
3,0
4,0
7,0
10,0
11,0
12,0
12,7
10
8
6
4
2
0
-2,5E-16
0,05
0,1
0,15
0,2
44.
HA + MeOH MeA + H2Oco
b
c
H
c
H
b cA
c
Me
KW
c
H
H
c
H+
H
c
c
b cA cOH
cA b
2
KW
2K W
cOH b c b c
A
A
cA
b 2 4K w
2 4K W
2
45.
Сильная кислотаb = 0,
c
H
c
cA = co
>> cOH ,
H
cA co ,
c c 4KW
2
A
рН = – lgco
В т. экв. cA = b, cH = K W
После т. экв.
c
H
2
o
(рН = 7 при 298К)
cOH >> c , (cA – b)2 >> 4KW,
H
KW
b cA
pH = pKW + lg (b – cA )
46.
Слабая кислота co = cHA + cA ;cA b c
H+
cOH , cHA co cA co b c
H
H
c
H+
b = 0;
c
cHA
K HA
cA
K HA
c
H
co b c
b c
H
>> cOH ,
1
c K HA
H
2
H
cOH
cOH
c
H+
K HA
2
K HA
4co K HA
2
co c
H
c
H
cOH
47.
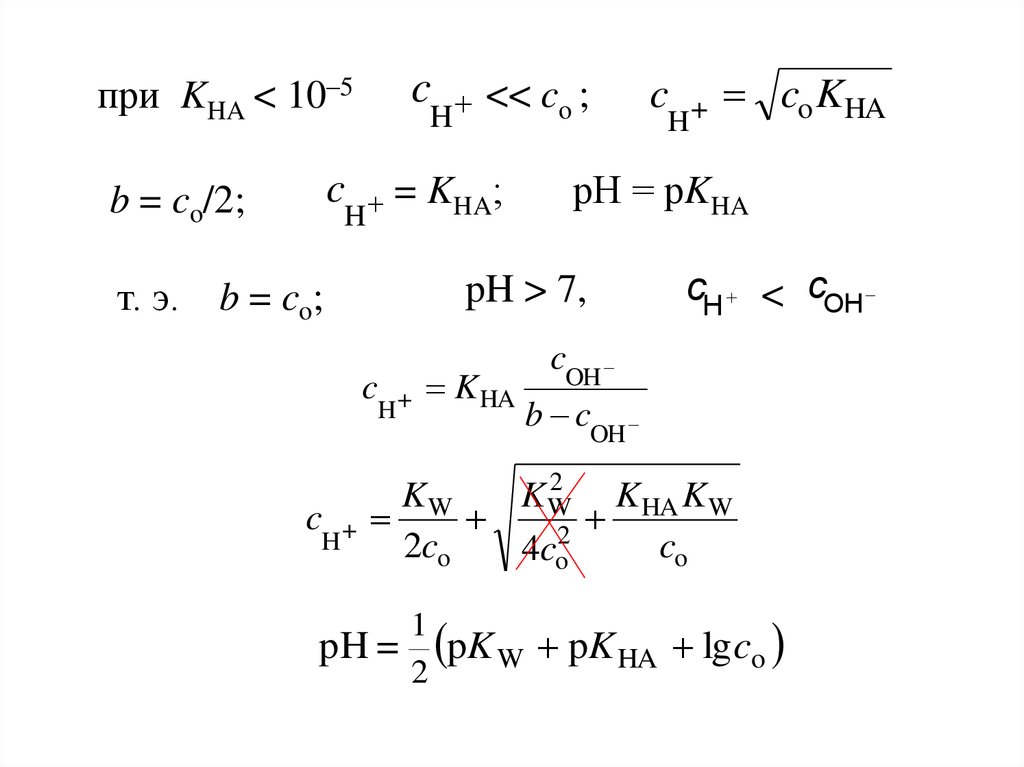
cпри KHA < 10–5
c
H
b = co/2;
т. э.
H
= KHA;
c
H+
H+
K HA
c
H+
co KHA
рН = pKHA
pH > 7,
b = co;
c
<< co ;
cH < cOH
cOH
b cOH
2
KW
KW
K HA K W
2co
co
4co2
1
pH = pK W pK HA lg co
2
48.
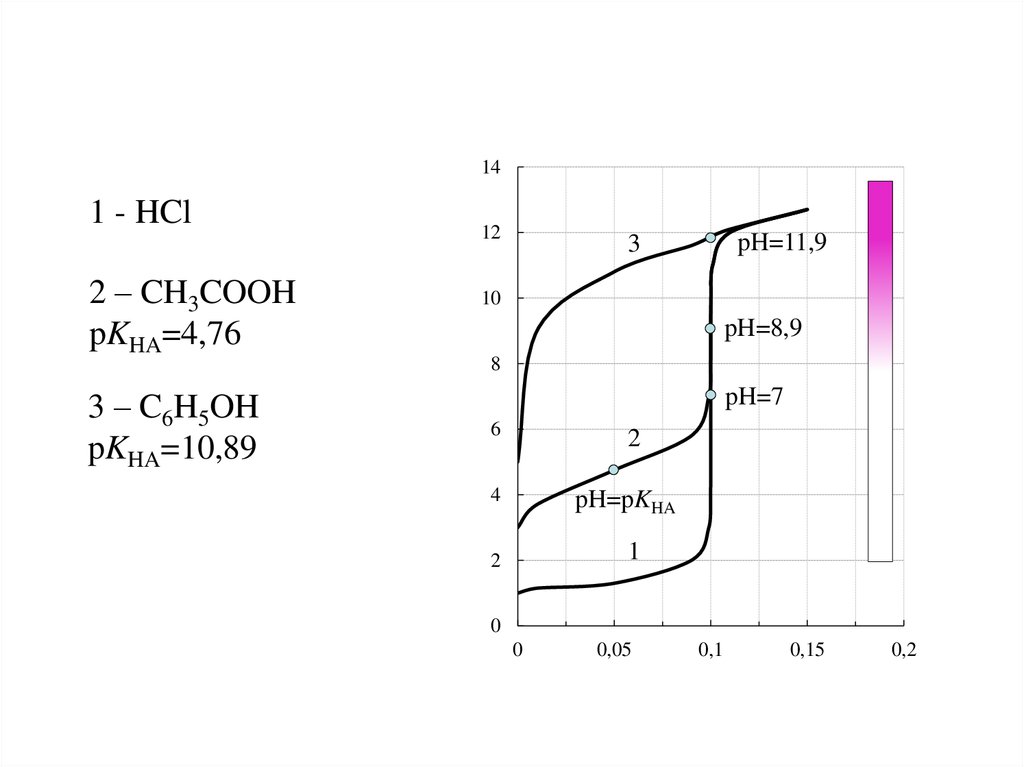
141 - HCl
2 – CH3COOH
pKHA=4,76
3 – C6H5OH
pKHA=10,89
12
pH=11,9
3
10
pH=8,9
8
pH=7
6
2
4
pH=pKHA
1
2
0
0
0,05
0,1
0,15
0,2
49.
Титрование смеси двух кислотHA I H A I
[H ][ A I ]
KI
[HA I ]
HA II H A II
[H ][ A II ]
K II
[HA II ]
K II [A II ][HA I ]
K I [A I ][HA II ]
условие и точность совместного титрования двух кислот
при coI = coII =0,1 точность титрования 1%
достигается, если KII/KI > 104
при coI = coII =0,1 и KII/KI = 103
точность титрования 10%
при KII/KI < 102 кислоты не раститровываются
при титровании в воде точности 0,1% можно
достичь, если KHA l 10-6
50.
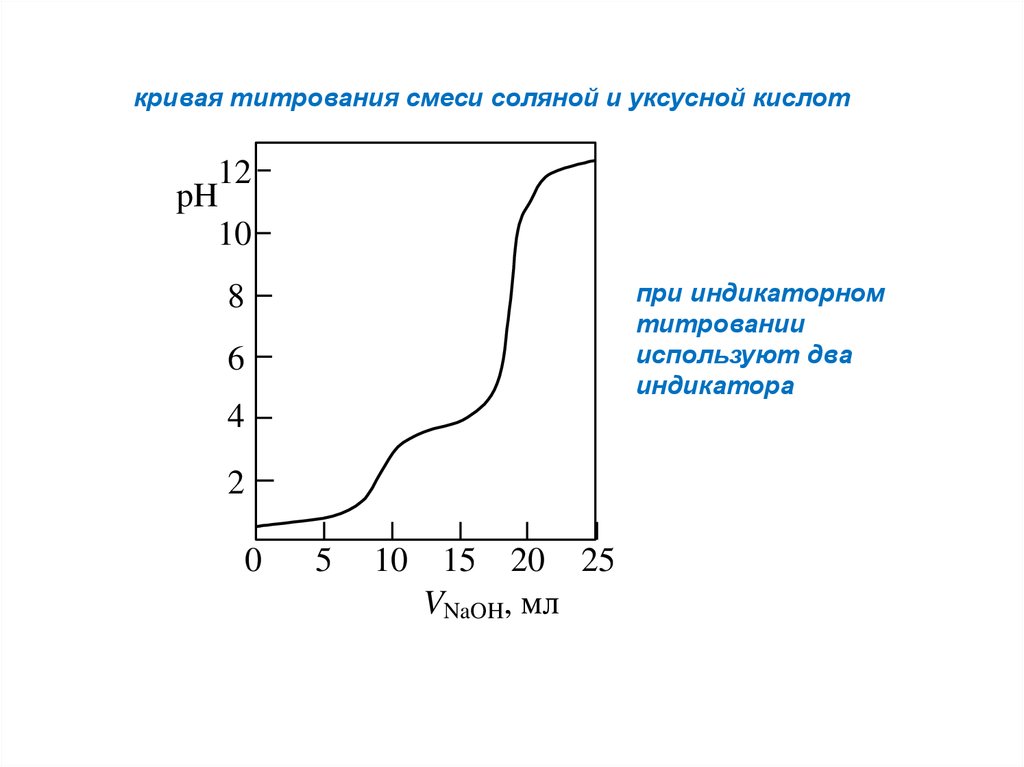
кривая титрования смеси соляной и уксусной кислот12
pH
10
при индикаторном
титровании
используют два
индикатора
8
6
4
2
0
5
10 15 20 25
VNaOH, мл
51.
ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИApBq L pAz+ +qBz-
тв
2
нас. p p
2
p A q B const
i io RTln ai
тв
2
o
p A
p
RTlna
A
ln a p a q
A
o
q B
2тв p Ao q Bo
B
p q
Ks a a
A B
RT
(ПР, La)
q
RTlna
B
const(T )
K s [A ] p [B ]q
52.
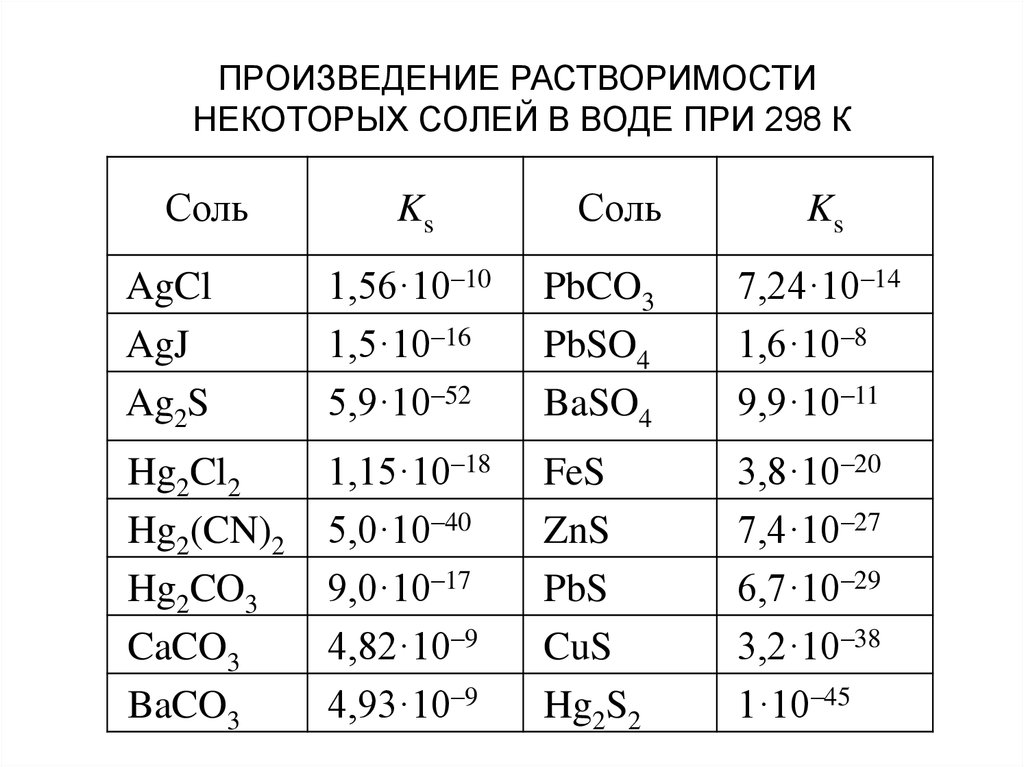
ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИНЕКОТОРЫХ СОЛЕЙ В ВОДЕ ПРИ 298 К
Соль
Ks
Соль
Ks
AgCl
AgJ
Ag2S
1,56·10–10
1,5·10–16
5,9·10–52
PbCO3
PbSO4
BaSO4
7,24·10–14
1,6·10–8
9,9·10–11
Hg2Cl2
Hg2(CN)2
Hg2CO3
CaCO3
BaCO3
1,15·10–18
5,0·10–40
9,0·10–17
4,82·10–9
4,93·10–9
FeS
ZnS
PbS
CuS
Hg2S2
3,8·10–20
7,4·10–27
6,7·10–29
3,2·10–38
1·10–45















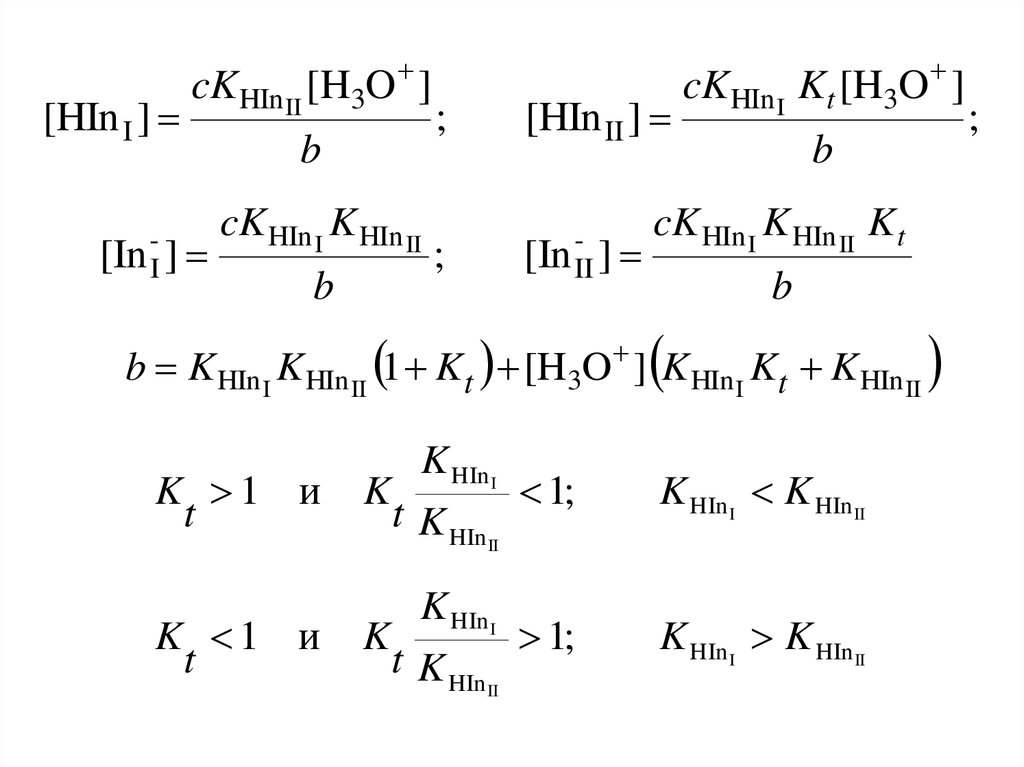






 Химия
Химия








