Похожие презентации:
Окислительно-восстановительный процесс - электролиз
1.
Электролиз2.
Электролиз –окислительно-восстановительный процесс,
протекающий на электродах при прохождении
постоянного электрического тока через раствор
или расплав электролита.
Электролиз – процесс
несамопроизвольный, т.е. ∆G > 0
Электрический ток является самым
сильным окислителем и самым сильным
восстановителем.
3.
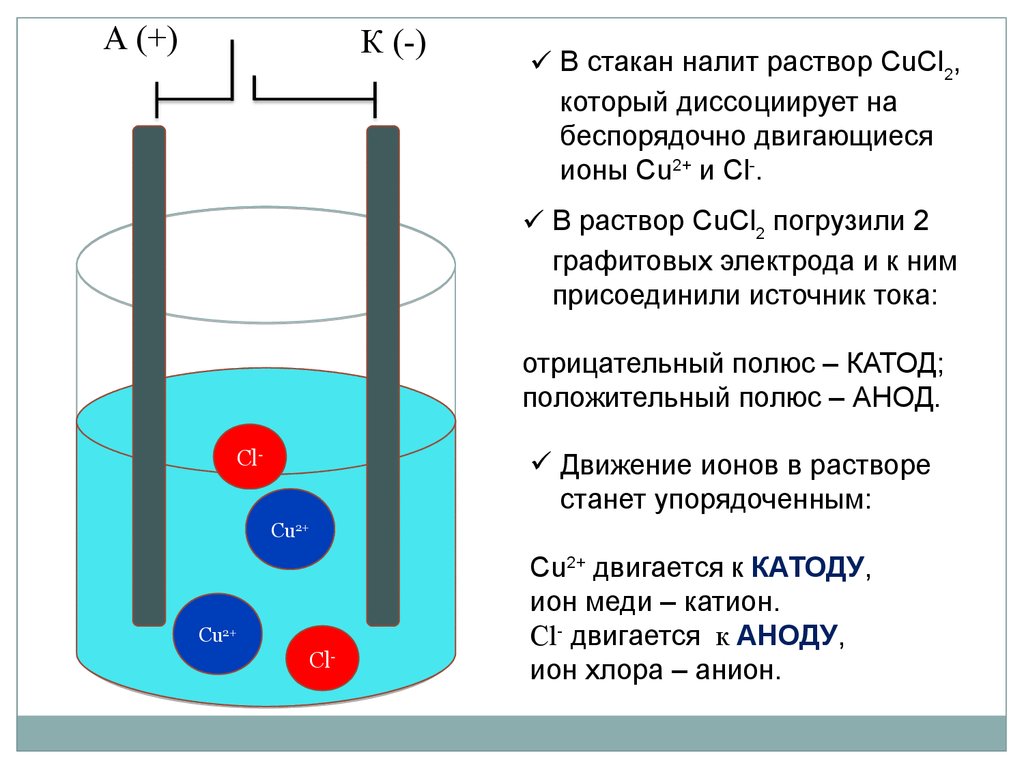
А (+)К (-)
В стакан налит раствор CuCl2,
который диссоциирует на
беспорядочно двигающиеся
ионы Cu2+ и Cl-.
В раствор CuCl2 погрузили 2
графитовых электрода и к ним
присоединили источник тока:
отрицательный полюс – КАТОД;
положительный полюс – АНОД.
Сl-
Движение ионов в растворе
станет упорядоченным:
Сu2+
Сu2+
Сl-
Cu2+ двигается к КАТОДУ,
ион меди – катион.
Cl- двигается к АНОДУ,
ион хлора – анион.
4.
При электролизе:на отрицательном электроде (катоде) идет
процесс восстановления,
восстановления
а на положительном электроде (аноде) идет
процесс окисления.
окисления
Анодные и катодные процессы зависят от
природы электролита (раствор или расплав) и
материала, из которого изготовлены электроды
(инертный или растворимый электрод).
5. Электролиз расплавов
NaCl → Na+ + ClK(-) Na+A(+) ClNa+ -1e
→ Na0 |*2
2Cl- →+2eCl20
2Na+ + 2Cl- → Na0 + Cl20
эл. ток
2NaCl → Na0 + Cl20
6. Анодные процессы
SO42- -2e → SO2 + O22NO3- -2e → 2NO2 + O2
4PO43--12e → 2P2O5 + 3O2
2SiO32- -2e → 2SiO2 + O2
2CO32- -2e → 2CO2 + O2
7. Электролиз растворов
NaCl → Na+ + Cl Кроме ионов Na+ и Cl- в раствореприсутствуют молекулы Н2О. В такой ситуации
пользуются правилами:
1) на аноде более вероятен тот процесс, для
которого электродный потенциал меньше;
2) на катоде более вероятен тот процесс, для
которого электродный потенциал больше.
8.
Сравнение величин электродных потенциалов приводитк выводу:
Катодный процесс:
1. В растворах солей
металлов, стоящих в ЭХН
левее Al, происходит
катодное восстановление
воды.
2. В растворах солей
металлов, стоящих в ЭХН
правее водорода,
происходит
восстановление металла.
3. В растворах солей
металлов, находящихся
между Al и Н2, возможно
одновременное
восстановление металла
и молекул воды
Анодный процесс:
1. В растворах,
содержащих анионы
кислородсодержащих
кислот, происходит
анодное окисление
воды.
2. В растворах,
содержащих анионы
бескислородных кислот
(кроме F-), происходит
анодное окисление
аниона.
9. Электролиз раствора NaCl
NaCl → Na+ + ClK(-) Na+, Н2ОA(+) Cl- , Н2О
2H2O - 2e→H2 + 2OН- 2Cl- +2е→Cl20
2H2O + 2Cl- →Н2 + 2ОH- + Сl2
2H2O + 2NaCl →Н2 + 2NaОH + Сl2
10. Самостоятельная работа
Написать суммарное уравнение реакции,уравнения катодных и анодных
процессов, происходящих при
электролизе раствора соли:
Вариант 1
ZnSO4
Вариант 2
NiCl2
Вариант 3
MgSO4
Вариант 4
AlCl3
Вариант 5
AgNO3
Вариант 6
FeCl3








 Физика
Физика Химия
Химия








