Похожие презентации:
Щелочные металлы
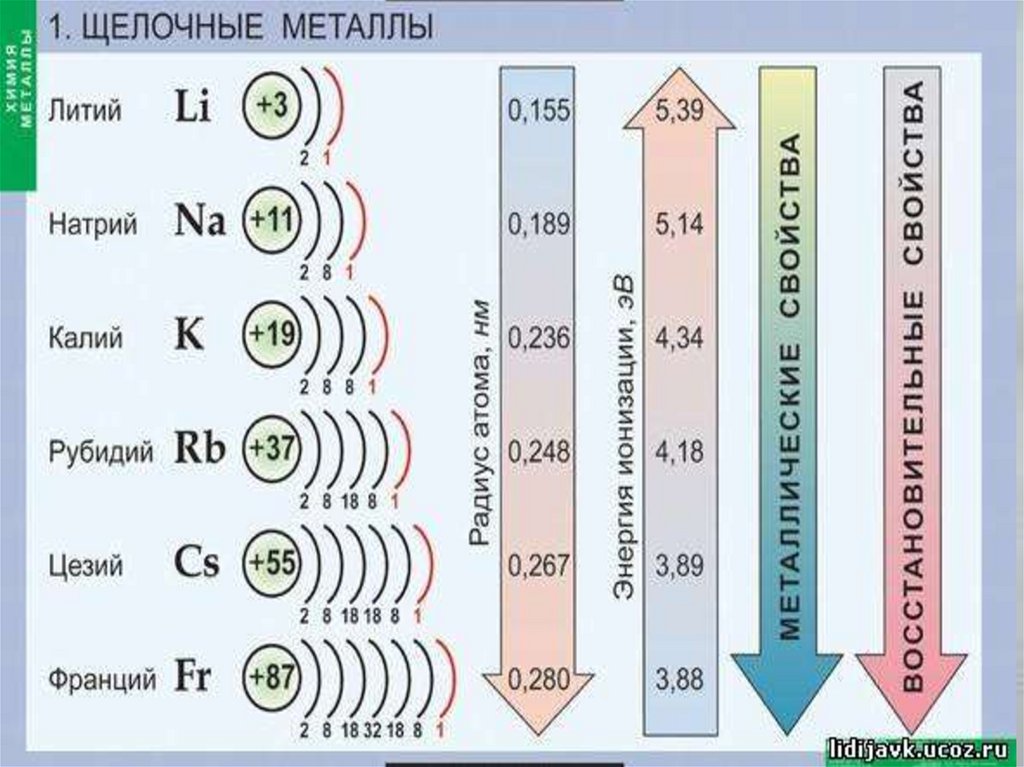
1. Щелочные металлы
Выполнили:Осипова А., Печенкина С
2.
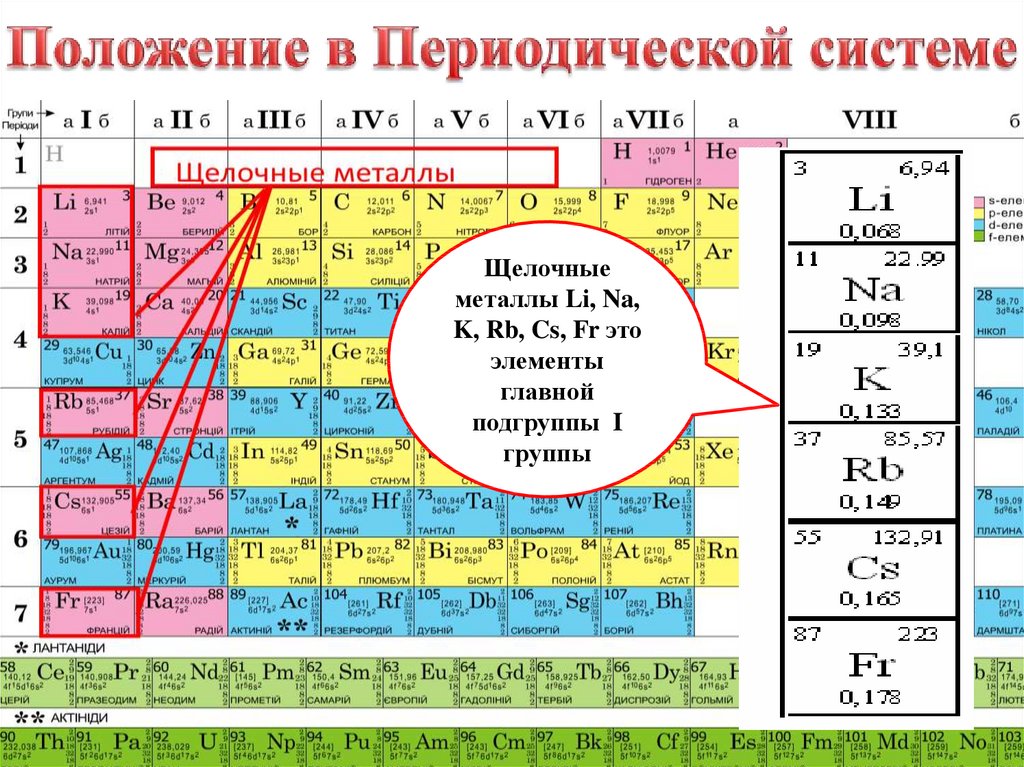
Щелочныеметаллы Li, Na,
K, Rb, Cs, Fr это
элементы
главной
подгруппы I
группы
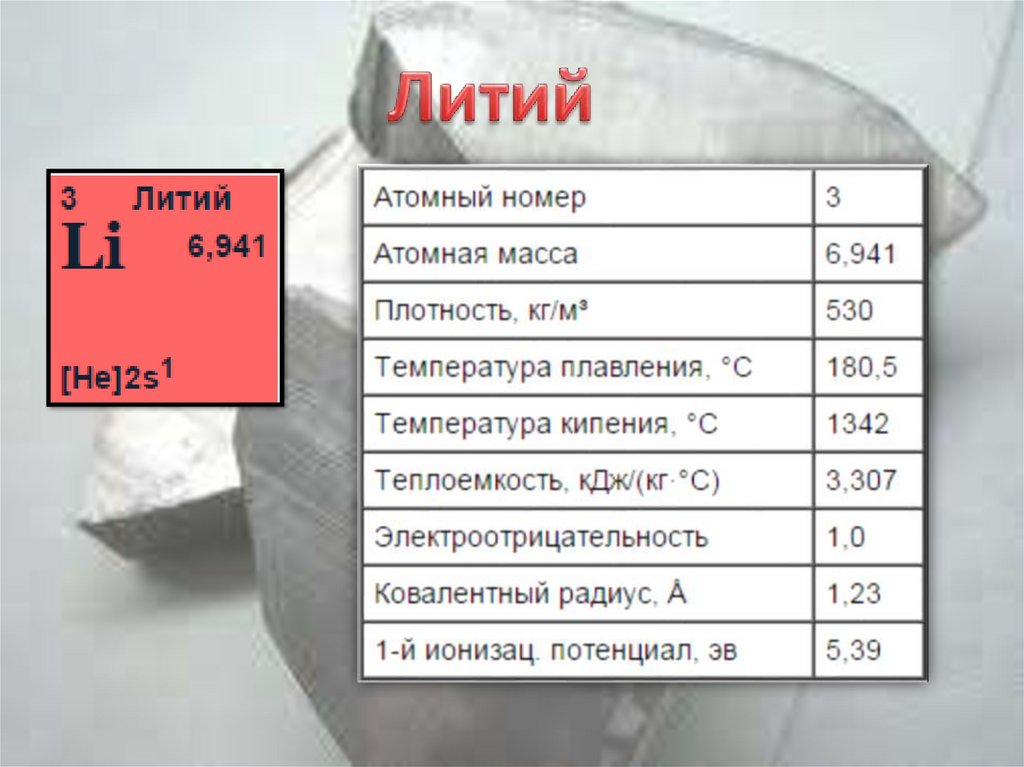
3.
4.
5.
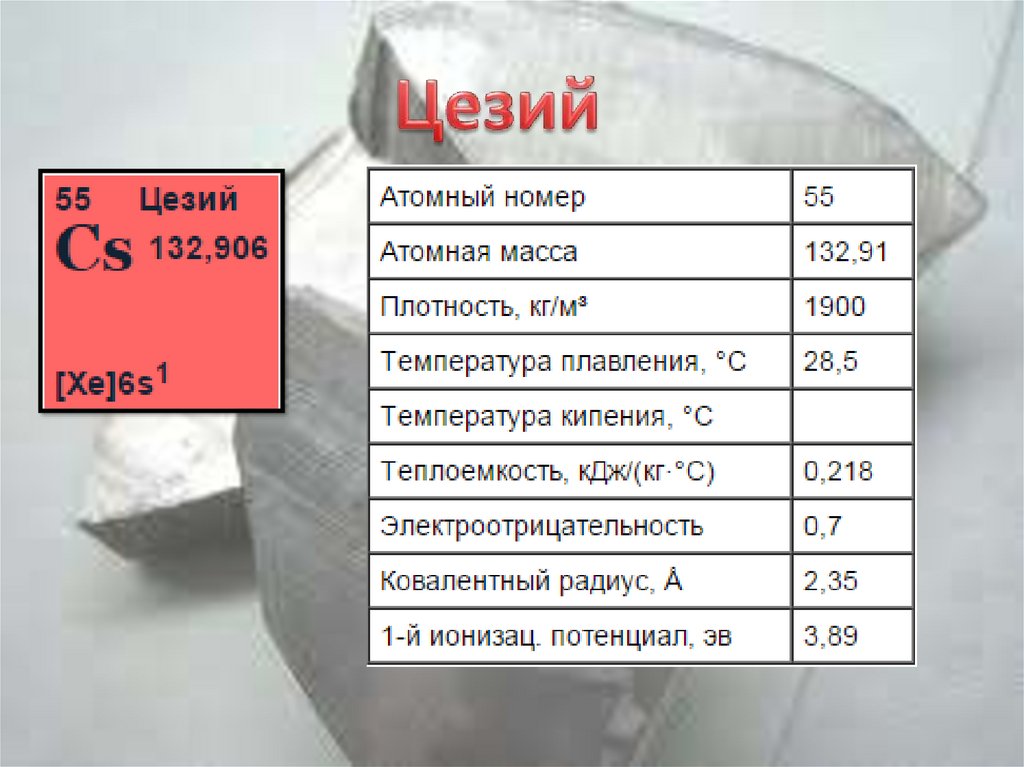
6.
7.
8.
9.
10. Щелочные металлы в свободном виде в природе не встречаются т.к. очень сильно окисляются,они встречаются в виде алюмоселикатов
Нахождение в природе (по массе)2,5
Na
2
K
1,5
1
0,5
0
Li
остальные
элементы редкие
11.
петалит (Li,Na)[Si4AlO10]лепидолит KLi1.5Al1.5[Si3AlO10](F,OH)2.
сподумен LiAl[Si2O6]
12.
Na2SO4· 10H2O - глауберова сольNa3AlF6 - криолит
NaNO3 - чилийская селитра
Na2B4O7· 10H2O - бура
13.
KCl - сильвинKCl·MgCl2·6H2O карналлит
KCl NaCl - сильвинит
14.
циннвальдитRbCl·MgCl2·6H2O карналлит
амазонит
15.
поллуцитавонгадрид
16.
Цвет - серебристо-белый (Сs - золотисто-желтый);
Тип связи – металлический;
Кристаллическая решетка – объемоцентрированная;
Тепло- и электропроводность – высокая;
Все металлы очень активны, поэтому их хранят в
запаянных ампулах, под слоем вазелинового масла или
керосина.
• Обладают мягкостью и пластичностью, могут быть
порезаны ножом.
17.
• Взаимодействие с неметалламиоксид образует только литий:
4Li + O2 = 2Li2O,
натрий образует пероксид:
2Na + O2 = Na2O2,
калий, рубидий и цезий – надпероксид:
K + O2 = KO2.
18.
С галогенами образуют галогениды: 2Na + Cl2 = 2NaCl.С водородом образуются гидриды: 2Na + H2 = 2NaH,
с серой – сульфиды: 2K + S = K2S,
с фосфором – фосфиды: 3K + P = K3P,
с кремнием – силициды: 4Cs + Si = Cs4Si,
с углеродом карбиды образуют литий и натрий:
2Li + 2C = Li2C2,
С азотом легко реагирует только литий, реакция
протекает при комнатной температуре с образованием
нитрида лития: 6Li + N2 = 2Li3N.
19.
• Взаимодействие с водойВсе щелочные металлы с водой, литий реагирует
спокойно, держась на поверхности воды, натрий
часто воспламеняется, а калий, рубидий и цезий
реагируют со взрывом:
2Mе + 2H2O = 2MOH + H2.
20.
• Взаимодействие с кислотамиЩелочные металлы способны реагировать с
разбавленными кислотами с выделением водорода,
однако реакция будет протекать неоднозначно,
поскольку металл будет реагировать и с водой, а
затем образующаяся щелочь будет нейтрализоваться
кислотой. Взаимодействие щелочных металлов с
кислотами практически всегда сопровождается
взрывом, и такие реакции на практике не проводятся.
21.
• Взаимодействие с аммиаком.Щелочные металлы реагируют с аммиаком с
образованием амида натрия:
2Li + 2NH3 = 2LiNH2 + H2.
22.
• Взаимодействие с органическимивеществами
Щелочные металлы реагируют со спиртами и
фенолами, которые проявляют в данном случае
кислотные свойства:
2Na + 2C2H5OH = 2C2H5ONa + H2;
2K + 2C6H5OH = 2C6H5OK + H2;
23.
• Восстановление металлов из оксидов и солейМенее активные металлы могут быть получены
восстановлением щелочными металлами:
3Na + AlCl3 = Al + 3NaCl.
24.
окрашивание пламени в следующие цвета:Общая характеристика щелочных
металлов
25.
Важнейшиекомпоненты
химических
производств
Отбелка и
дезинфекция
Na2O2
Мыловарение
Na2CO3
Производство
стекла Na2CO3,
K2CO3,
Na2SO4, Li2O
Минеральные
удобрения KCl,
KNO3





















 Химия
Химия








