Похожие презентации:
Теория электролитической диссоциации
1.
Химия. 11 класс(профильный уровень)
Теория
электролитической
диссоциации
2.
3.
4.
Электролитическая диссоциация (ЭД) –процесс распада молекул электролита на
ионы в растворе (под действием молекул
воды – полярного растворителя) или
расплаве.
5.
Теория электролитической диссоциации1887 г.
Аррениус Сванте
(1859–1927)
Основные работы
посвящены учению о
растворах и кинетике
химических реакций.
На основании своих
исследований (1882–1883)
высказал идею об
электролитической
диссоциации.
6.
7.
8.
Диссоциация многоосновной кислотыпротекает главным образом по первой ступени,
в меньшей степени по второй и лишь в
незначительной степени – по третьей.
9.
10.
11.
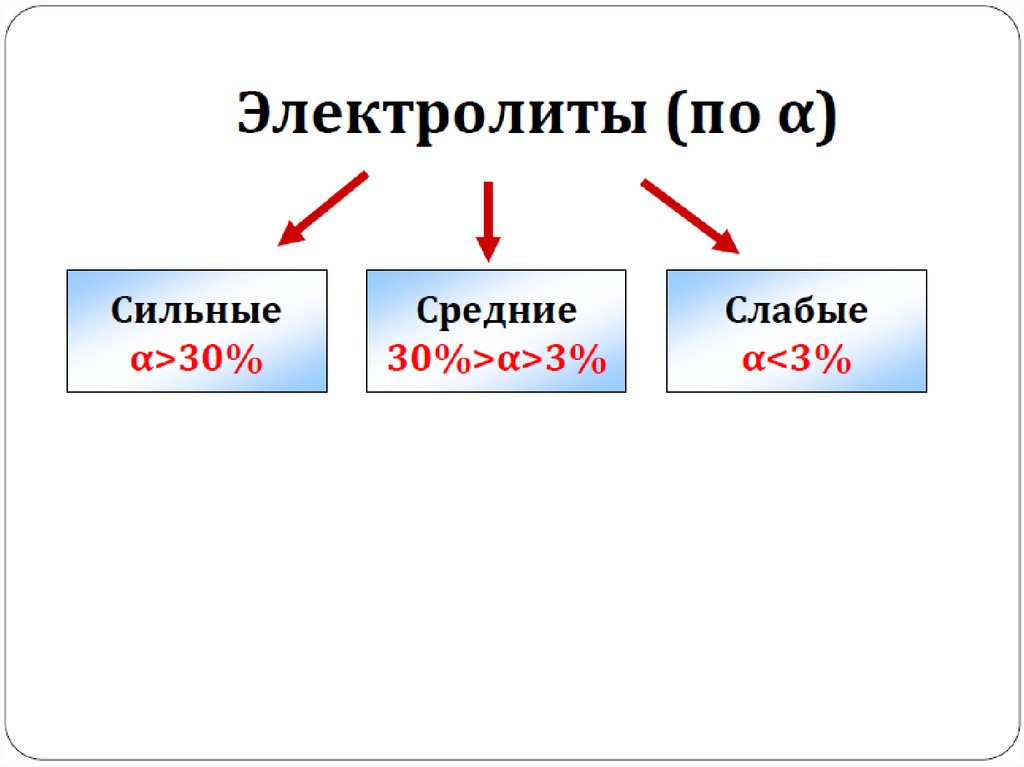
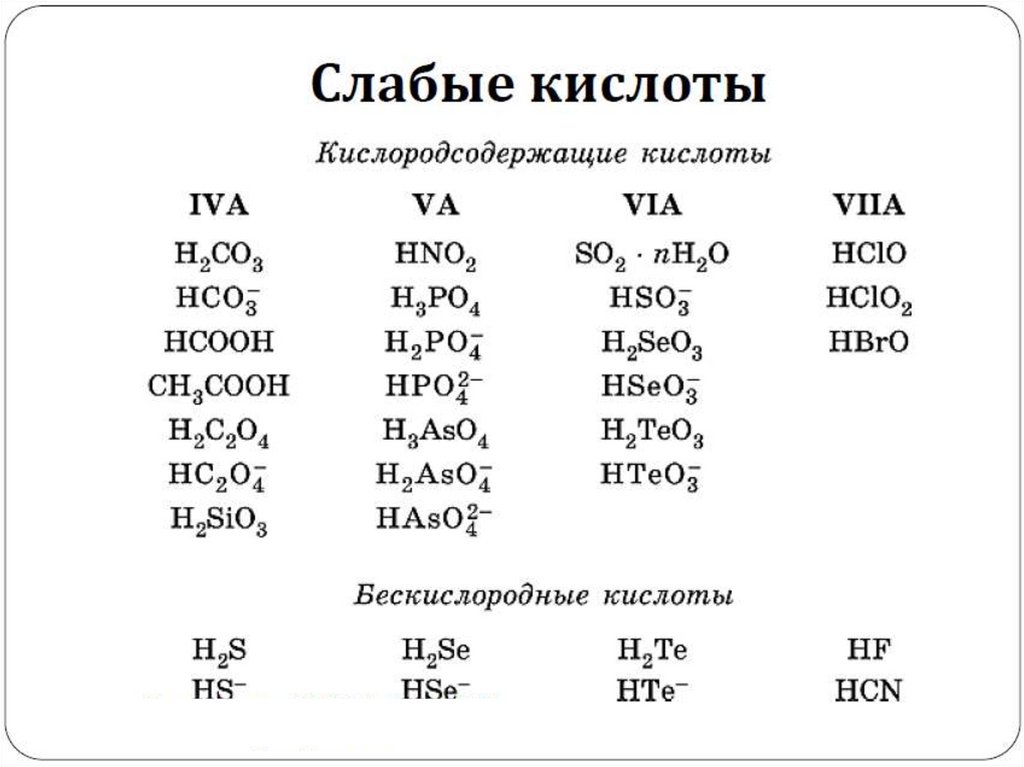
Сильные и слабыеэлектролиты.
Степень и константа
диссоциации.
12.
13.
14.
15.
16.
17.
18.
19.
20.
21.
22.
23.
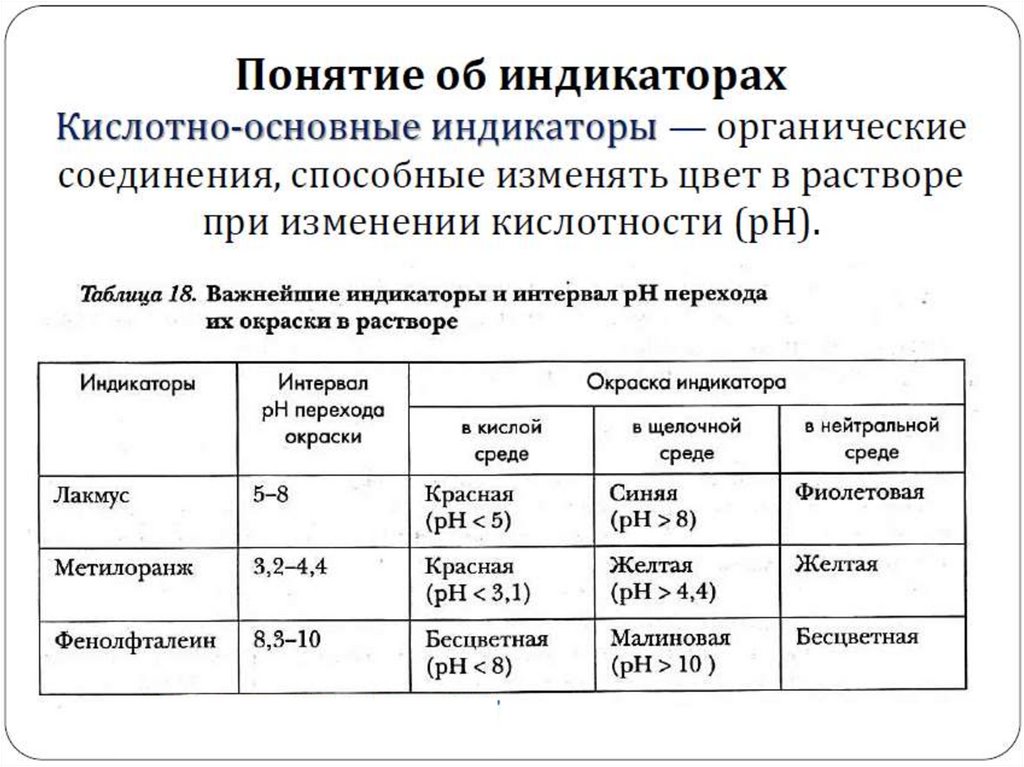
Ионное произведение воды.Понятие о рН раствора.
24.
25.
26.
27.
28.
29.
30.
Гидролиз неорганическихи органических
соединений
31.
1. Гидролиз неорганическихсоединений
32.
Гидролиз – реакция обменного взаимодействияхимического вещества с молекулами воды.
Слово «гидролиз» означает разложение водой
(«гидро» вода, «лизис» - разложении).
Гидролиз солей – процесс взаимодействия ионов
соли с молекулами воды, приводящий к
образованию слабого электролита.
33.
34.
Гидролизу подвергаются:I.
Растворимые соли, в состав которых входит хотя
бы один слабый ион (обратимый гидролиз):
1. Соли, образованные слабым основанием и сильной
кислотой FeCl2, NH4Cl, Al2(SO4)3, MgSO4 (гидролиз по
катиону).
2. Соли, образованные сильным основанием и слабой
кислотой Na2CO3, К2S, Na2SO3 (гидролиз по аниону).
3. Соли, образованные слабым основанием и слабой
кислотой NН4NO2, Ni(NO2)2, (CН3COO)2Cu (гидролиз по
катиону и аниону).
35.
36.
37.
38.
39.
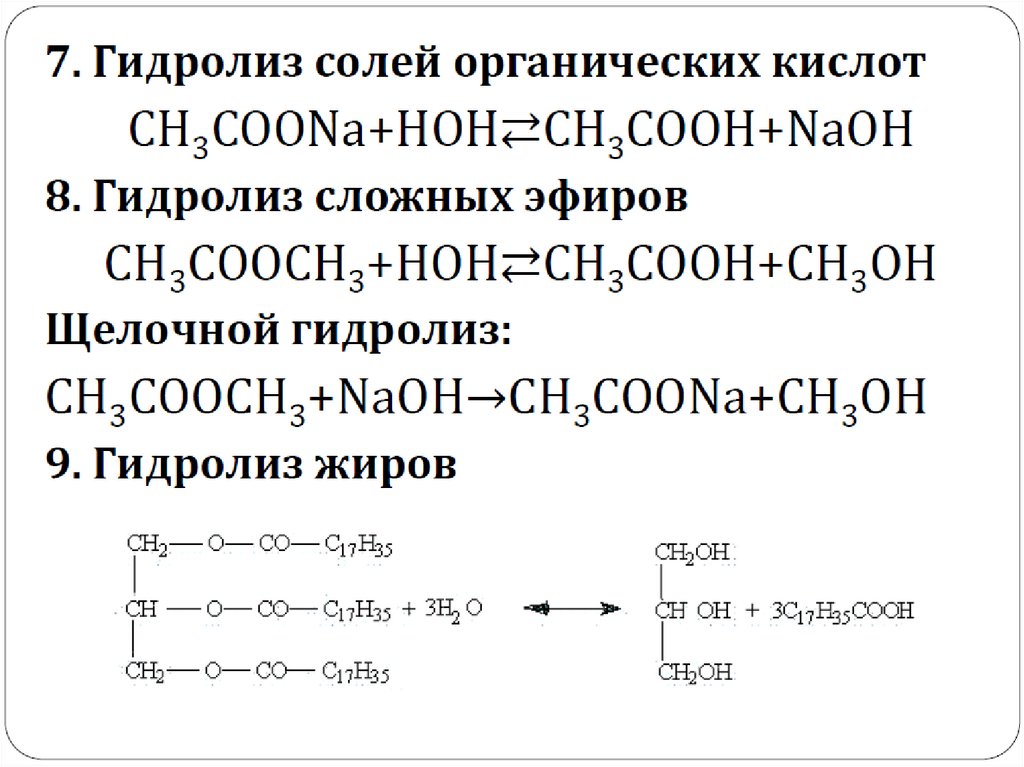
2. Гидролиз органическихсоединений
40.
41.
42.
43.
44.
1. Температура.Опыт. Усиление гидролиза солей при нагревании
Т.к. реакция гидролиза эндотермическая, повышение температуры
смещает равновесие в системе вправо, степень гидролиза возрастает.
2. Концентрация продуктов гидролиза.
Повышение концентрации Н+ или ОН- смещает равновесие влево,
степень гидролиза уменьшается.
3. Разбавление.
При разбавлении равновесие смещается вправо, степень гидролиза
возрастает.
4. Концентрация соли.
Концентрация соли уменьшает степень гидролиза. Рассмотрение этого
фактора приводит к парадоксальному выводу: равновесие в системе
смещается вправо, в соответствии с принципом Ле Шателье, но
степень гидролиза уменьшается.










































 Химия
Химия