Похожие презентации:
Электролитическая диссоциация. Теория электролитической диссоциации (ТЭД)
1. Электролитическая диссоциация
2. Теория электролитической диссоциации (ТЭД)
СвантеАррениус
В 1887г. Шведский учёный
С. Аррениус для объяснения
особенностей водных растворов
веществ предложил теорию
электролитической
диссоциации.
В дальнейшем эта теория была
развита многими учёными.
3.
Аррениус Сванте(1859–1927)
Один из основоположников физической
химии. Основные работы посвящены учению
о растворах и кинетике химических реакций.
На основании своих исследований (1882–
1883), свидетельствовавших об увеличении
электрической проводимости и активности
растворов при их разбавлении,
сформулировал вывод о самопроизвольном
распаде молекул солей в растворе на
заряженные частицы – ионы, т. е. высказал
идею об электролитической диссоциации.
Осуществил (1884–1886) цикл работ по
изучению зависимости между химическими
свойствами растворов электролитов и их
проводимостью и предложил (1887)
всесторонне обоснованную теорию
электролитической диссоциации, согласно
которой активность и степень диссоциации
электролитов на ионы уменьшается с ростом
концентрации их растворов.
4. Они развили ТЭД
И.А. КаблуковД.И.Менделеев
В.А. Кистяковский
5. Иван Алексеевич Каблуков (1857-1942).
Ввёл в наукупредставление о
сольватации (гидратации)
ионов, послужившее
основой для объединения
химических и физических
теорий растворов.
6. Менделеев против Аррениуса
Растворение –химический процесс
Раствор – результат
химических
взаимодействий между
растворенным
веществом и
растворителем
Растворение – процесс
диффузии
Раствор – результат
смешивания молекул
растворенного вещества
и растворителя
Растворы электролитов
состоят из ионов
Электролитическая диссоциация, как и растворение
– физико-химический процесс
7.
Все вещества по их способностипроводить электрический ток в
растворах делятся на электролиты и
неэлектролиты.
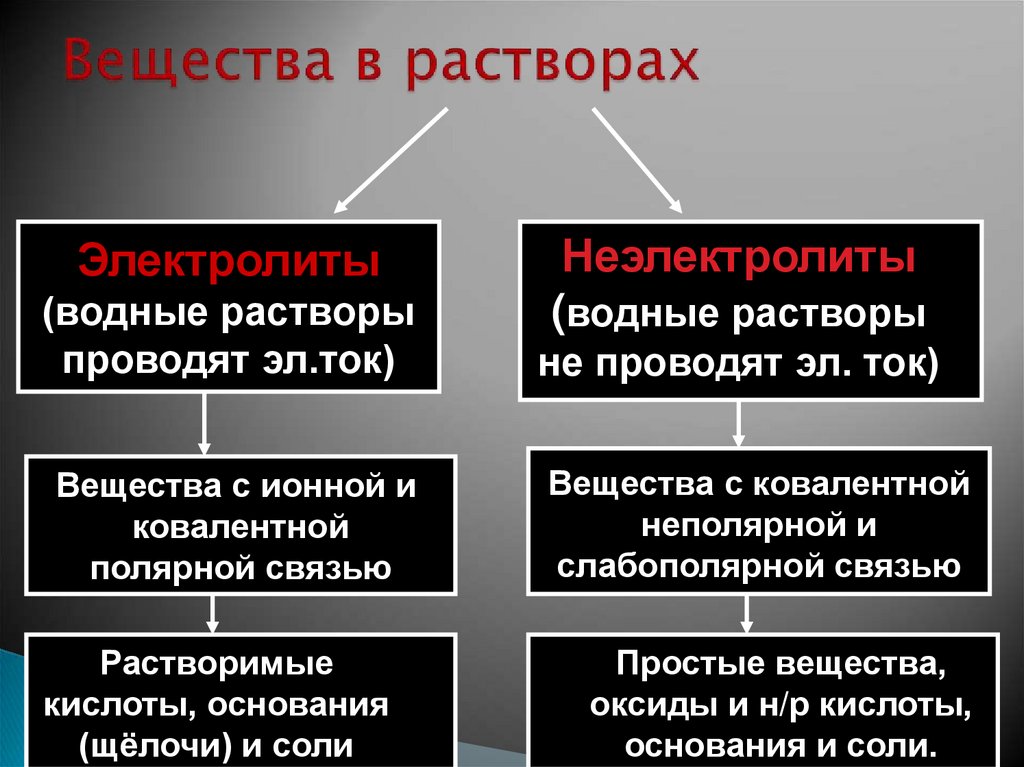
8. Вещества в растворах
ЭлектролитыНеэлектролиты
(водные растворы
(водные растворы
проводят эл.ток)
не проводят эл. ток)
Вещества с ионной и
ковалентной
полярной связью
Вещества с ковалентной
неполярной и
слабополярной связью
Растворимые
кислоты, основания
(щёлочи) и соли
Простые вещества,
оксиды и н/р кислоты,
основания и соли.
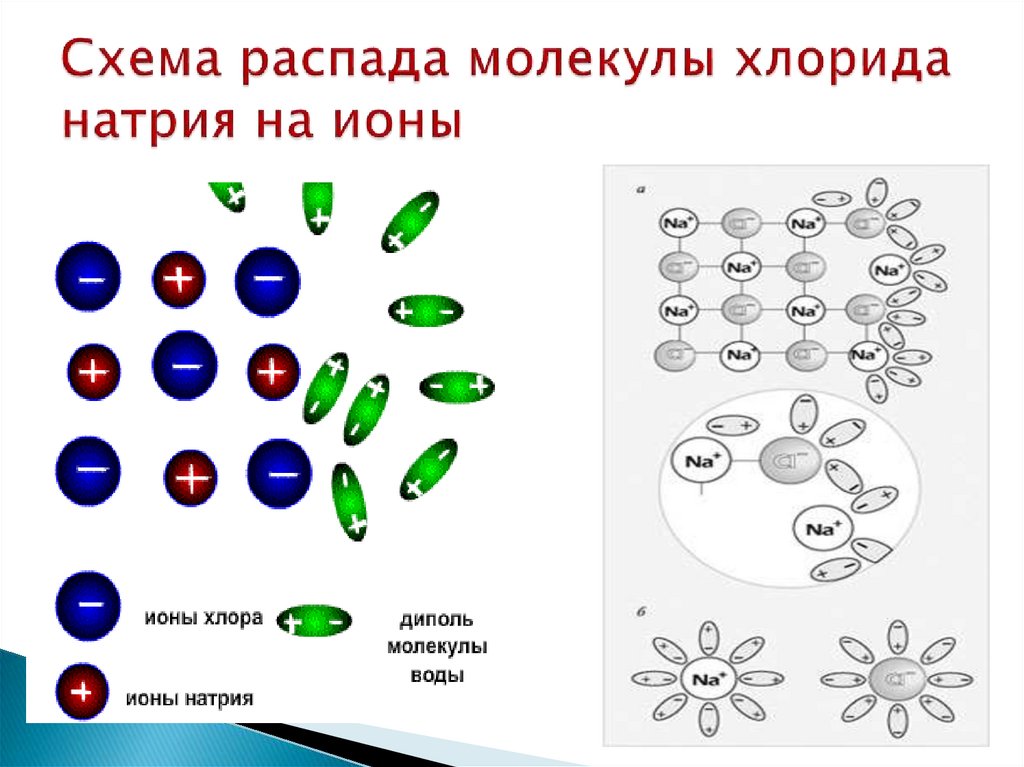
9. Схема распада молекулы хлорида натрия на ионы
10. Механизм электролитической диссоциации веществ с ионным типом связи
а) ориентация молекул – диполей водыоколо ионов кристалла
б) гидратация (взаимодействие) молекул
воды с ионами поверхностного слоя
кристалла
в) диссоциация (распад) кристалла
электролита на гидратированные ионы
11. Диссоциация молекул HCl на ионы в водном растворе
12. Сущность процесса электролитической диссоциации веществ с ковалентной полярной связью
а) ориентация молекул воды вокруг полюсовмолекулы электролита
б) гидратация (взаимодействие) молекул воды с
молекулами электролита
в) ионизация молекул электролита (превращение
ковалентной полярной связи в ионную)
г) диссоциация (распад) молекул электролита на
гидратированные ионы
13. Основные положения ТЭД
1.При растворении в воде электролиты
диссоциируют (распадаются) на
положительные и отрицательные ионы.
NaCl = Na+ + Cl-
Ионы – это одна из форм существования
химического элемента
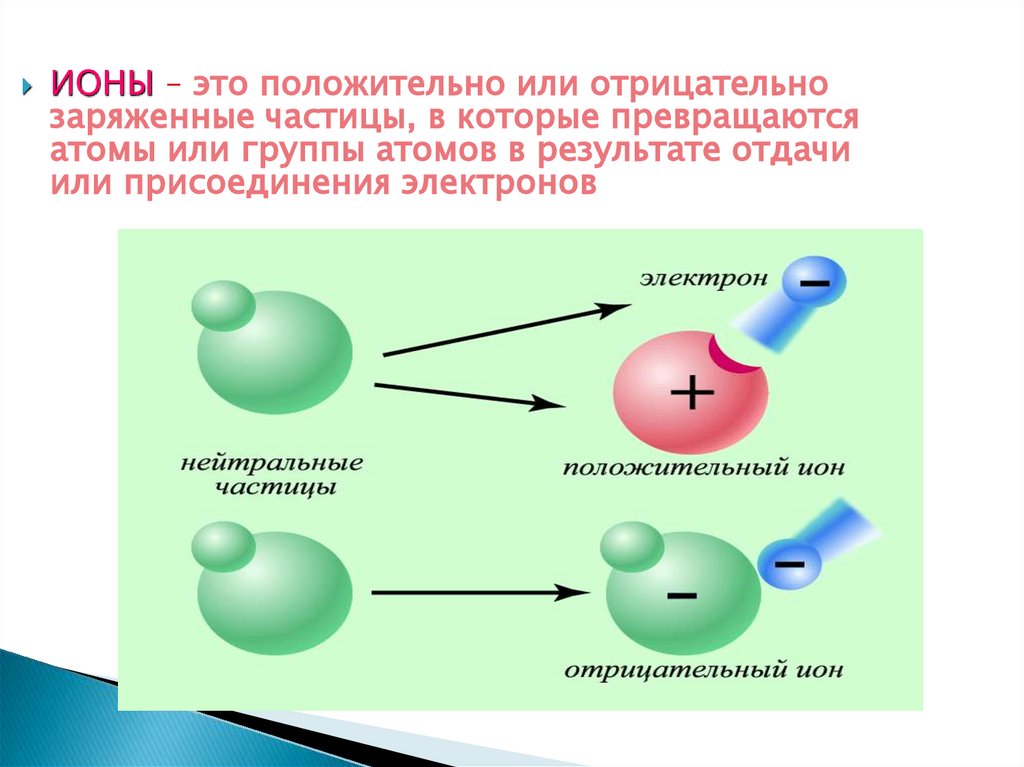
14.
ИОНЫ – это положительно или отрицательнозаряженные частицы, в которые превращаются
атомы или группы атомов в результате отдачи
или присоединения электронов
15. ИОНЫ (по составу)
ПРОСТЫЕСЛОЖНЫЕ
Например:
Cl K+
Например:
NO3 SO42-
16. Основные положения ТЭД
2. Причиной диссоциации электролита вводном растворе является его гидратация,
т.е. взаимодействие электролита с
молекулами воды и разрыв химической
связи в нем.
17. ИОНЫ (по наличию водной оболочки)
ГИДРАТИРОВАННЫЕНапример:
В растворах и
кристаллогидратах
CuSO4 * 5H2O
Na2SO4* 10H2O
НЕГИДРАТИРОВАННЫЕ
Например:
В безводных солях
Cu2+SO42Na+NO3-
18. Основные положения ТЭД
3. Под действием электрического токаположительно заряженные ионы движутся к
отрицательному полюсу источника тока –
катоду, поэтому их называют катионами, а
отрицательно заряженные ионы движутся к
положительному полюсу источника тока –
аноду, поэтому их называют анионами.
19. ИОНЫ (по знаку заряда)
КАТИОНЫположительно
заряженные
частицы
АНИОН
отрицательно
заряженные
частицы
20. Основные положения ТЭД
4. Электролитическая диссоциация –процесс обратимый для слабых
электролитов.
Наряду с процессом диссоциации
протекает и обратный процесс –
ассоциация (соединение ионов)
HNO2
H+ + NO2-
21. Основные положения ТЭД
5. Не все электролиты в одинаковой мередиссоциируют на ионы.
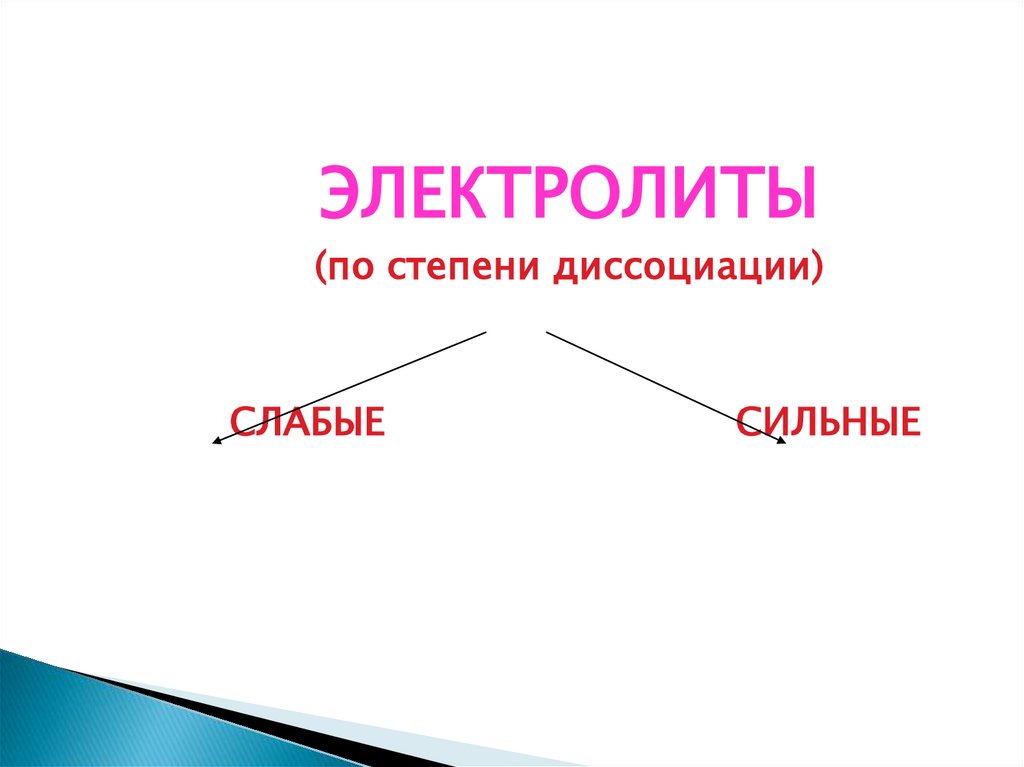
22.
ЭЛЕКТРОЛИТЫ(по степени диссоциации)
СЛАБЫЕ
СИЛЬНЫЕ
23.
24.
25.
Степень диссоциации –отношение числа частиц,
распавшихся на ионы, к общему
числу частиц
N распавшихся молекул на ионы
α = -------------------------------------------N общее число молекул
26. Основные положения ТЭД
6. Химические свойства растворовэлектролитов определяются свойствами тех
ионов, которые они образуют при
диссоциации.
27. ЭЛЕКТРОЛИТЫ (по характеру образующихся ионов)
КИСЛОТЫОСНОВАНИЯ
СОЛИ
28.
Кислоты, основания и соли в светеТЭД
1.Кислотами называют электролиты, которые при
диссоциации образуют катионы водорода и анионы
кислотного остатка:
HnK ↔ nH+ + Kn2.Основаниями называются электролиты, которые
при диссоциации образуют катионы металла и
анионы гидроксогрупп: Me(OH)n ↔ Men+ + nОН-
3.Солями называются электролиты, которые при
диссоциации образуют катионы металла и анионы
кислотных остатков: MenKm ↔ nMem+ + mKn-
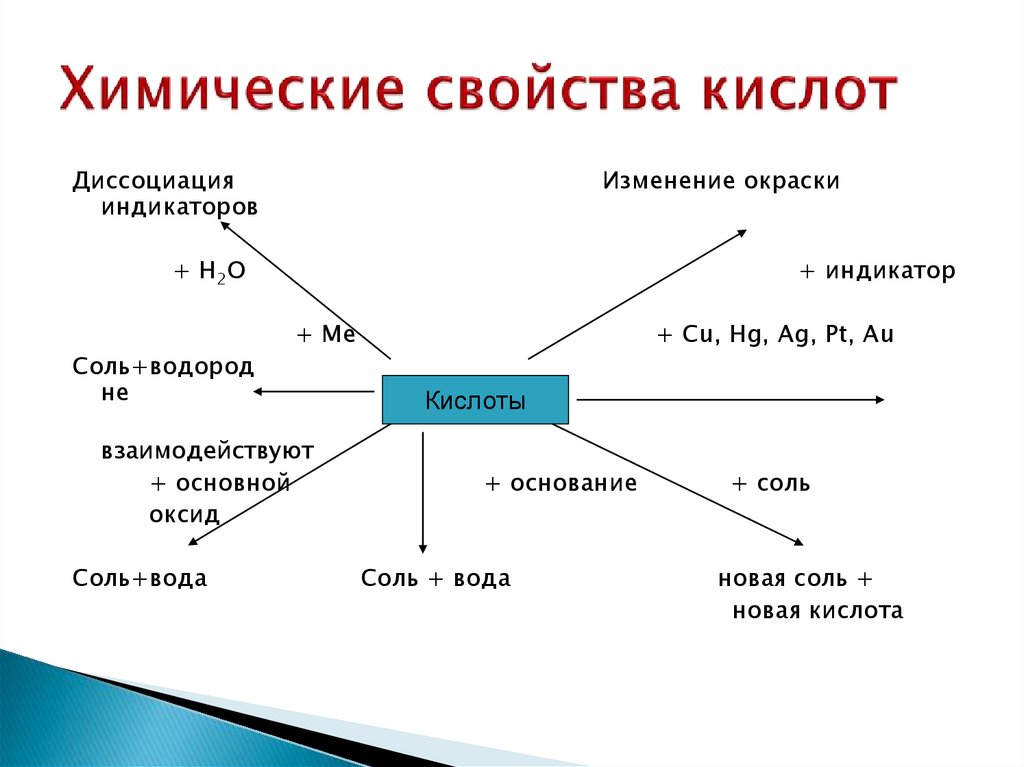
29. Химические свойства кислот
Диссоциацияиндикаторов
Изменение окраски
+ H2O
+ индикатор
+ Ме
Соль+водород
не
взаимодействуют
+ основной
оксид
Соль+вода
+ Cu, Hg, Ag, Pt, Au
Кислоты
+ основание
Соль + вода
+ соль
новая соль +
новая кислота
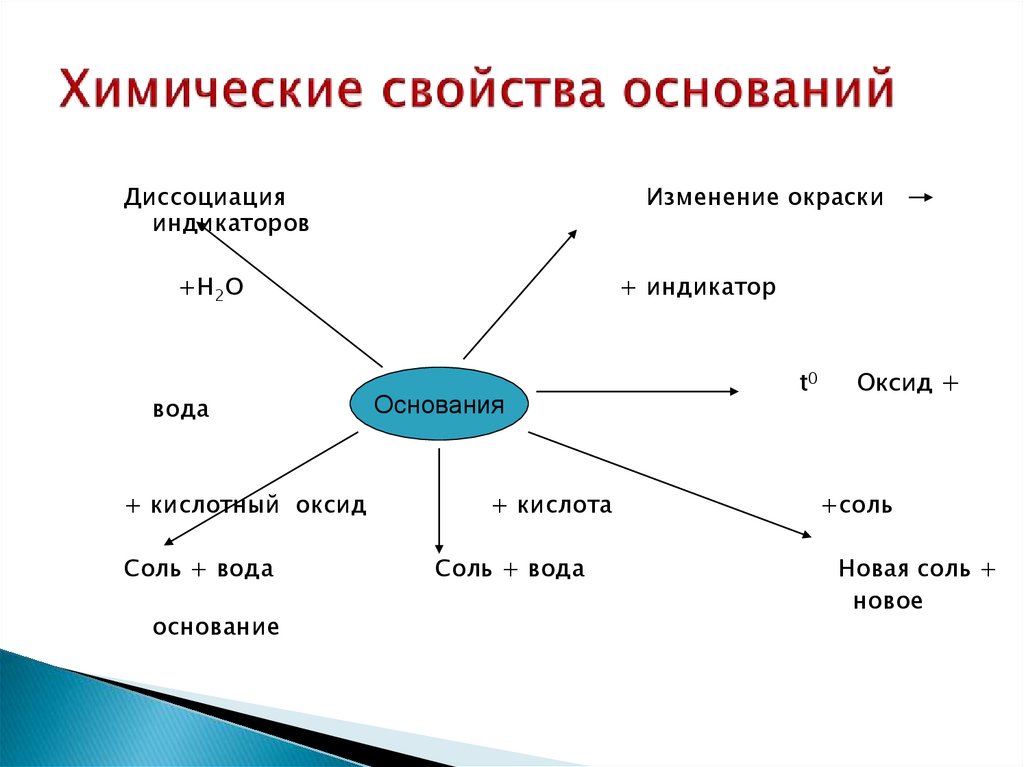
30. Химические свойства оснований
Диссоциацияиндикаторов
Изменение окраски
+H2О
вода
+ кислотный оксид
Соль + вода
основание
+ индикатор
Основания
+ кислота
Соль + вода
t0
Оксид +
+соль
Новая соль +
новое
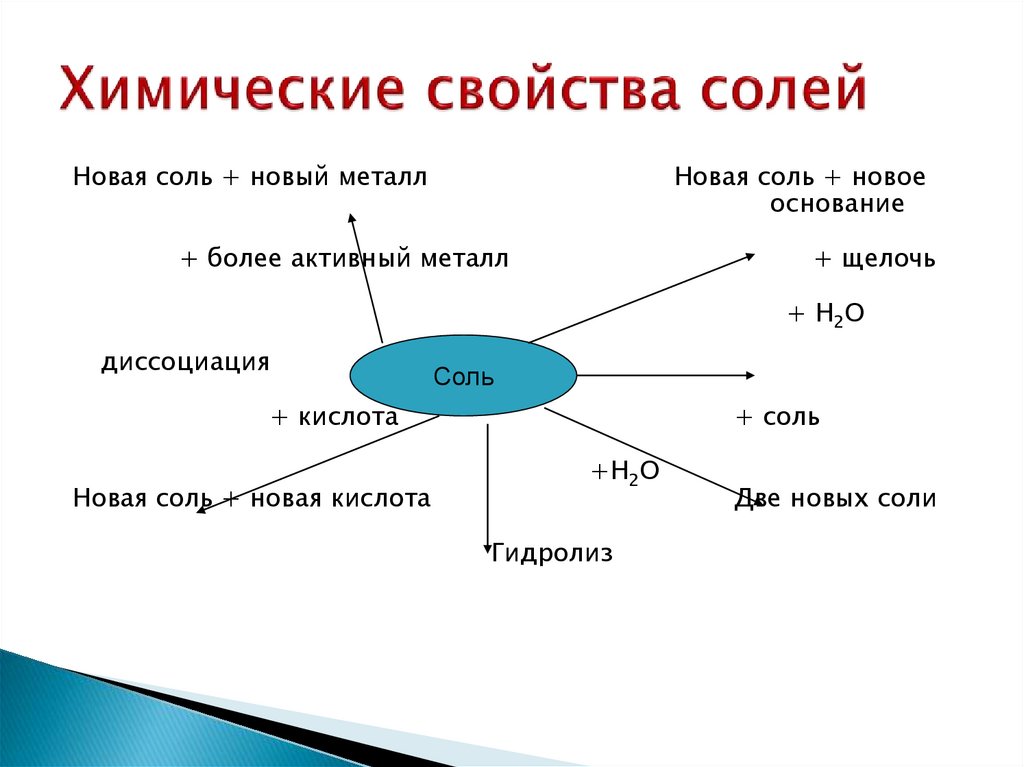
31. Химические свойства солей
Новая соль + новый металлНовая соль + новое
основание
+ более активный металл
+ щелочь
+ Н2О
диссоциация
Соль
+ кислота
Новая соль + новая кислота
+ соль
+Н2О
Гидролиз
Две новых соли
32.
Выводы:Химические свойства растворов электролитов
определяются свойствами тех ионов, которые
они образуют при диссоциации.
1) ионы металлов, гидроксильные группы и
кислотные остатки реагируют в водных
растворах как самостоятельно существующие
частицы;
2) гидроксильные группы, кислотные остатки,
атомы водорода кислот и атомы металлов солей
являются теми электрически заряженными
частицами, которые находятся в растворах
кислот, щелочей и солей.
33. Запишите уравнения ЭД веществ в растворе:
1.2.
3.
4.
5.
6.
Карбонат натрия
Сульфат алюминия
Гидроксид меди (II)
Хлорид железа (III)
Фосфорная кислота
Нитрат магния


























 Химия
Химия








