Похожие презентации:
Строение атома
1.
2.
• Атом - именно это понятие быловведено более 20 столетий назад
древнегреческим ученым Левкиппом
для обозначения мельчайших единиц
бытия.
3. Начальные представления о строении атома
Вещества состоят изатомов –
мельчайших неделимых
частиц
(атомос (греч.)- неделимый)
Демокрит
(ок.460 – 370 до н.э.)
4.
ЛомоносовМихаил Васильевич
(1711-1765)
Лавуазье
Антуан Лоран
(1743-1794)
Доказана реальность существования
атомов
5. 1833г. Исследование явления электролиза
Ток в растворе электролита этоупорядоченное движение
заряженных частиц – ионов
Фарадей
Майкл
(1791-1867)
Элементарный
электрический заряд
e = 1,6·10–19 Кл
В состав атомов входят заряженные частицы
6.
1885 г.Исследование линейчатых
спектров
Бальмер
Иоганн Якоб
(1825-1898)
Открыты дискретные
спектральные линии в
излучении атомов
водорода в видимой
части спектра
Атомы имеют сложную структуру
7.
1896 г.Соли урана являются
источником неизвестного
излучения
Открыто явление
радиоактивности
Беккерель
Антуан Анри
(1852-1908)
8.
Склодовская-КюриМария
(1867-1934)
Кюри Пьер
(1859-1906)
9.
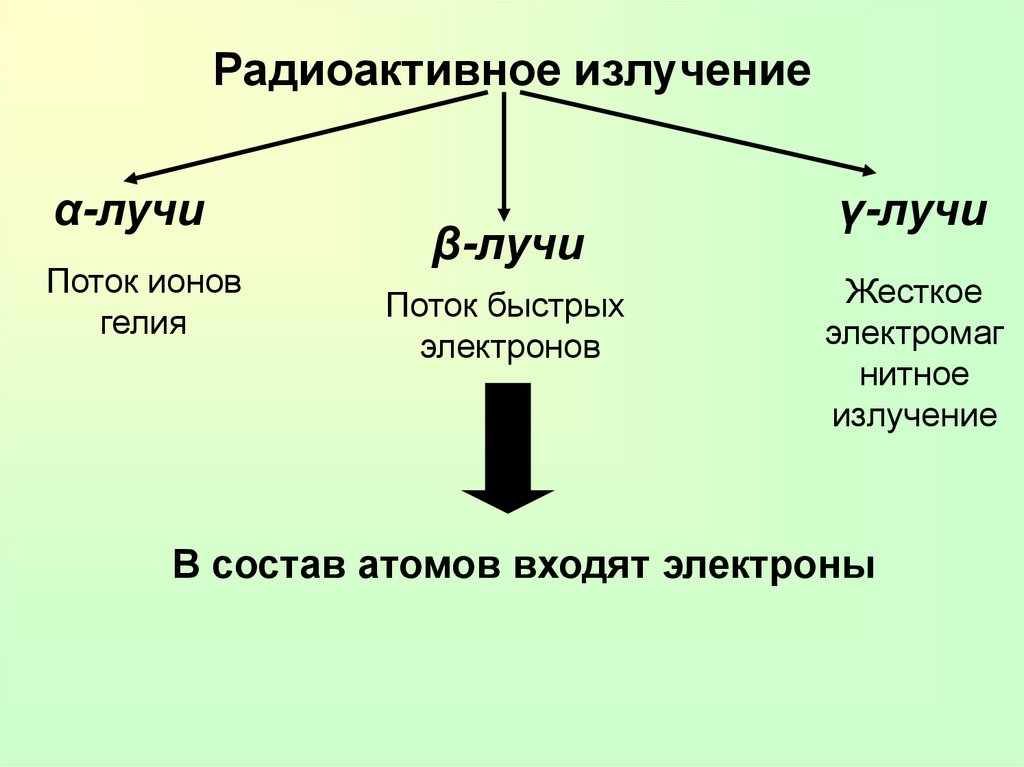
Радиоактивное излучениеα-лучи
Поток ионов
гелия
β-лучи
Поток быстрых
электронов
γ-лучи
Жесткое
электромаг
нитное
излучение
В состав атомов входят электроны
10.
1897 г.Открыл электрон
и измерил отношение e / m
заряда электрона к массе.
Томсон
Джозеф Джон
(1856-1940)
Электроны входят в состав атомов
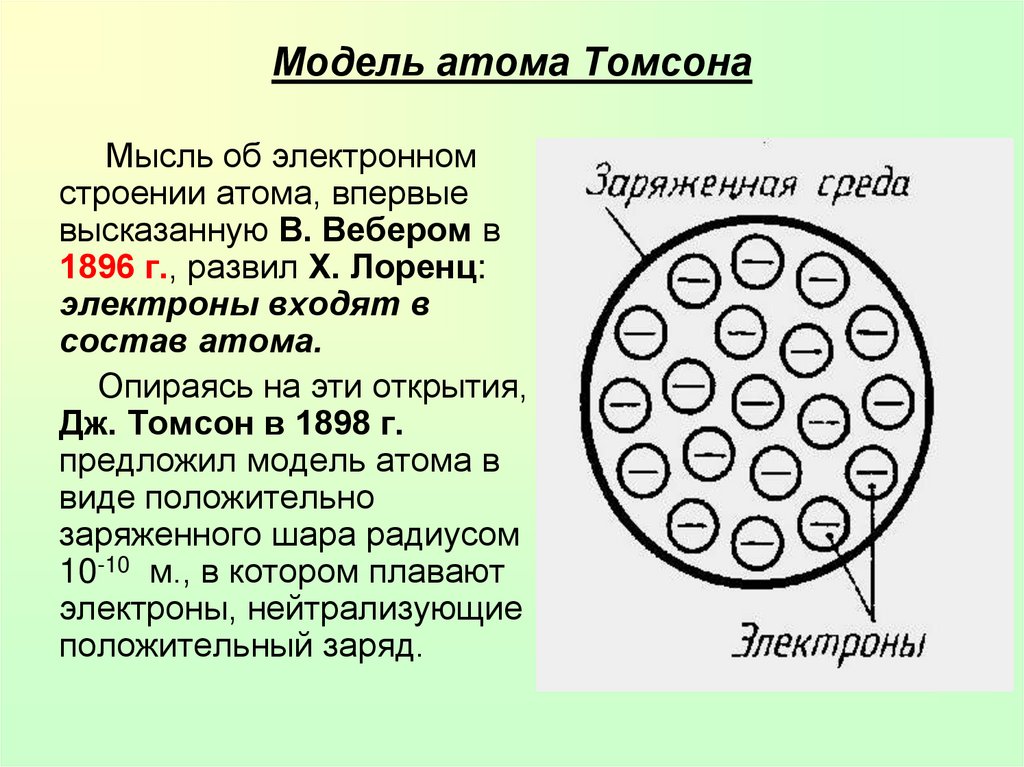
11. Модель атома Томсона
Мысль об электронномстроении атома, впервые
высказанную В. Вебером в
1896 г., развил X. Лоренц:
электроны входят в
состав атома.
Опираясь на эти открытия,
Дж. Томсон в 1898 г.
предложил модель атома в
виде положительно
заряженного шара радиусом
10-10 м., в котором плавают
электроны, нейтрализующие
положительный заряд.
12.
1911г.Проверка
состоятельности
модели атома Томсона
Резерфорд Эрнест
(1871-1937)
13. Ядерная модель атома
• Экспериментальная проверка моделиТомсона была осуществлена в 1911 г.
английским физиком Э. Резерфордом.
• Идея опыта заключалась в изучении
рассеяния -частиц (заряд +2е, масса
6,64*10-27 кг) на атомах вещества.
• -частицы были выбраны, т.к. их
кинетическая энергия много больше
кинетической энергии электронов ( -лучи) и,
в отличие от -лучей они имеют
электрический заряд.
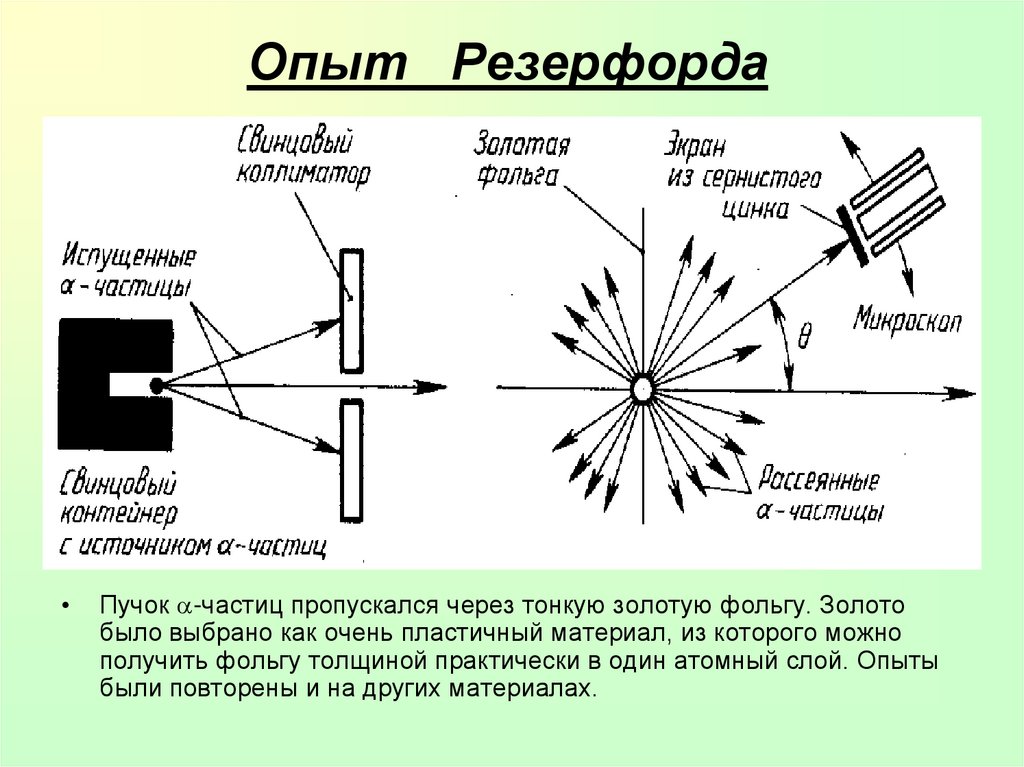
14. Опыт Резерфорда
Пучок -частиц пропускался через тонкую золотую фольгу. Золото
было выбрано как очень пластичный материал, из которого можно
получить фольгу толщиной практически в один атомный слой. Опыты
были повторены и на других материалах.
15. Выводы из опыта Резерфорда
Э. Резерфорд и его помощники обнаружили, что какая-то часть-частиц отклоняется на довольно значительный угол от
своего первоначального направления, а небольшая часть
отражается от фольги.
Резерфорд показал, что модель Томсона находится в
противоречии с его опытами. Обобщая результаты своих
опытов, Резерфорд предложил ядерную (планетарную)
модель строения атома:
1. Атом имеет ядро, размеры которого малы по сравнению с
размерами самого атома ( 10-15 м).
2. В ядре сконцентрирована почти вся масса атома.
3. Отрицательный заряд всех электронов распределен по
всему объему атома и компенсирует положительный
заряд ядра.
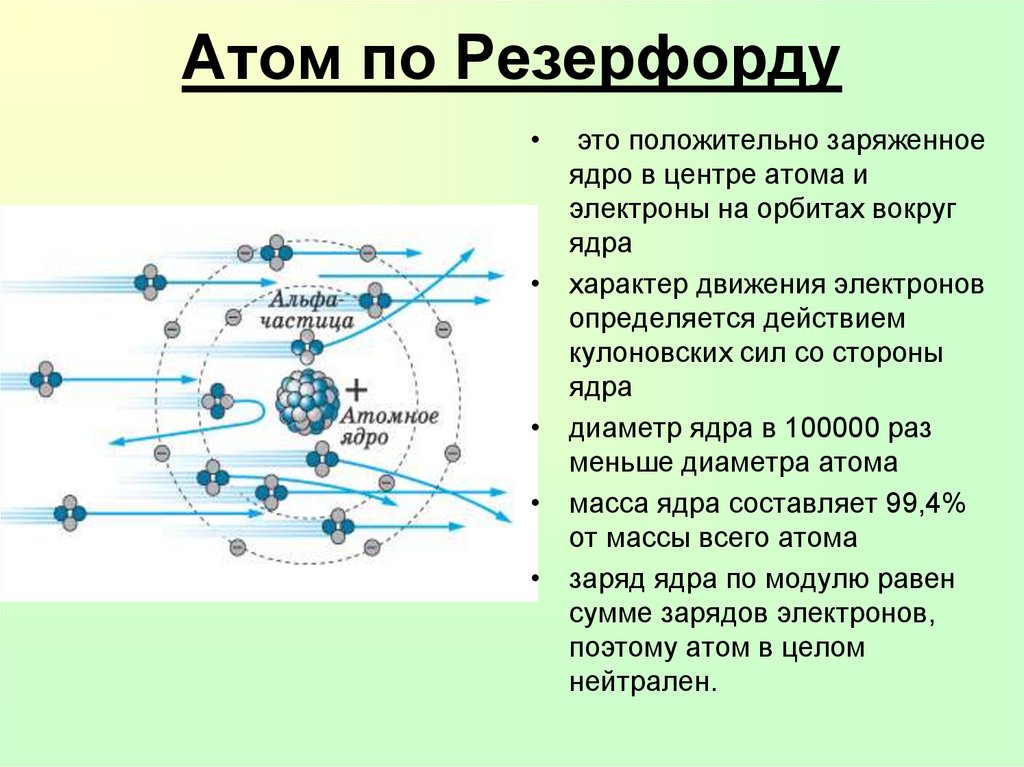
16. Атом по Резерфорду
это положительно заряженное
ядро в центре атома и
электроны на орбитах вокруг
ядра
характер движения электронов
определяется действием
кулоновских сил со стороны
ядра
диаметр ядра в 100000 раз
меньше диаметра атома
масса ядра составляет 99,4%
от массы всего атома
заряд ядра по модулю равен
сумме зарядов электронов,
поэтому атом в целом
нейтрален.
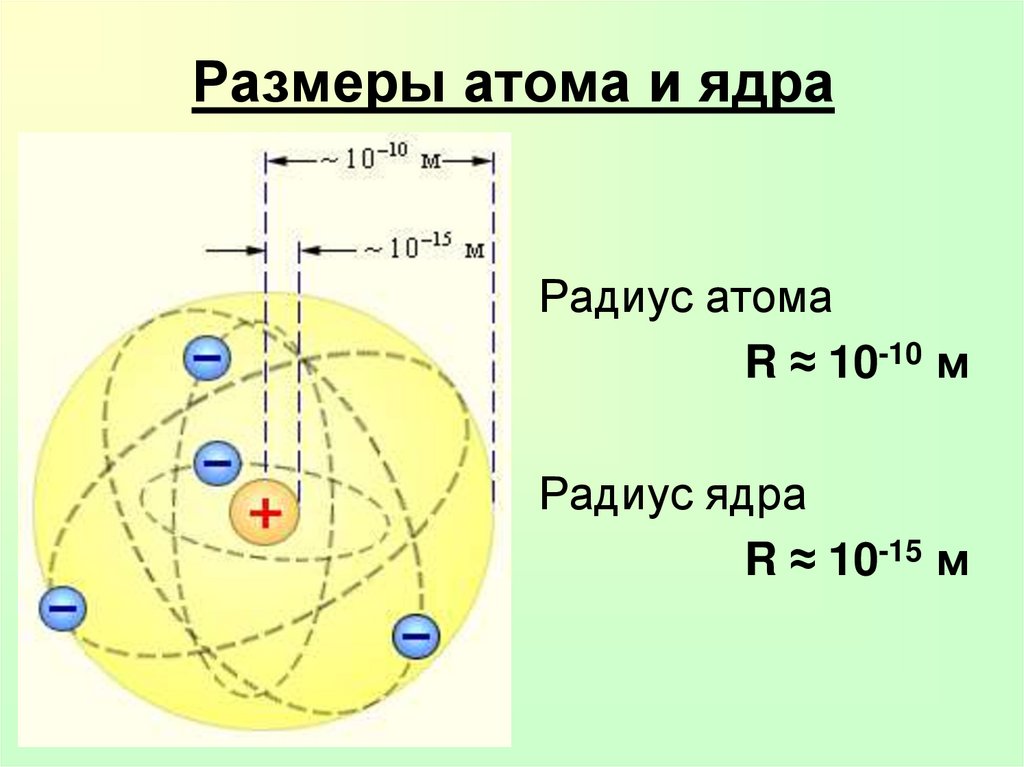
17. Размеры атома и ядра
Радиус атомаR ≈ 10-10 м
Радиус ядра
R ≈ 10-15 м
18. Недостатки планетарной модели
Предложенная модель строения атома не позволилаобъяснить устойчивость атома:
ускоренное движение электрона согласно теории Максвелла
сопровождается электромагнитным излучением, поэтому
энергия электрона уменьшается, и он движется по спирали,
приближаясь к ядру. Казалось бы, электрон должен упасть на
ядро (расчет показывает, что это должно произойти за 10-8 с),
так как при движении по спирали уменьшается энергия
электрона, в действительности атомы являются устойчивыми
системами;
спектр излучения при этом должен быть непрерывным
(должны присутствовать все длины волн). На опыте спектр
получается линейчатым;
нет ответа на вопрос о строении ядра. Если в него входят
только положительные частицы, то почему они не
отталкиваются?
19.
Модель атома Бора«Перед нами - безумная теория.
Вопрос в том, достаточно ли она безумна,
чтобы быть верной?»
Нильс Бор
20. I постулат - постулат стационарных состояний:
I постулат - постулатстационарных состояний:
• В атоме существуют стационарные квантовые
состояния. В этих состояниях атом не излучает
электромагнитных волн.
• Каждому стационарному состоянию атома
соответствует определенная энергия атома.
Стационарным состояниям соответствуют
стационарные орбиты, по которым движутся
электроны.
21. II постулат - правило частот:
II постулат - правило частот:• При переходе атома из одного стационарного
состояния в другое излучается или поглощается
квант электромагнитного излучения – фотон.
а) Атом излучает фотон, когда электрон переходит
из состояния с большей энергией (Еk) в состояние с
меньшей энергией (Еn).
Энергия излученного фотона:
22.
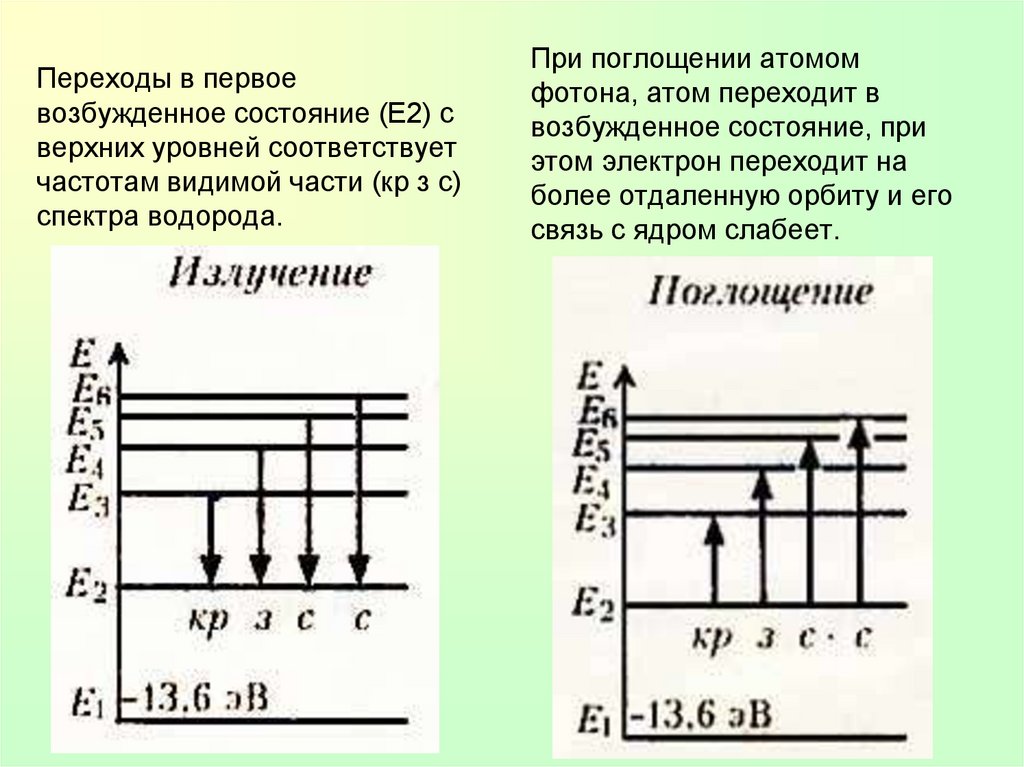
Переходы в первоевозбужденное состояние (Е2) с
верхних уровней соответствует
частотам видимой части (кр з с)
спектра водорода.
При поглощении атомом
фотона, атом переходит в
возбужденное состояние, при
этом электрон переходит на
более отдаленную орбиту и его
связь с ядром слабеет.
23. Модель атома водорода по Бору
• Свои постулаты Н. Бор применил для построениятеории строения простейшего атома (атома
водорода).
Согласно этой теории Бор смог вычислить для
атома водорода:
- возможные радиусы орбит электрона и размеры
атома
- энергии стационарных состояний атома
- частоты излучаемых и поглощаемых
электромагнитных волн.
24. Правило квантования орбит:
• Электроны могут двигаться в атоме толькопо определённым орбитам, которые
определяются условием:
mv n rn n
• где rn - радиус n-ой орбиты; vn - скорость электрона
на этой орбите; m - масса электрона, n - целое число
- номер орбиты (главное квантовое число).
25.
• Выражение для радиусовразрешённых орбит:
2
2
nh
rn
2
m e
26.
Квантованные значениярадиусов орбит:
r1 : r2 : r3 n : n : n ....
2
1
2
2
2
3
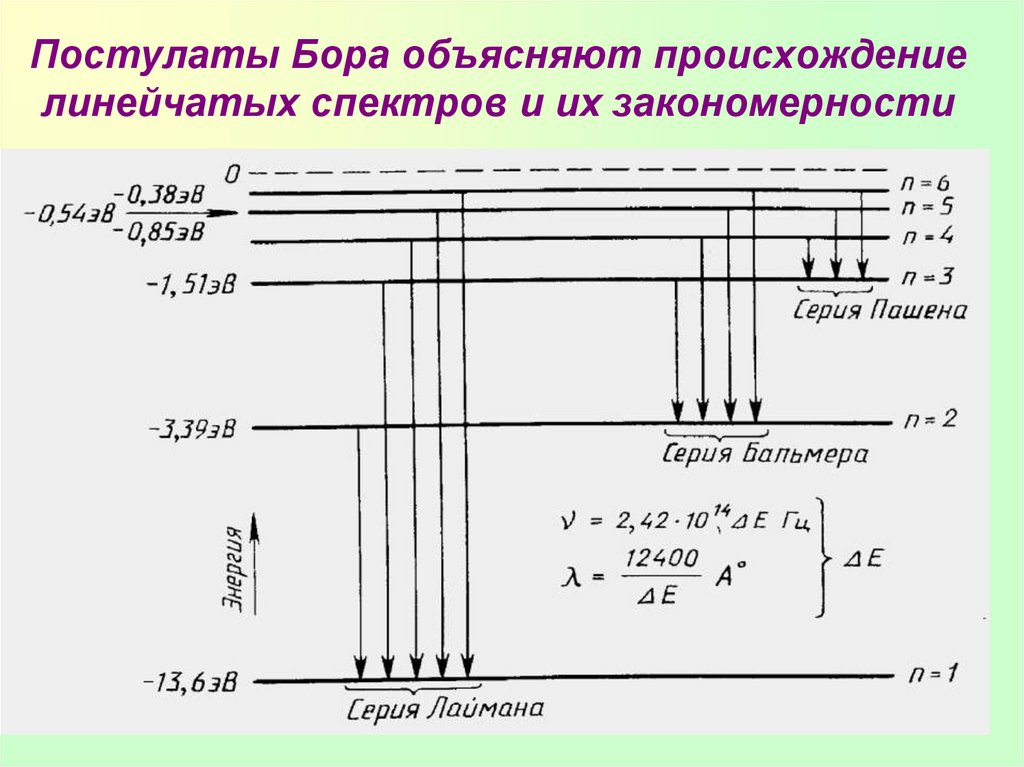
27. Постулаты Бора объясняют происхождение линейчатых спектров и их закономерности
28. По второму постулату Бора возможные частоты излучения водорода равны:
Ek Enkn
, или
h
1
1
kn R ( 2 2 )
n
k
где R – постоянная Ридберга, равна 3,2*1015 с-1;
n и k – номера орбит.
29.
• В спектре водорода обнаруженыследующие серии:
• n = 1 - серия Лаймана ультрафиолетовое излучение
• n = 2 - серия Бальмера (1885г.) видимое излучение
• n = 3 - серия Пашена - инфракрасное
излучение
• и т.д.
30. P.S. Надо помнить!
P.S. Надо помнить!• Однако, надо помнить, что для атомов с большим
числом электронов ( больше 1) расчеты по теории
Бора неприменимы (например, уже для гелия).
Движение электрона в атоме мало похоже на
движение планет по орбитам.
• Точнее, электрон на орбите можно смоделировать
электронным облаком, имеющим разную плотность.
Орбитой электрона в атоме называется
геометрическое место точек, в которых с
наибольшей вероятностью можно его обнаружить.
31. Трудности теории Бора
Правило квантования Бора применимо не всегда,
представление об определенных орбитах, по
которым движется электрон в атоме Бора, оказалось
условным. Теория Бора неприменима для
многоэлектронных атомов и не объясняет ряд
спектральных закономерностей.
В 1917 г. А. Эйнштейн предсказал возможность
перехода атома с высшего энергетического
состояния в низшее под влиянием внешнего
воздействия. Такое излучение называется
вынужденным излучением и лежит в основе работы
лазеров.
32.
• В 1908 году знаменитый физик ЭрнестРезерфорд сказал, что он имел дело со многими
превращениями в природе, но такое сиюминутное
превращение ему вряд ли удалось бы предвидеть. –
Из физиков в химики!
В 1908 году Э. Резерфорд получил Нобелевскую
премию по химии за свои работы в области
изучения атома. В те годы исследования по
строению атома и радиоактивности относили к
химии.
























 Физика
Физика








