Похожие презентации:
Бионеорганическая химия. Комплексообразование в организме. (Лекция 3)
1. Бионеорганическая химия
Лекция №3Комплексообразование в организме
2014
2.
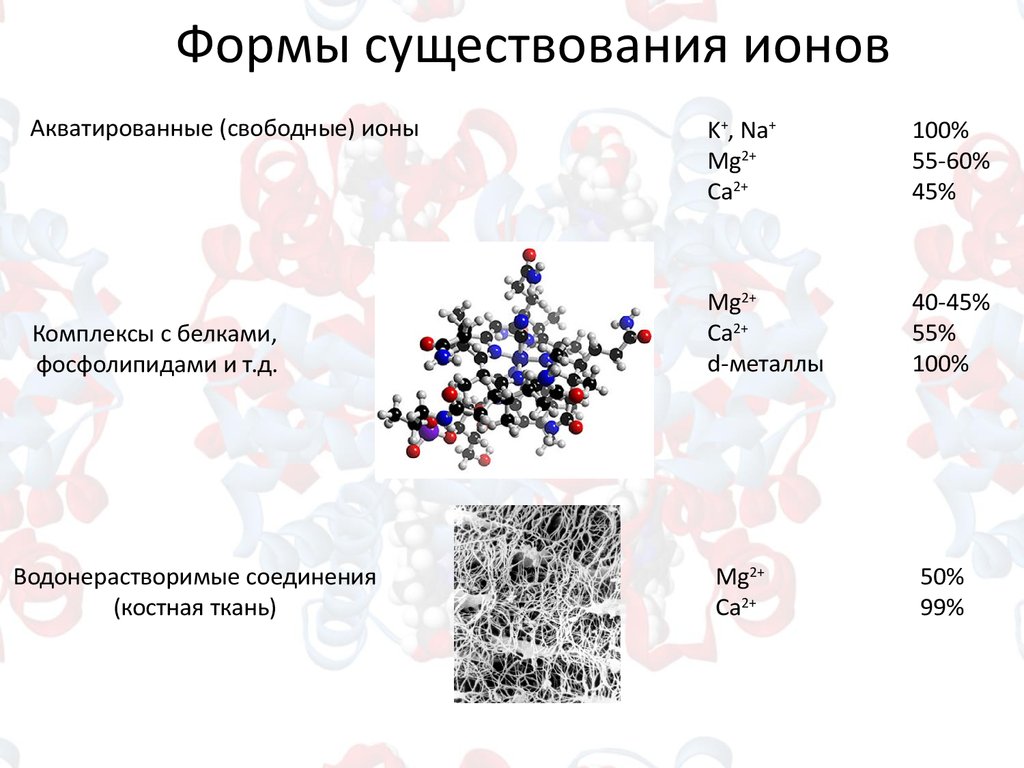
Формы существования ионовАкватированные (свободные) ионы
Комплексы с белками,
фосфолипидами и т.д.
Водонерастворимые соединения
(костная ткань)
K+, Na+
Mg2+
Сa2+
100%
55-60%
45%
Mg2+
Сa2+
d-металлы
40-45%
55%
100%
Mg2+
Сa2+
50%
99%
3.
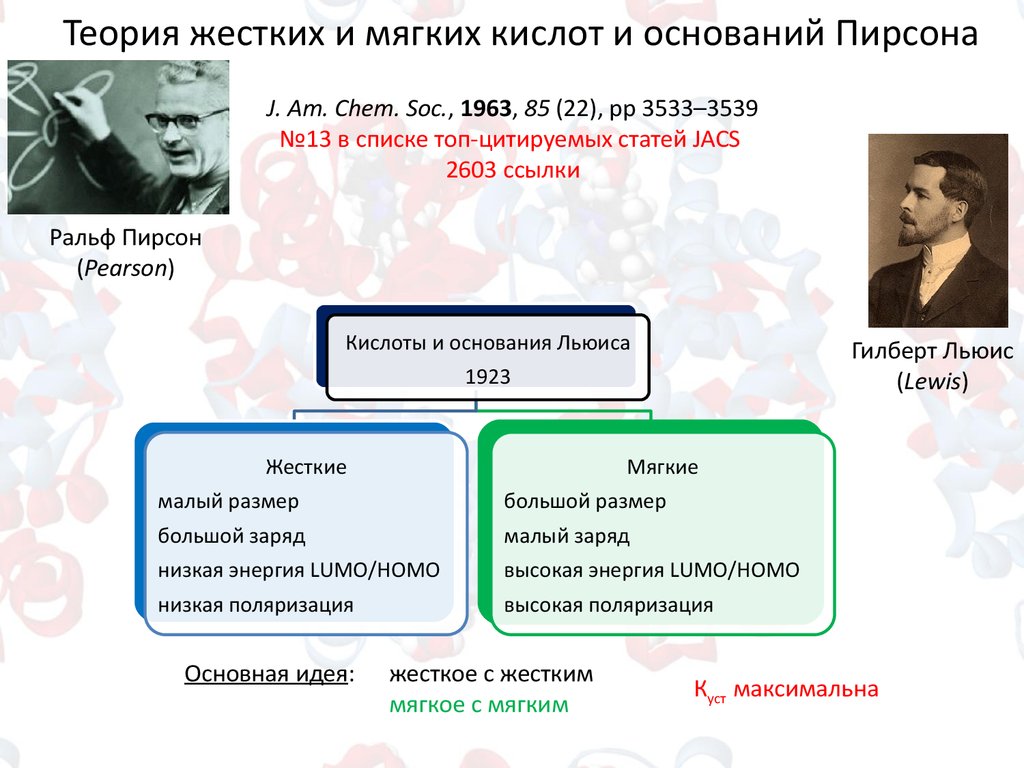
Теория жестких и мягких кислот и оснований ПирсонаJ. Am. Chem. Soc., 1963, 85 (22), pp 3533–3539
№13 в списке топ-цитируемых статей JACS
2603 ссылки
Ральф Пирсон
(Pearson)
Кислоты и основания Льюиса
Гилберт Льюис
(Lewis)
1923
Жесткие
Мягкие
малый размер
большой размер
большой заряд
малый заряд
низкая энергия LUMO/HOMO
высокая энергия LUMO/HOMO
низкая поляризация
высокая поляризация
Основная идея:
жесткое с жестким
мягкое с мягким
Куст максимальна
4.
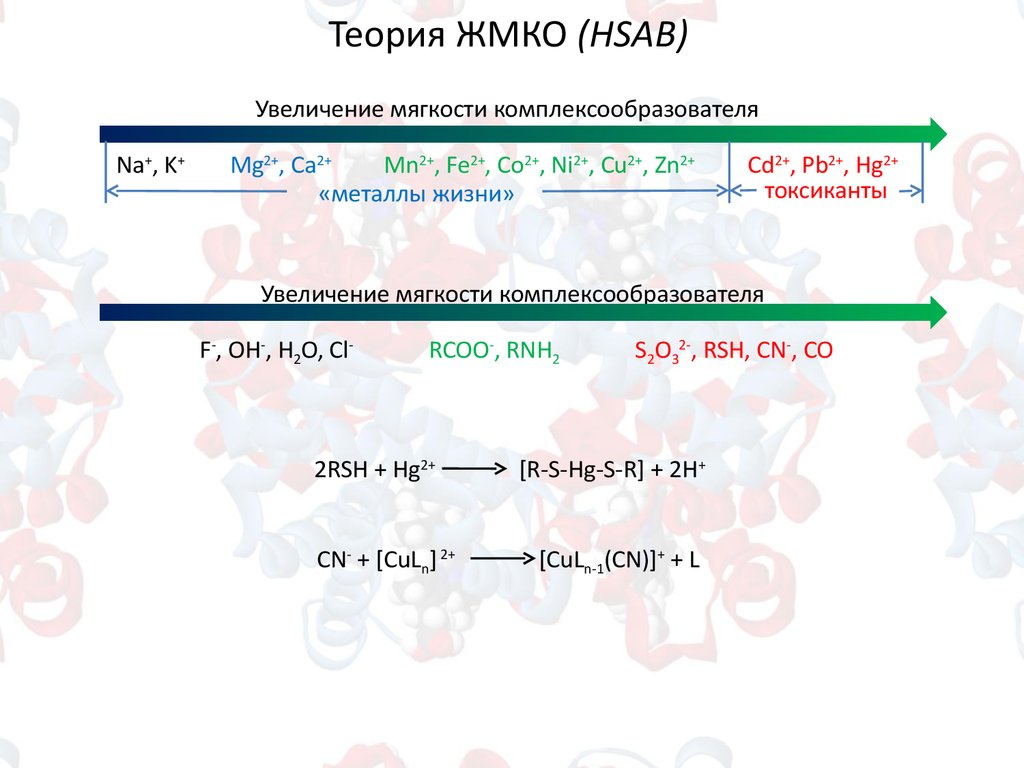
Теория ЖМКО (HSAB)Увеличение мягкости комплексообразователя
Na+, K+
Mg2+, Ca2+
Mn2+, Fe2+, Co2+, Ni2+, Cu2+, Zn2+
«металлы жизни»
Cd2+, Pb2+, Hg2+
токсиканты
Увеличение мягкости комплексообразователя
F-, OH-, H2O, Cl-
RCOO-, RNH2
2RSH + Hg2+
CN- + [CuLn] 2+
S2O32-, RSH, CN-, CO
[R-S-Hg-S-R] + 2H+
[CuLn-1(CN)]+ + L
5.
Металлолигандный гомеостазбиометалл
MB + L B
MBLB
биолиганд
Гомеостаз – постоянство неравновесных концентраций
Причины нарушения металлолигандного гомеостаза
1. Нехватка или избыток биометалла MB
2. Появление в организме металла-токсиканта МТ (поступает извне)
MТLB
МТ
LB
MB
MBLB
Куст (MТLB ) > Куст (MBLB)
Хелатотерапия – введение хелатного препарата LП,
эффективно связывающегося с MТ и не затрагивающего MB
LB
LB
LП
LП
MBLП
MB
MBLB
MТ LП
MТ
MТ LB
Куст (MBLП) < Куст (MBLB)
Куст (MТ LП) > Куст (MТ LB)
6.
Металлолигандный гомеостазХелатирующие препараты
EDTA в виде тетацин-кальция
Унитиол
Тиосульфат натрия Na2S2O3
3. Появление в организме лигандов-токсикантов LT
поступают извне
образуются в результате лигандной патологии
MBLT
LT
MB
LB
MBLB
Куст (MBLT) > Куст (MBLB)
Сукцимер
7.
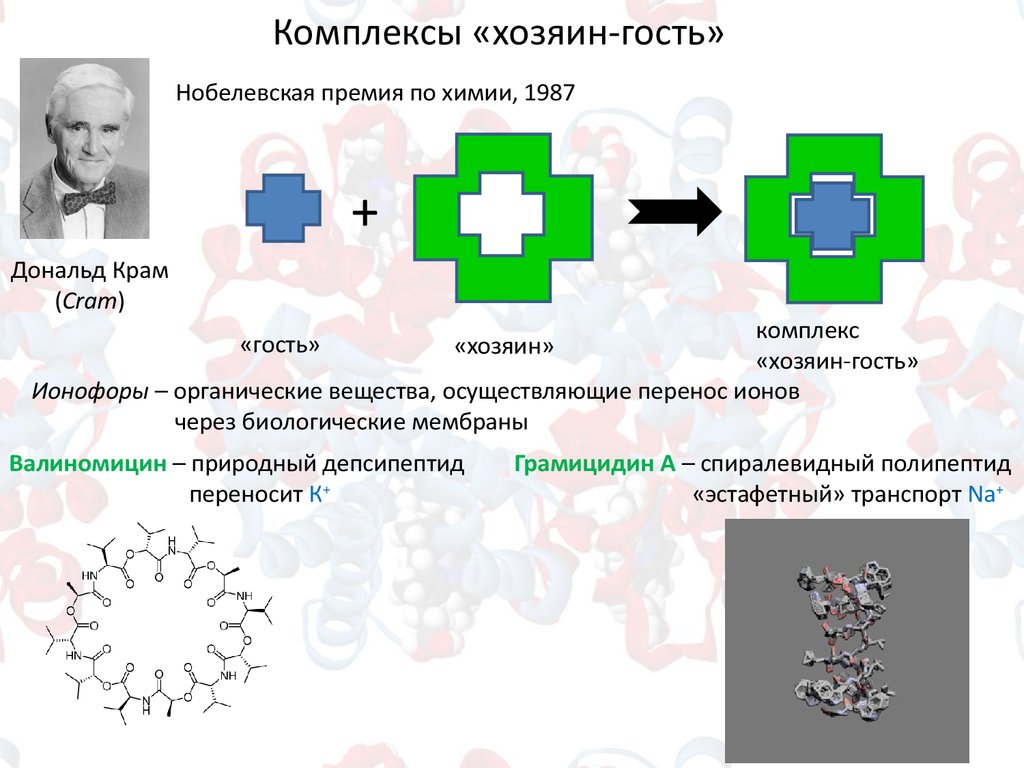
Комплексы «хозяин-гость»Нобелевская премия по химии, 1987
+
Дональд Крам
(Cram)
комплекс
«хозяин-гость»
Ионофоры – органические вещества, осуществляющие перенос ионов
через биологические мембраны
«гость»
«хозяин»
Валиномицин – природный депсипептид
переносит К+
Грамицидин А – спиралевидный полипептид
«эстафетный» транспорт Na+
8.
ГемоглобинПорфин
Гем B
Миоглобин: гем В + глобин
Хлорофилл
Гемоглобин: 4 гема В + 4 глобина
9.
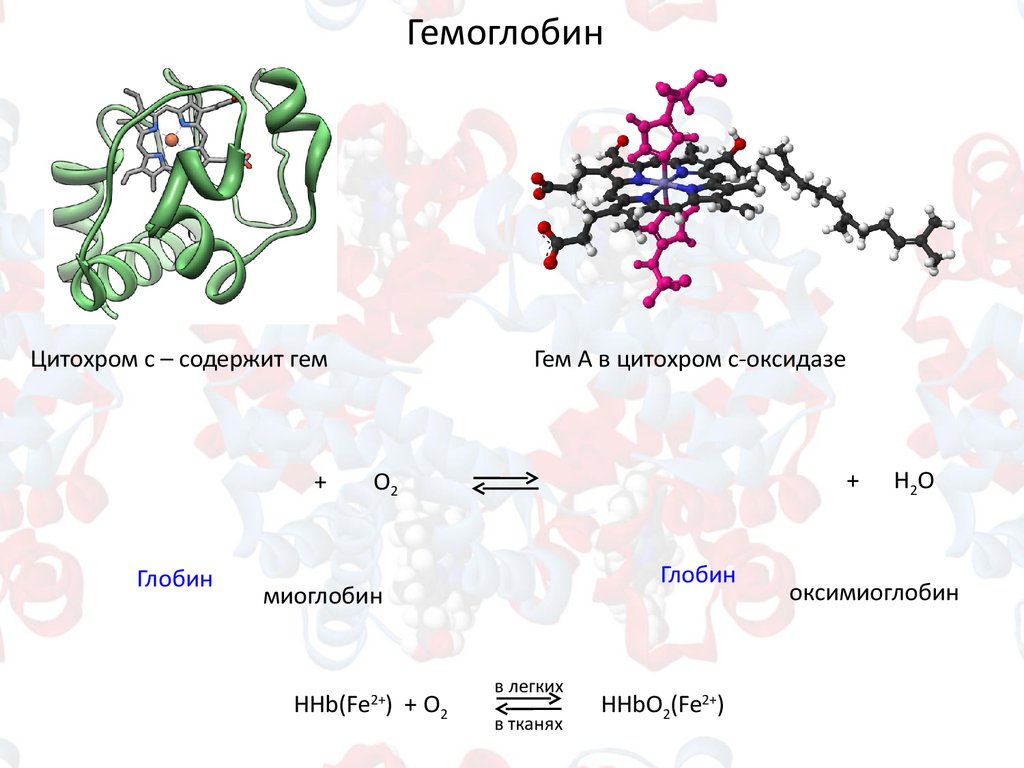
ГемоглобинЦитохром с – содержит гем
+
Глобин
Гем А в цитохром с-оксидазе
+
О2
Глобин
миоглобин
HHb(Fe ) + O2
2+
в легких
в тканях
HHbO2(Fe2+)
Н2О
оксимиоглобин
10.
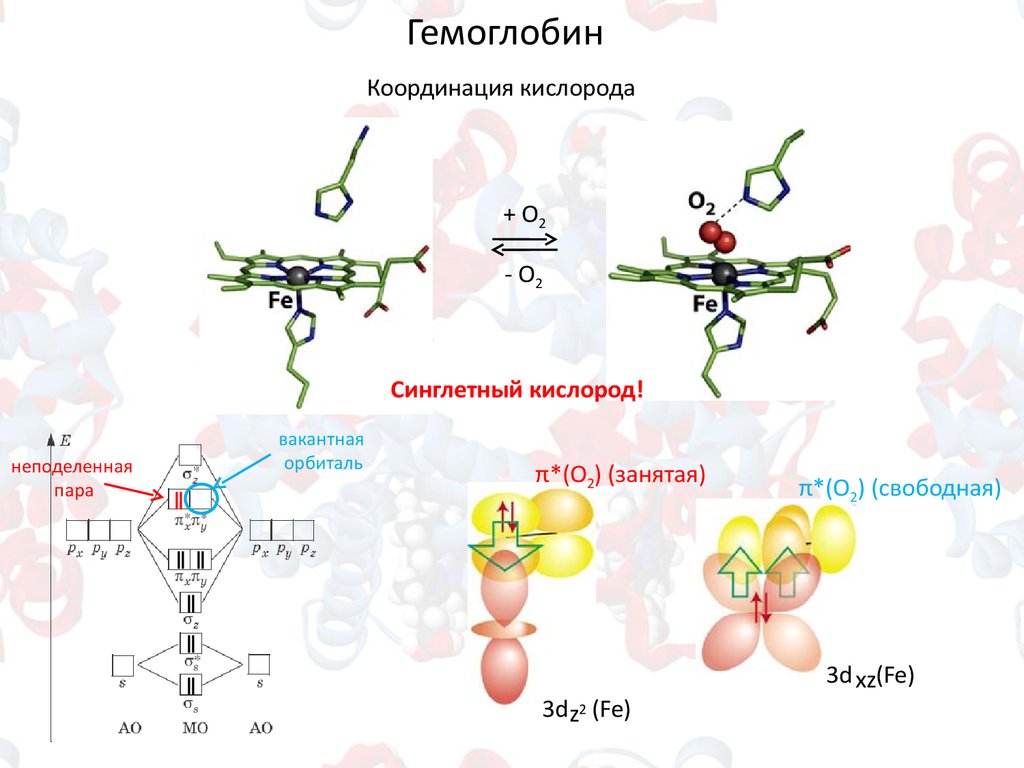
ГемоглобинКоординация кислорода
+ О2
- О2
Синглетный кислород!
неподеленная
пара
вакантная
орбиталь
ǁ
π*(O2) (занятая)
π*(O2) (свободная)
ǁ ǁ
ǁ
ǁ
ǁ
3dz2 (Fe)
3d xz(Fe)
11.
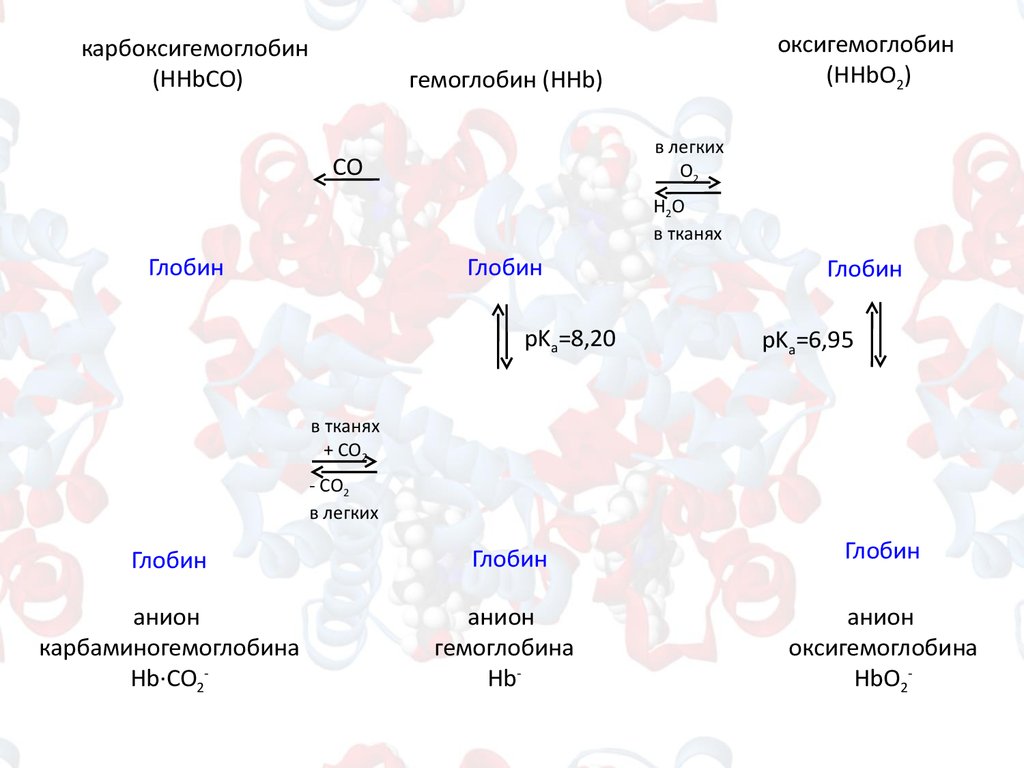
карбоксигемоглобин(HHbСО)
оксигемоглобин
(HHbО2)
гемоглобин (HHb)
в легких
O2
СО
H2O
в тканях
Глобин
Глобин
pKa=8,20
Глобин
pKa=6,95
в тканях
+ СO2
- СO2
в легких
Глобин
Глобин
Глобин
анион
карбаминогемоглобина
Hb∙СО2-
анион
гемоглобина
Hb-
анион
оксигемоглобина
HbО2-
12.
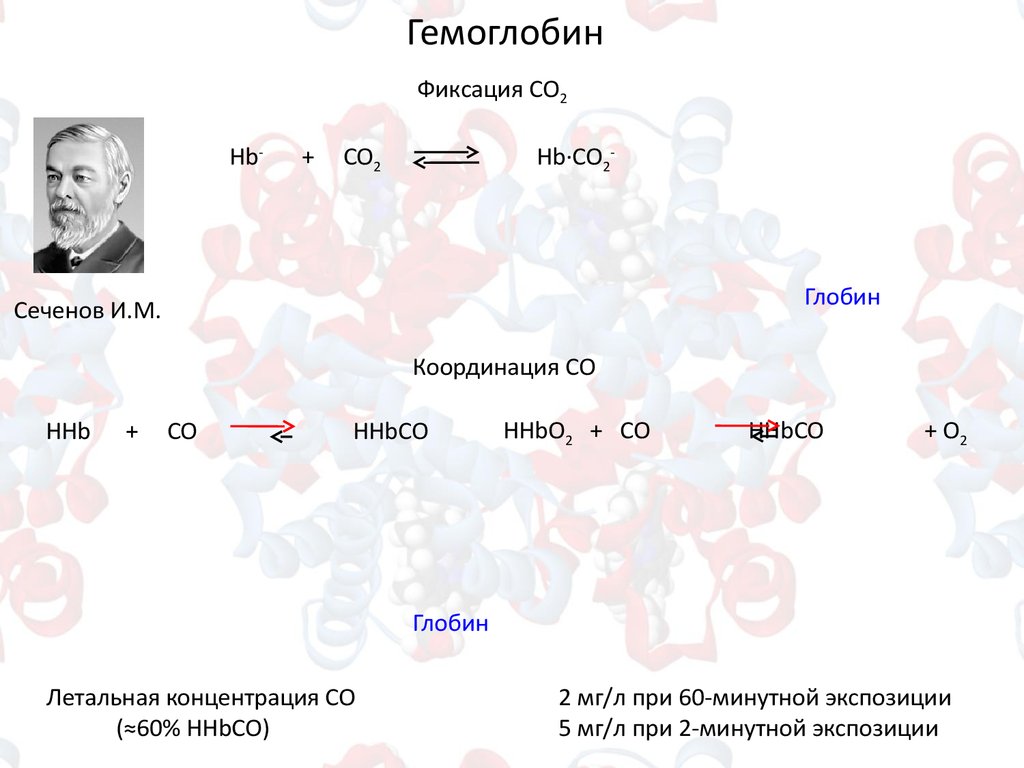
ГемоглобинФиксация СО2
Hb-
+
CO2
Hb∙СО2-
Глобин
Сеченов И.М.
Координация СО
HHb
+
CO
HHbСО
HHbO2 + CO
HHbСО
+ O2
Глобин
Летальная концентрация СО
(≈60% HHbСО)
2 мг/л при 60-минутной экспозиции
5 мг/л при 2-минутной экспозиции
13.
ГемоглобинВлияние окислителей
NO3-, NO2- …
окислитель
+ Н+ + ē
восстановитель
Глобин
Глобин
метгемоглобин
метНHb(Fe3+)
метНHb(Fe3+) + O2
HHb(Fe2+) + NO2- + 2H+
HHb
+
метНHb(Fe3+) + NO + H2O
NO
нитрозогемоглобин
Глобин
14.
Цитохромоксидаза+ CN-
Белок
Белок
М = Fe3+/2+, Cu2+/1+
М = Fe3+, Cu2+
+ CN-
Na2S2O3 + KCN = Na2SO3 + KSCN
роданид
- OH
Глобин
метгемоглобин
Глобин
цианметгемоглобин
15.
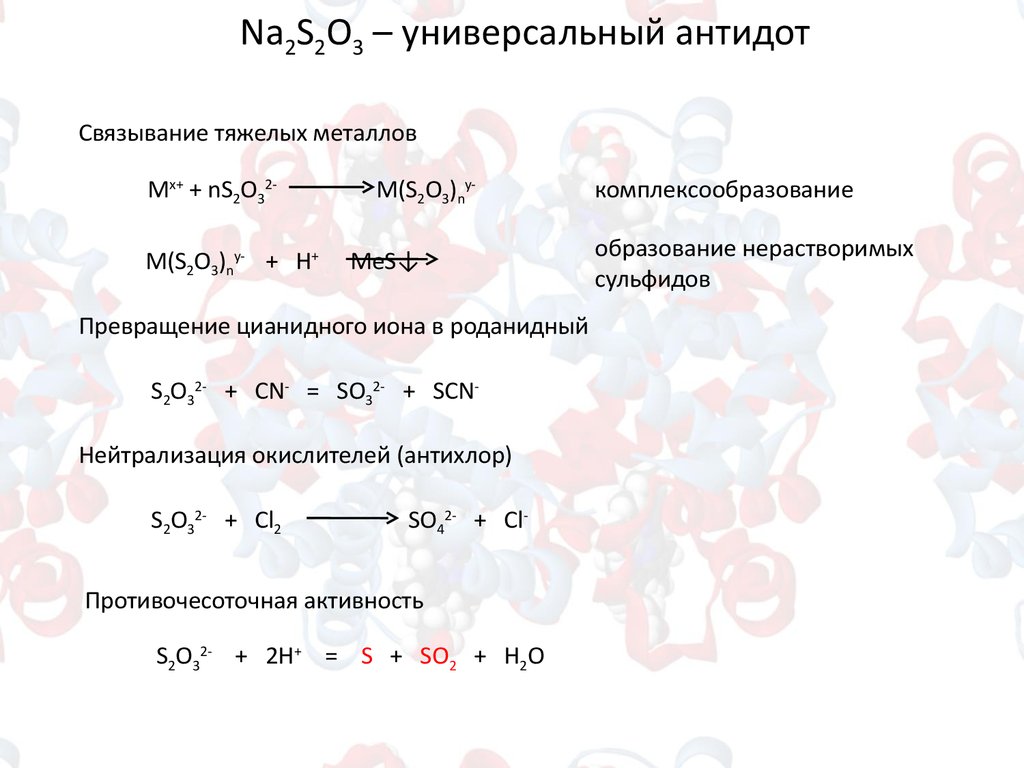
Na2S2O3 – универсальный антидотСвязывание тяжелых металлов
Mx+ + nS2O32M(S2O3)ny- + H+
M(S2O3)nyMeS↓
Превращение цианидного иона в роданидный
S2O32- + CN- = SO32- + SCNНейтрализация окислителей (антихлор)
S2O32- + Сl2
SO42- + Cl-
Противочесоточная активность
S2O32- + 2H+ = S + SO2 + H2O
комплексообразование
образование нерастворимых
сульфидов






 Биология
Биология Химия
Химия








