Похожие презентации:
Протолитическая теория кислот и оснований. Протолитическое равновесие. Буферные растворы. Лекция 01
1.
Кто спал, когдаБог раздавал
encephalon?!
2. Протолитическая теория кислот и оснований. Протолитическое равновесие. Буферные растворы
Лекция №1Лектор:
кандидат химических наук, доцент
Иванова Надежда Семёновна
3. Синквейн
1я строка – существительное (дисциплина)2я строка – 2 прилагательных (признаки и
свойства существительного)
3я строка – 3 глагола, характеризующих
существительное
4я строка – фраза из 4х слов (отношение к
существительному)
5я строка – 1 слово (резюме).
4. Основная литература
Ершов Ю.А.,Попков В.А.
Общая химия.
Биофизическая химия.
Химия биогенных
элементов
Издательство: Высшая
школа, 2005. - 560 с.
5. Основная литература
Попков В.А.,Пузаков С.А.
Общая химия
Издательство: ГЭОТАР-
Медиа, 2007.- 976 с.
6. Основная литература
Ленский А.С.Биофизическая и
бионеограническая
химия
Издательство: МИА,
2008. – 416 с.
Издательство: ВШ, 1989.
– 245 с.
7. Основная литература
Пузаков С.А.Химия
Издательство: ГЭОТАР-
Медиа, 2006.- 640 с.
8. Основная литература
Слесарев В.И.Химия. Основы химии
живого
Издательство: Химиздат,
2009. – 784 с.
9. Дополнительная литература
Глинка Н.Л.Общая химия
Издательство: любое
10. Дополнительная литература
Тюрина Е.Ф.,Иванова Н.С.
Общая химия. Вопросы и
ответы
Издательство: Медицина
ДВ, 2008. - 172с.
11. Дополнительная литература
Иванова Н.С.,Мусина С.А.
Введение в химию
биогенных элементов
Издательство: Полисфера,
2005. – 89 с.
12. Дополнительная литература
Тюрина Е.Ф.Химия. Теоретические
основы. Вопросы. Тесты.
Задачи с решениями
Издательство: Медицина
ДВ, 2008. – 248 с.
13. Дополнительная литература
Харвуд Л.,Мак-Кендрик Дж.,
Уайтхед Р.
Наглядная органическая
химия
Издательство: «ГОЭТАР-
Медиа», 2010г. – с.120.
14. Дополнительная литература
Сонина Г.П.Практические умения по
биоорганической химии
Издательство: Медицина
ДВ, 2005г.
15. Введение
Врезультате
метаболизма
в
организме
образуется большое количество кислот, а больше
всего Н2СО3 (до 13 моль ежедневно). Выводится
она, в основном, при дыхании в виде СО2 и Н2О,
но задержка её до 0,15 моль в организме ведёт к
нарушению кислотно – основного состояния
(КОС).
16.
Теория Бренстеда Лаури (Б-Л),предложенная
в
определяет
основания
по
1923
г.,
кислоты
и
отношению
к
+
одному партнёру Н . Поэтому
кислоты
Йоханнес-Николаус Брёнстед
(1879-1947)
и
основания
называются протолитами;
обратимые реакции, в которых осуществляется
перенос
протонов,
протолитическими
равновесиями, а теория Б-Л протолитической
теорией.
17. Кислоты и основания Б-Л
Кислота протон-донорное вещество.Основание протон-акцепторное вещество.
Из этого можно записать соотношение:
Кислота
Основание
Кислоту и основание, связанные приведённым
соотношением, называют сопряжённой
кислотно-основной парой:
Кислота
Основание
Сопр.
основание
Сопр.
кислота
18.
Тогда протолитическое равновесие можетбыть выражено схемой:
Кислота 1
Основание 2
Сопр.
основание 1
Сопр.
кислота 2
Направление протолитического равновесия
устанавливается в результате конкуренции за
Н+ между основаниями сопряжённых
кислотно-основных пар и всегда смещается в
сторону более слабой кислоты.
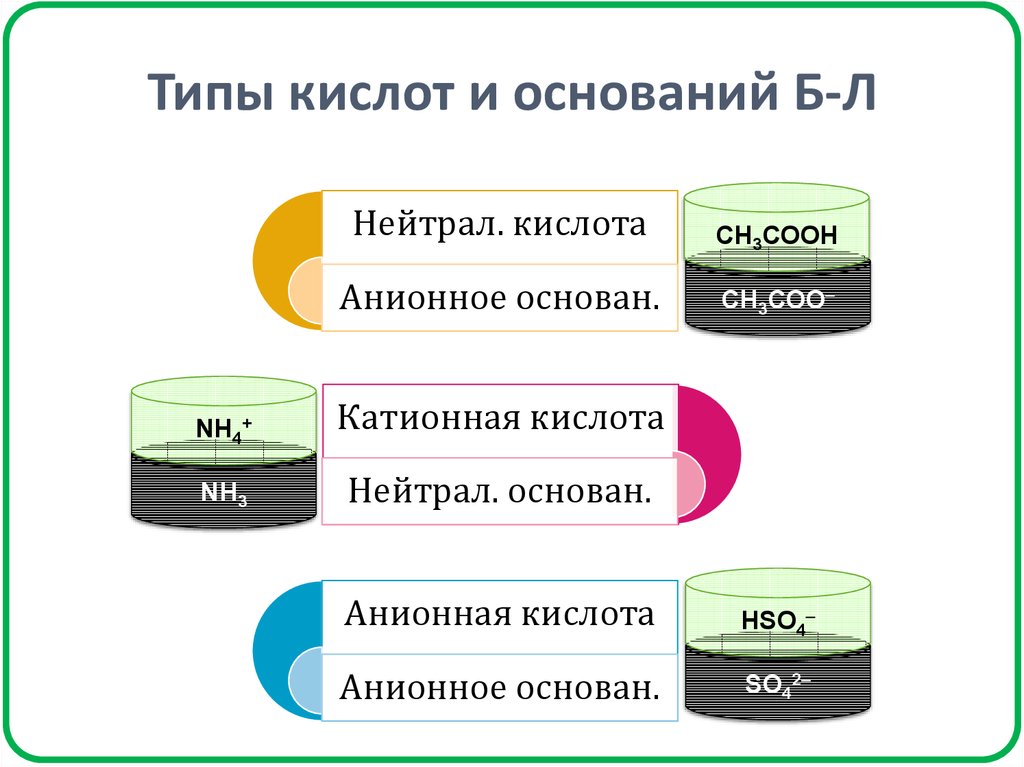
19. Типы кислот и оснований Б-Л
Нейтрал. кислотаСН3СООН
Анионное основан.
СН3СОО
NH4+
Катионная кислота
NH3
Нейтрал. основан.
Анионная кислота
HSO4
Анионное основан.
SO42
20. Типы протолитических реакций
Типпротолитичес
кого
равновесия
Ионизация слабой
кислоты
СН3СООН + Н2О
СН3СОО + Н3О+
Кравн.
Const.
кислот
ности
Ка
Ионизация слабого Const.
Основн
основания
ости
NH3 + H2O
NH4+ + OH
Kb
Выражение
Кравновесия
рН
CH COO H 1 pK
3
CH3COOH
2
1
lg
c
CH
COOH
a
3
1
NH OH 14 12 pK lg c 11 NH
4
NH3
b
3
Для сопряжённой кисл. осн. пары Ka Kb =10 14 чем сильнее
кислота в паре, тем слабее основание и наоборот.
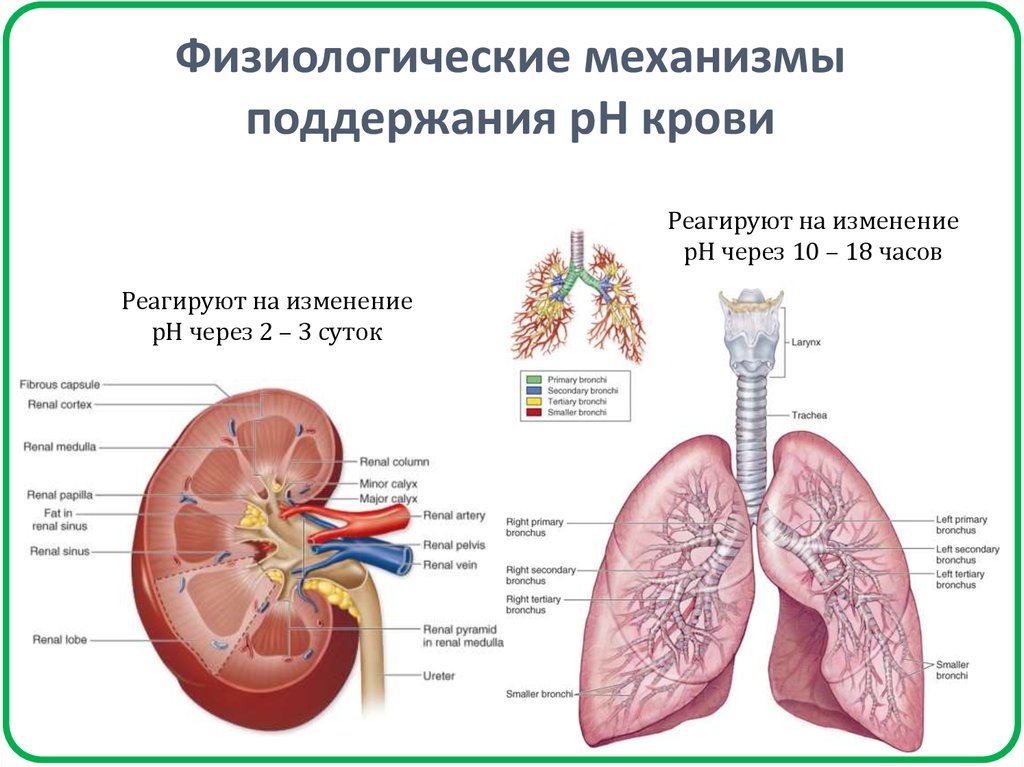
21. Физиологические механизмы поддержания рН крови
Реагируют на изменениерН через 10 – 18 часов
Реагируют на изменение
рН через 2 – 3 суток
22. Физико-химические механизмы поддержания рН крови
Буферное действие проявляетсяпрактически мгновенно (10 – 15 мин).
Ионный обмен.
Диффузия.
эозинофил
нейтрофил
базофил
гранулоциты
агранулоциты
лимфоцит
моноцит
23. Буферные системы – …
… раствор, содержащий протолитическуюравновесную систему, способную поддерживать
практически постоянный рН при разбавлении
или добавлении небольших количеств кислоты
и щёлочи.
… система, состоящая из слабого протолита и
избытка сопряжённого с ним основания или
кислоты. рН буферных систем незначительно
изменяется при добавлении сильного
протолита и разбавления.
24. Состав буферных систем
Из определения в состав буферной системывходит слабый протолит:
НА + Н2О ↔ Н3О+ + А–
кисл
с. осн
Избыток сопряжённого основания (А–)
образуется за счёт соли этой кислоты с сильным
основанием.
МеА Ме+ + А–
с. осн
25. Типы буферных систем
1. кислая буферная система: слабая кислота иеё соль с сильным основанием
СН3СООН + СН3СООNa;
2. основная буферная система: слабое
основание и его соль с сильной кислотой
NH4OH + NH4Cl.
26. Расчёт рН буферных систем. Уравнение Гендерсона – Гассельбаха
кислая буферная система1
1
n con.bas
c sal Vsal
z
z
pH pKa lg
pKa lg
1
1
n acid
c acid Vacid
z
z
основная буферная система
pH 14 pKb lg
1
n con.acid
z
14 pKb lg
1
n bas
z
1
c sal Vsal
z
1
c bas Vbas
z
27.
ВыводыИз уравнения очевидно:
1.
рН буферной системы определяется Ка или Кb
слабого протолита:
рКа = –lgKa
pKb = –lgKb
2.
рН зависит от соотношения количеств
компонентов буферной системы.
3.
рН зависит от температуры, т.к. величины рКа
и рКb зависят от температуры.
28.
Механизм действия буфернойсистемы …
… и основные свойства буфера (противостоять
изменению рН при добавлении сильных протолитов и
разбавлению) заключаются в совмещении нескольких
протолитических равновесий:
HB + H2O ↔ B‒ + H3O+
кисл.
с.осн
B‒ + H2O ↔ HB + OH‒
с.осн
кисл.
Вывод: в протолитической буферной системе
имеет место совмещённое равновесие процессов
ионизации и гидролиза.
29.
Механизм действия буфернойсистемы
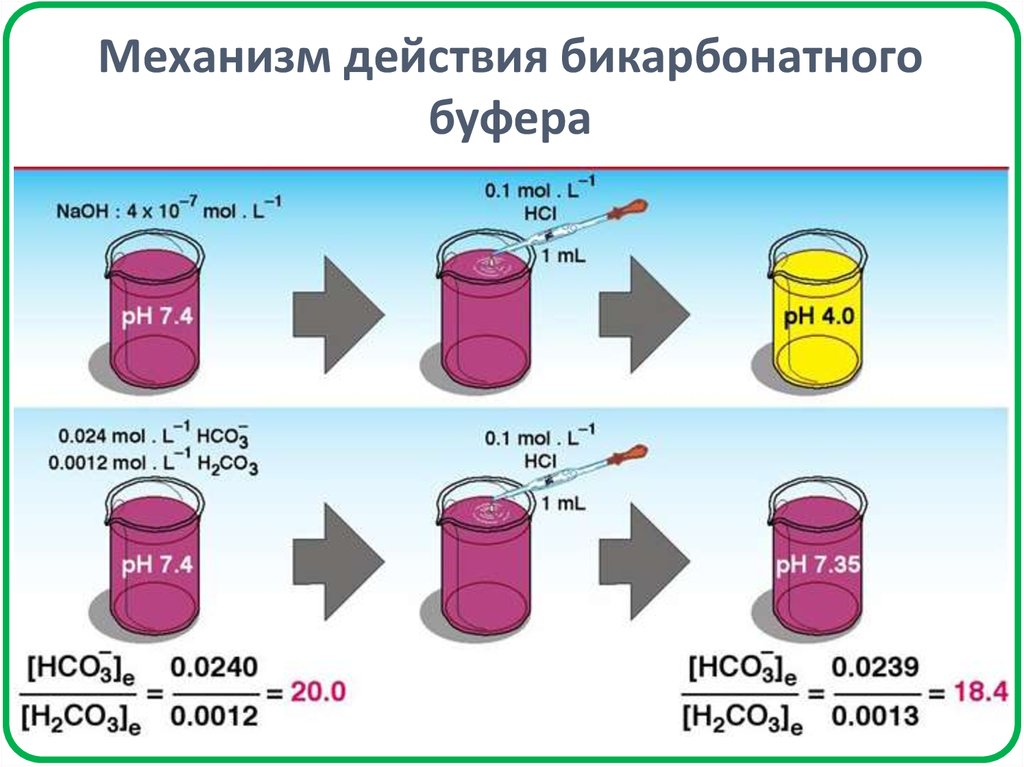
При добавлении HCl
При добавлении NaOH
СН3СООН
СН3СОО–
СН3СОО– + Н+ ↔ СН3СООН
СН3СООН + OН- ↔ СН3СОО– + H2O
HCl заменяется
эквивалентным
количеством СН3СООН,
что приводит к
незначительному
уменьшению рН буфера.
NaOH заменяется
эквивалентным количеством
СН3СООNa, что приводит к
незначительному увеличению
рН буфера.
Разбавление буферной системы до концентрации компонентов
буфера ≈ 0,01 моль/дм3 практически не влияет на рН буфера.
30. Механизм действия бикарбонатного буфера
31. Основные характеристики буферной системы
Буферная ёмкость (В, β) ‒ количествовещества эквивалента сильного протолита Х,
которое нужно добавить к 1 дм3 буферной
системы, чтобы изменить её рН на единицу.
1 1
n x c x Vx
z z
pH
pH VБ .С .
моль дм
3
32. Факторы, влияющие на β
Концентрации компонентов буферной системы:чем выше концентрации, тем выше β.
Соотношение концентраций компонентов
буферной системы: чем ближе к 1, тем выше β.
33. Основные характеристики буферной системы
Зона буферного действия ‒ интервалзначений рН, в котором сохраняется буферное
действие данной буферной системы.
β
Зона буферного действия
определяется по рК
слабого протолита
буферной системы.
рК ± 1
3,8
5,8
рН
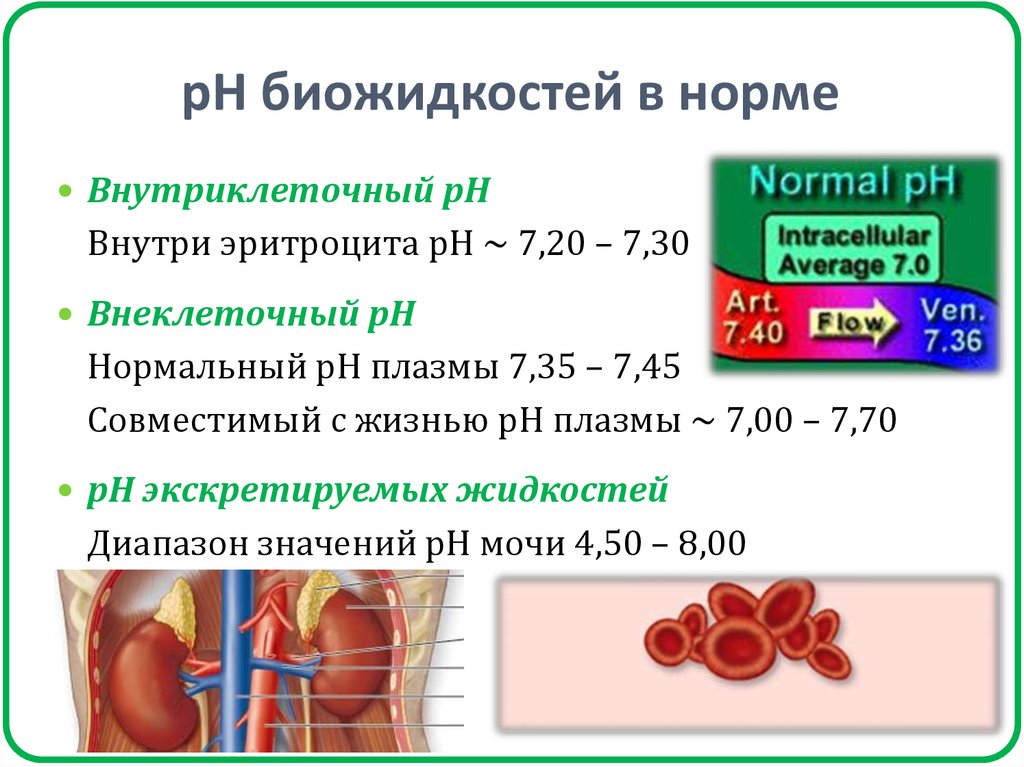
34. рН биожидкостей в норме
Внутриклеточный рНВнутри эритроцита рН ~ 7,20 – 7,30
Внеклеточный рН
Нормальный рН плазмы 7,35 – 7,45
Совместимый с жизнью рН плазмы ~ 7,00 – 7,70
рН экскретируемых жидкостей
Диапазон значений рН мочи 4,50 – 8,00
35. Совмещённые протолитические равновесия …
… в буферной системе имеют место приодновременном присутствии в ней нескольких
буферных систем.
Условия совмещённого
равновесия:
НА
МеА
1.
НВ
МеВ
2.
3.
оба основания (А–, В–) буф.
системы связывают Н+ в
другой компонент –
кислоту;
«работает» буфер,
образующий более
прочный протолит (более
слабую кислоту);
Ка (НА) < Ка (НВ).
36. Совмещённое протолитическое равновесие
Вывод: в совмещённом–
В
протолитическом равновесии
Н+
доминирует тот процесс, в
результате которого образуется
более прочный протолит.
А–
H2PO4–
HPO42–
Ka = 6,2 10–8
HHb
Hb–
Ка=6,31 10–9

































 Химия
Химия








