Похожие презентации:
Органические производные трехвалентного фосфора
1. Органические производные трехвалентного фосфора
ХЕМО-01-17Наумова Н. В.
2. Фосфор
Фосфор расположен в V группе Периодическойсистемы элементов Д. И. Менделеева. Фосфор —
один из распространённых элементов земной коры:
его содержание составляет 0,08—0,09 % её массы.
Важнейшими минералы:
апатит Ca5(PO4)3(F,Cl),
фосфотит Ca5(PO4)3(OH, CO3), и другие.
2Ca3(PO4) + 10C + 6SiO2 → P4 + 10CO + 6CaSiO3
3. Аллотропные модификации
Белый фосфор имеетмолекулярную кристаллическую решётку,
формула молекулы белого фосфора — P4, причём
атомы расположены в вершинах тетраэдра.
Плохо растворяется в воде, но легко растворим
в органических растворителях. Химически белый фосфор
чрезвычайно активен. Например, он медленно окисляется
кислородом воздуха уже при комнатной температуре и
светится (бледно-зелёное свечение). Явление такого рода
свечения вследствие химических реакций окисления
называется хемилюминесценцией.
4.
Красный фосфор — это более термодинамическистабильная модификация элементарного фосфора.
Красный фосфор имеет формулу Рn и представляет
собой полимер со сложной структурой. Химическая
активность красного фосфора значительно ниже, чем
у белого; ему присуща исключительно малая
растворимость.
Красный фосфор на воздухе не самовоспламеняется,
вплоть до температуры 240—250 °С (при переходе в
белую форму во время возгонки), но
самовоспламеняется при трении или ударе, у него
полностью отсутствует явление хемилюминесценции.
Нерастворим в воде, а также в бензоле, сероуглероде и
других веществах, растворим в трибромиде фосфора.
5. Фосфин
Фосфористый водород, или фосфин, РН3, - бесцветный газ снеприятным запахом, токсичен, при нагревании разлагается, на
воздухе самовоспламеняется, в смеси с кислородом взрывается.
Получается разложением фосфидов некоторых металлов:
Ca3P2 + 6H2O → 2PH3↑ + 3Ca(H2PO2)2,
Mg3P2 + 6HCl → 2PH3↑ + 3MgCl2
6. Способы получения органофосфинов
1) Взаимодействием металлорганических соединений (магния,лития) и трихлорид фосфора:
RMgBr +
2RMgBr +
PCl3
PCl3
RPCl2
R2PCl
+ RMgBrCl
+ 2MgBrCl
R3P + 3MgBrCl
3RMgBr + PCl3
2) Гидридное присоединение фосфина к олефинам, например:
CH3
C6H13CH
CH2
+ PH3
C6H13CH PH2
7.
3) Восстановление оксидов третичных фосфинов:HSiCl3
(C6H5)3P
O
(C6H5)3P
4) Реакция прямого синтеза из элементного фосфора и
галогеналкила в присутствии металлической меди при
повышенной температуре:
P + RCl
300-360 oC
Cu
RPCl2
+
R2PCl + PCl3
5) Фосфорлирование по типу реакции Фриделя-Крафтса –
взаимодействие ароматических соединений с трихлоридом
фосфора в присутствии трихлорид алюминия:
AlCl3
C6H6 + PCl3
C6H5PCl2
+
HCl
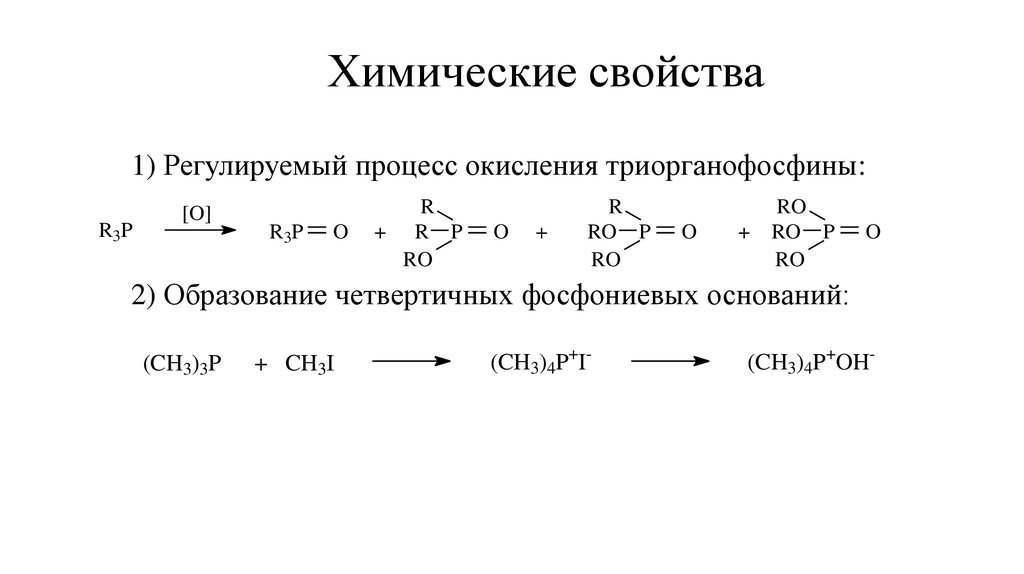
8. Химические свойства
1) Регулируемый процесс окисления триорганофосфины:R 3P
[O]
R 3P
O
R
+ R P
RO
O
+
R
RO P
RO
O
+
RO
RO P
RO
O
2) Образование четвертичных фосфониевых оснований:
(CH3)3P
+ CH3I
(CH3)4P+I-
(CH3)4P+OH-
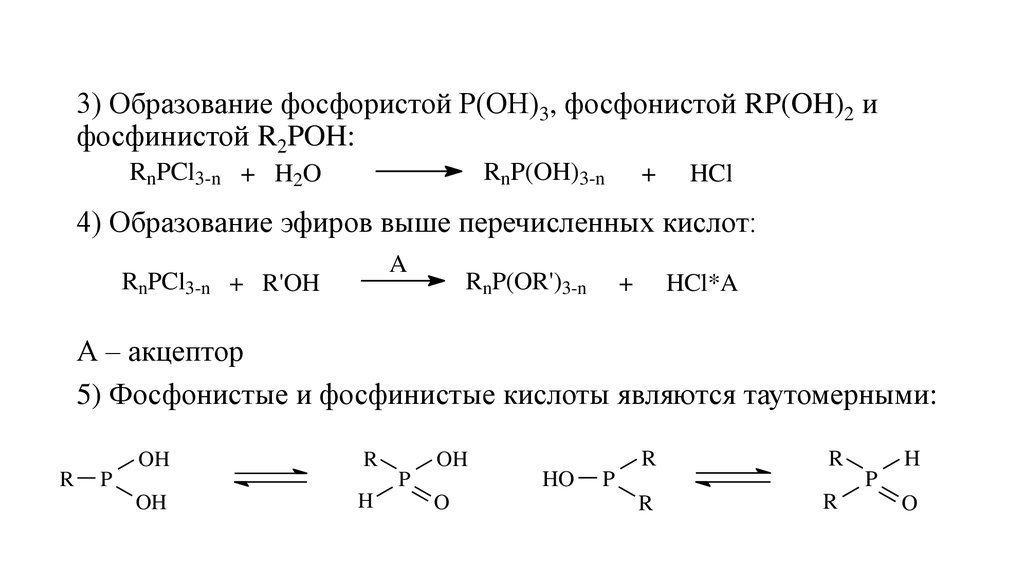
9.
3) Образование фосфористой Р(ОН)3, фосфонистой RP(OH)2 ифосфинистой R2POH:
RnPCl3-n + H2O
RnP(OH)3-n
+
HCl
4) Образование эфиров выше перечисленных кислот:
A
RnPCl3-n + R'OH
RnP(OR')3-n
+
HCl*A
А – акцептор
5) Фосфонистые и фосфинистые кислоты являются таутомерными:
OH
R
R
P
HO
P
OH
H
R
OH
O
R
P
H
P
R
R
O
10.
6) Взаимодействие трихлорид фосфора с этиленоксидом собразованием три-β-хлорэтилфосфита и последующая его
переэтерификация органическими спиртами:
O
PCl3
+
P(CH2CH2Cl)3
3CH2
+
CH2
3ROH
P(CH2CH2Cl)3
P(OR)3 +
3HOCH2CH2Cl
7) Реакция Арбузова — алкилирование триалкилфосфитов
алкилгалогенидами с образованием диалкилфосфонатов:
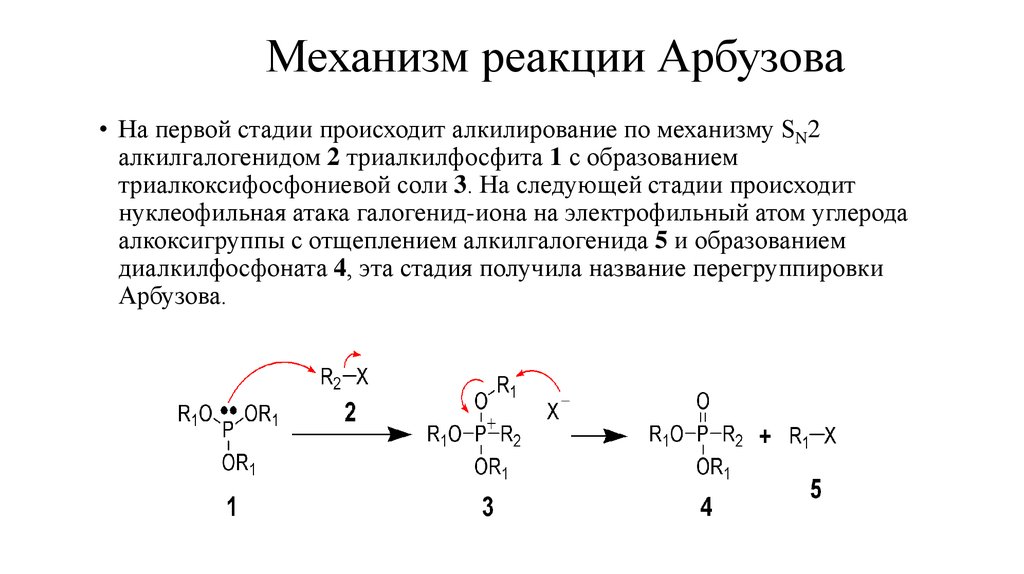
11. Механизм реакции Арбузова
• На первой стадии происходит алкилирование по механизму SN2алкилгалогенидом 2 триалкилфосфита 1 с образованием
триалкоксифосфониевой соли 3. На следующей стадии происходит
нуклеофильная атака галогенид-иона на электрофильный атом углерода
алкоксигруппы с отщеплением алкилгалогенида 5 и образованием
диалкилфосфоната 4, эта стадия получила название перегруппировки
Арбузова.









 Химия
Химия
![Фосфор [Ne] 3s23p3 Фосфор [Ne] 3s23p3](https://cf3.ppt-online.org/files3/thumb/o/Of5DLqgAnizsE8CK9TMhdQxGSr1YpPjBtUvaWy.jpg)







