Похожие презентации:
Основы составления балансов
1. Общая химическая технология
Доцент ЩетинскийАндрей Валерьевич
2. 2. Основные закономерности химико-технологического процесса
Основы составления балансовДля анализа работы технологической схемы, отдельных аппаратов, при
проектировании новых производств, разработке и проектировании новых
аппаратов, для отыскания важнейших технологических показателей,
составляют материальный и тепловой балансы либо всего технологического
производства, либо той его части, которая непосредственно связана с
конструированием аппарата или определяемым показателем.
На основе знаний о закономерностях и ходе рассчитываемого химикотехнологического процесса с учетом известных для данного процесса
величин, составляется методика расчета, зависящая от:
• рода производства;
• способа переработки исходных материалов;
• качества сырьевых материалов;
• режима работы аппаратов;
• условий производства;
• и других факторов.
В основе всех химико-технологических процессов лежат законы сохранения!
(массы, энергии и импульса)
3. 2. Основные закономерности химико-технологического процесса
Основы составления балансовЗакон сохранения в покоящейся (закрытой) системе
Закон сохранения массы и энергии в покоящейся системе означает, что они
могут превращаться внутри системы (т.е. выступать в различных формах), но
совокупности их остаются неизменными.
Рассмотрим систему в которой не происходит химических превращений.
Допустим в системе имеется несколько компонентов "К" и только одна фаза
(φ = 1), то согласно закону сохранения массы, сумма масс всех компонентов должна
быть равна массе всей системы m, т.е.
m1 + m2 + mк = m
K
m
или
i 1
i
=m
В другом предельном случае система должна иметь несколько фаз (φ≠1) и
только один компонент (К=1).
Закон сохранения массы при этом выражается несколько иначе:
N f1 N f2 ...N
f
N
N
i 1
fi
N
4. 2. Основные закономерности химико-технологического процесса
Основы составления балансовЗакон сохранения массы
Согласно приведенным выражениям масса всей системы остается неизменной,
т.е. при изменении массы одной из фаз системы, за счет перехода вещества в другую
фазу, меняется масса другой фазы куда это вещество перешло.
Сформулируем закон сохранения массы для общего случая, когда в системе не
идут химические реакции, но присутствуют несколько фаз "φ" и несколько
компонентов "К". В этом случае закон сохранения массы нужно выразить для
каждого компонента отдельно.
Полученные таким образом уравнения обычно называют балансами уравнений
или частными массовыми балансами в отличии от общего массового баланса, или
брутто-массового баланса.
Если общий массовый баланс представляется уравнением, в котором не
различается химическая природа компонентов, то либо в системе имеется только
один компонент, либо масса всех компонентов, находящихся в разных фазах местах
системы, измеряется одной общей мерой.
5. 2. Основные закономерности химико-технологического процесса
Основы составления балансовЗакон сохранения массы
Частный массовый баланс проще всего составляется с помощью мольных
долей. Мольная доля j-го компонента в фазе, обозначенной через X, может быть
выражена следующим образом:
xj (
Nj
k
Ni
) (
fx
Nj
N
) fx
i 1
В другой фазе, обозначенной через Y, мольная доля j -го компонента равна
числу его молей, деленному на сумму чисел молей всех остальных,
присутствующих в этой фазе компонентов:
Yj (
Nj
k
Ni
i 1
) (
fy
Nj
N
)
fy
6. 2. Основные закономерности химико-технологического процесса
Основы составления балансовЗакон сохранения массы
Для каждой фазы существует отдельная зависимость, причем сумма мольных
долей всех компонентов, внутри данной фазы равна единице:
k
x
j 1
i
k
y
1
j 1
j
1
т.е. мы имеем баланс для каждой фазы.
Если в какой либо фазе присутствуют только два компонента, то
x1 x2 1
С помощью этих уравнений можно определить состав фазы, если известны
мольные доли, т.е. К-1 компонентов. Используя уравнение
xj (
Nj
N
) fx
7. 2. Основные закономерности химико-технологического процесса
Основы составления балансовМассу (число молей), N1 f
следующим образом
1
Закон сохранения массы
первого компонента в фазе X можно представить
N1 f1 N1 f1 * x1
Число молей этого же компонента в фазе Y будет равно
N1 f2 N1 f2 * y1
Из этих значений массы можно составить частный баланс первого компонента,
суммируя числа его молей во всех фазах системы:
N f1 x1 N f2 y1 ... N z1 N1
f
8. 2. Основные закономерности химико-технологического процесса
Основы составления балансовЗакон сохранения массы
Такие же частные балансовые уравнения можно составить для всех “К”
компонентов:
f
N f1 x1 N f2 y1 ... N z1 N1
N f1 x2 N f2 y2 ... N z2 N 2
f
N f1 xk N f2 yk ... N zk N k
f
Систему уравнении можно упростить, если принять во внимание, что каждое
слагаемое левых частей всех уравнений представляет число молей какого-либо
компонента в какой-либо фазе. Введем для этих чисел двойные индексы, причем
первая будет обозначать номер фазы, а вторая -номер компонента.
N1.1 N 2.1 ... N .1 N1
N1.2 N 2.2 ... N .2 N 2
N1.k N 2.k ... N .k N k
N1 f1 N2 f2 ... Nk
f
N
Пример!
9. 2. Основные закономерности химико-технологического процесса
Основы составления балансовЗакон сохранения массы в случае протекания химической реакции
В случае химической реакции Закон сохранения массы принимает иную
характерную форму: ему подчиняются не компоненты, а химические элемен-ты или
возможно, отдельные радикалы. Вместо суммы чисел молей отдель-ных
компонентов неизменной остается сумма чисел атомов отдельных эле-ментов. Этот
факт выражается с помощью уравнения химической реакции:
A A B ... k k L L M M ... S S
или в общем виде алгебраическая сумма исходных и полученных в результате
химической реакции компонентов (в виде атомов элементов или радикалов):
S
M
i A
i
i
0
где νi - стехиометрический коэффициент i-го компонента;
Mi - химическая формула i -го компонента с набором отдельных элементов,
любой химический элемент или радикал;
νi Mi - произведение дает число атомов отдельного элемента компонента (в
Знак перед коэффициентом!
соответствующих единицах массы).
10. 2. Основные закономерности химико-технологического процесса
Основы составления балансовЗакон сохранения энергии
Общее выражение закона сохранения энергии по первому Закону термодинамики
может быть сформулировано следующим образом: Внутренняя энергия
изолированной от внешней среды системы постоянна:
dU a L 0
или
U = const
и для совершения работы такой системой ей нужно сообщить теплоту.
Важнейшей формулой энергии в химической технологии является теплота. В
промышленных процессах теплообмен всегда должен быть рассчитанным. Если в
системе основная часть энергии потребляется в тепловой форме, то вместо закона
сохранения энергии с небольшой погрешностью к этой системе можно применить
закон сохранения теплоты.
Отсюда следует, что тепловой баланс является простейшей формой
энергетического баланса.
11. 2. Основные закономерности химико-технологического процесса
Основы составления балансовЗакон сохранения энергии
Большая часть процессов (в открытых или закрытых системах) происходит при
приблизительно постоянном давлении. Так как превращающееся вещество в
большей или меньшей степени претерпевает изменение объема, то это превращение
связано с работой изменения объема. Если объем уменьшается, то внешнее давление
совершает положительную работу, если же объем увеличивается, то система
совершает работу против внешнего давления, и знак ее будет отрицательный.
Работа изменения объема отличается по своему характеру от обычной работы,
так как она необходима или точнее отражает только взаимопревращения энергии в
ходе различных процессов из одной формы в другую, теплоты в механическую
работу, эквивалентно. Для других целей она не может быть использована.
Поэтому работу изменения объема целесообразно вычесть из общей работы L
или δL, причем остаток (δLh) равен полезной работе.
Lh = L ( pdV )
12. 2. Основные закономерности химико-технологического процесса
Основы составления балансовЗакон сохранения энергии
После введения понятия полезной работы основной закон сохранения энергии,
можно выразить
dU Q Lh pdV
Или
dU pdV Q Lh
Работа изменения объема, как и внутренняя энергия dU, является функцией
состояния (ее значение зависит исключительно от состояния системы и не зависит
от пути достижения этого состояния). Целесообразно объединить эти два понятия в
новую функцию, которая обозначается через Н и называется энтальпией.
При постоянном внешнем давлении для энтальпии действительно определение
в дифференциальной форме:
dH = dU pdV
или в общем виде (интегральной форме)
H = U pdV
13. 2. Основные закономерности химико-технологического процесса
Основы составления балансовЗакон сохранения энергии
Cравнивая эти уравнения, придем к окончательному выводу, что при
постоянном давлении закон сохранения энергии действителен и согласно этому
закону:
H = const следовательно
dH = 0
Для составления теплового баланса проще всего использовать удельную
энтальпию h – это энтальпия отнесенная к единице массы (одному молю).
Умножить каждый член массового баланса на соответствующую энтальпию h,
получаем уравнение теплового баланса.
Тепловой баланс, соответствующий массовому балансу будет иметь вид:
i k
N1h1 N 2 h2 ... N k hk N i hi
i 1
Где hi - удельная энтальпия, отнесенная к одному молю i-гo компонента.
14. 2. Основные закономерности химико-технологического процесса
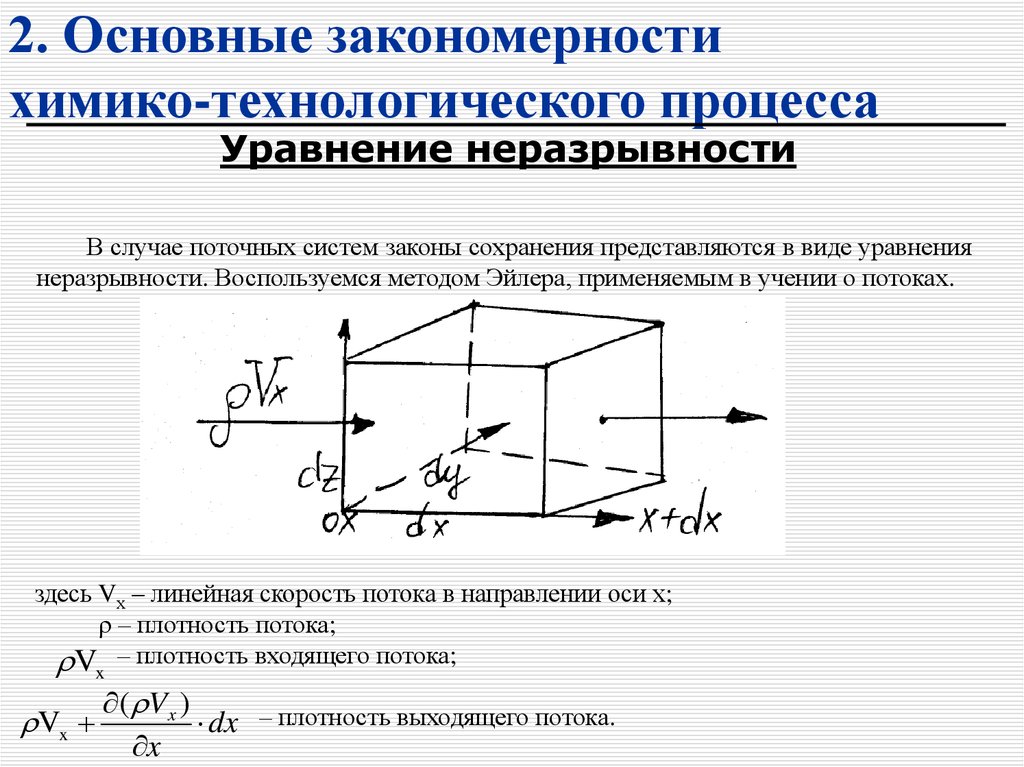
Уравнение неразрывностиВ случае поточных систем законы сохранения представляются в виде уравнения
неразрывности. Воспользуемся методом Эйлера, применяемым в учении о потоках.
здесь Vх – линейная скорость потока в направлении оси х;
ρ – плотность потока;
V – плотность входящего потока;
x
Vx
( Vx )
dx – плотность выходящего потока.
x
15. 2. Основные закономерности химико-технологического процесса
Уравнение неразрывностиОпределим количество массы, протекающей за время dτ через элементарный
объем dV=dx*dy*dz.
Если плотность умножить на dy*dz*dτ, то получим количество массы,
поступающей в куб за время dτ вдоль оси X.
Vx dydzd
Количество массы, выходящей за dτ время из этого элементарного объема в
направлении оси X на расстоянии x + dХ можно представить следующим образом:
( pVX )
[ Vx
dx]dydzd
x
Разность этих двух количеств (накопление массы) уравнений будет иметь вид:
( pVX )
dxdydzd
x
16. 2. Основные закономерности химико-технологического процесса
Уравнение неразрывностиАналогично получается разность количеств массы, движущихся в и в
направлении оси y:
( pVy )
y
dxdydzd
И в направлении оси Z:
( pVz )
dxdydzd
z
Согласно закону сохранения массы, сумма накоплений массы вещества (за
время dτ), движущегося в трех направлениях, должна быть равна убыли массы в
объеме dV.
p
( dxdydzd )
17. 2. Основные закономерности химико-технологического процесса
Уравнение неразрывностиСоставим уравнение массового баланса:
(накопление) убыль массы в объеме dV
или с противоположным знаком:
(накопление) убыль массы в объеме dV
Это означает что сумма разностей должна быть равна выражению
( pVy )
( pVx )
( pVz )
p
dxdydzd
dxdydzd
dxdydzd ( dxdydzd )
x
y
z
( pVx ) ( pVy ) ( pVz )
p
x
y
z
18. 2. Основные закономерности химико-технологического процесса
Уравнение неразрывностиВ векторно-аналитической форме вывод упростится и, очевидно, не бу-дет
зависеть от выбора системы координат, так как мы имеем в левой части
дивергенцию плотности потока, тогда
div( V )
0
Введем понятие обобщенного символа для плотности потока j тогда
выражение можно записать
j
divj
0
19. 2. Основные закономерности химико-технологического процесса
Уравнение неразрывностиСледствия из уравнения неразрывности
Если поток постоянен во времени (стационарен), то
0
и уравнение неразрывности запишется
div( V ) divj 0
Если движущийся поток несжимаем - const
div( V ) divV 0
Упростим уравнение неразрывности до вида:
divV
Vx Vy Vz
0
x
y
z
20. 2. Основные закономерности химико-технологического процесса
Уравнение неразрывностиПреобразуем уравнение неразрывности. Для упрощения рассмотрим поток
только в одном направлении, например, вдоль оси X, и проведем рас-чет не по
плотности потока, а по потоку, протекающему через рассматриваемое сечение F.
( pVx ) ( pVy ) ( pVz )
p
x
y
z
- Тогда
( pVx ) F
p
F
0
x
Если поток стационарный, то выражение упростится до
Vx F const
Если движущийся поток несжимаем то
VF=const или V1F1 V2 F2
( pVx ) F
0
x
и
21. 2. Основные закономерности химико-технологического процесса
Уравнение неразрывностиУравнение неразрывности в стационарной системе действительно также для
потока компонента и указывает на то, что дивергенция плотности компонента равна
нулю. Это значит, что для системы, в которой не происходит химическая реакция,
уравнение неразрывности потока компонента, подобно уравнению
m1 m2 ... mk m
Упрощается до следующей формы:
N N
a
z
Здесь индекс относится к входящему веществу, а индекс z к выходящему. Точка над
N (число молей) обозначает, что это величина отнесена к единице времени, т.е.
Число молей входящего компонента равно числу молей выходящего и при этом
dN/dτ = const
Если в элементе процесса происходит еще и химическая реакция, то закон
сохранения в форме уравнения должен быть отнесен к числу атомов химического
элемента, выраженному в соответствующих единицах массы.




















 Химия
Химия








