Похожие презентации:
Теоретические основы химической технологии
1. Теоретические основы химической технологии
Лекция 42.
Основу химического производства составляетХИМИКО-ТЕХНОЛОГИЧЕСКИЙ ПРОЦЕСС
– последовательность процессов целенаправленной
переработки
исходных
веществ
в
продукт,
включающие химические и физико-химические
процессы и их сочетание.
В совокупном химико-технологическом процессе
выделяются следующие виды отдельных процессов и
операций, классифицированных по их основному
назначению, и соответствующие аппараты или
машины, в которых они осуществляются.
Общая химическая технология
2
3. Классификация химико-технологических процессов
Механические и гидромеханические процессы -протекают безизменения химического и фазового состава обрабатываемого
материала. Осуществляются через транспортеры, питатели, дробилки,
диспергаторы, формователи, компрессоры, насосы, смесители,
фильтры.
Теплообменные процессы - нагрев, охлаждение, изменение фазового
состояния. Химический состав веществ в них не меняется. Они
протекают в теплообменниках, кипятильниках, конденсаторах,
плавилках, сублиматорах.
Массообменные процессы - межфазный обмен, в результате которого
меняется компонентный состав контактирующих фаз без коренного
изменения химического состава, т.е. химических превращений. К ним
относятся растворение, кристаллизация, сушка, дистилляция,
ректифиация, абсорбция, экстракция, десорбция, осуществляемые в
соответствующих
аппаратах
кристаллизаторах,
сушилках,
дистилляторах, ректификаторах, абсорберах, экстракторах, десорберах.
Общая химическая технология
3
4. Классификация химико-технологических процессов
Химические процессы - коренное изменение химическогосостава в химических реакторах.
В химическом производстве осуществляются также:
энергетические процессы - взаимное преобразование
различных видов энергии (тепловой, механической,
электрической) в турбинах, генераторах, моторах.
информационно-управляющие процессы - получение и
передача информации о состоянии потоков и веществ,
выработка и передача сигналов на управление процессами.
Осуществляются через - датчики состояния потоков и
оборудования (температуры, давления, состава, скорости
вращения двигателей и т.д.), сигнальные и информационные
системы, системы автоматического регулирования, включая
управляющие вычислительные машины, и др.
Общая химическая технология
4
5. Математическое моделирование как метод исследования химических процессов и реакторов
Моделирование - метод исследования объекта (явления,процесса, устройства) на модели: исследование самого
объекта заменяют исследованием его модели. Полученные
свойства модели переносят на свойства моделируемого
объекта.
Модель - специально созданный объект любой природы,
более простой, чем исследуемый, по всем свойствам,
кроме тех, которые надо изучить, и способный заменить
исследуемый объект так, чтобы получить новую
информацию о нем.
Общая химическая технология
5
6.
Модель специально создают, чтобы исследоватьвыбранные свойства объекта.
Для изучения разных свойств объекта может быть
создано несколько его моделей, каждая из которых
отвечает определенной цели исследования (единство
"цель-модель«).
Если модель отражает большее (или меньшее) число
свойств, то она называется широкой (или узкой).
Используемое иногда понятие "общая модель" как
отражающая все свойства объекта, - бессмысленно по
сути.
Общая химическая технология
6
7.
При исследовании процесса на каждой моделиисследуются
отдельные
явления
и
влияние
соответствующих параметров процесса.
Учитываемые в каждой модели явления и параметры составляющие модели.
На изучаемые свойства модели должны оказывать влияние
те же факторы, что и на свойства объекта. Составляющие
и параметры процесса, влияющие на изучаемые свойства –
существенные составляющие модели.
Изменение некоторых параметров может очень слабо
влиять на свойства объекта. Такие составляющие и
параметры называют несущественными, и их можно не
учитывать в модели.
Соответственно, простая модель содержит лишь
существенные составляющие, иначе модель будет
избыточной.
Общая химическая технология
7
8.
творчество и научный подход к построению модели выделить именно те явления и учесть те параметры,которые существенны для изучаемых свойств.
модель должна предсказывать неизвестные свойства
объекта, давать о нем новую информацию.
Это может быть достигнуто,
во-первых, если модель простая, и ее можно
исследовать, работать с ней,
во-вторых, если она полная, чтобы могли проявиться
изучаемые свойства.
Общая химическая технология
8
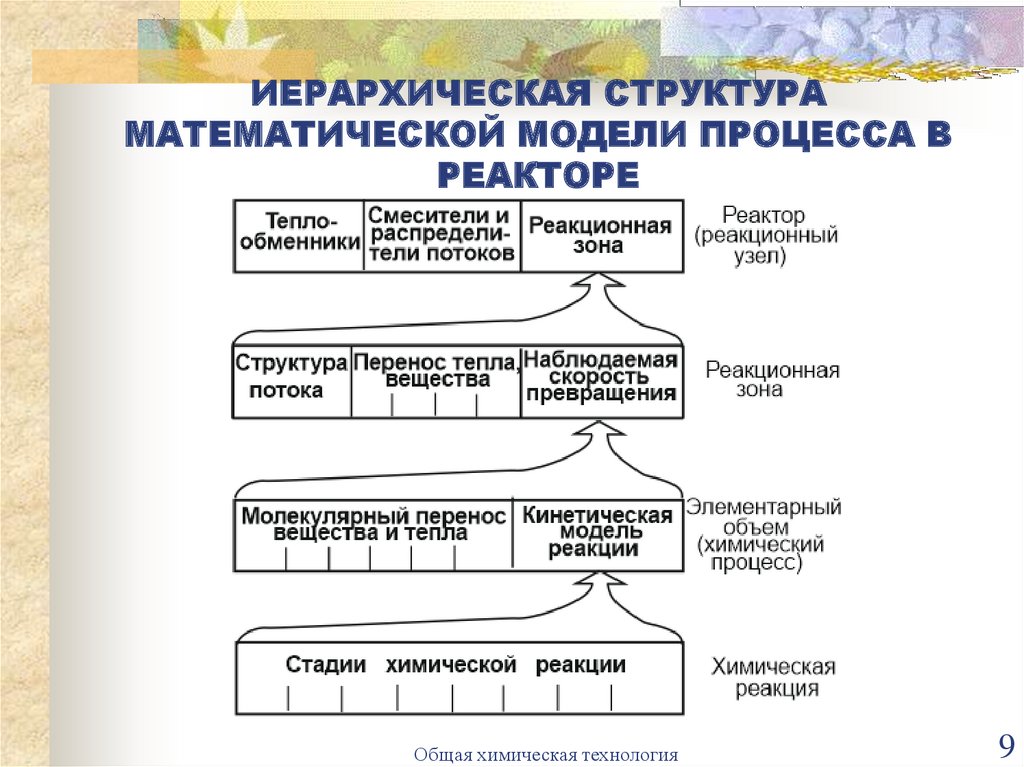
9.
ИЕРАРХИЧЕСКАЯ СТРУКТУРАМАТЕМАТИЧЕСКОЙ МОДЕЛИ ПРОЦЕССА В
РЕАКТОРЕ
Общая химическая технология
9
10. Условия процесса
состав исходной реакционной смеси (начальныеконцентрации реагентов – сi0),
объём поступающего потока (нагрузка на реактор V0),
температуры T в реакторе (для изотермического
процесса),
температуры входного потока T0,
температура теплоносителя (хладоагента) TX (для
процессов с теплоотводом).
Общая химическая технология
10
11. Свойства составляющих процесса
– характеристики химического процесса:схема превращения,
тип реакций (вид кинетического уравнения),
энергия активации,
тепловой эффект;
для неизотермических процессов – параметры
теплоотвода (коэффициенты теплопередачи,
поверхность теплообмена, теплофизические
свойства потока).
Общая химическая технология
11
12. ПОКАЗАТЕЛИ ПРОЦЕССА
степень превращения х,селективность S,
выход продукта Е,
профили концентраций, степени
превращения и температуры в реакторе,
изменение
концентраций, степени
превращения и температуры во времени.
Зная эти показатели, можно далее
определить конструктивные параметры
реактора,
энергетические
затраты,
экономические показатели.
Общая химическая технология
12
13. СТЕХИОМЕТРИЯ
Стехиометрическиеуравнения
показывают,
в
каких
соотношениях
вещества
вступают
в
химическое
взаимодействие.
Общий вид стехиометрического уравнения:
AA + BB + .... = RR + SS +...
где А, В,... - исходные вещества; R, S,... - продукты; A, B, R ,, S ... стехиометрические коэффициенты.
Стехиометрическое уравнение устанавливает соотношение между
количествами превратившихся веществ:
(NA0 – NA)/ A = (NB0 – NB)/ B = (NR – NR0)/ R = (NS – NS0)/ S,
где NA0, NB0, NR0, NS0 - начальные количества компонентов A, B, R,
S; NA, NB, NR0, NS - количества тех же компонентов после
превращения.
13
14. Алгебраическая форма стехиометрических уравнений
Уравнение, связывающее количества прореагировавших веществ,стехиометрическое уравнение в алгебраической форме:
i Ai=0, где Ai - наименование веществ (Ai A, B, …, R, S…)
i - стехиометрический коэффициент i-го вещества.
В этой формуле принято:
i < 0 для исходных веществ, которые расходуются,
i > 0 для продуктов, которые образуются.
i = 0 для веществ,которые в реакции не участвуют или для инертного
вещества
Для сложной реакции стехиометрические уравнения в алгебраической
форме :
ij Ai=0
j =1,2…
где j – индекс (номер) стехиометрического уравнения;
ij - стехиометрический коэффициент i-го вещества в j-м
стехиометрическом уравнении ( ij = 0, если вещество не входит в j-е
стехиометрическое уравнение).
14
15. АЛГЕБРАИЧЕСКАЯ ФОРМА СТЕХИОМЕТРИЧЕСКИХ УРАВНЕНИЙ
Используя алгебраическую форму стехиометрическогоуравнения,
получим
основное
стехиометрическое
соотношение между количествами превратившихся веществ:
(N1 - N10)/ 1 = (N2 - N20)/ 2 = ..... = (N i – N i0)/ i = const,
где N10, N20,..., N i0 - начальные количества компонентов;
N1, N 2… N i - количества компонентов после превращения;
1, 2 ... i - стехиометрические коэффициенты.
Исходные вещества убывают и для них (Ni - Ni0) < 0,
продукты образуются и для них (Ni - Ni0) > 0.
Соответствующий
знак
имеют
стехиометрические
коэффициенты i для исходных веществ ( i < 0) и продуктов
( i > 0).
15
16. Стехиометрически независимые уравнения
На основании стехиометрической количественной связимежду реагентами можно рассчитать состав реакционной
смеси в химическом превращении.
Стехиометрические уравнения служат для составления
материальных балансов в химически реагирующей системе
и на этой основе- тепловых балансов и расчетов основных
технологических показателей: расходный коэффициент,
степень превращения, выход продукта, селективность.
Для расчета материальных и тепловых балансов
необходимо использовать только стехиометрически
независимые уравнения, т.е. такую систему уравнений, в
которой ни одно из них не может быть получено
линейной комбинацией других.
16
17. БАЗИСНАЯ СИСТЕМА СТЕХИОМЕТРИЧЕСКИХ УРАВНЕНИЙ,
однозначно и полно описывающая процесс, должнасодержать число стехиометрически независимых уравнений,
определяемых уравнениями:
Для реакций обмена:
У = В – (Э – 1),
где В - число веществ, Э - число элементов, из которых
состоят вещества
Для ОВР:
У=В–Э
(соблюдается не только поэлементный баланс, но и баланс по
электронам)
17
18.
АЛГОРИТМ ОПРЕДЕЛЕНИЯСТЕХИОМЕТРИЧЕСКИ ЗАВИСИМЫХ
УРАВНЕНИЙ
Реагирует n веществ А1, А2, А3 ,..., Аn.
Их взаимодействие описано m уравнениями вида
iAi=0, которые представим в матричной
форме:
11 21 31 … n1
А1
12 22 32 … n2
А2
13 23 33 … n2 А3 0
……………………….
….
1m 2m 3m … nm
А4
18
19.
Матрицу стехиометрических коэффициентов надо привестик виду с единичными элементами по диагонали
1 а21 а31 … аn 1
0 1 а32 … аn 2
0 0 1 … аn 3
… … … … ….
0 0 0 0 аn m
.
Если появится строчка с нулевыми коэффициентами, то
соответствующее уравнение лишнее.
19
20. СТЕПЕНЬ ПРЕВРАЩЕНИЯ
- отношение количества превращенного исходноговещества N0 – N к его начальному количеству N0.
N A0 N A
xA
N A0
Степень превращения может быть определена для
любого исходного реагента, например,
xВ = (NВ0 - NВ)/NВ0.
Связь между степенями превращения двух исходных
веществ:
B N A0
xB x A
A N B0
20
21.
Количество любого вещества Ni в реагирующейсмеси можно определить по формуле:
i
N i N i0
N A0 xA
A
В
сложной
реакции
полнота
превращения
определяется для каждого стехиометрического
уравнения. Определив xAj - его степень превращения
в каждом j-ом уравнении, можно рассчитать
количество Ni любого компонента:
ij
N i N i0
N A0 xAj
j Aj
21
22. СТЕХИОМЕТРИЯ В ТЕХНОЛОГИЧЕСКИХ РАСЧЕТАХ КОНЦЕНТРАЦИИ КОМПОНЕНТОВ В РЕАКЦИОННОЙ СМЕСИ
Стехиометрическое уравнение и степень превращенияопределяют изменение количества вещества. На практике
состав смеси выражают через концентрации компонентов:
ci N i / N i
i
Общее количество реагирующей смеси
N A0 xA
N i N i 0 xA N A0 i / A N i 0
A
i
i
i
i
Начальные концентрации
Ci 0 N i 0 / N i 0
i
Текущие концентрации компонентов реакционной смеси
Ci 0 ( i / A )CA0 x A
Ci
1 ( / A )CA0 xA
22
23. ВЫХОД ПРОДУКТА, СЕЛЕКТИВНОСТЬ
Выход продукта - отношение количества исходноговещества к количеству этого вещества, превращенного в
продукт.
А(NR-NR0)
Для продукта R: ЕR=
RNА0
Для простой реакции: ЕR=хА
Для сложной реакции селективность показывает, какая
доля превратившегося исходного вещества пошла на
образование заданного продукта.
A ( N R - N R0 )
SR
R ( N A - N A0 )
для простых реакций SR = 1.
23






















 Химия
Химия Промышленность
Промышленность








