Похожие презентации:
Уравнение состояния идеального газа
1.
Тема урока: Уравнение состояния идеальногогаза.
2.
Цели урока:• Выяснить, что такое «уравнение состояния
идеального газа»
• познакомиться с двумя видами уравнения
состояния идеального газа: уравнением
Клапейрона и уравнением МенделееваКлапейрона.
• научиться решать задачи на применение
уравнения состояния идеального газа.
3.
Состояние макроскопической системыописывается макроскопическими (или
термодинамическими) параметрами:
давлением p, объемом V и температурой T.
Уравнение, связывающее
макроскопические параметры p, V и T
называется уравнением состояния
идеального газа.
4.
Французский физик и инженерКлапейрон Бенуа Поль Эмиль
на основе эксперимента
установил, что
давление, объем и температура
неизменной массы газа связана
соотношением:
pV
const
T
p1V1 p2V2
если m const
T1
T2
Уравнение состояния в таком виде называется
уравнение Клапейрона.
5.
Русский ученыйДмитрий Иванович
Менделеев,
обобщив уравнение
Клапейрона,
вывел общее уравнение
состояния идеального
газа:
m
pV
RT
M
или
pV RT
Уравнение состояния в таком виде называется
уравнение Менделеева-Клапейрона (М-К)
6.
1. При сжатии идеального газа его объемуменьшился в 2 раза, а температура
увеличилась в 2 раза. Как изменилось при этом
давление газа?
1) увеличилось в 2 раза
2) уменьшилось в 2 раза
3) увеличилось в 4 раза +
4) не изменилось
2
4
pV
const
T
2
4
7.
2. Давление идеального газа увеличилось в 2раза, а его температура уменьшилась в 4
раза. Как изменился при этом объем газа?
1) увеличился в 2 раза
2) уменьшился в 2 раза
3) увеличился в 8 раз
2
4) уменьшился в 8 раз+
8
8
pV
const
T
4
8.
3. Давление неизменного количестваидеального газа уменьшилось в 2 раза, а его
температура уменьшилась в 4 раза. Как
изменился при этом объем газа?
1) увеличился в 2 раза
2) уменьшился в 2 раза
3) увеличился в 8 раз
4) уменьшился в 8 раз
9.
3. Давление неизменного количестваидеального газа уменьшилось в 2 раза, а его
температура уменьшилась в 4 раза. Как
изменился при этом объем газа?
1) увеличился в 2 раза
2) уменьшился в 2 раза
3) увеличился в 8 раз
2
4) уменьшился в 8 раз
2
2
pV
const
T
4
10.
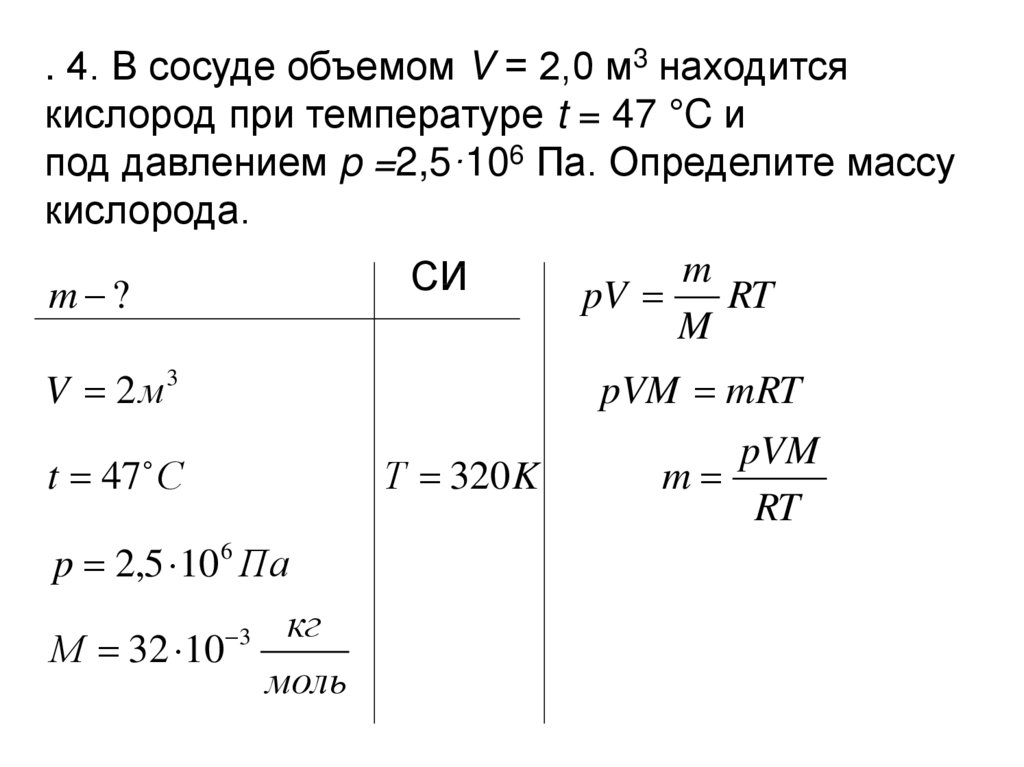
. 4. В сосуде объемом V = 2,0 м3 находитсякислород при температуре t = 47 °C и
под давлением p =2,5·106 Па. Определите массу
кислорода.
m
СИ
m ?
pV
RT
M
V 2 м3
t 47 С
Т 320 K
p 2,5 10 6 Па
М 32 10
3
кг
моль
pVM mRT
pVM
m
RT
11.
5. Какой объем занимает 200 г водорода придавлении 0,3 МПа и температуре 27ºС ?
V ?
m 200 г
p 0,3МПа
t 27 С
М 2 10
3
кг
моль
си
12.
5. Какой объем занимает 200 г водорода придавлении 0,3 МПа и температуре 27ºС ?
m
pV
RT
M
pVM mRT
mRT
V
pM
13.
6. Найти массу воздуха в классе, длинакоторого 10 м, ширина 6 м, а высота 3 м.
Температура воздуха в классе 27ºС. Молярная
масса воздуха равна 29∙10-3кг/моль. В классе
нормальное атмосферное давление равное
105 Па.
Домашнее задание:
§ 68,
№ 493, 494.












 Физика
Физика








