Похожие презентации:
Уравнение состояния идеального газа
1.
СОДЕРЖАНИЕ• Уравнение состояния идеального газа …...
• Понятие изопроцесса ……………………........
• Изотермический процесс……………………..
• Изобарный процесс ……………………………
• Изохорный процесс …………………………....
• Тестовые задания …………………………….....
2.
Зависимость давления идеального (достаточно разреженного) газа оттемпературы и концентрации его молекул имеет вид: p = nkT
Попытаемся получить на основе этой зависимости уравнение,
связывающее все три макроскопических параметра, характеризующие
состояние идеального газа: p, V , T
p = nkT
n=N
V
p = N kT
V
m
N=
N
M А
m
1
NА kT
p=
V M
m
NА kT
обе части уравнения умножим на V, получим : pV =
M
NAk = R = 6,02 х 10 231/моль х 1,38 х10 -23 Дж/К = 8,31 Дж/(моль.К)
R = 8,31 Дж/(моль К) – универсальная газовая постоянная
m
pV =
RT
M
уравнение состояния
идеального газа
3.
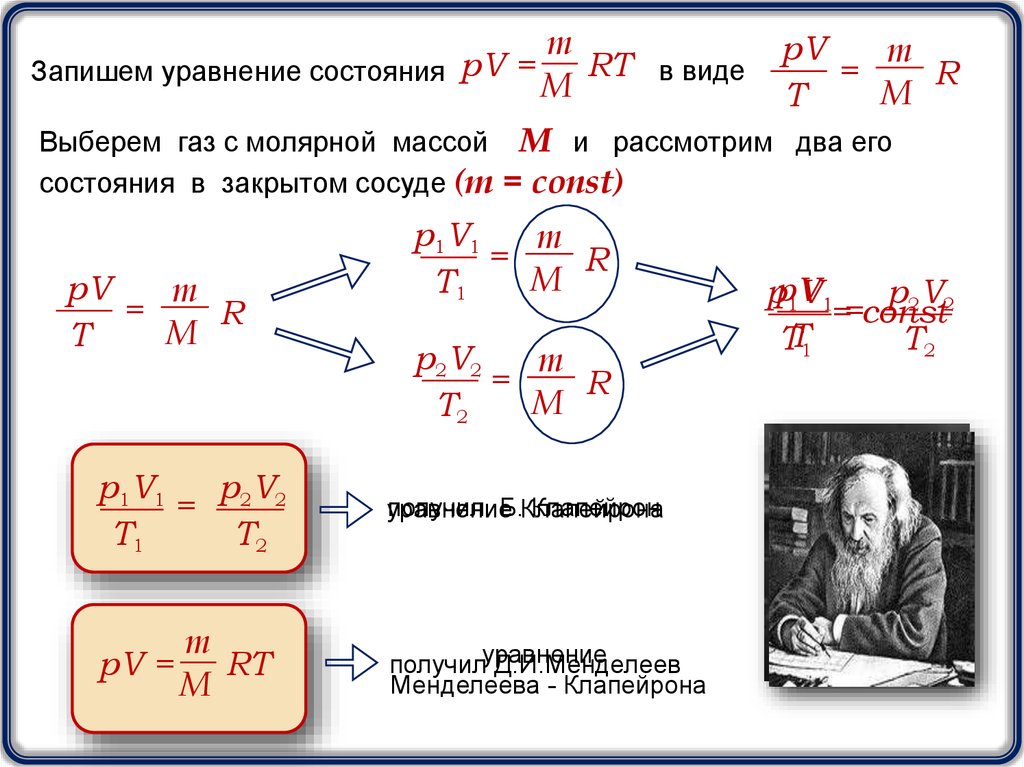
mRT в виде
Запишем уравнение состояния pV =
M
pV
m
=
R
M
T
Выберем газ с молярной массой М и рассмотрим два его
состояния в закрытом сосуде (m = const)
pV
m
=
R
M
T
p1V1
m
=
R
M
T1
p2V2
m
=
R
M
T2
p1V1
pV
= 2 2
T1
T2
получил Б.Клапейрона
Клапейрон
уравнение
m
pV =
RT
M
получилуравнение
Д.И.Менделеев
Менделеева - Клапейрона
ppV
p2V2
1V1
==const
TT1
T2
4.
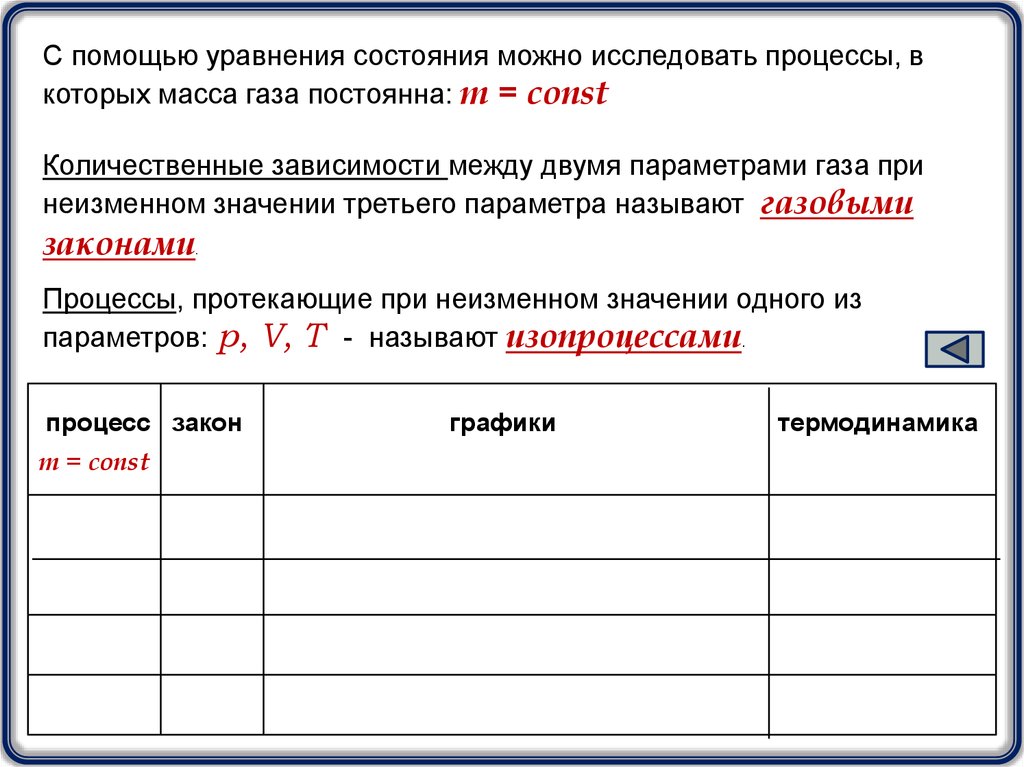
С помощью уравнения состояния можно исследовать процессы, вкоторых масса газа постоянна: m = const
Количественные зависимости между двумя параметрами газа при
неизменном значении третьего параметра называют газовыми
законами.
Процессы, протекающие при неизменном значении одного из
параметров: p, V, T - называют изопроцессами.
процесс закон
m = const
графики
термодинамика
5.
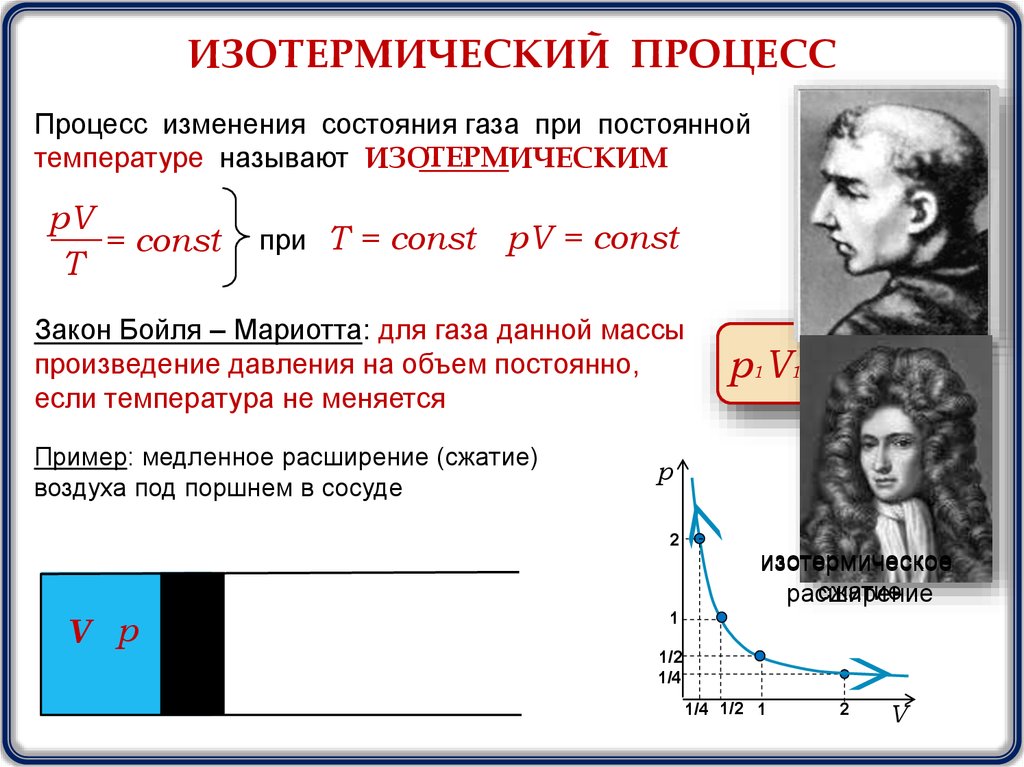
ИЗОТЕРМИЧЕСКИЙ ПРОЦЕССПроцесс изменения состояния газа при постоянной
температуре называют ИЗОТЕРМИЧЕСКИМ
pV
= const
T
при Т = const
pV = const
Закон Бойля – Мариотта: для газа данной массы
произведение давления на объем постоянно,
если температура не меняется
Пример: медленное расширение (сжатие)
воздуха под поршнем в сосуде
p
2
V р
р1V1 = р2V2
изотермическое
сжатие
расширение
1
1/2
1/4
1/4 1/2 1
2
V
6.
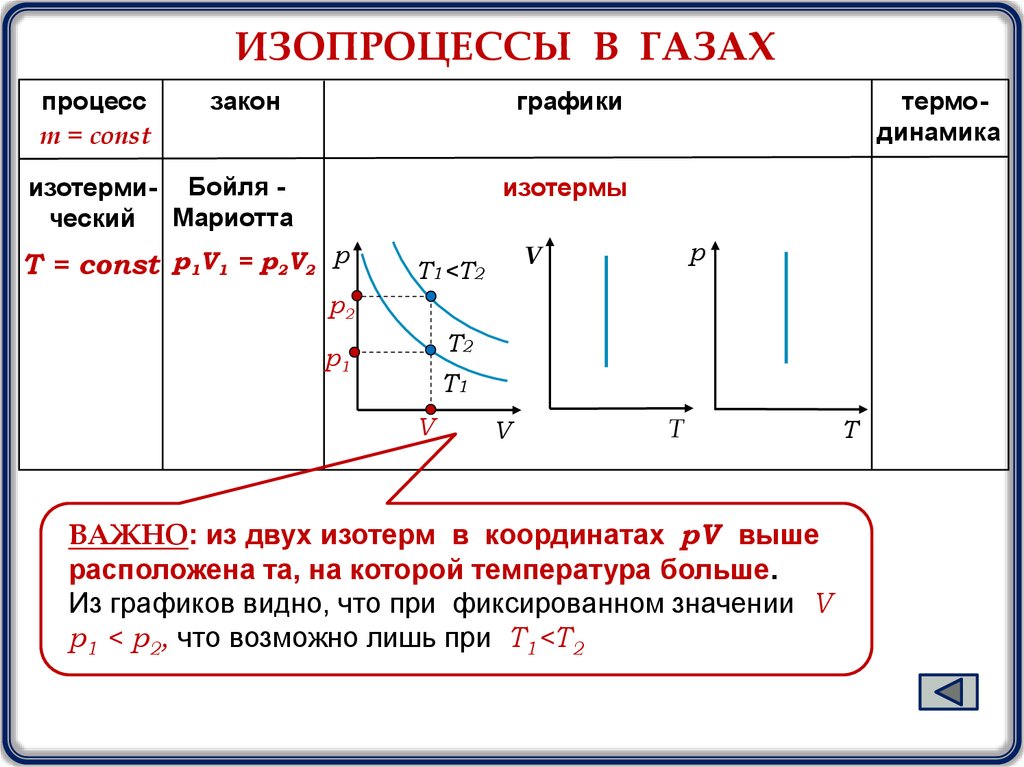
ИЗОПРОЦЕССЫ В ГАЗАХпроцесс
m = const
закон
графики
изотерми- Бойля ческий Мариотта
термодинамика
изотермы
Т = const р1V1 = р2V2 р
р
V
T1<T2
р2
T2
р1
T1
V
V
T
ВАЖНО: из двух изотерм в координатах pV выше
расположена та, на которой температура больше.
Из графиков видно, что при фиксированном значении V
р1 < р2, что возможно лишь при T1<T2
T
7.
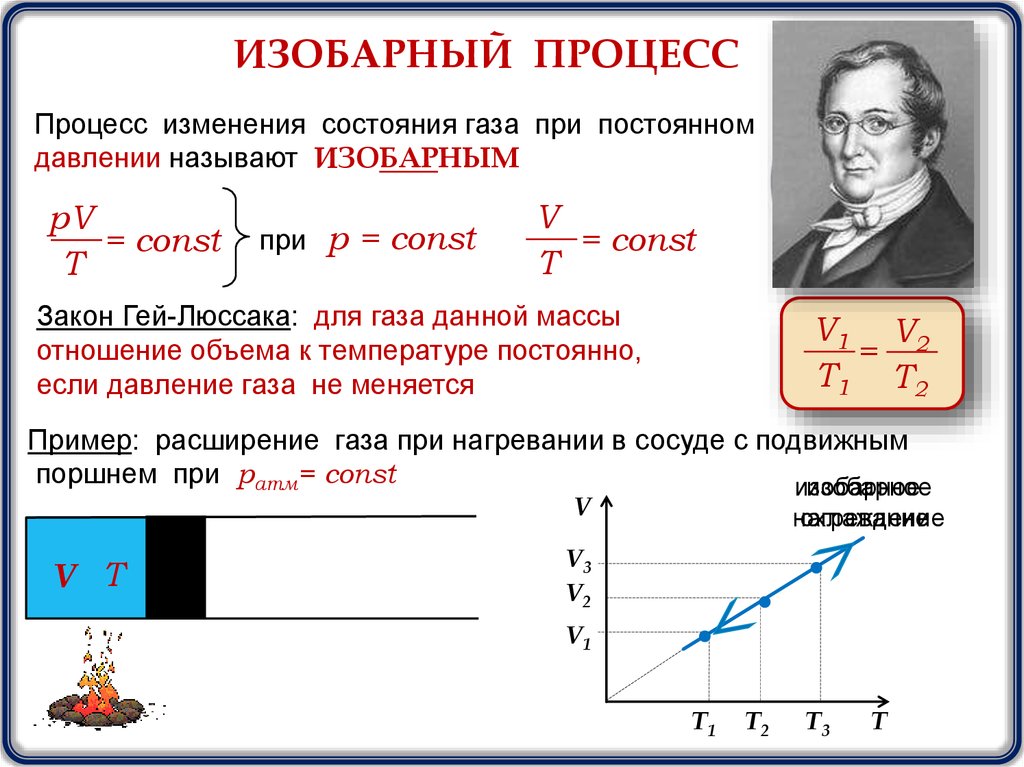
ИЗОБАРНЫЙ ПРОЦЕССПроцесс изменения состояния газа при постоянном
давлении называют ИЗОБАРНЫМ
pV
= const
T
при р = const
V
= const
T
Закон Гей-Люссака: для газа данной массы
отношение объема к температуре постоянно,
если давление газа не меняется
V1 V2
=
T1 T2
Пример: расширение газа при нагревании в сосуде с подвижным
поршнем при ратм= const
изобарное
изобарное
V
V Т
нагревание
охлаждение
V3
V2
V1
T1
T2
T3
T
8.
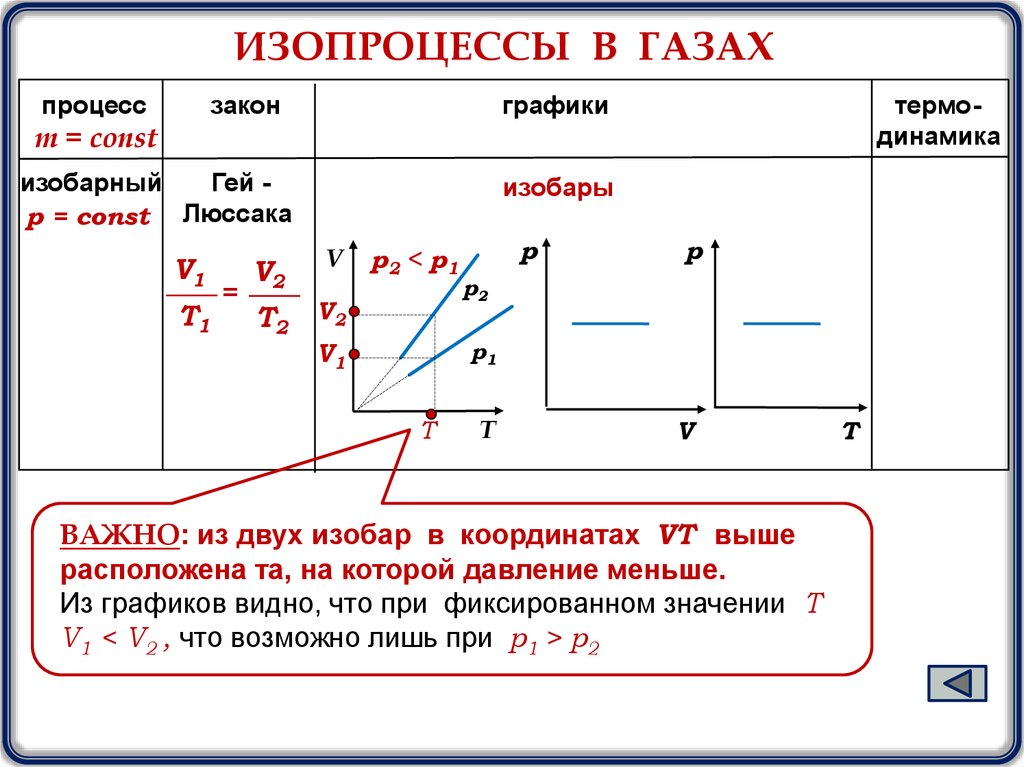
ИЗОПРОЦЕССЫ В ГАЗАХпроцесс
закон
графики
термодинамика
m = const
изобарный
Гей р = const Люссака
V1
T1
=
изобары
V2
V
T2
V2
p2 < p1
V1
р
р
р2
р1
T
T
V
ВАЖНО: из двух изобар в координатах VТ выше
расположена та, на которой давление меньше.
Из графиков видно, что при фиксированном значении Т
V1 < V2 , что возможно лишь при p1 > p2
T
9.
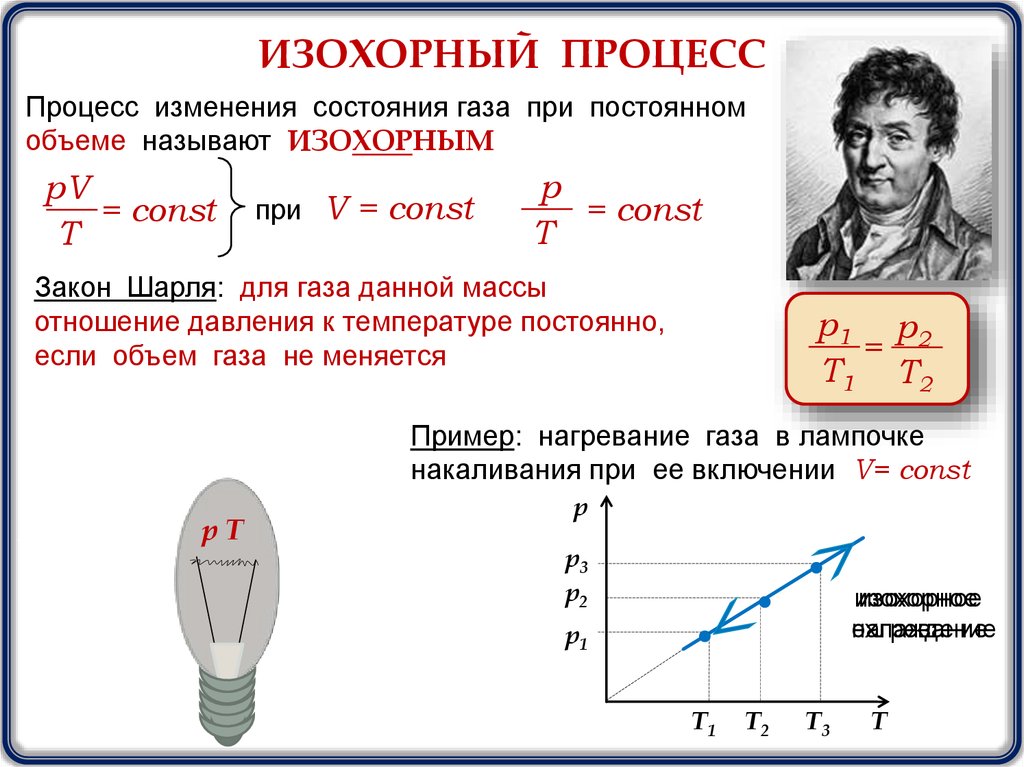
ИЗОХОРНЫЙ ПРОЦЕССПроцесс изменения состояния газа при постоянном
объеме называют ИЗОХОРНЫМ
pV
= const
T
при V = const
p
= const
T
Закон Шарля: для газа данной массы
отношение давления к температуре постоянно,
если объем газа не меняется
р1 р 2
=
T1 T2
Пример: нагревание газа в лампочке
накаливания при ее включении V= const
рТ
р
р3
р2
изохорное
изохорное
охлаждение
нагревание
р1
T1
T2
T3
T
10.
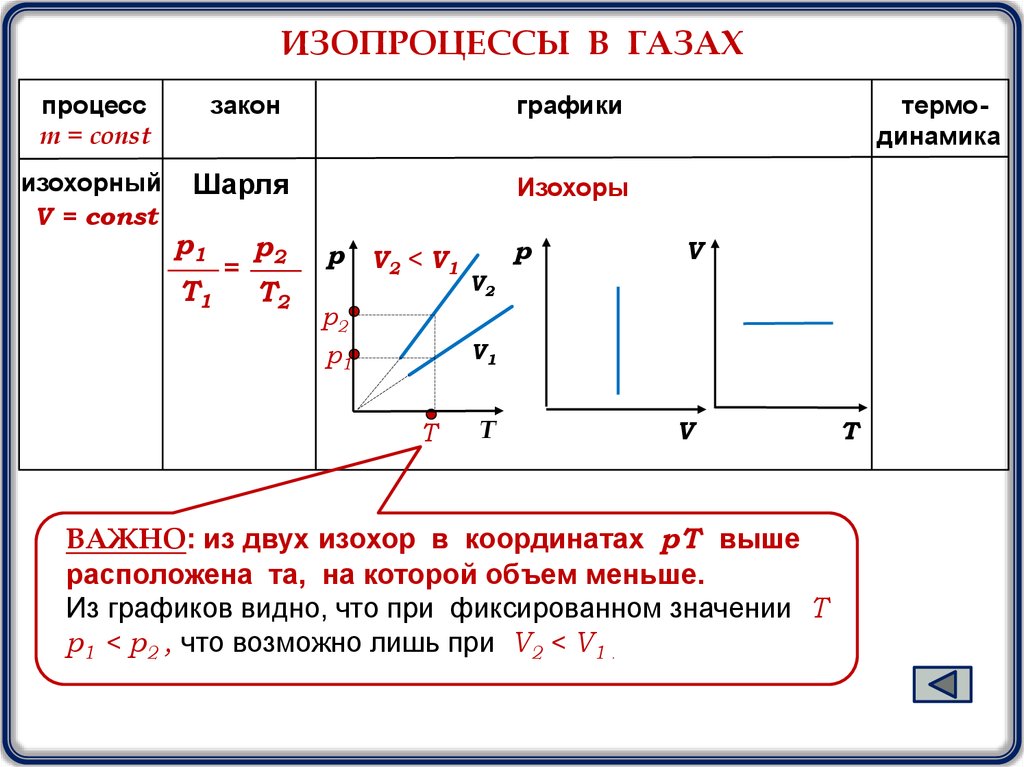
ИЗОПРОЦЕССЫ В ГАЗАХпроцесс
m = const
закон
графики
изохорный
V = const
Шарля
Изохоры
p1
T1
=
p2
T2
р
V2 < V1
p2
p1
р
термодинамика
V
V2
V1
T
T
V
ВАЖНО: из двух изохор в координатах pТ выше
расположена та, на которой объем меньше.
Из графиков видно, что при фиксированном значении Т
р1 < р2 , что возможно лишь при V2 < V1 .
T
11.
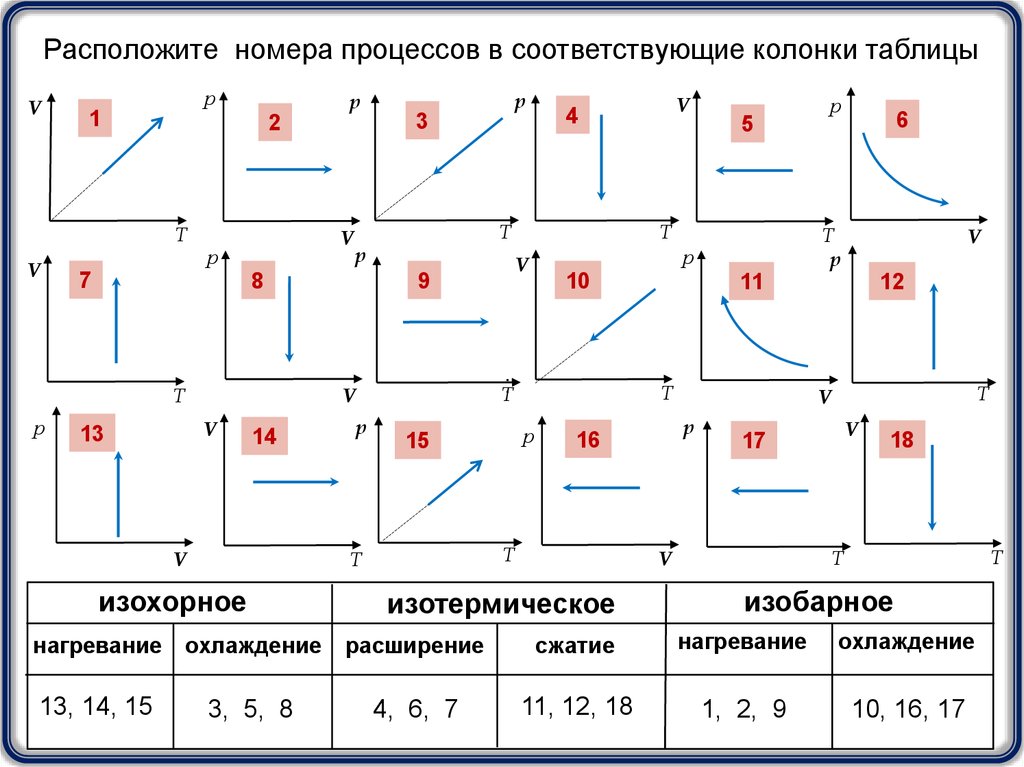
Расположите номера процессов в соответствующие колонки таблицыV
р
2
T
V
р
1
V
р
7
T
р
V
13
14
р
изохорное
12
T
V
17
18
T
T
V
изотермическое
V
V
р
16
T
6
11
T
р
15
T
V
10
р
T
р
р
T:
V
5
T
V
9
V
4
T
р
8
р
3
изобарное
нагревание
охлаждение
расширение
сжатие
нагревание
охлаждение
13, 14, 15
3, 5, 8
4, 6, 7
11, 12, 18
1, 2, 9
10, 16, 17
12.
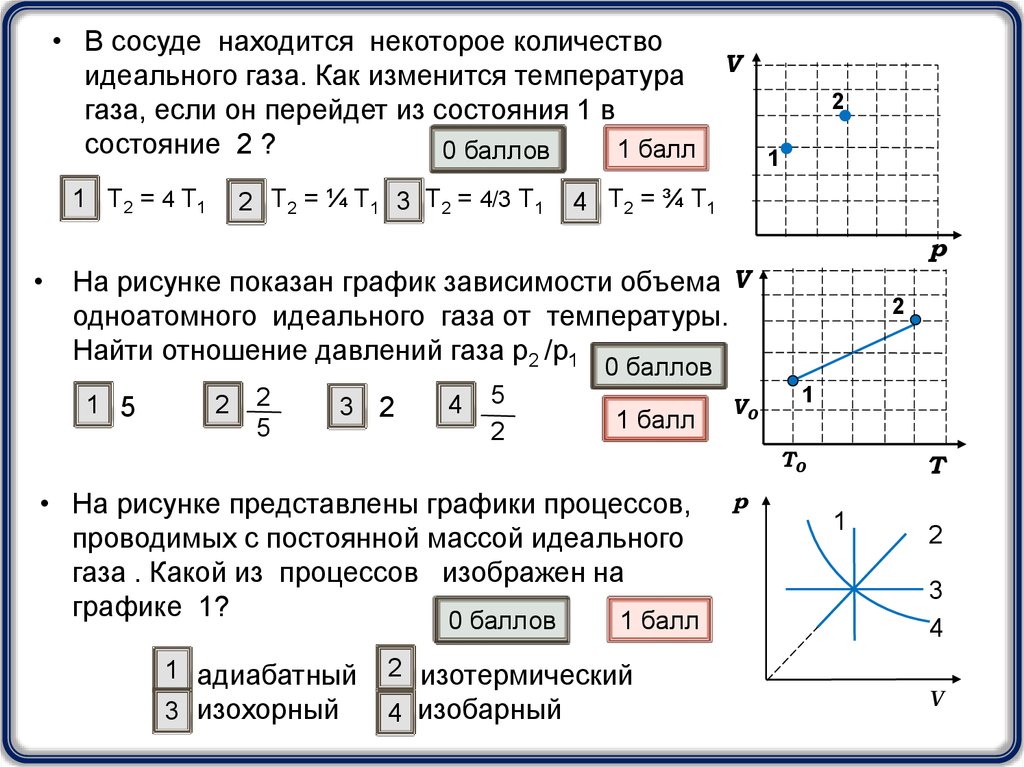
• В сосуде находится некоторое количествоидеального газа. Как изменится температура V
газа, если он перейдет из состояния 1 в
состояние 2 ?
1 балл
0 баллов
1 Т2 = 4 Т1
2 Т2 = ¼ Т1 3 Т2 = 4/3 Т1
2
1
4 Т2 = ¾ Т1
р
• На рисунке показан график зависимости объема V
одноатомного идеального газа от температуры.
Найти отношение давлений газа р2 /р1
2
0 баллов
1 5
2
2
5
3
2
4
5
2
1 балл
V0
1
Т0
• На рисунке представлены графики процессов,
проводимых с постоянной массой идеального
газа . Какой из процессов изображен на
графике 1?
0 баллов
1 балл
0 баллов
1 адиабатный
3 изохорный
2 изотермический
4 изобарный
р
Т
1
2
3
4
V
13.
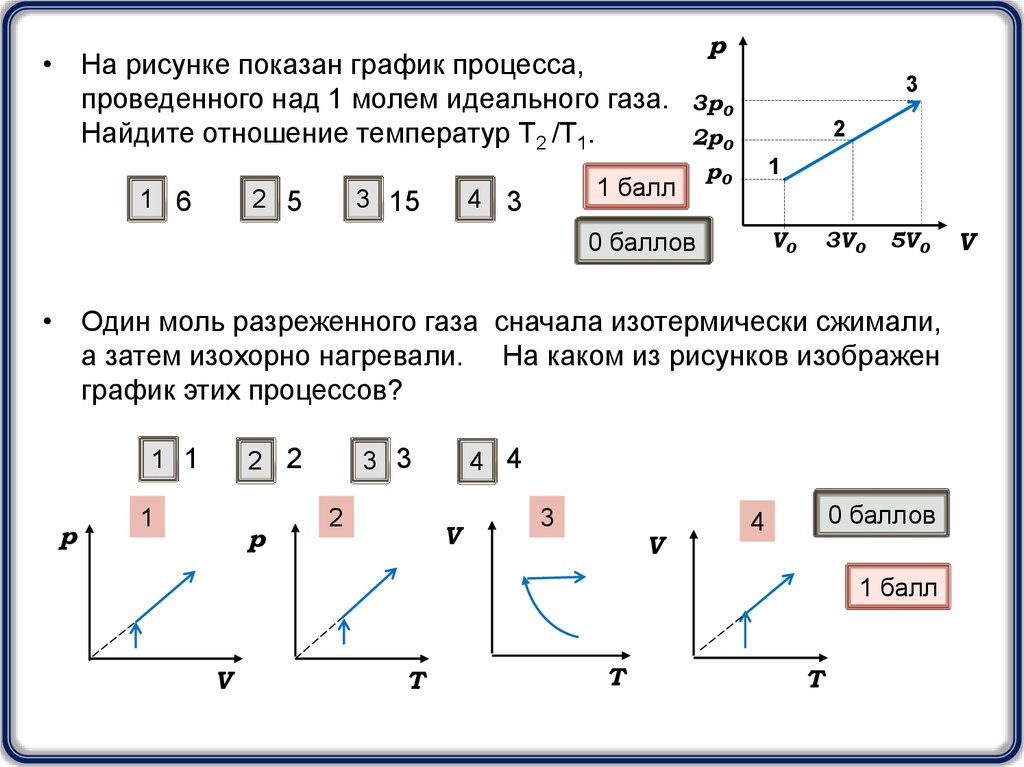
• На рисунке показан график процесса,проведенного над 1 молем идеального газа.
Найдите отношение температур Т2 /Т1.
1 6
2 5
3 15
р
2
2р0
1 балл
4 3
3
3р0
р0
1
баллов
00 баллов
V0
3V0
5V0
• Один моль разреженного газа сначала изотермически сжимали,
а затем изохорно нагревали. На каком из рисунков изображен
график этих процессов?
1 1
р
2 2
1
р
3 3
2
4 4
V
3
V
0 баллов
4
1 балл
V
Т
Т
Т
V
14.
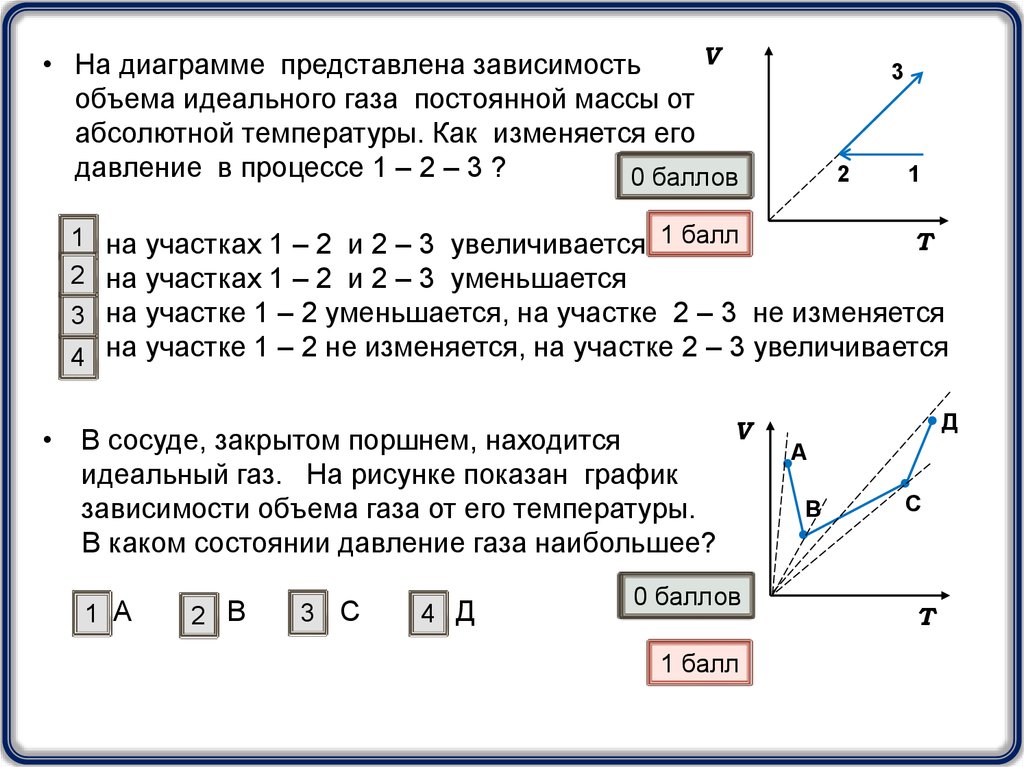
V• На диаграмме представлена зависимость
объема идеального газа постоянной массы от
абсолютной температуры. Как изменяется его
давление в процессе 1 – 2 – 3 ?
баллов
00 баллов
3
2
1
1 на участках 1 – 2 и 2 – 3 увеличивается 1 балл
Т
2 на участках 1 – 2 и 2 – 3 уменьшается
3 на участке 1 – 2 уменьшается, на участке 2 – 3 не изменяется
4 на участке 1 – 2 не изменяется, на участке 2 – 3 увеличивается
• В сосуде, закрытом поршнем, находится
идеальный газ. На рисунке показан график
зависимости объема газа от его температуры.
В каком состоянии давление газа наибольшее?
1 А
2 В
3 С
4 Д
V
баллов
00 баллов
1 балл
Д
А
В
С
Т
15.
• Разреженный углекислый газ изобарно сжимается. Масса газапостоянна. Как надо изменить абсолютную температуру газа, чтобы
уменьшить его объем в 4 раза?
0 баллов
1
повысить в 16 раз
3 понизить в 16 раз
2
повысить в 4 раза
4 понизить в 4 раза
1 балл
• В цилиндрическом сосуде под поршнем находится идеальный
газ, давление которого 4 х 105 Па и температура 300 К. Как надо
изменить объем газа, не меняя его температуры, чтобы
давление увеличилось до 0,8 х 106 Па?
0 баллов
0 баллов
1 увеличить в 2 раза
3 уменьшить в 2 раза
2 увеличить в 4 раза
4 уменьшить в 4 раза
0 баллов
1 балл
• Давление 3 моль водорода в сосуде при температуре 300 К равно р1.
Каково давление 1 моль водорода в этом сосуде при вдвое большей
температуре?
0 баллов
1 3/2р1
2 2/3 р1
3 1/6 р1
4 6р1
1 балл
16.
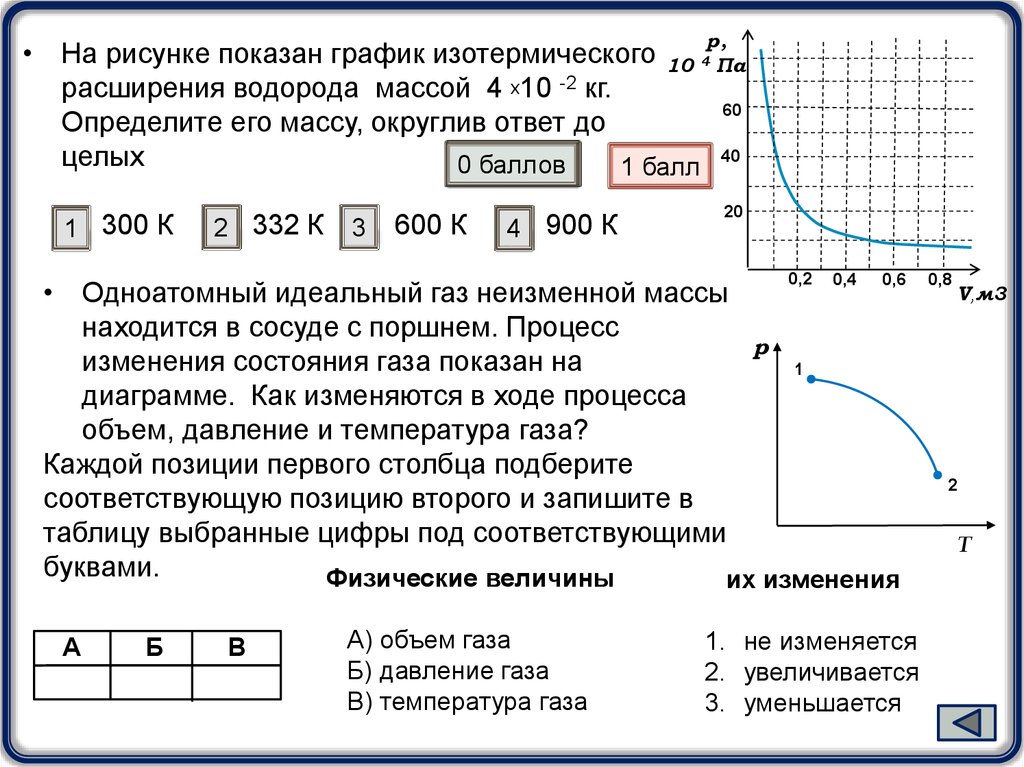
р,• На рисунке показан график изотермического 10 4 Па
расширения водорода массой 4 х10 -2 кг.
60
Определите его массу, округлив ответ до
40
целых
0 баллов
1 балл
1 300 К
2 332 К
3
600 К
4 900 К
20
0,2
0,4
0,6
• Одноатомный идеальный газ неизменной массы
находится в сосуде с поршнем. Процесс
р
изменения состояния газа показан на
1
диаграмме. Как изменяются в ходе процесса
объем, давление и температура газа?
Каждой позиции первого столбца подберите
соответствующую позицию второго и запишите в
таблицу выбранные цифры под соответствующими
буквами.
Физические величины
их изменения
А
Б
В
А) объем газа
Б) давление газа
В) температура газа
1. не изменяется
2. увеличивается
3. уменьшается
0,8
V,м3
2
Т
17.
Использованная литература• Физика : Учеб. для 10 кл. общеобразоват. учреждений / Г.Я.Мякишев,
Б.Б. Буховцев, Н.Н.Сотский. – 12-е изд. – М. : Просвещение, 2004 .
• ЕГЭ 2011. Физика. Универсальные материалы для подготовки
учащихся / ФИПИ – М. : Интеллект – Центр. 2011.
• Самое полное издание типовых вариантов ЕГЭ: 2011, 2012 : Физика /
авт. – сост. А.В.Берков, В.А.Грибов. – М.: АСТ: Астрель, 2011, 2012.
• Портреты ученых – страницы свободного доступа сети интернет
• Рекомендации по использованию триггеров в тестовых заданиях даны
Г.Ф.Кузнецовым.




 Физика
Физика








