Похожие презентации:
Водород. Свойства водорода
1.
ХИМИЯ8 класс
Водород
Мария Дмитриевна Смирнова
Smirnova@sch2101.ru
Vk.com/masha2101
1
2.
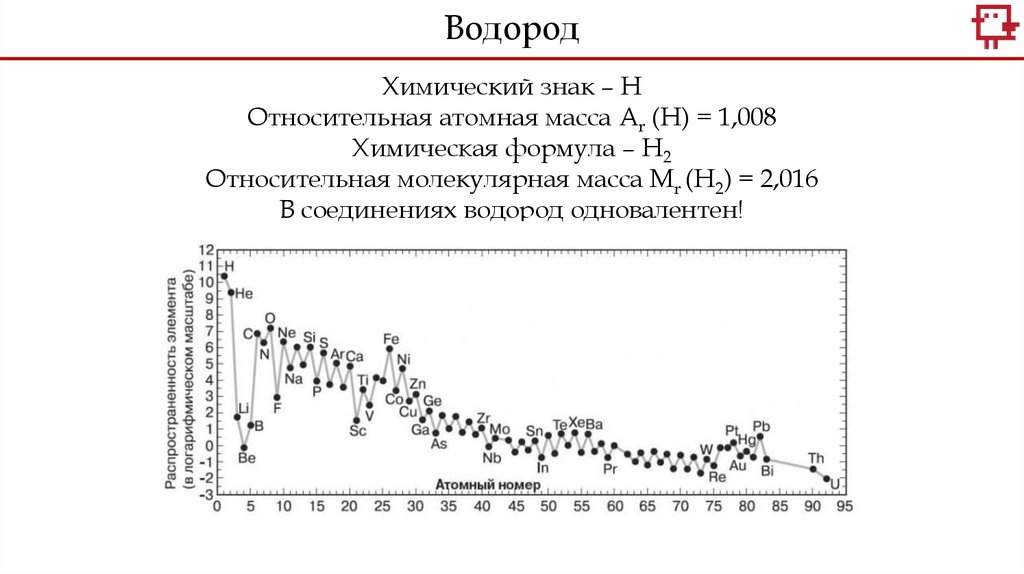
ВодородХимический знак – Н
Относительная атомная масса Аr (Н) = 1,008
Химическая формула – Н2
Относительная молекулярная масса Мr (Н2) = 2,016
В соединениях водород одновалентен!
3.
ВодородПолучение водорода:
2H2O (ж) = 2H2(г) + O2(г) – 484 кДж
В лабораторных условиях водород проще получать при
взаимодействии некоторых металлов с кислотами, обычно
используют цинк и соляную кислоту:
Zn + 2HCl = ZnCl2 + H2
В промышленности водород получаются из
природного газа CH4 или из воды.
4.
ВодородВодород – бесцветный самый легкий газ.
Растворимость водорода в воде крайне мала.
Температура сжижения -252,8С
5.
Химические свойстваВодород соединяется с кислородом…
Гремучей газ – смесь двух объёмов водорода и одного объёма
кислорода.
Водород взаимодействует с оксидами некоторых металлов:
H2 + CuO = H2O + Cu
6.
Химические свойстваВодород взаимодействует с оксидами некоторых металлов:
H2 + CuO = H2O + Cu
При обычной температуре:
H2 + F2 = 2HF + 547кДж
На свету:
H2 + Cl2 = 2HCl(г) + 185 кДж
7.
Химические свойстваПро свет.
Для света характерен корпускулярно-волновой дуализм.
8.
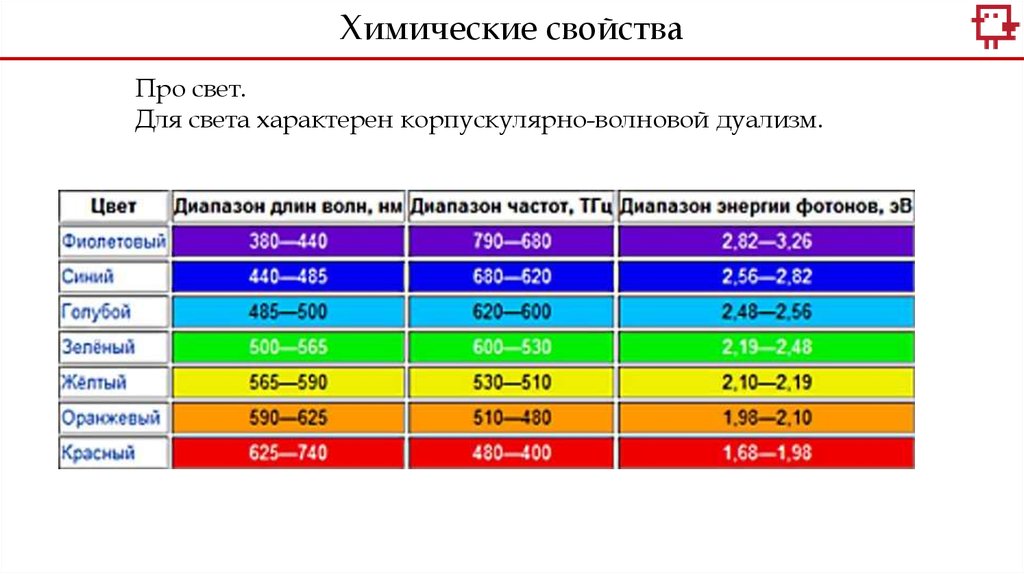
Химические свойстваПро свет.
Для света характерен корпускулярно-волновой дуализм.
9.
Химические свойстваНа свету:
H2 + Cl2 = 2HCl(г) + 185 кДж
Посмотрим схему реакции:
Cl2 + hν = 2Cl
(происходит «разложение» газа хлора на атомы)
Cl + H2 = HCl + H
(H тоже в виде атома)
H + Cl2 = HCl + Cl
и т.д.
Семёнов Николай
Николаевич
10.
Химические свойстваПри реакции с простыми веществами образуются гидриды:
2Li + H2 = 2LiH (гидрид лития)
Гидриды взаимодействуя с водой образуют щёлочь и водород:
NaH + H2O = NaOH + H2
При нагревании гидриды до температуры плавления:
2KH = 2K + H2
11.
Получение в промышленностиПолучение водорода.
В промышленности.
Электролиз водных растворов солей.
2H2O = H2 + O2
Пропускание паров воды над раскалённым углём при температуре 1000С.
CO + H2O(пар) = CO2 + H2
Получение из природного газа.
СH4 + H2O = CO + 3H2
Крекинг и риформинг углеводородов.
12.
Получение в лабораторииПолучение водорода.
В лаборатории.
Получение водорода действием разбавленных кислот на металлы.
Zn + 2HCl = ZnCl2 + H2
Действие щелочей на цинк или алюминий.
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
Гидролиз гидридов.
KH + H2O = KOH + H2
Взаимодействие кальция с водой.
Ca + 2H2O = Ca(OH)2 + H2









 Химия
Химия








