Похожие презентации:
Водород. Химические свойства
1.
Презентация к уроку химии«ВОДОРОД»
к учебнику О.С. Габриеляна
9 класс
2.
Тема урока«ВОДОРОД»
3.
Цель урока: систематизация иразвитие знаний учащихся о
водороде как химическом элементе
и простом веществе,
освойствах водорода, способах его
получения.
4.
В день, когда его запасы иссякнут, жизнь воВселенной прекратится. Погаснут солнца,
не станет воды... Вещество, без которого
жизнь невозможна, «сидит» в самом центре
нашей планеты — в ядре и вокруг него, и
оттуда «мигрирует» наружу.
Этот газ — начало всех начал.
Его название — «водород».
5.
6.
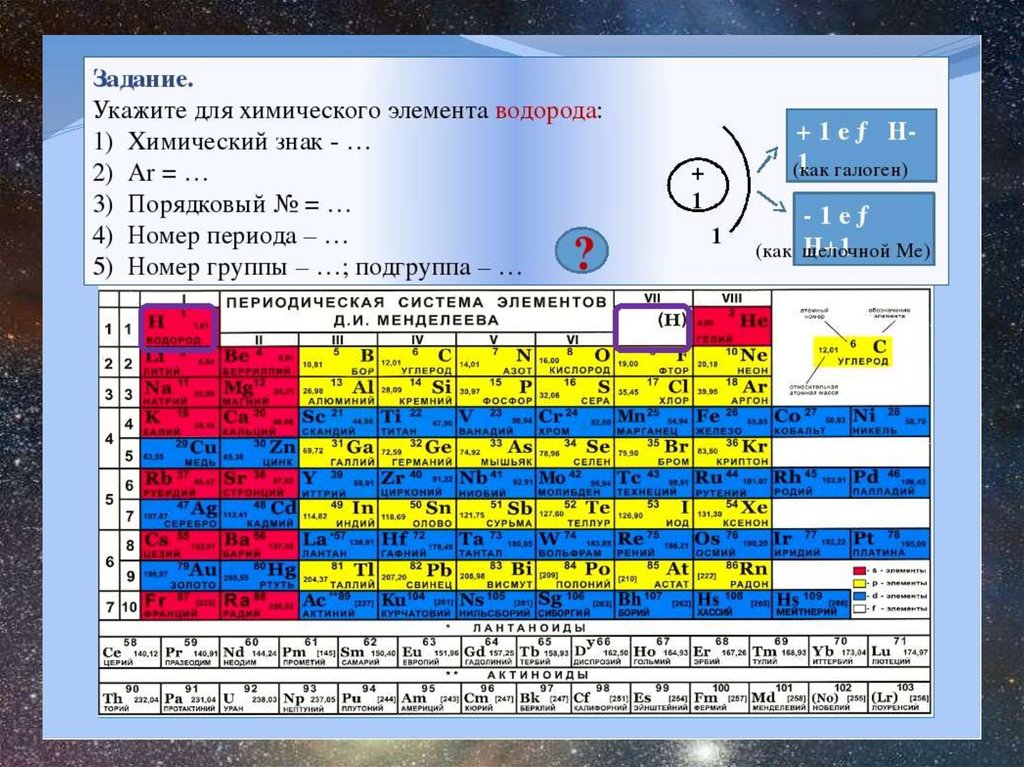
Химический элемент• Порядковый номер
• Группа
• Период
• Электронная формула
• Степень окисления
?
7.
8.
9.
Химические свойстваСтроение атома 1 1 Н) 1 1s
Находится в первом периоде первой группе таблицы
Д.И.Менделеева, так как на внешнем слое у него один электрон и
он его отдает, проявляя степень окисления +1, и в седьмой
группе, как галогены, до завершения уровня не хватает одного
электрона и водород может взять его, проявляя при этом степень
окисления -1.
10.
Водород как простое веществоХимические свойства.
I. Восстановительные свойства водорода:
Горение водорода
2Н2 + О2 = 2Н2О
Взаимодействие с неметаллами
3H2 + N2 = 2NH3
H2 + Cl2 = 2HCl
C+ 2H2 = CH4
11.
Водород как простое веществоХимические свойства.
Взаимодействие с неметаллами
H2 + F2 = 2HF (взрыв даже в темноте)
H 2 + S = H2 S
Восстановление металлов из их оксидов
H2 + CuO = Cu + H2O
12.
Водород как простое веществоХимические свойства.
II. Окислительные свойства водорода:
Взаимодействие с металлами
H2 + 2Na = 2NaH
H2 + Ca = CaH2
13.
14.
Получение водорода1) В лаборатории:
Цинк и разбавленная серная кислота
Zn + 2HCl = ZnCl2 + H2
2) В промышленности:
Взаимодействием угля с водой
С + Н2О = СО + Н2
Метана с водой
СН4 + Н2О = СО + 3Н2
Электролизом воды
2Н2О = 2Н2 + О2
15.
16.
117.
18.
В продажу водород поступает вбаллонах под давлением свыше 150
атм. Они окрашены в тёмнозелёный цвет и снабжаются красной
надписью "Водород".


















 Химия
Химия








