Похожие презентации:
Алкины. Общая характеристика, гомологический ряд, номенклатура, изомерия. Методы синтеза алкенов. Лекция №4
1. Лекция №4 Тема: «Алкины» План: 1. Общая характеристика,гомологический ряд,номенклатура ,изомерия. 2. Методы синтеза алкенов. 3.
Лекция №4План:
1. Общая характеристика,гомологический
ряд,номенклатура ,изомерия.
2. Методы синтеза алкенов.
3. Физические свойства
4. Химические свойства:
а) реакции присоединения;
б) реакции замещения;
в)реакции окисления;
в) реакции полимеризации;
5.Отдельные представители алкинов.
2. 1. Общая характеристика,гомологический ряд,номенклатура ,изомерия.
Ацетиленовымиуглеводородами
(алкинами)
называются
непредельные
(ненасыщенные)
углеводороды, содержащие в молекуле одну тройную
связь.
CnH2n-2
Общая формула
Родоначальником гомологического ряда этих
углеводородов является ацетилен HC≡CH.
В молекуле алкинов ненасыщенные атомы углерода
находятся в третьем валентном состоянии sp –
гибридизации и связаны тройной связью: 1σ – связь
и 2π – связь.
3.
Формулы ацетилена (этина)4. Гомологический ряд
Этин: C2H2Пропин: C3H4
Бутин: C4H6
Пентин: C5H8
Гексин: C6H10
Гептин: C7H12
Октин: C8H14
Нонин: C9H16
Децин: C10H18
5. Номенклатура
1. Систематическая (международная) номенклатура:а) выбираем длинную цепочку с тройной связью;
б) нумеруем цепочку с той стороны, где ближе тройная связь;
в) называем радикалы;
г) называем цепочку, окончание – ан меняем на –ин;
д) в конце цифрой указываем место тройной связи.
1
2
3
4
5
СН3- С ≡ С – СН - СН3
СН3
4 –метилпентин - 2
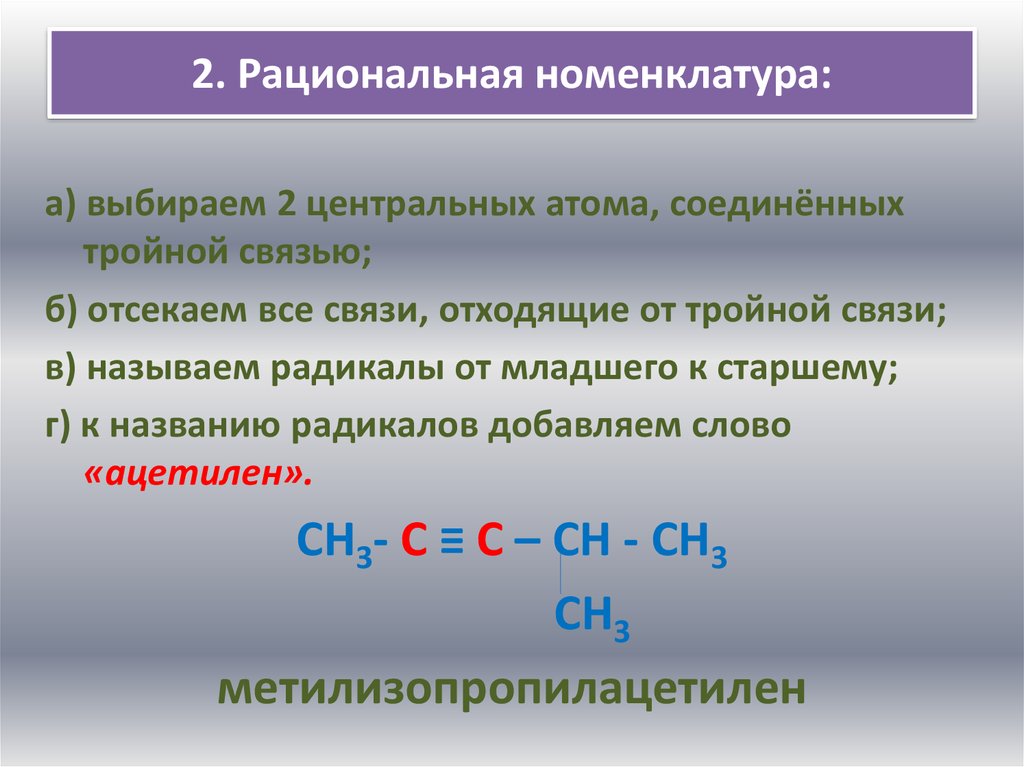
6. 2. Рациональная номенклатура:
а) выбираем 2 центральных атома, соединённыхтройной связью;
б) отсекаем все связи, отходящие от тройной связи;
в) называем радикалы от младшего к старшему;
г) к названию радикалов добавляем слово
«ацетилен».
СН3- С ≡ С – СН - СН3
СН3
метилизопропилацетилен
7. Изомерия Алкинам свойственна изомерия углеродного скелета (начиная с C5H8), изомерия положения тройной связи (начиная с C4H6) и
межклассоваяизомерия с алкадиенами.
Изомерия положения тройной связи :
1
2
3
4
СН ≡С - СН2 - СН3
1
2
3
бутин - 1
4
СН3 - С ≡ С - СН3
бутин - 2
8. 2. Методы синтеза алкенов.
1.Разложением водой карбида кальцияСаС2,который получают спеканием
негашеной извести СаО с коксом:
СаО + 3C 2500°C CaC2 + CO
СаС2 + 2Н2O → НС ≡ СН + Са(ОН)2
9.
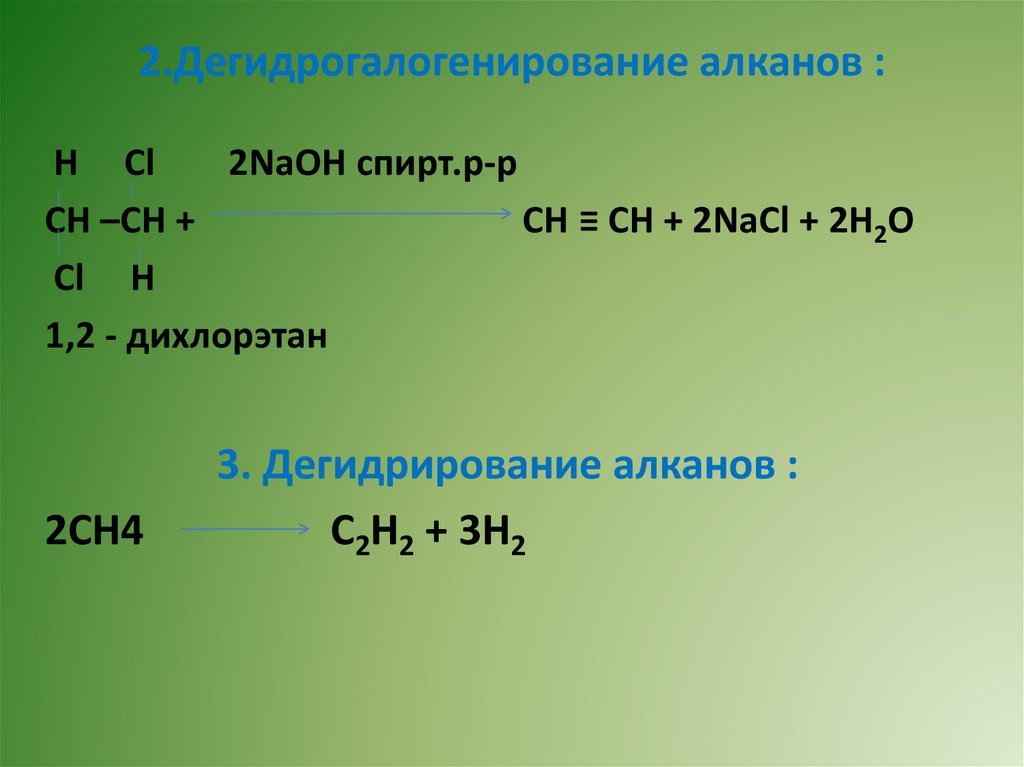
2.Дегидрогалогенирование алканов :Н Сl
2NaOH спирт.р-р
СН –СН +
СН ≡ СН + 2NaСl + 2Н2О
Сl Н
1,2 - дихлорэтан
2СН4
3. Дегидрирование алканов :
С2Н2 + 3Н2
10. 3. Физические свойства алканов
• Ацетиленовые углеводороды,содержащие в молекуле от двух
до четырех углеродных атомов
(при обычных условиях), — газы,
• начиная с C5H8 — жидкости,
• а высшие алкины (с С16Н30 и
выше) — твердые вещества.
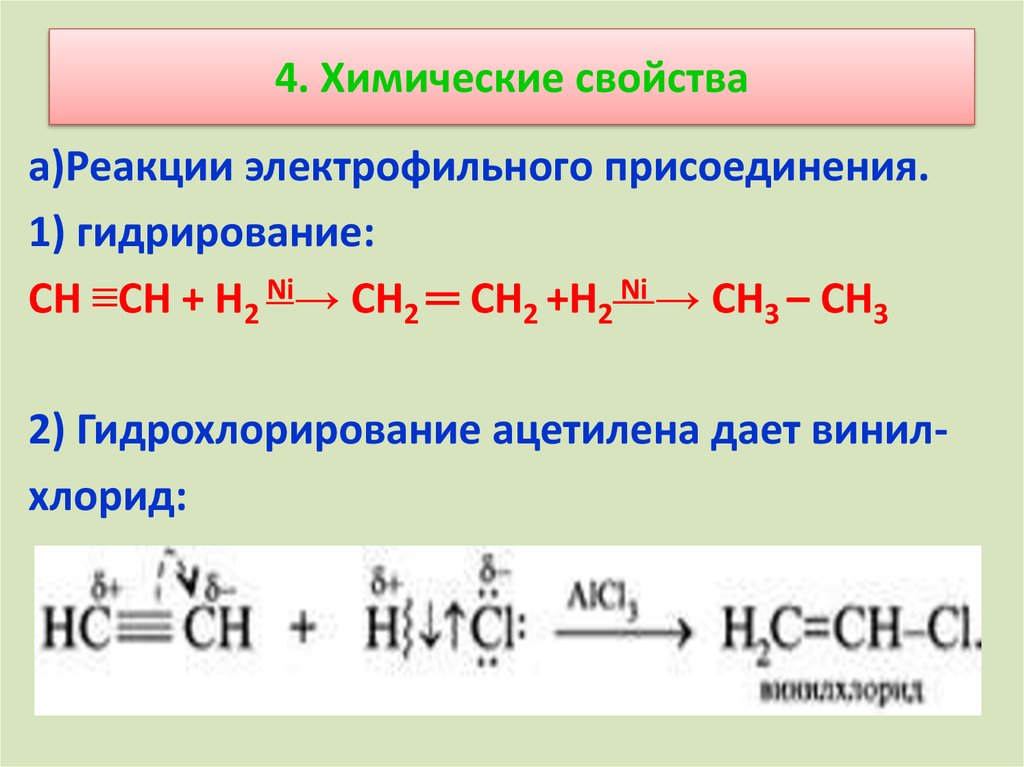
11. 4. Химические свойства
а)Реакции электрофильного присоединения.1) гидрирование:
СН ≡СН + Н2 Ni→ СН2 ═ СН2 +Н2 Ni → СН3 – СН3
2) Гидрохлорирование ацетилена дает винилхлорид:
12.
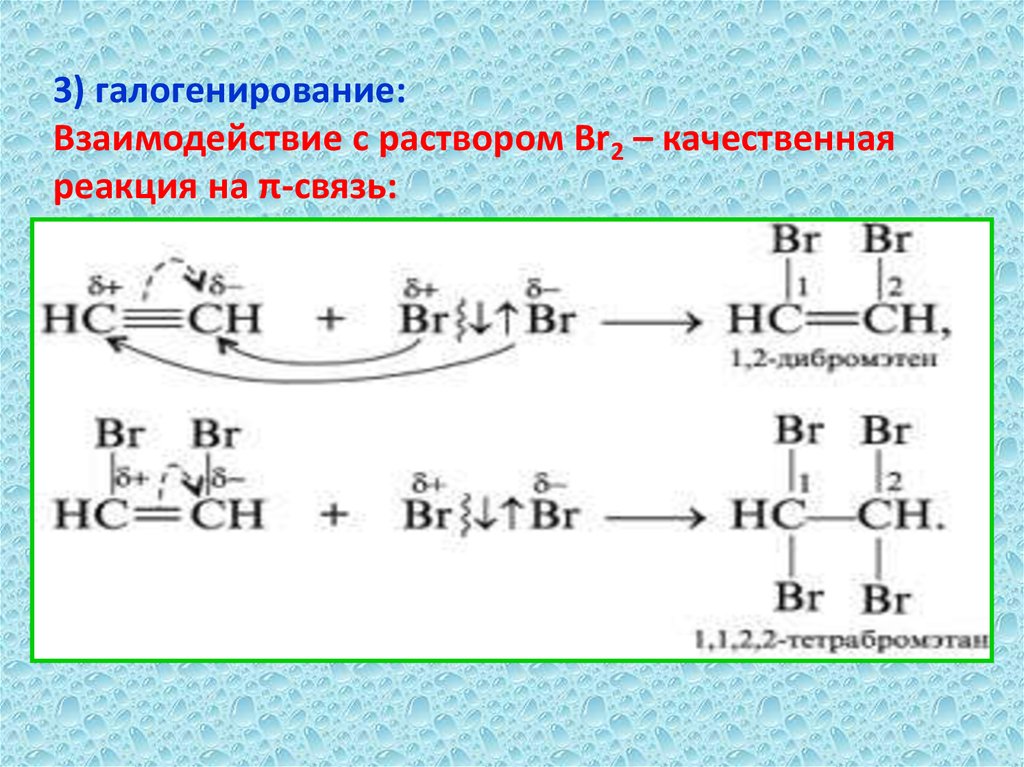
3) галогенирование:Взаимодействие с раствором Br2 – качественная
реакция на π-связь:
13.
4) Гидратация ацетилена по Кучерову (1881):Отличительной чертой алифатических ненасыщенных
соединений, содержащих гидроксильную группу при двойной
связи, явл. их неустойчивость. В момент образования они
изомеризуются в более стабильные соединения – альдегиды или
кетоны. Эта закономерность носит название правила Эльтекова,
по имени русского ученого.
Изомеризация состоит в том, что протон гидроксильной группы
переходит к соседнему атому С при 2-ной связи с разрывом πсвязи между атомами углерода и образованием её между
атомами С и О.
14.
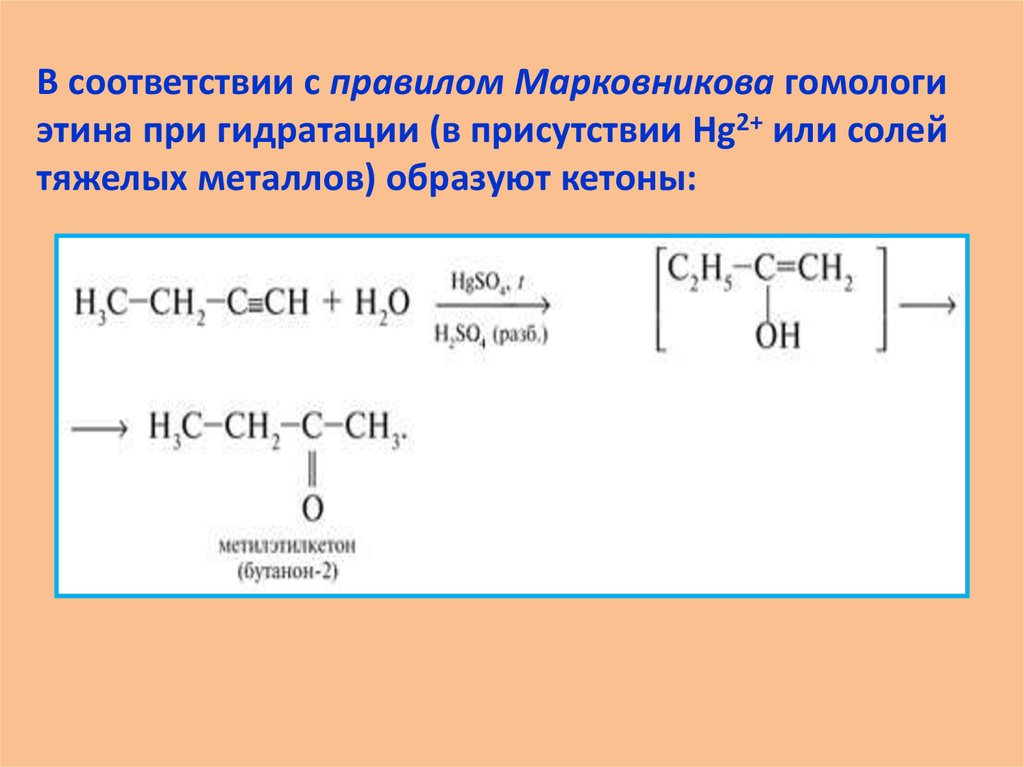
В соответствии с правилом Марковникова гомологиэтина при гидратации (в присутствии Hg2+ или солей
тяжелых металлов) образуют кетоны:
15. б). Реакции замещения
Особенностью алкинов, явл. их способность отщеплять протон по действием сильных оснований,т.е. проявлять слабые кислотные свойства.
Возможность отщепления протона обусловлена
сильной поляризацией σ- связи =С←Н. Причиной
поляризации явл. высокая электроотрицательность
атома С в состоянии sp –гибридизации. Алкины в
отличии от алкенов способны обр. соли - ацетилениды
+2[Ag(NН3)2]ОН
НС ≡ СН
AgС=СAg↓ + 4NН3 ↑+ 2Н2О
желто-серый, ацетиленид серебра
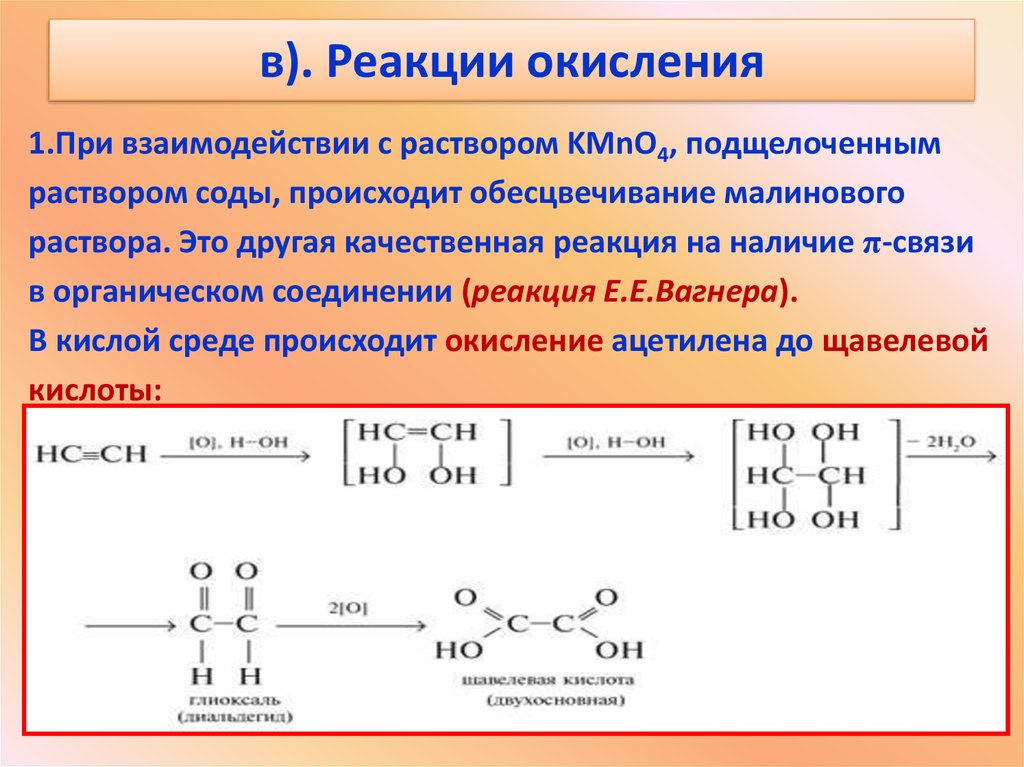
16. в). Реакции окисления
1.При взаимодействии с раствором KMnО4, подщелоченнымраствором соды, происходит обесцвечивание малинового
раствора. Это другая качественная реакция на наличие π-связи
в органическом соединении (реакция Е.Е.Вагнера).
В кислой среде происходит окисление ацетилена до щавелевой
кислоты:
17. 2. Окисление алкинов в более жёстких условиях:
1)СН ≡ СН + 2KMnО4 + 3Н2SО4К2SО4 +2MnSО4
2СО2 + Н2О +
[о]
2)СН3-С ≡ С - СН3
бутин-2
MnSО4
2СН3-СООН + К2SО4+Н2О +
18. г). Реакции полимеризации
Как и алкены, алкины вступают в реакциюполимеризации. Полимеризация этина и его гомологов в зависимости от применяемого катализатора проходит по-разному.
Димеризация:
19.
Вследствие более высокой электроотрицательностиsp-гибридного атома С по сравнению с sp2-гибридным
атомом С электронная плотность в молекуле димера
смещена в сторону тройной связи. Именно по тройной
связи в первую очередь идут реакции присоединения:
20.
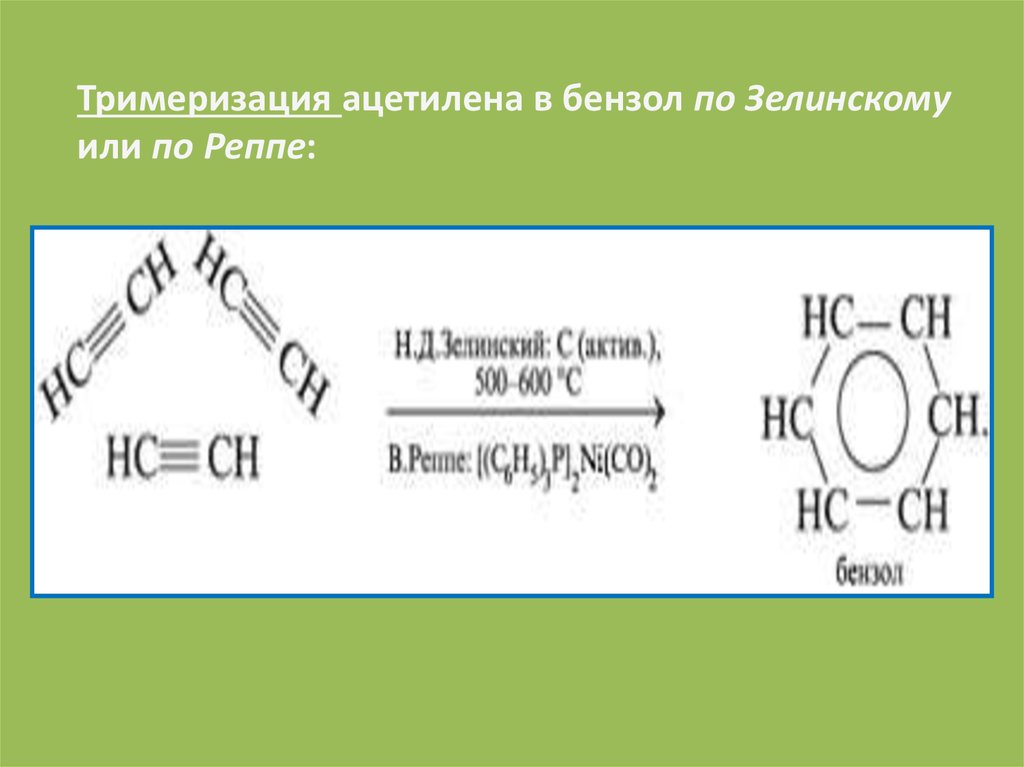
Тримеризация ацетилена в бензол по Зелинскомуили по Реппе:
21. 5. Отдельные представители алкинов
Наибольшее практическое значение имеют ацетиленH–C ≡ C–H и винилацетилен CH2= CH–C ≡ CH.
Ацетилен (С2Н2) – бесцветный газ, без запаха, обладает слабым наркотическим свойством, мало
растворим в воде ,хорошо в ацетоне. Смеси ацетилена с воздухом взрывоопасны. При горении ацетилена в кислороде выделяется большое количество тепла и температура пламени достигает 30000С. На этом
основано применение ацетилена для резки и сварки
металлов. Ацетилен является исходным сырьем для
производства уксусной кислоты, синтетических
каучуков.
22.
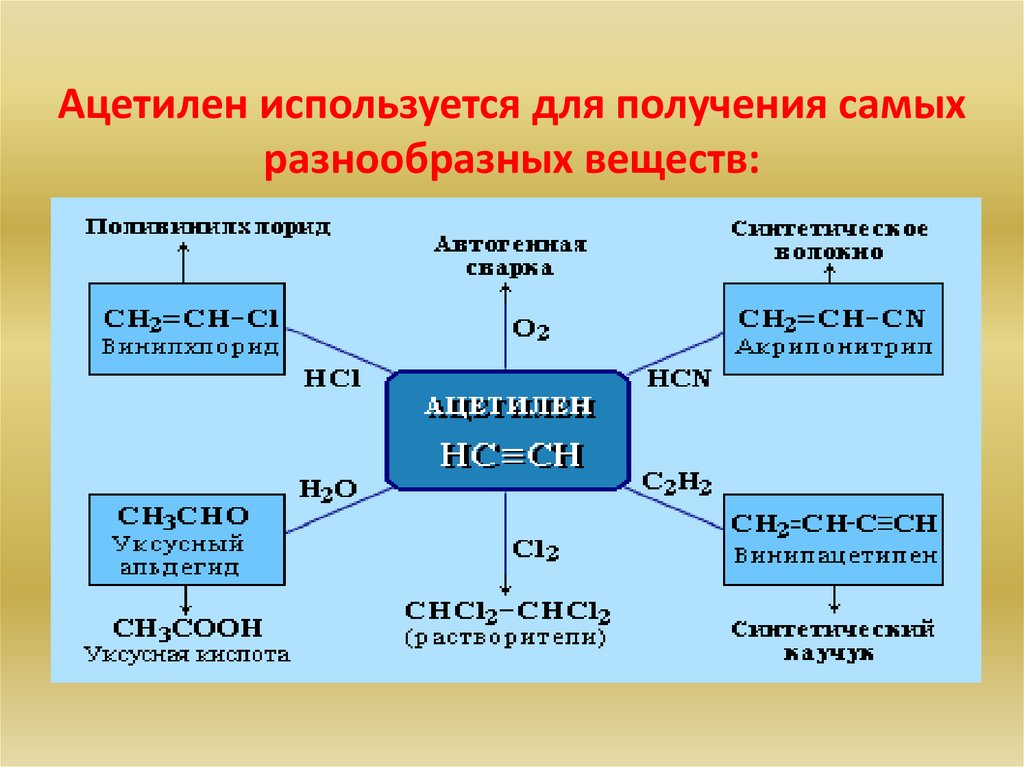
Ацетилен используется для получения самыхразнообразных веществ:
23.
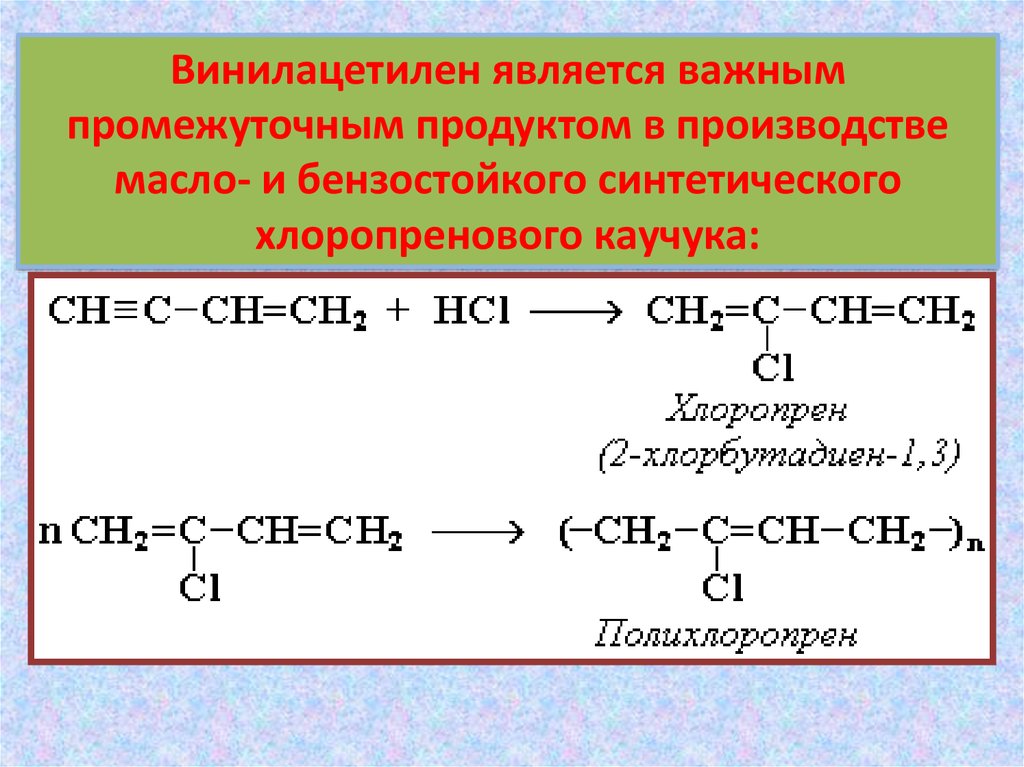
Винилацетилен является важнымпромежуточным продуктом в производстве
масло- и бензостойкого синтетического
хлоропренового каучука:














 Химия
Химия








