Похожие презентации:
Кремний и его соединения. Силикатная промышленность
1.
Кремний и его соединения.Силикатная промышленность
2.
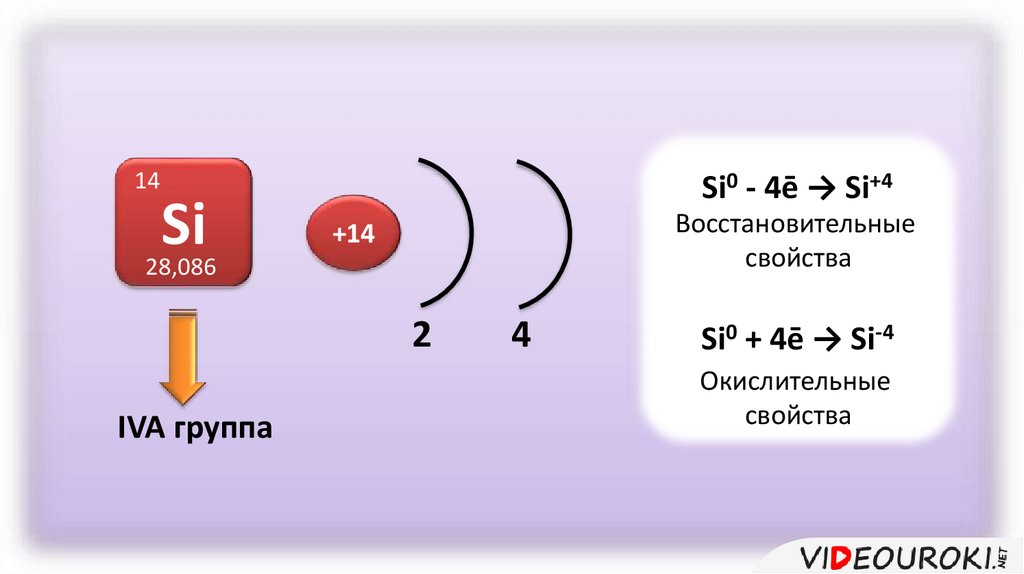
14Si
28,086
Si0 - 4ē → Si+4
Восстановительные
свойства
+14
2
IVA группа
4
Si0 + 4ē → Si-4
Окислительные
свойства
3.
SiO2Состав земной коры
О
7%
Si
Al
18%
Остальные
оксид кремния (IV)
кремнезём
горный
хрусталь
топаз
аметист
опал
халцедон
агат
яшма
сердолик
49%
26%
4.
Природные силикаты – сложные вещества.Алюмосиликаты – силикаты, в состав которых входит
алюминий.
Al2O3 · 2SiO2 · 2H2O
K2O · Al2O3 · 6SiO2
K2O · Al2O3 · 6SiO2 · 2H2O
5.
6.
Из разновидностей минералов на основе оксида кремния (IV)первобытные люди изготавливали орудия труда.
7.
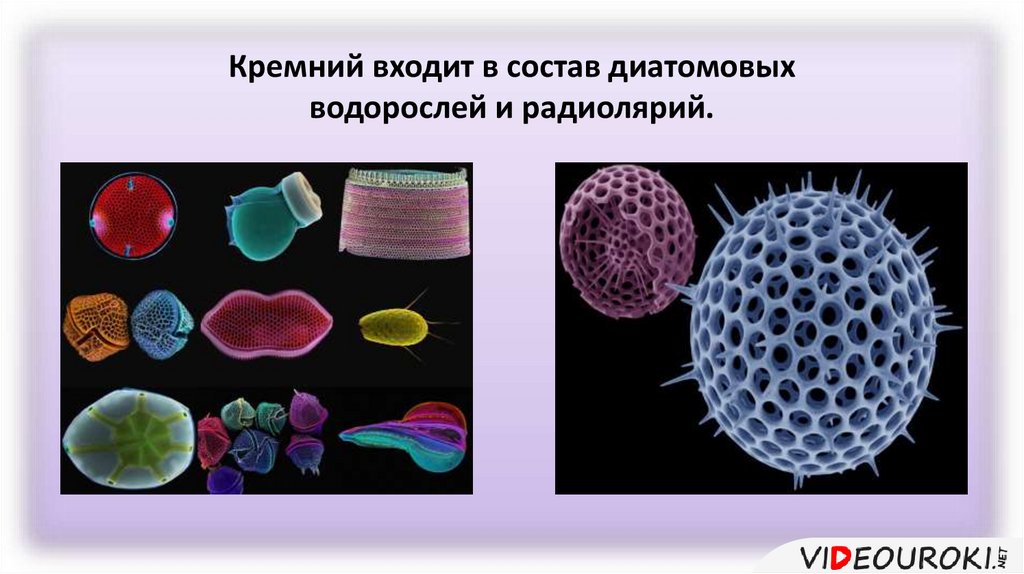
Оксид кремния (IV) у растений и животных8.
Кремний входит в состав диатомовыхводорослей и радиолярий.
9.
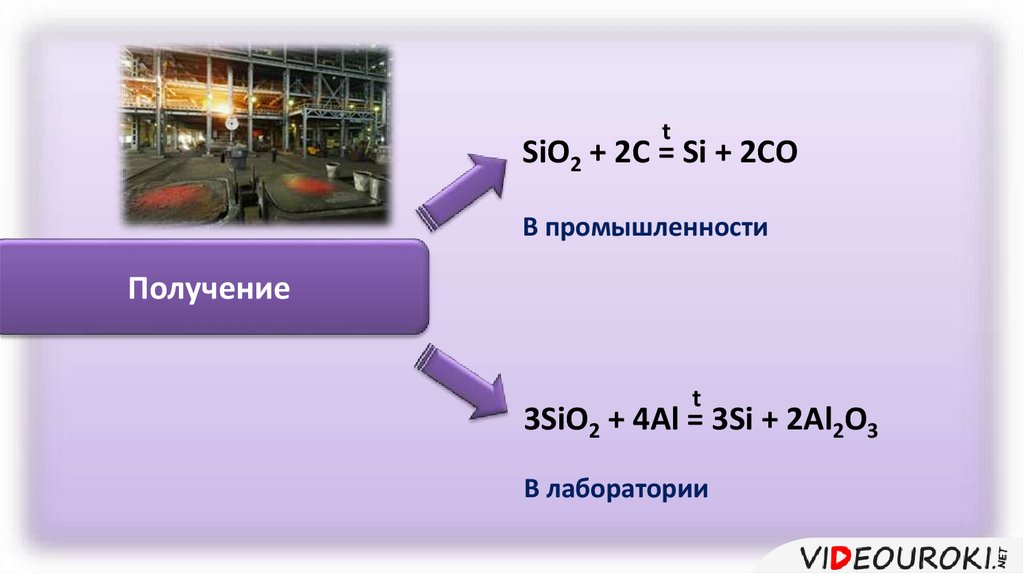
tSiO2 + 2C = Si + 2CO
В промышленности
Получение
t
3SiO2 + 4Al = 3Si + 2Al2O3
В лаборатории
10.
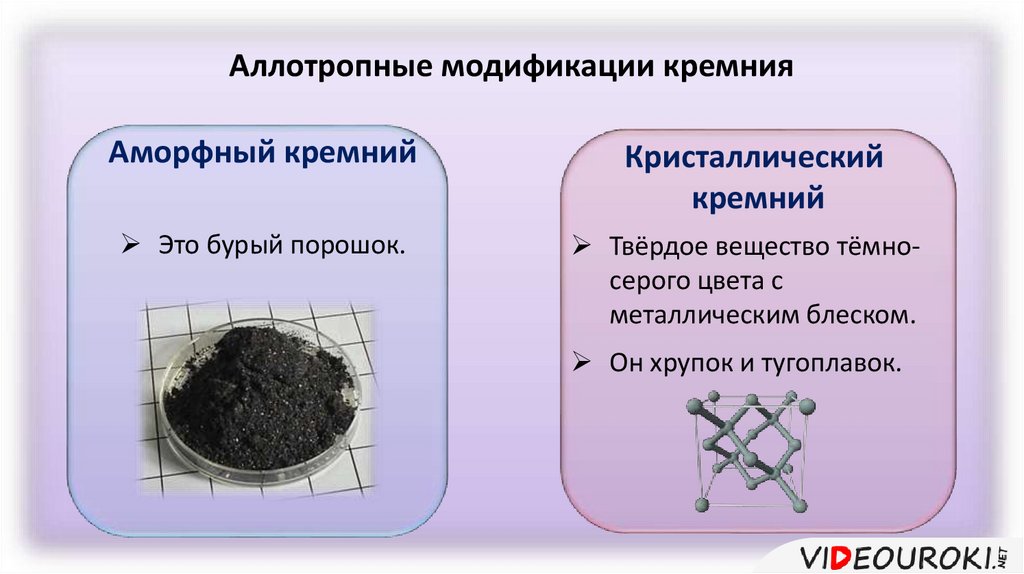
Аллотропные модификации кремнияАморфный кремний
Это бурый порошок.
Кристаллический
кремний
Твёрдое вещество тёмносерого цвета с
металлическим блеском.
Он хрупок и тугоплавок.
11.
12.
Химические свойства кремнияРеакция с кислородом
0
0
t +4 -2
Si + O2 = SiO2
Восст-ль Ок-ль оксид
кремния (IV)
Реакции с оксидами
металлов
t
2MgO + Si = 2Mg + SiO2
Восст-ль
13.
Химические свойства кремнияРеакции с металлами
0
0 t +2 -4
2Mg + Si = Mg2Si
Восст-ль Ок-ль силицид
магния
Реакция силицида с
кислотой
Mg2Si + 4HCl = 2MgCl2 + SiH4↑
хлорид
магния
силан
14.
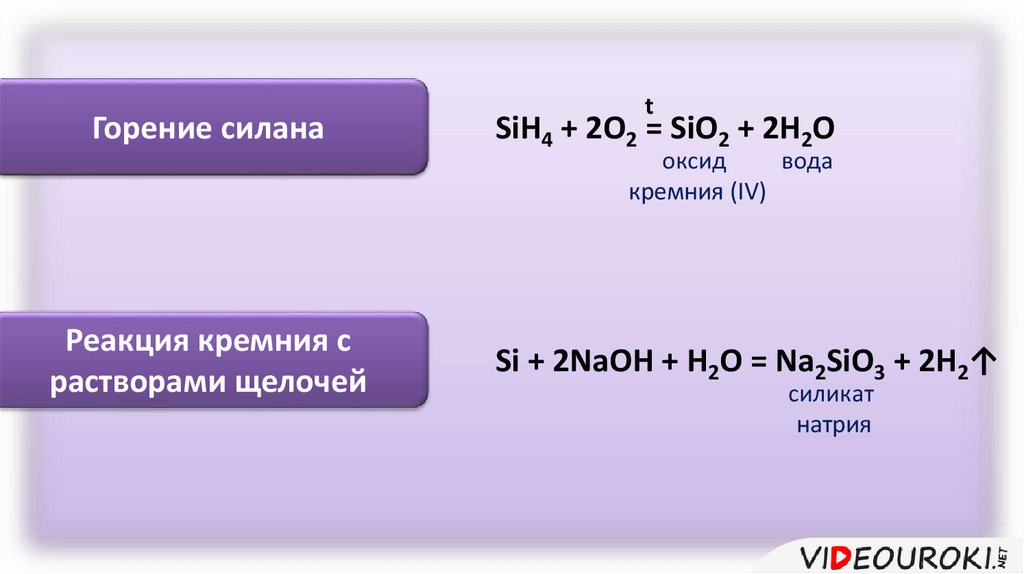
Горение силанаt
SiH4 + 2O2 = SiO2 + 2H2O
оксид
вода
кремния (IV)
Реакция кремния с
растворами щелочей
Si + 2NaOH + H2O = Na2SiO3 + 2H2↑
силикат
натрия
15.
Получение кремнияt
SiO2 + 2Mg = 2MgO + Si
Восст-ль
t
SiO2 + 2С = Si + 2CO↑
Восст-ль
16.
Оксид кремния (IV), кремнезёмSiO2
Это твёрдое, очень тугоплавкое вещество.
Он нерастворим в воде.
Имеет атомную кристаллическую решётку.
17.
Химические свойства оксида кремния (IV)Оксид кремния (IV) не растворяется в воде: SiO2 + H2O ≠
Реакции со щелочами
t
SiO2 + 2NaOH = Na2SiO3 + H2O
силикат
натрия
Реакции с основными
оксидами
t
SiO2 + CaO = CaSiO3
силикат
кальция
18.
Химические свойства оксида кремния (IV)Реакции с карбонатами
t
SiO2 + Na2CO3 = Na2SiO3 + CO2↑
силикат углекислый
газ
натрия
Силикаты натрия и калия называются растворимыми стёклами.
Реакция с HF
t
SiO2 + 4HF = SiF4↑ + 2H2O
фторид
кремния
19.
Химические свойства кремниевой кислотыH2SiO3 Студенистое, нерастворимое в воде вещество.
H2SiO3 Она относится к очень слабым кислотам.
H2SiO3
При высыхании раствора, содержащем кремниевую
кислоту, образуется силикагель.
H2SiO3 Кремниевая кислота – непрочное соединение.
t
H2SiO3 = SiO2 + H2O
20.
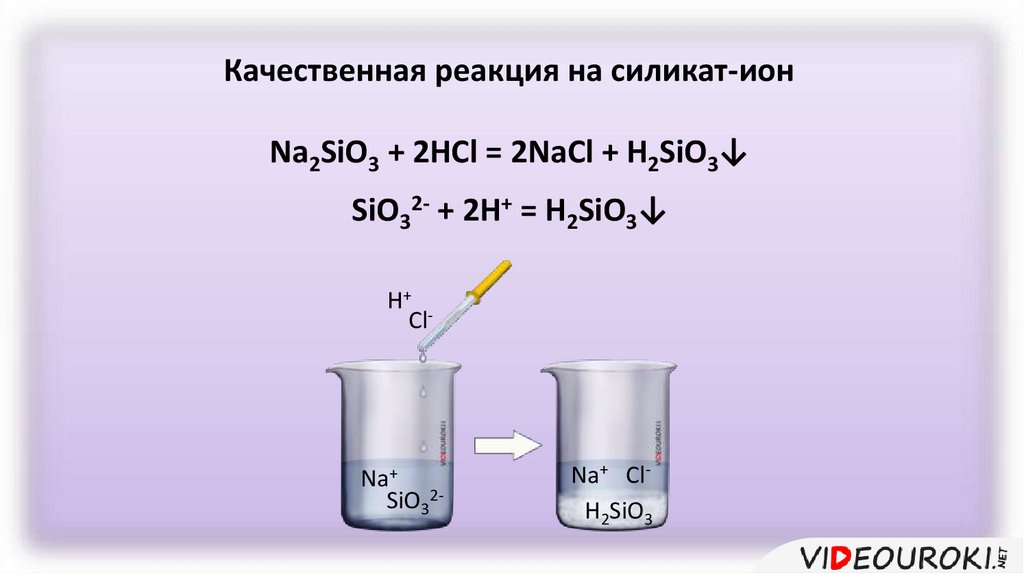
Качественная реакция на силикат-ионNa2SiO3 + 2HCl = 2NaCl + H2SiO3↓
SiO32- + 2H+ = H2SiO3↓
H+ Cl
Na+
SiO32-
Na+ ClH2SiO3
21.
Na2SiO3 + CO2 + H2O = Na2CO3 + H2SiO3↓22.
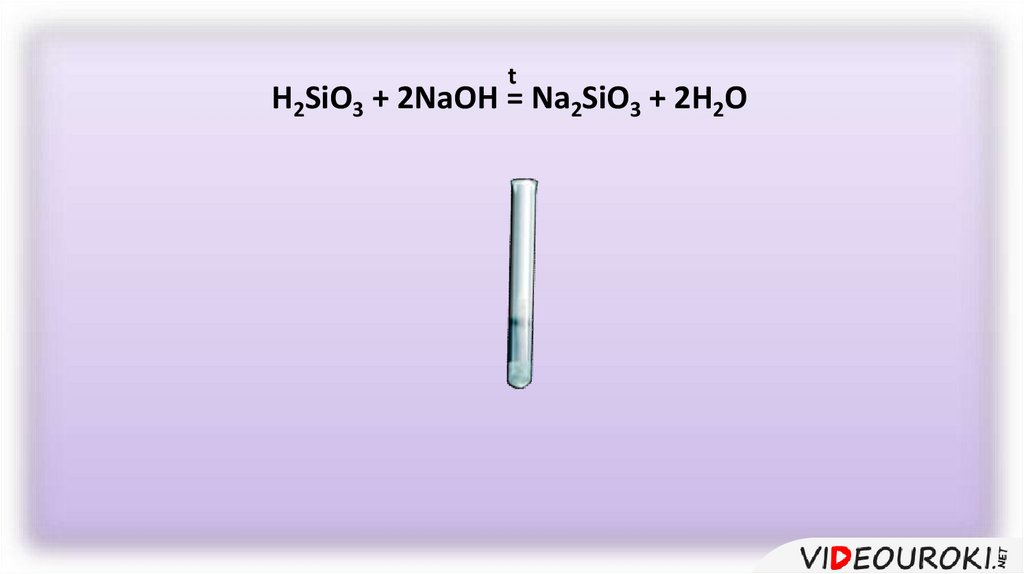
tH2SiO3 + 2NaOH = Na2SiO3 + 2H2O
23.
Применение кремния и его соединений1
4
2
5
3
41 -- «растворимые
получения полупроводниковых
стёкла»
применяют
материаловкак
и кислотоупорных
огнеупорное сплавов
средство для пропитки древесины и
2 - карбид кремния используют для
тканей
затачивания резцов металлорежущих
станков и шлифовки драгоценных
5
- асбест для изготовления
камней
несгораемых и электроизоляционных
3
- из кварца изделий
изготавливают
текстильных
кварцевую химическую посуду
24.
Силикатное производствоСтекло
Керамические
изделия
Цемент
25.
Производство стеклаСода + известняк + песок = оконное стекло
Na2O · CaO · 6SiO2
26.
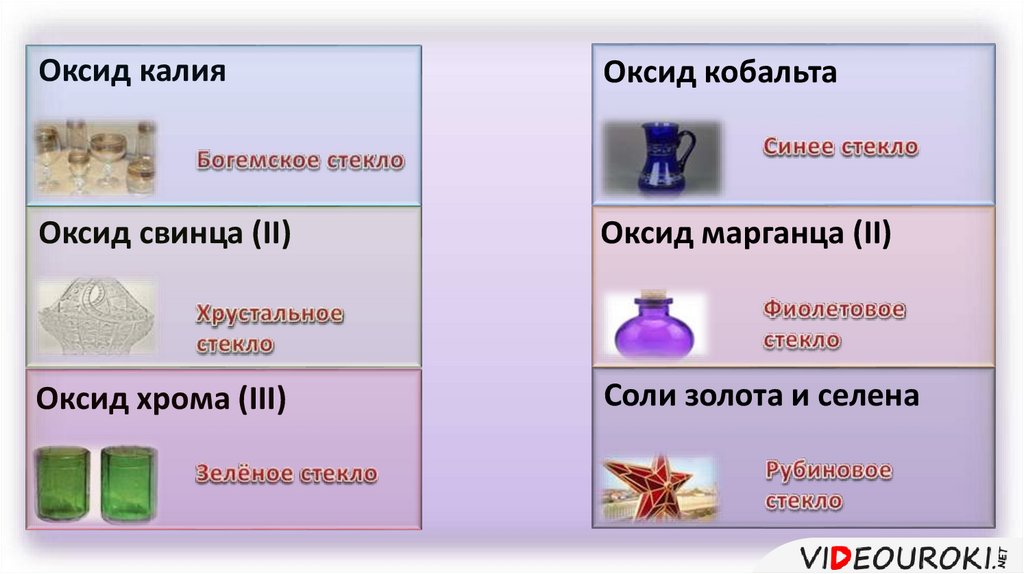
Оксид калияОксид кобальта
Оксид свинца (II)
Оксид марганца (II)
Оксид хрома (III)
Соли золота и селена
27.
28.
Стекло человеку известно давно, уже3-4 тыс. лет назад производство стекла
было в Египте, Сирии, Финикии,
Причерноморье.
29.
Оконное стеклоБутылочное стекло
Ламповое стекло
Зеркальное стекло
Оптическое стекло
30.
31.
32.
Кремний былполучен в
1824 году.
Латинское название силициум от
латинского силекс – «кремень».
Й. Я. Берцелиус
Получили
кремний,
но он был
очень
загрязнён
примесями.
Ж. Гей-Люссак
Л. Тенар
Русское название «кремний»
происходит от греческого кремнос –
«утёс, скала».
33.
Кремний – элемент IVA группы.В соединениях для него характерны степени окисления
+4 и -4.
В реакциях с кислородом и другими неметаллами
кремний проявляет восстановительные свойства, а в
реакциях с металлами – окислительные.
В природе кремний встречается в виде соединений.
Наиболее распространённое его соединение – оксид
кремния (IV) – кремнезём.
34.
Водороднымсоединением
кремния
является
силан –
Оксид
кремния
(IV) и силикаты
находят
широкое
SiH4.
применение
в промышленности.
К
Силан
силикатной
образуется
промышленности
при действии кислот
относятили
производство
воды на
стекла
силициды.
и цемента, керамических изделий и кирпича.
Оксиду кремния (IV) соответствует кремниевая кислота.
Кремниевая кислота слабая двухосновная, студенистая и
нерастворимая в воде.
Качественной реакцией на силикат-ион является
действие сильных кислот на силикаты.


























 Химия
Химия








