Похожие презентации:
Кислоты, их классификация и свойства
1. Кислоты, их классификация и свойства.
2. Кислоты -
сложныехимические
соединения, состоящие из
одного или нескольких атомов
водорода и кислотного остатка.
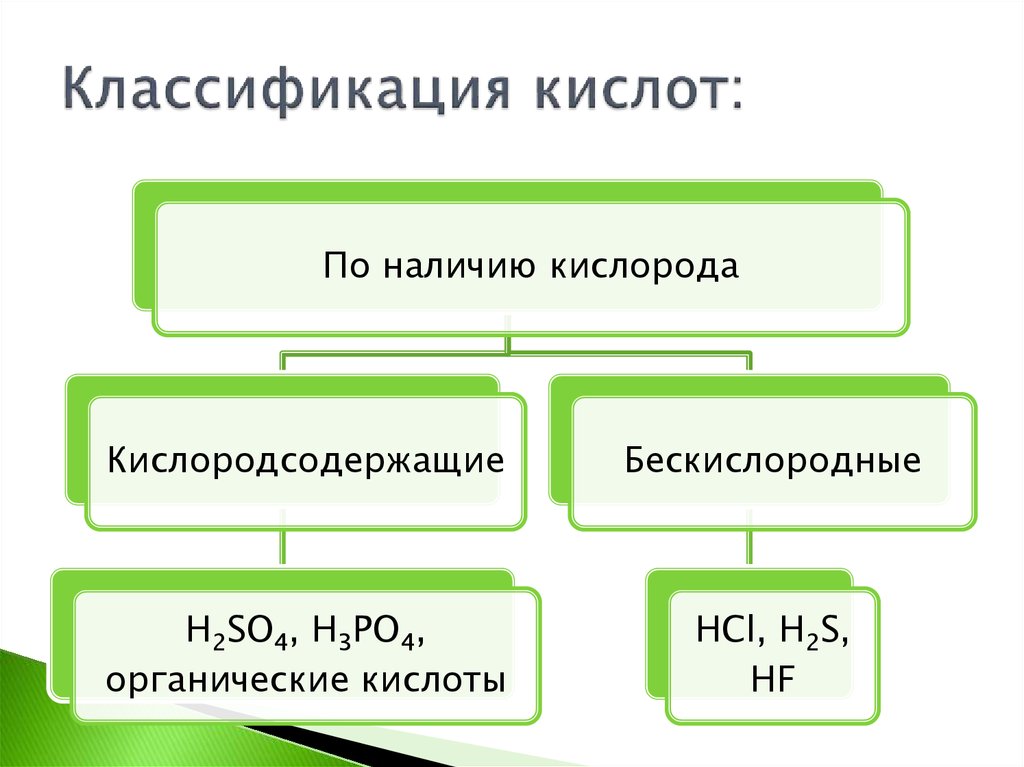
3. Классификация кислот:
По наличию кислородаКислородсодержащие
Бескислородные
H2SO4, H3PO4,
органические кислоты
HCl, H2S,
HF
4. По основности:
А) Одноосновные (HCl, HNO3)Б) Двухосновные (H2SO4, H2SiO3)
В) Трехосновные (Н3РО4)
По растворимости:
А) Растворимые (см. таблицу растворимостей)
Б) Нерастворимые (H2SiO3)
По летучести:
А) Летучие(H2S, HCl)
Б) Нелетучие (H2SO4, H2SiO3)
По степени электролитической диссоциации:
А) Сильные (H2SO4, HNO3)
Б) Слабые (H2SiO3, Н3РО4)
По стабильности:
А) Стабильные (HCl, HNO3)
Б) Нестабильные (H2SO3, H2CO3)
5. Химические свойства кислот:
1) Кислота + основание → соль + вода(реакция обмена, нейтрализации)
А) Растворимое основание:
2NaOH + H2SO4 → Na2SO4 + 2H2O
2Na+ + 2OH- + 2H+ +SO42- → 2Na + + SO42- + 2H2O
2OH- + 2H+ → 2 H2O
Б) Нерастворимое основание:
Ni(OH)2 + H2SO4 → NiSO4 + 2 H2O
Ni(OH)2 + 2H+ +SO42- → Ni 2+ + SO42- + 2H2O
Ni(OH)2 + 2H+ → 2H2O + Ni 2+
6. 2) Кислота + оксид металла → соль + вода (реакция обмена, нейтрализации)
Fe2O3 + 6HCl → 2FeCl3 + 3H2O3) Кислота + металл → соль + H2↑
2HCl + Fe → FeCl2 + H2↑
Правила:
∗ если металлы стоят в ряду
активности от [Mg до водорода;
∗ в результате реакции должна
получаться растворимая соль;
∗ особо взаимодействуют с металлами
HNO3 и концентрированная H2SO4.
7. 4) Соль + кислота → соль + кислота (условие: должен образоваться ↓ или ↑)
2HCl+ Na2SiO3 →H2SiO3↓ + 2NaCl2H+ + 2Cl- + 2Na+ + SiO32- →H2SiO3↓ + 2Na+ + 2Cl2H+ + SiO32- →H2SiO3↓
СаСО3 + H2SO4 → СаSO4 + Н2О + СО2↑
*С солями (н, м) реагируют только сильные
кислоты.
8. Домашнее задание:
§38, № 3, с. 214







 Химия
Химия








