Похожие презентации:
Кислоты. Классификация кислот, их химические свойства
1. Кислоты.
Задачи:Рассмотреть классификацию
кислот, их химические
свойства.
2. Выполните упражнения.
1.2.
3.
4.
Закончите уравнения возможных
реакций. Запишите уравнения в
молекулярном и ионном виде:
NaOH + CuCl2 →
AgNO3 + LiCl →
NaNO3 + HCl →
CaCO3 + H2SO4 →
3. Ответьте на вопросы.
Какие реакции называются ионными?Какие уравнения реакций называются
ионными?
Какие существуют правила написания
ионных уравнений реакций?
4. Кислоты в свете ТЭД.
Кислоты с точки зрения ТЭД – этоэлектролиты, которые при
диссоциации образуют катионы
водорода и анионы кислотного
остатка.
5. Общие свойства кислот.
Кислый вкус.Изменение окраски индикаторов.
Разъедают растительные и
животные ткани.
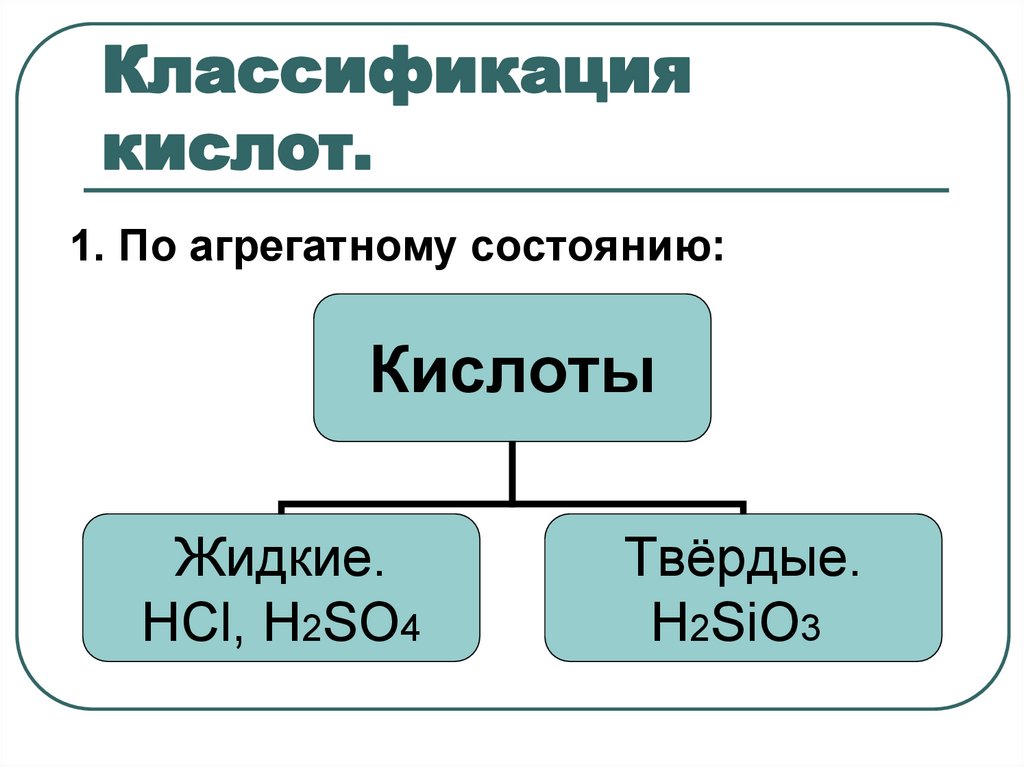
6. Классификация кислот.
1. По агрегатному состоянию:Кислоты
Жидкие.
НСl, H2SO4
Твёрдые.
H2SiO3
7. Классификация кислот.
2. По наличию кислорода вкислотном остатке.
Кислоты
Бескислородные.
НСl, H2S, HBr
Кислородсодержащие.
H2SO4, H2SiO3, H3PO4
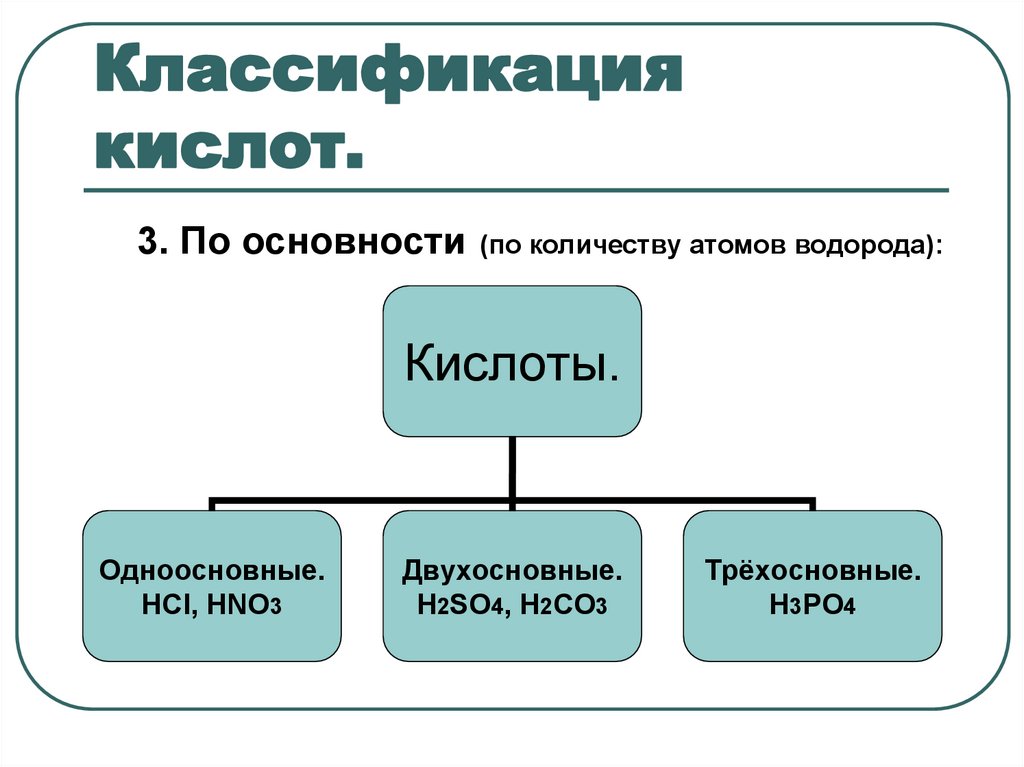
8. Классификация кислот.
3. По основности(по количеству атомов водорода):
Кислоты.
Одноосновные.
НСl, HNO3
Двухосновные.
H2SO4, H2CO3
Трёхосновные.
H3PO4
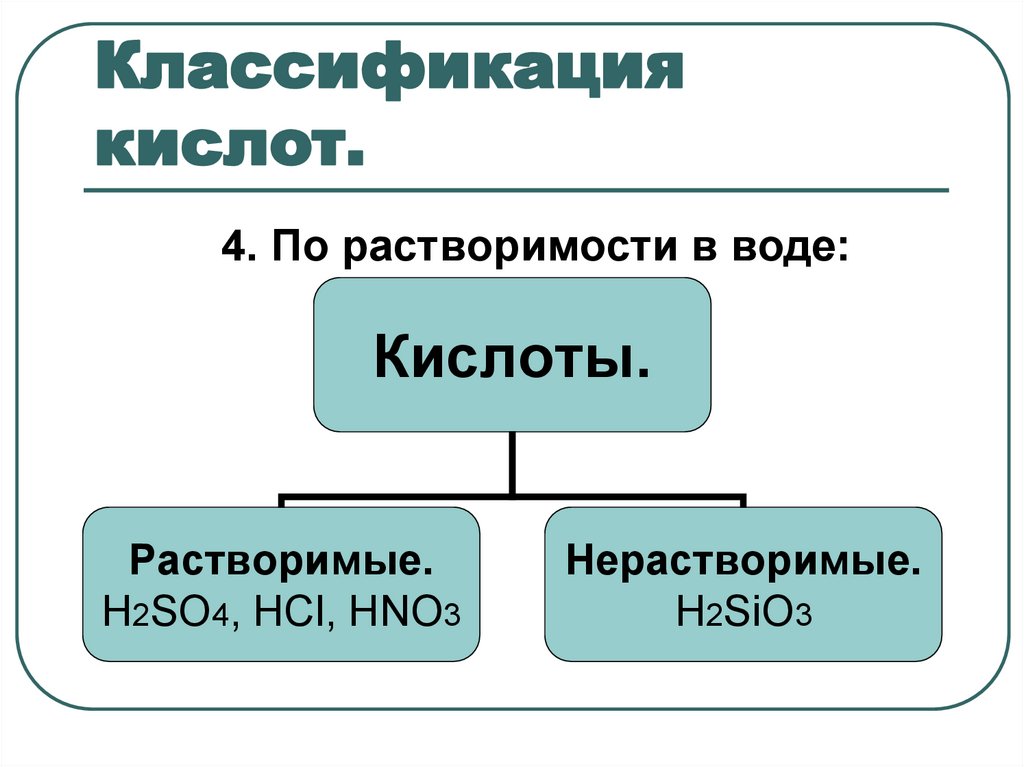
9. Классификация кислот.
4. По растворимости в воде:Кислоты.
Растворимые.
H2SO4, НСl, HNO3
Нерастворимые.
H2SiO3
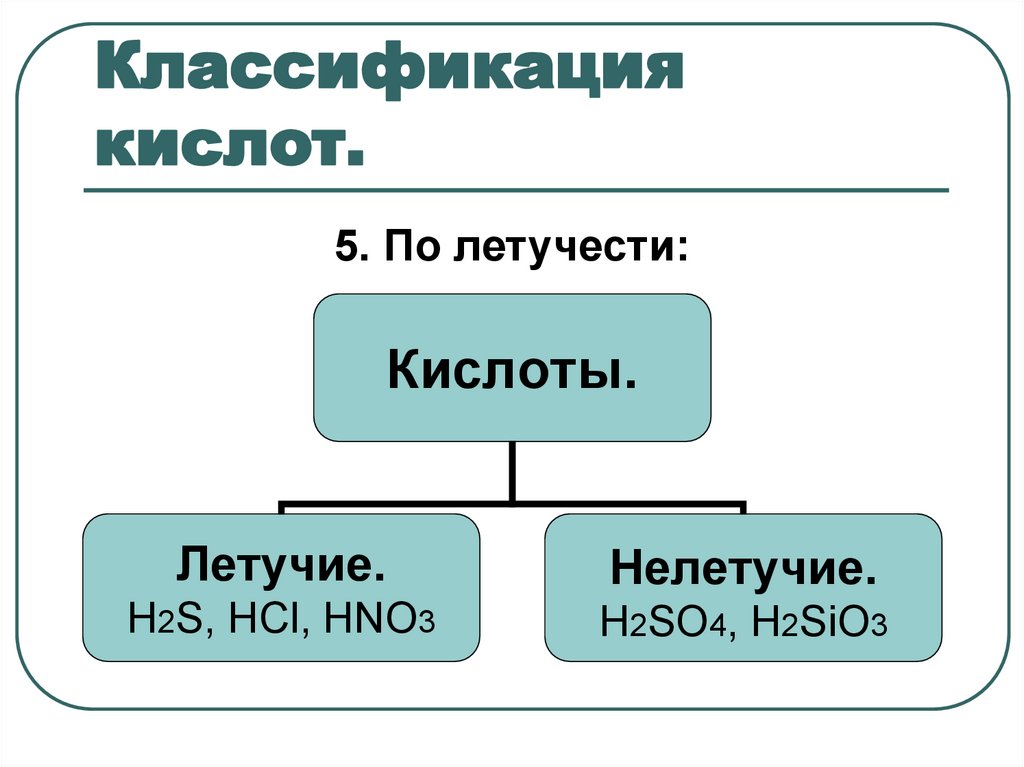
10. Классификация кислот.
5. По летучести:Кислоты.
Летучие.
Нелетучие.
H2S, HCl, HNO3
H2SO4, H2SiO3
11. Классификация кислот.
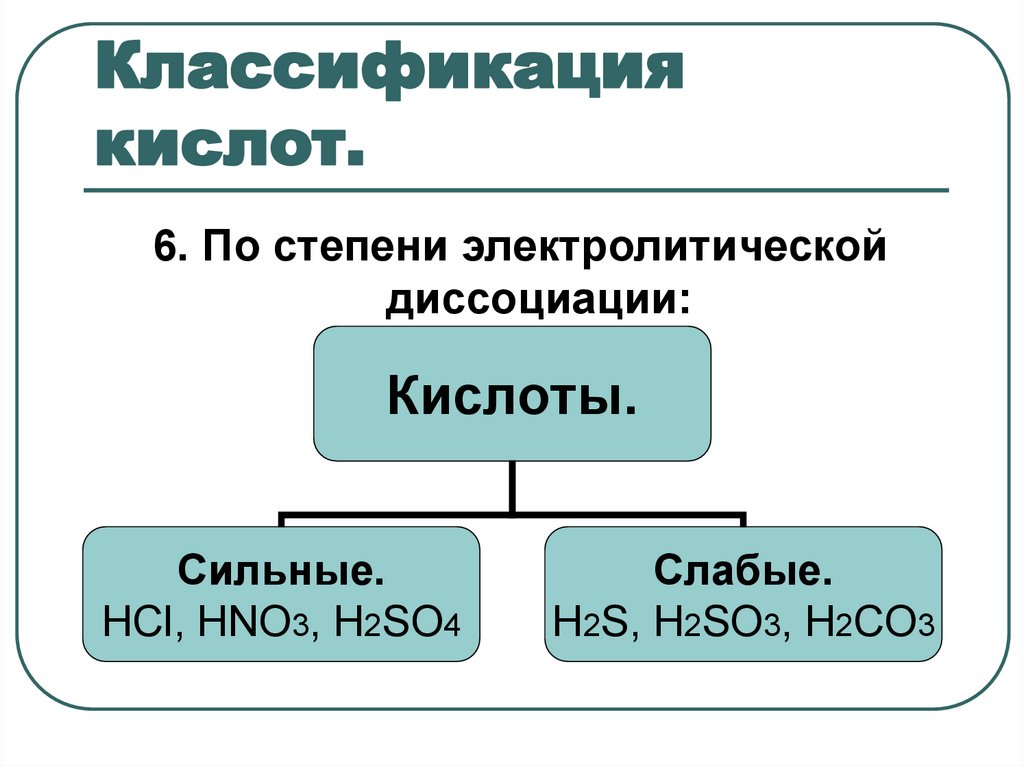
6. По степени электролитическойдиссоциации:
Кислоты.
Сильные.
HCl, HNO3, Н2SO4
Слабые.
Н2S, H2SO3, H2CO3
12. Классификация кислот.
7. По стабильности:Кислоты.
Стабильные.
HCl, HNO3, Н2SO4
Нестабильные.
H2SO3, H2CO3
13. Закрепление.
Дайте классификацию сернойкислоте по всем известным
признакам классификации.
Напишите уравнение диссоциации
серной кислоты.
14. Химические свойства кислот.
1. Кислота + основание → соль + вода(реакция нейтрализации), (реакция обмена)
HNO3 + NaOH → NaNO3 + H2O
H+ + OH- → H2O
2HCl + Fe(OH)2 → FeCl2 + 2H2O
2H+ + Fe(OH)2 → Fe+2 + 2H2O
15. Химические свойства кислот.
2. Кислота+оксид металла→ соль+вода(реакция обмена)
СuO + H2SO4 → CuSO4 + H2O
СuO +2H+ → Cu+2 + H2O
16. Химические свойства кислот.
3. Кислота + металл → соль + водород(реакция замещения)
Чтобы прошла эта реакция, необходимо
выполнить несколько условий:
1. Металл должен находиться в ряду напряжений до
водорода.
Zn + 2HCl → ZnCl2 + H2↑
Cu + HCl → не идёт
17. Химические свойства кислот.
2. Должна получиться растворимая соль.Pb + H2SO4 → PbSO4↓ + H2↑ -
образующаяся соль покрывает
поверхность металла защитной плёнкой
и реакция прекращается.
3. Эта реакция характерна для растворов
кислот, поэтому нерастворимые кислоты
не вступают в реакции с металлами.
Zn + H2SiO3 → не идёт
18. Химические свойства кислот.
4. Концентрированный раствор сернойкислоты и раствор азотной кислоты любой
концентрации взаимодействуют с
металлами иначе, поэтому уравнения
реакций между металлами и этими
кислотами записываются по другой схеме:
H2SO4(разб.) + Ме(до Н2) → соль + водород
19. Химические свойства кислот.
4. Кислота + соль →→ новая кислота + новая соль
(Если образуется осадок или газ) (реакция обмена)
H2SO4 + BaCl2 → BaSO4↓+ 2HCl
SO42- + Ba2+ → BaSO4↓
2HCl + CaCO3 → CaCl2 + H2O + CO2↑
2H+ + CaCO3 → Ca2+ + H2O + CO2↑
20. Закрепление.
1.2.
3.
4.
Напишите уравнения реакций
взаимодействия серной кислоты с:
Гидроксидом магния.
Сульфатом меди.
Оксидом натрия.
Магнием.
21. Домашнее задание.
§38, упр. 2
















 Химия
Химия








