Похожие презентации:
Соли. Классификация
1. Соли
Подготовила ученица 8 «Б»класса, МАОУ СОШ № 19
Протасова Екатерина.
2. Определение
солейСо́ ли — вещества, состоящие из
катионов металла (или катионов
+
аммония NH4 ; известны соли фосфония
+
PH4 ) и анионов кислотного остатка.
Со́ ли — электролиты, которые в водном
растворе диссоциируют с образованием
катионов металла и анионов кислотного
остатка.
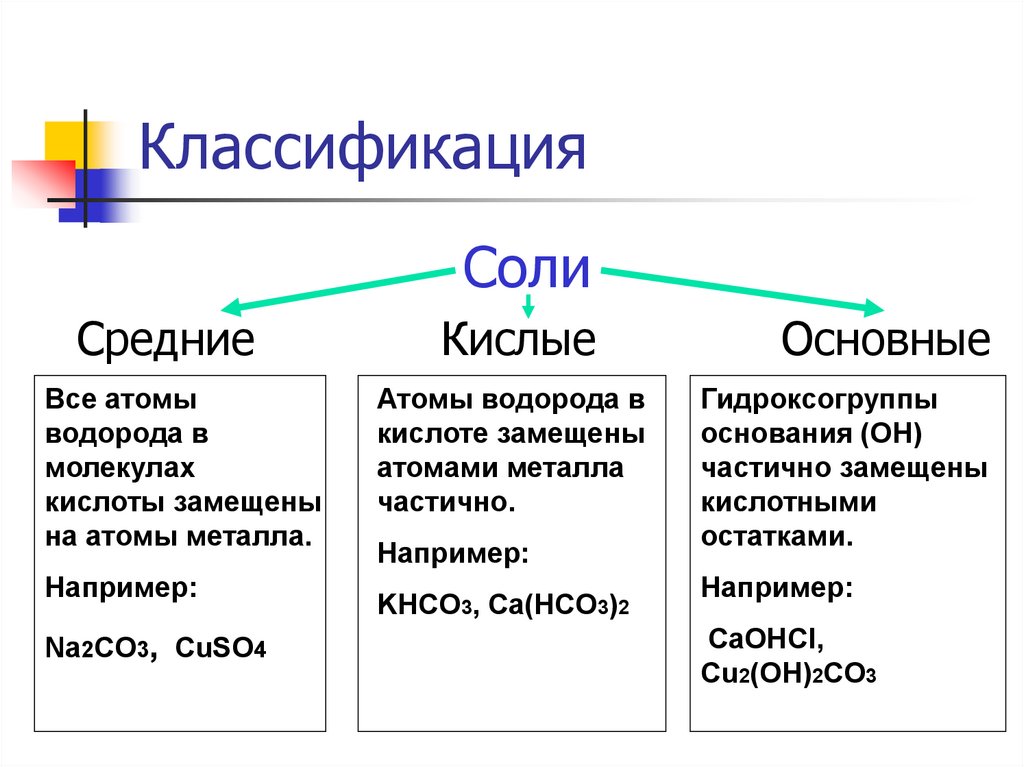
3. Классификация
СолиСредние
Все атомы
водорода в
молекулах
кислоты замещены
на атомы металла.
Например:
Na2CO3, CuSO4
Кислые
Атомы водорода в
кислоте замещены
атомами металла
частично.
Например:
KHCO3, Ca(HCO3)2
Основные
Гидроксогруппы
основания (OH)
частично замещены
кислотными
остатками.
Например:
CaOHCl,
Cu2(OH)2CO3
4. Физические свойства солей
Как все ионные вещества,соли при н.у. – твердые
кристаллы.
Окраска зависит от окраски
катионов и анионов.
Растворимость различна.
5. Химические свойства
Взаимодействие с металлами:М + соль
М* + соль*
р
р
Fe + CuSO4
Cu + FeSO4
Cu + AgCl
Fe + MgCl2
Mg + Zn(NO3)2
6. Химические свойства
Взаимодействие со щелочами:NaOH + CuSO4
KOH + AgCl
NaOH + K2CO3
Взаимодействие с кислотами:
NaCl + HNO3
K2CO3 + HCl
7. Химические свойства
Взаимодействие солей друг с другом:соль1 + соль2 = соль3 + соль4
Р
Р
NaCl + AgNO3
BaSO4 + KCl
KCl + Na2SO4
ИЛИ (И)
8. Химические свойства
Некоторые соли разлагаются принагревании:
9. Химические свойства
Взаимодействие с водой:CuSO4 + 5H2O CuSO4 5H2O
Al2S3 + 6H2O 2Al(OH)3 + 3H2S
.
10. Соли в природе
Многиеминералы — соли,
образующие залежи
(например, галит
NaCl, сильвин KCl,
флюорит CaF2).
11.
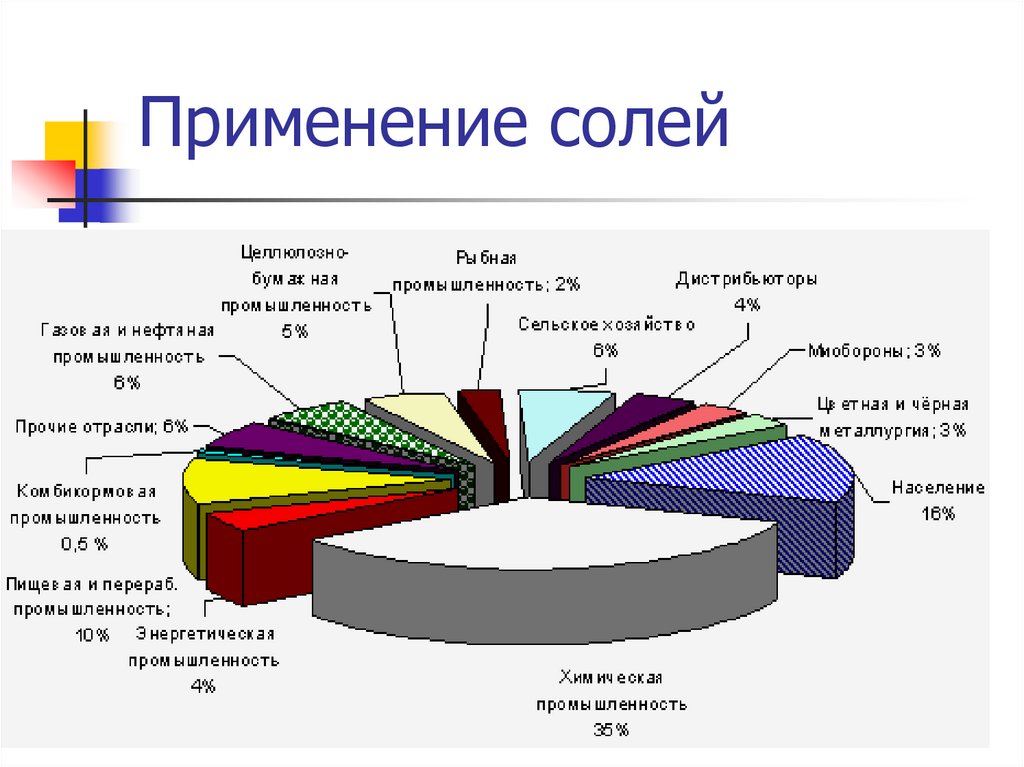
12. Применение солей
13. Общие способы синтеза солей
1.Получение средних солей:1) металла с неметаллом: 2Na + Cl2 = 2NaCl
2) металла с кислотой: Zn + 2HCl = ZnCl2 + H2
3) металла с раствором соли менее активного
металла Fe + CuSO4 = FeSO4 + Cu
4) основного оксида с кислотным оксидом: MgO +
CO2 = MgCO3
5) основного оксида с кислотой CuO + H2SO4=
CuSO4 + H2O
14.
6) основания с кислотным оксидом Ba(OH)2+ CO2= BaCO3 + H2O
7) основания с кислотой: Ca(OH)2 + 2HCl = CaCl2
+ 2H2O
8) соли с кислотой: MgCO3 + 2HCl = MgCl2 + H2O
+ CO2
BaCl2 + H2SO4 = BaSO4 + 2HCl
9) щелочи с раствором соли: Ba(OH)2 + Na2SO4 =
2NaOH + BaSO4
10) растворов двух солей 3CaCl2 + 2Na3PO4 =
Ca3(PO4)2 + 6NaCl
15. 2.Получение кислых солей:
1. Взаимодействие кислоты снедостатком основания. KOH + H2SO4 =
KHSO4 + H2O
2. Взаимодействие основания с избытком
кислотного оксида
Ca(OH)2 + 2CO2 = Ca(HCO3)2
3. Взаимодействие средней соли с
кислотой Ca3(PO4)2 + 4H3PO4 =
3Ca(H2PO4)2
16. 3.Получение основных солей:
1. Добавление (по каплям) небольших количествщелочей к растворам средних солей металлов
AlCl3 + 2NaOH = Al(OH)2Cl + 2NaCl
2. Взаимодействие солей слабых кислот со
средними солями
2MgCl2 + 2Na2CO3 + H2O = Mg(OH)2CO3 + CO2 +
4NaCl
3. Гидролиз солей, образованных слабым
основанием и сильной кислотой
ZnCl2+ H2O = Zn(OH)Cl + HCl
17. Гидролиз солей
Некоторые соли в водном растворе способны подвергатьсягидролизу. Данная реакция протекает обратимо для солей
слабых кислот (Na2CO3) или слабых оснований (CuCl2), и
необратимо — для солей слабых кислот и слабых оснований
(Al2S3).















 Химия
Химия








