Похожие презентации:
Пиролиз нефтяного сырья
1. Пиролиз нефтяного сырья
Пиролиз – крекинг, но при более высокойтемпературе (700–800 °С) и атмосферном
давлении.
Назначение процесса: до недавнего времени
получение ароматических углеводородов
(бензол, толуол и др.), поэтому процесс
назывался высокотемпературной
ароматизацией. В настоящее время
производство низших олефинов,
преимущественно этилена, являющихся
ценным сырьем (мономером) для синтеза
важнейших нефтехимических продуктов
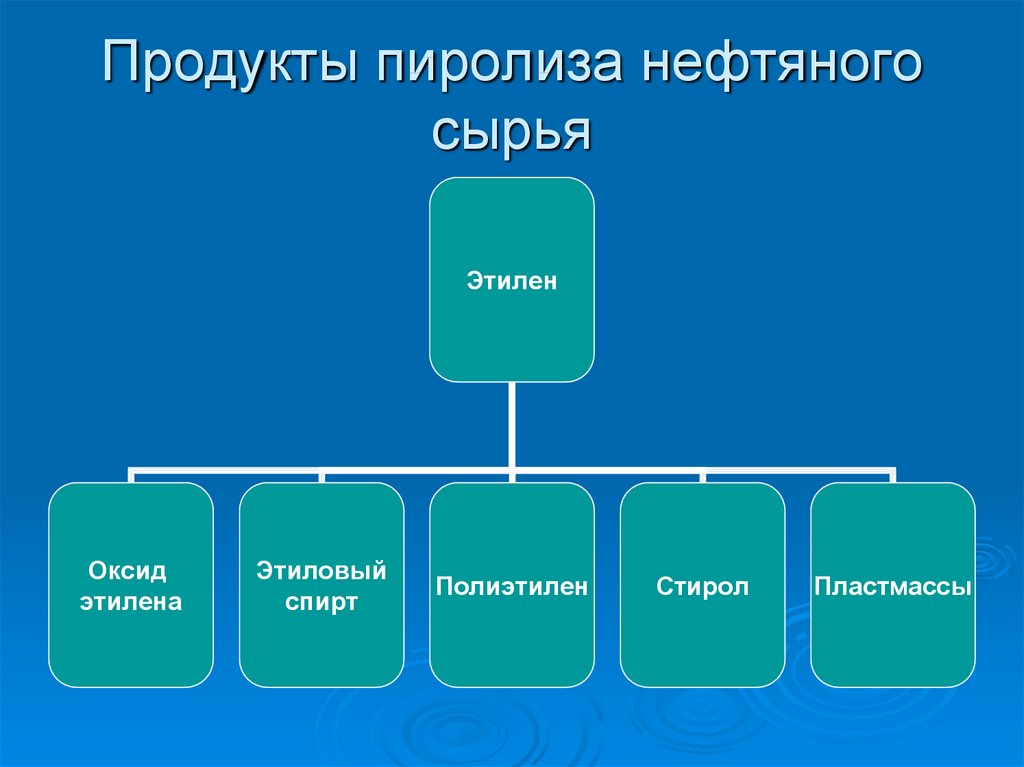
2. Продукты пиролиза нефтяного сырья
ЭтиленОксид
этилена
Этиловый
спирт
Полиэтилен
Стирол
Пластмассы
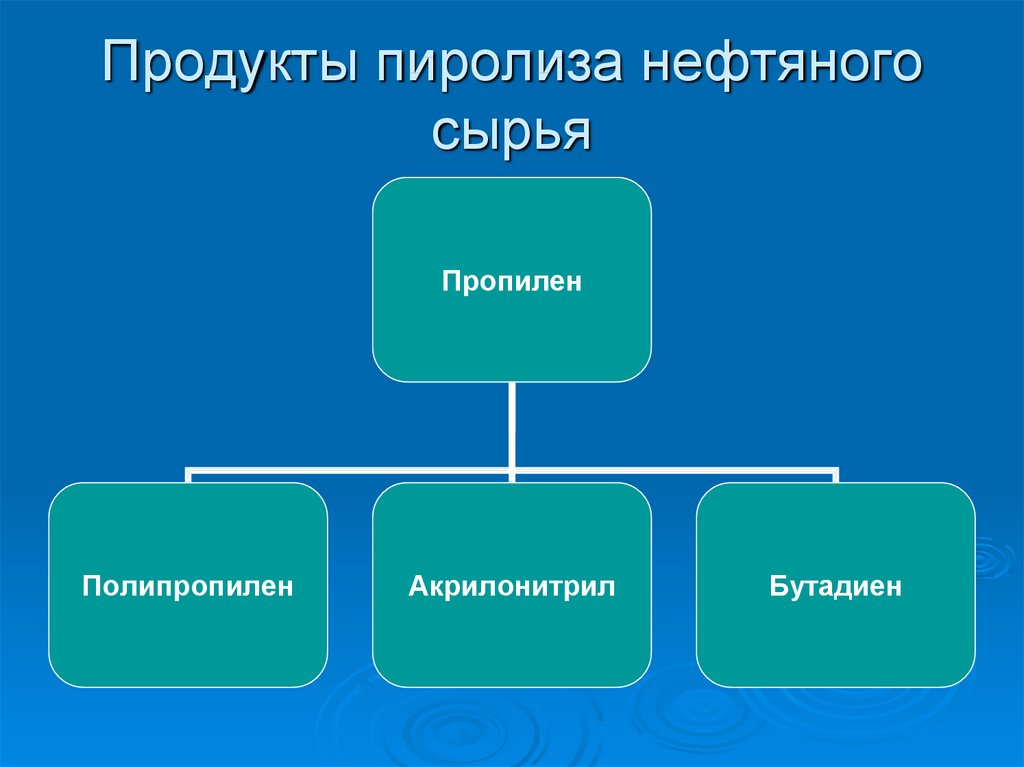
3. Продукты пиролиза нефтяного сырья
ПропиленПолипропилен
Акрилонитрил
Бутадиен
4. Сырье
Газообразныеи жидкие углеводороды:
газы, легкие бензиновые фракции,
газоконденсаты, рафинаты
каталитического риформинга, реже
керосино-газойлевые фракции
5. Направления использования жидких продуктов пиролиза
Получениебензола и других
ароматических углеводородов
Получение нефтеполимерных смол
Получение котельных топлив
Получения сырья для производства
технического углерода
Получение пеков
Получение высококачественных коксов
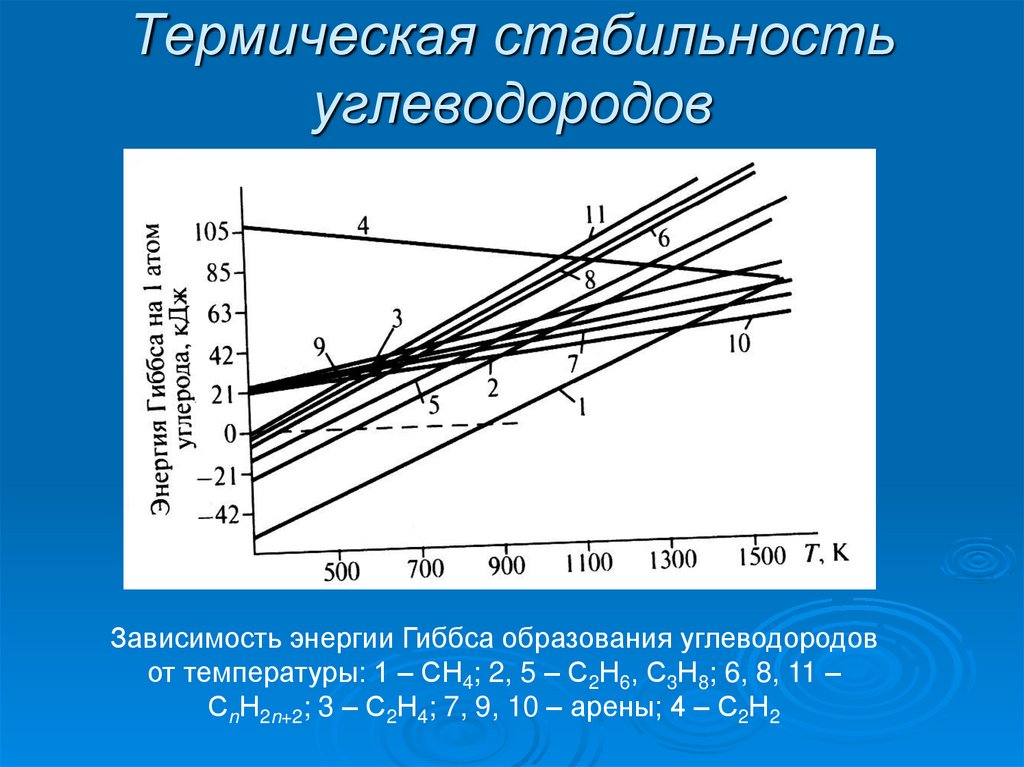
6. Термическая стабильность углеводородов
Зависимость энергии Гиббса образования углеводородовот температуры: 1 – СН4; 2, 5 – С2Н6, С3Н8; 6, 8, 11 –
СnН2n+2; 3 – С2Н4; 7, 9, 10 – арены; 4 – С2Н2
7. Термодинамика реакций крекинга и пиролиза
Термодинамическаявероятность
протекания химической реакции
определяется величиной изменения в
процессе свободной энергии Гиббса GТ0
GТ0
lg Kp
4,575Т
8. Кинетика и механизм
Внастоящее время принят радикальноцепной механизм термической
деструкции: инициирование,
продолжение и обрыв цепи.
9. Основные стадии
инициирование– распад углеводородов
на радикалы – происходит
преимущественно по связи С–С
(крекинг), при более высоких
температурах – по связи С–Н (пиролиз).
При температуре 400–500 °С разрыв
углеводородной цепи идет посередине,
по более слабым связям:
C2H6
C2H6
.
.
CH3 + CH3
.C H + H .
2 5
10. Основные стадии
продолжениецепи:
а) замещение:
.
CH3 + C2H6
.
C2H5 + CH4
б)
распад радикалов с образованием
ненасыщенных молекул:
.
CH3CH2CHCH3
.
CH2=CHCH3 + CH3
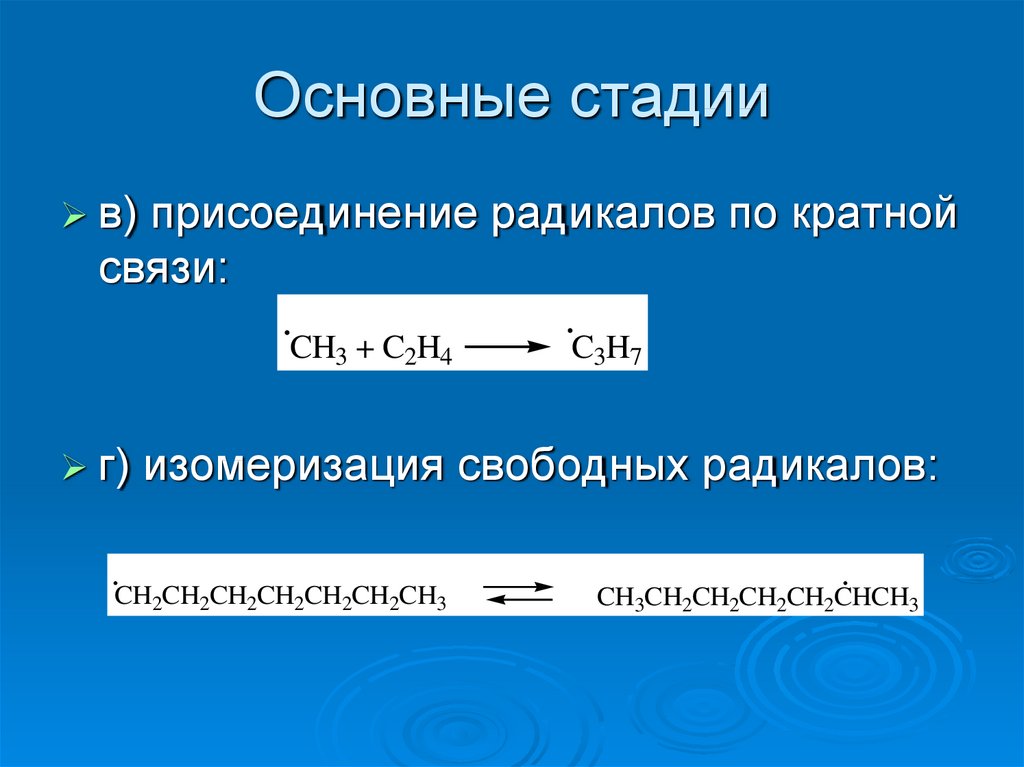
11. Основные стадии
в)присоединение радикалов по кратной
связи:
.
CH3 + C2H4
г)
.
.
C3H7
изомеризация свободных радикалов:
CH2CH2CH2CH2CH2CH2CH3
.
CH3CH2CH2CH2CH2CHCH3
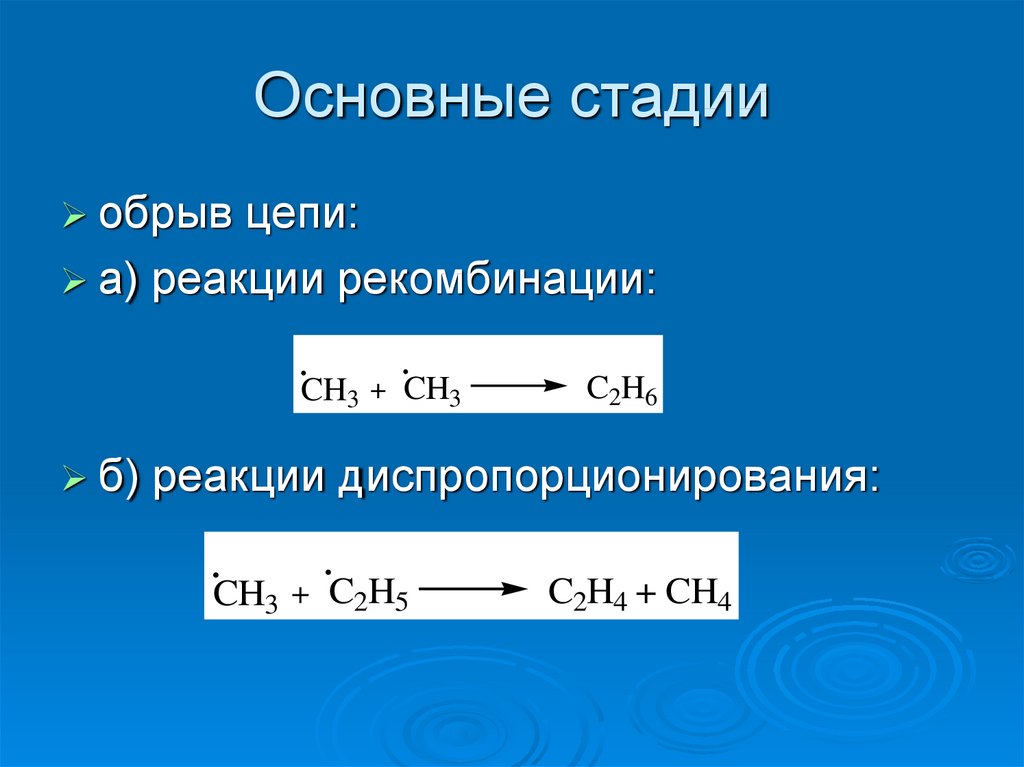
12. Основные стадии
обрывцепи:
а) реакции рекомбинации:
.
.
CH3 + CH3
б)
C2H6
реакции диспропорционирования:
.
.
CH3 + C2H5
C2H4 + CH4
13. Кинетика
Реакциитермического разложения
обычно описываются уравнением 1-го
порядка:
dx
k ( a x)
dτ
где
x – доля превращенного сырья;
τ – время;
a– количество исходного сырья.
14. Кинетика процесса с учетом тормозящего влияния продуктов распада
dxk (a x)
dτ a β(a x)
β – постоянная, характеризующая степень
торможения.
15. Основные типы реакций для углеводородов различных классов
Превращениеалканов – реакция
распада по связи С–С с образованием
алкена и алкана:
CmH2m + CqH2q+2
CnH2n+2
Превращение
алкенов. а) уплотнения
nСnН2n (CnH2n)n при низкой
температуре и высоком давлении; б)
распада алкенов при высоких
температурах по правилу связи
.
CH3 CH2 .. CH2 CH CH2
.
C5H10 + R
.
.
CH3 CH2 + CH2 CH CH2
RH + CH3 CH2 CH CH = CH2
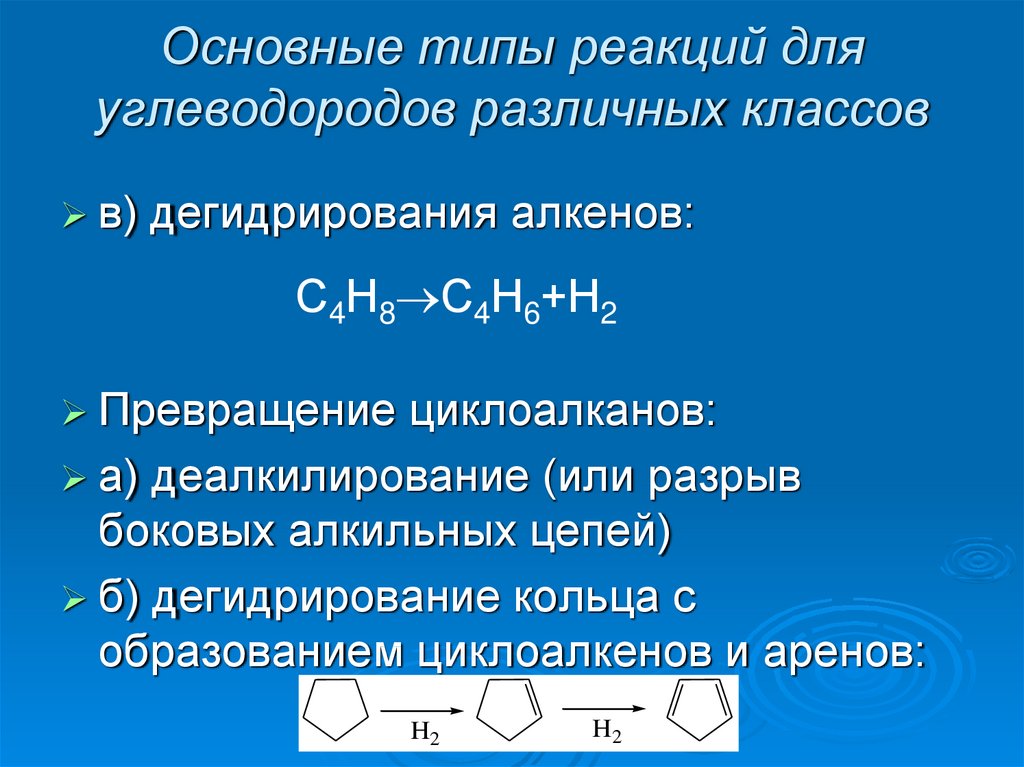
16. Основные типы реакций для углеводородов различных классов
в)дегидрирования алкенов:
С4Н8 С4Н6+Н2
Превращение
циклоалканов:
а) деалкилирование (или разрыв
боковых алкильных цепей)
б) дегидрирование кольца с
образованием циклоалкенов и аренов:
H2
H2
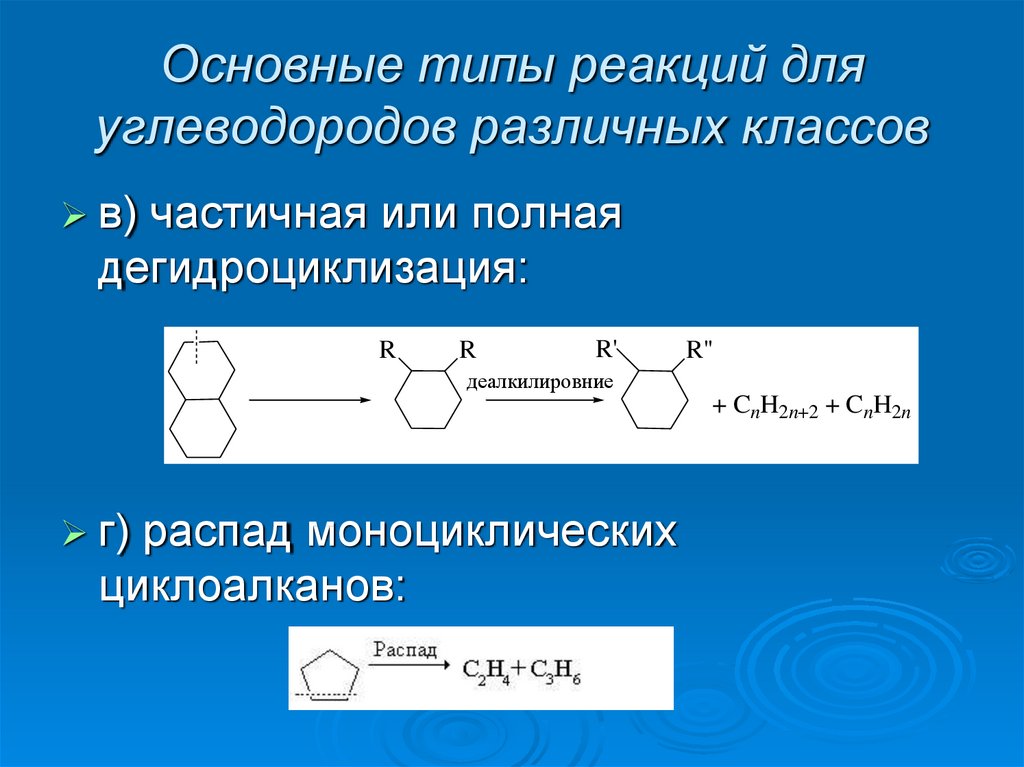
17. Основные типы реакций для углеводородов различных классов
в)частичная или полная
дегидроциклизация:
R
R
R'
R''
деалкилировние
+ CnH2n+2 + CnH2n
г)
распад моноциклических
циклоалканов:
18. Основные типы реакций для углеводородов различных классов
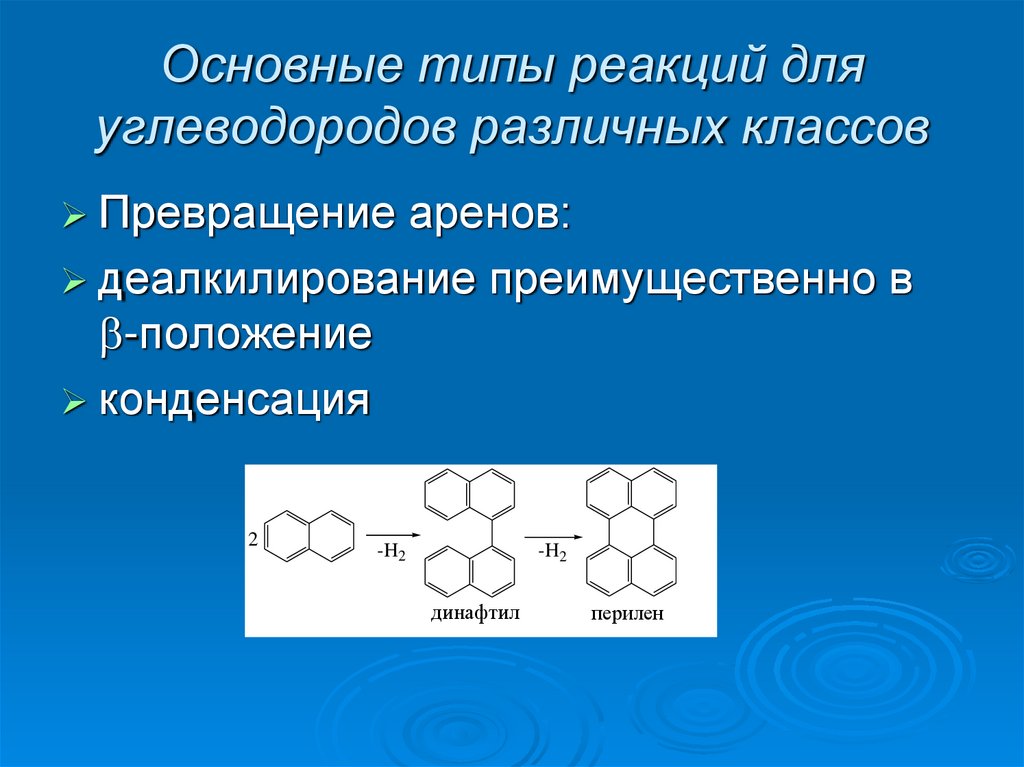
Превращениеаренов:
деалкилирование преимущественно в
-положение
конденсация
2
-H2
-H2
динафтил
перилен
19. Основные типы реакций для углеводородов различных классов
Превращениесеросодержащих
соединений: разложение с выделением
Н2S, меркаптанов и углеводородных
осколков, либо накопление в
высокомолекулярных продуктах.
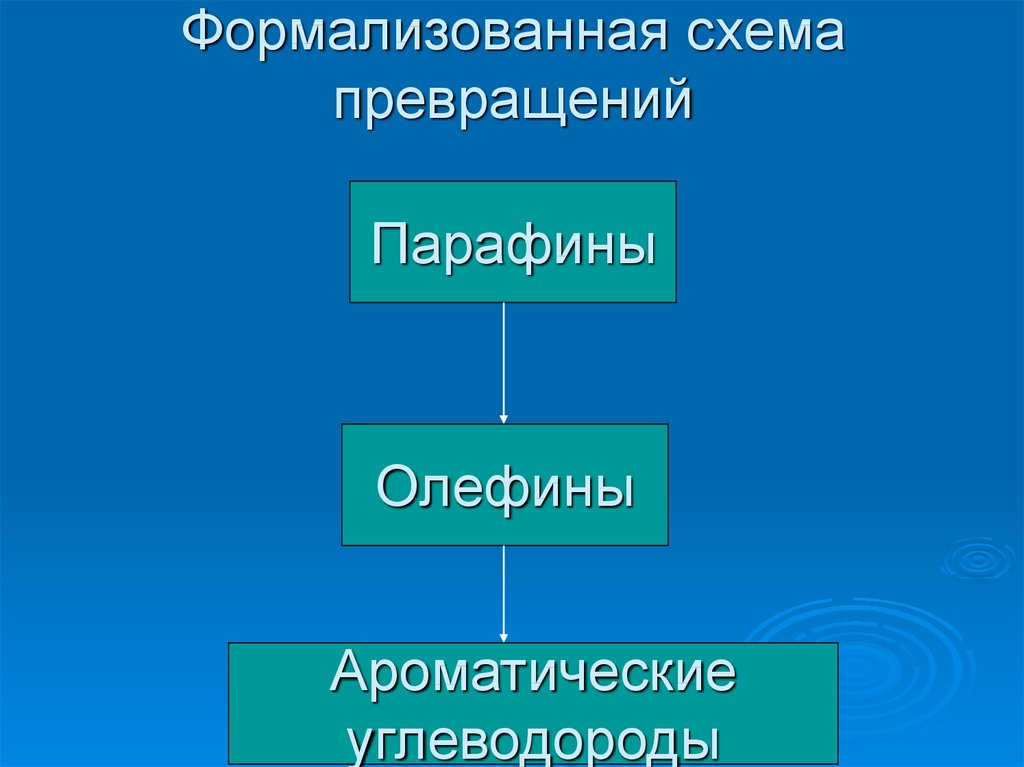
20. Формализованная схема превращений
ПарафиныОлефины
Ароматические
углеводороды













 Химия
Химия








