Похожие презентации:
Посттрансляционная регуляция экспрессии генов
1. Посттрансляционная регуляция экспрессии генов
2.
3.
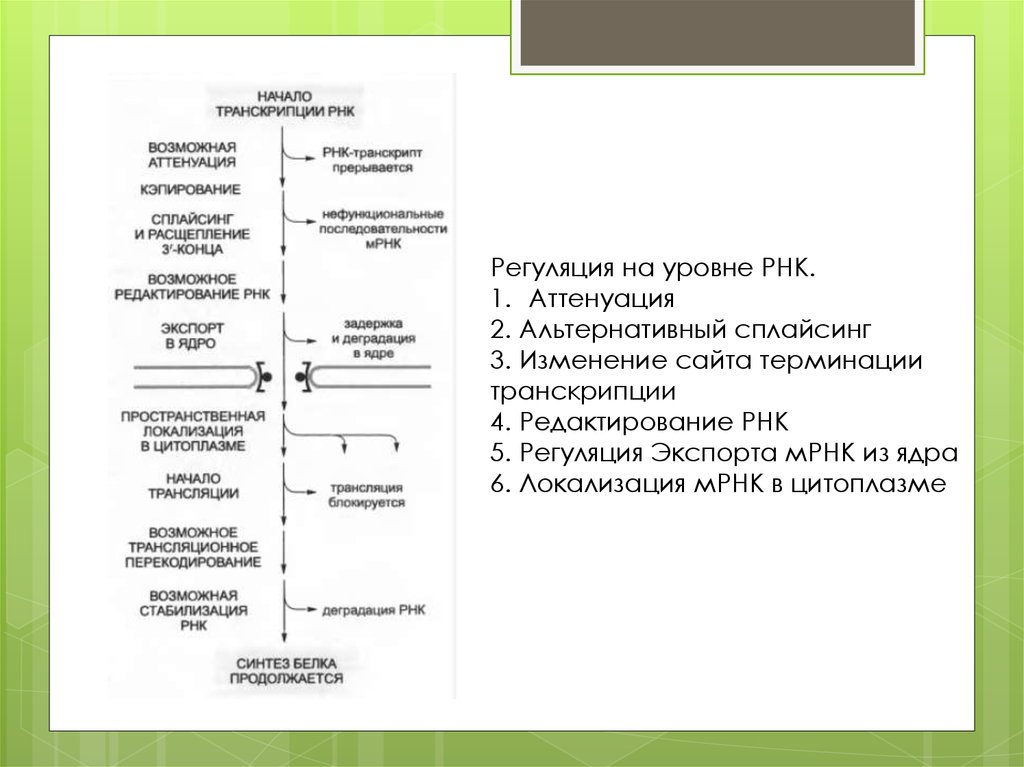
Регуляция на уровне РНК.1. Аттенуация
2. Альтернативный сплайсинг
3. Изменение сайта терминации
транскрипции
4. Редактирование РНК
5. Регуляция Экспорта мРНК из ядра
6. Локализация мРНК в цитоплазме
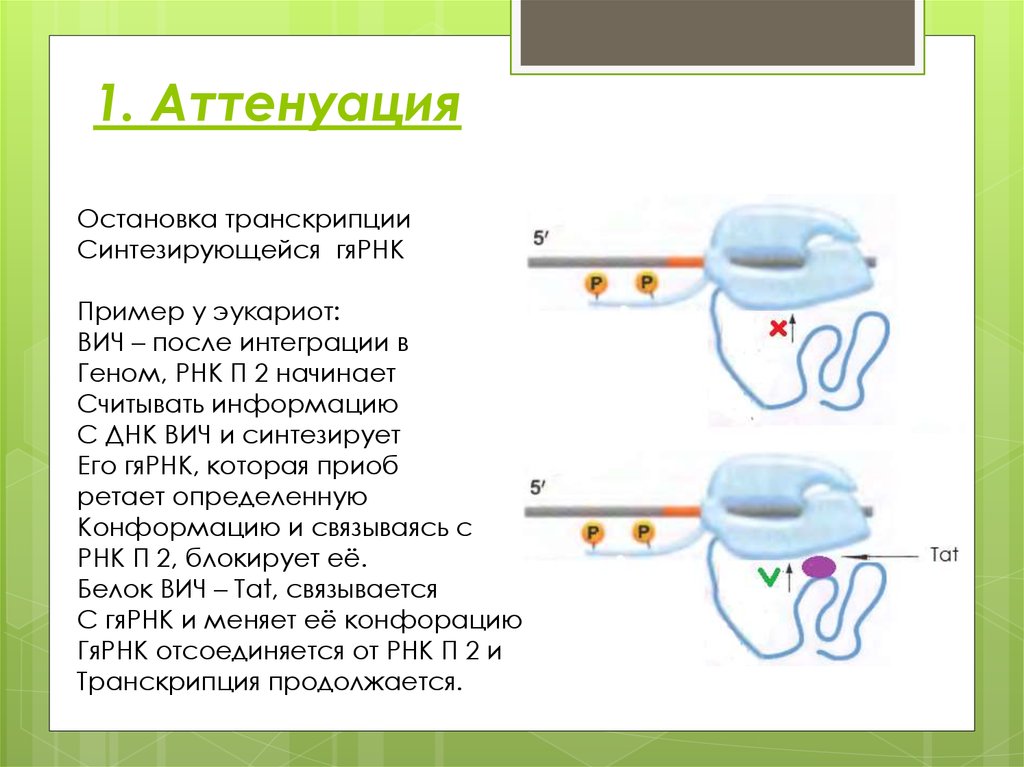
4. 1. Аттенуация
Остановка транскрипцииСинтезирующейся гяРНК
Пример у эукариот:
ВИЧ – после интеграции в
Геном, РНК П 2 начинает
Считывать информацию
С ДНК ВИЧ и синтезирует
Его гяРНК, которая приоб
ретает определенную
Конформацию и связываясь с
РНК П 2, блокирует её.
Белок ВИЧ – Tat, связывается
С гяРНК и меняет её конфорацию
ГяРНК отсоединяется от РНК П 2 и
Транскрипция продолжается.
5. Рибопереключатели.
Регулируют экспрессию на разных этапахКороткие последовательности РНК, меняющие
свою конформацию при связывании с малыми молекулами
Например: молекулами метаболитов.
Каждый РП узнает специфическое низкомолекулярное соединение
РП часто располагаются возле 5’ конца гяРНК.
В зависимости от того связана молекула или нет они блокируют
движение РНК П 2 или позволяют ей двигаться вперед.
6. Применение рибопереключателей.
создание биосенсоров, которые в ответ насвязывание с лигандами испускают какойнибудь детектируемый результат,
например, электрохимический сигнал
или флуоресценцию.
https://www.ncbi.nlm.nih.gov/pubmed/27432
066?dopt=Abstract
https://www.ncbi.nlm.nih.gov/pubmed/27220
466?dopt=Abstract
7. 2.Альтернативный сплайсинг.
Существует несколько возможных точек сплайсинга. Что
Позволяет получать с одного
Гена несколько различных
Версий одного и того же белка
Или разных белков (функциони
рующий/ нефункционирующий)
1. Различные экзоны, по
Разному сшиваются.
2. Неоднозначность интрона
Сплайсосома не может четко
Различить 2 или более альтерна
тивные пары 3’ и 5’ сайтов из за
Этого реализуются различные
Формы белка
8.
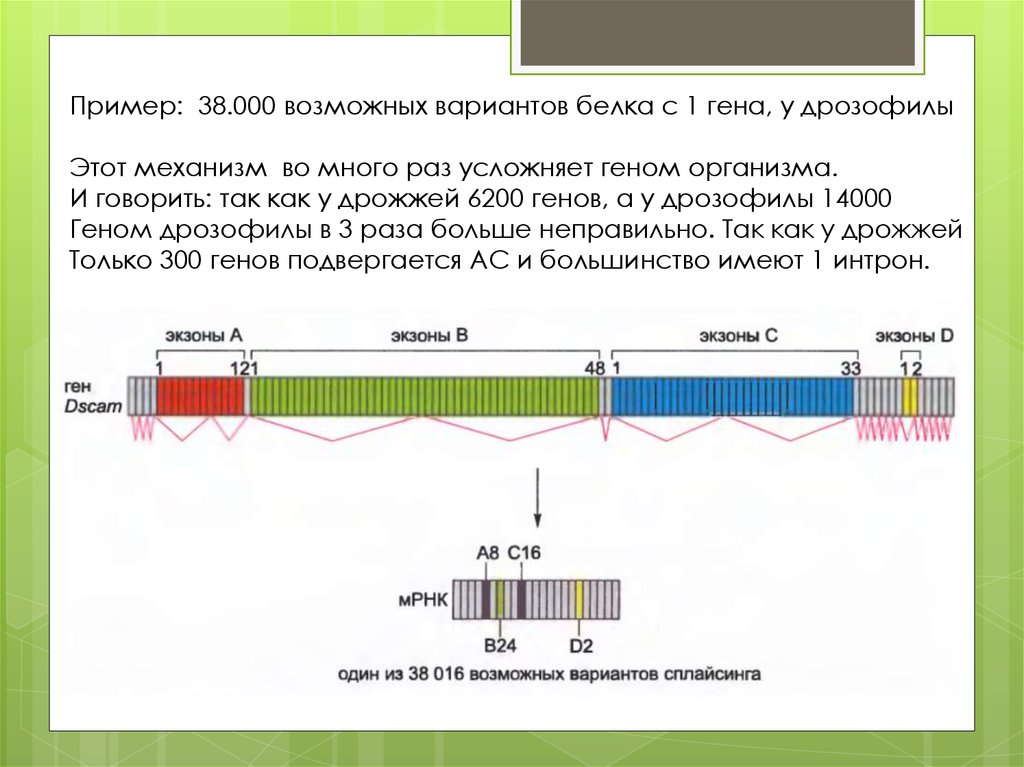
Пример: 38.000 возможных вариантов белка с 1 гена, у дрозофилыЭтот механизм во много раз усложняет геном организма.
И говорить: так как у дрожжей 6200 генов, а у дрозофилы 14000
Геном дрозофилы в 3 раза больше неправильно. Так как у дрожжей
Только 300 генов подвергается АС и большинство имеют 1 интрон.
9. Регуляция АС может быть отрицательной и положительной
10.
При негативной регуляции белок-репрессорсвязывается с транскриптом пре-мРНК и
блокирует доступ аппарата сплайсинга к границе
сплайсинга. Это часто приводит к использованию
скрытых сайтов сплайсинга и, таким образом, к
изменению варианта сплайсинга (не показан).
При позитивной регуляции аппарат сплайсинга не
способен эффективно удалять определенную
интронную последовательность без помощи
белкаактиватора. Поскольку нуклеотидные
последовательности, с которыми связываются эти
активаторы, могут располагаться на много
нуклеотидных пар дальше контролируемых ими
границ сплайсинга, они часто называются
энхансерами сплайсинга.
11.
12. 3. Изменение сайта терминации транскрипции.
Терминация синтеза гяРНК, осуществляется в ходе расщепленияРНК. Клетка может контролировать место такого расщепления
С тем, чтобы изменить карбоксильный конец РНК.
Пример: Переключение синтеза Антител при созревании В-лимфоцитов
С мембраносвязывающих на секретируемые формы
Мембраносвязывающая форма содержит длинную цепь из
Гидрофобных аминокислот.
Изменение участка расщепления происходит из-за увеличения
Концентрации субъединиц белка CsrF, который связывается
С G/U богатыми последовательностями сайтов расщепления
и полиаденилирования РНК и стимулирует расщепление.
13.
14.
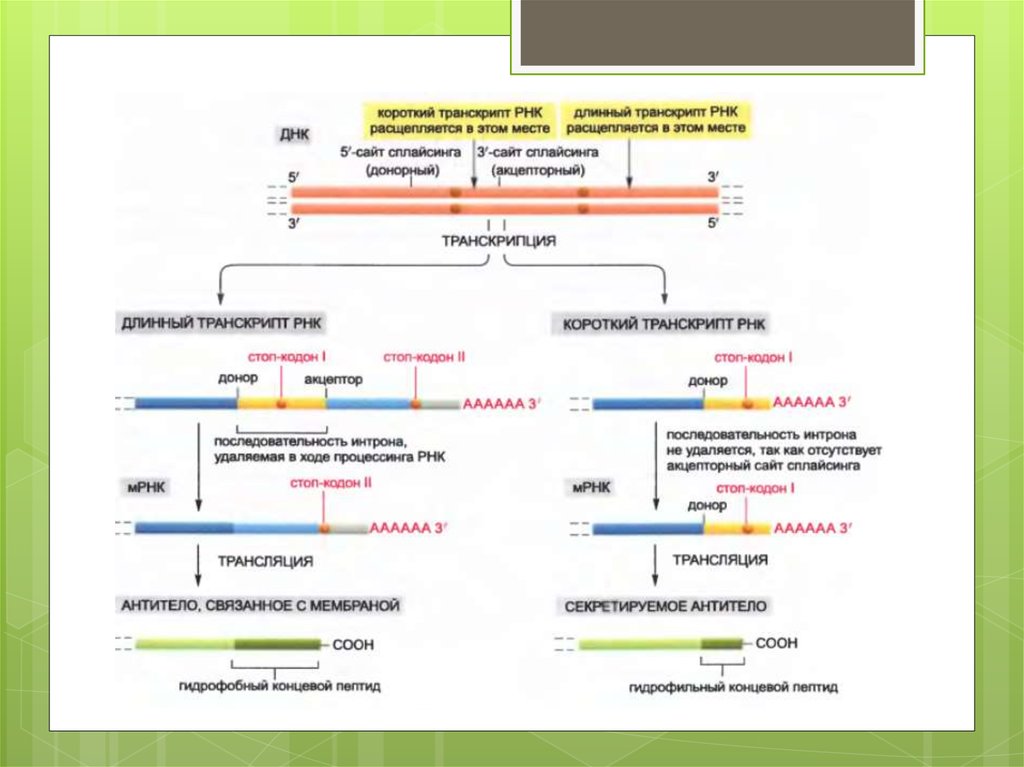
В нестимулированных B-лимфоцитах (слева)образуются длинные транскрипты РНК, и при
сплайсинге РНК удаляется последовательность
интрона вблизи 3'-конца этой молекулы. В
результате образуется мРНК, которая кодирует
молекулу антитела, связывающуюся с мембраной.
Напротив, после стимуляции антигеном (справа)
первичный транскрипт РНК расщепляется раньше
сайта сплайсинга, находящегося перед
последним экзоном. В результате часть
последовательности интрона, удалявшейся из
длинного транскрипта, остается в качестве
кодирующей последовательности в коротком
транскрипте. Это те нуклеотидные
последовательности, которые кодируют
гидрофильную часть на карбоксильном конце
секретируемой молекулы антитела
15.
16. 4. Редактирование РНК
1)2)
У млекопитающих существует 2 механизма
редактирования:
Дезаминирование аденозина с образованием
инозина
Дезаминирование цитозина с образованием
урацила
Редактирование в кодируемой облости может привести
к изменению аминокислотную последовательность .
Редактирование за пределами кодирующей облости
может повлиять на:
1)
- сплайсинг гяРНК,
2)
- транспорт мРНК из ядра в цитозоль
3)
-эффективность трансляци
17.
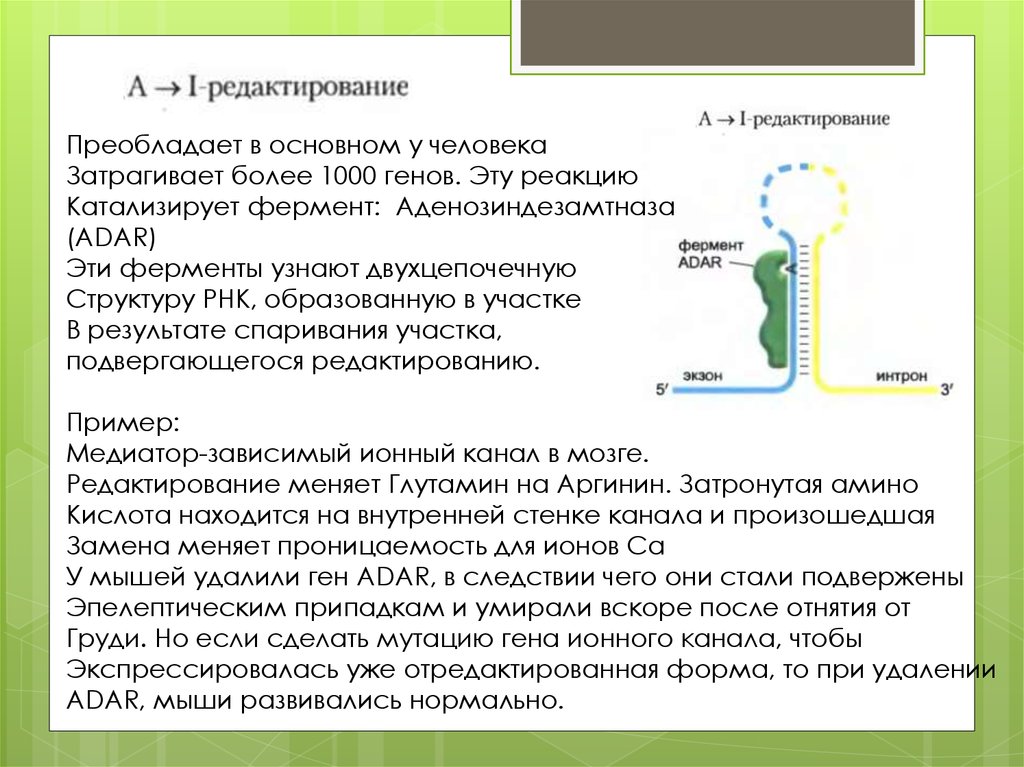
Преобладает в основном у человекаЗатрагивает более 1000 генов. Эту реакцию
Катализирует фермент: Аденозиндезамтназа
(ADAR)
Эти ферменты узнают двухцепочечную
Структуру РНК, образованную в участке
В результате спаривания участка,
подвергающегося редактированию.
Пример:
Медиатор-зависимый ионный канал в мозге.
Редактирование меняет Глутамин на Аргинин. Затронутая амино
Кислота находится на внутренней стенке канала и произошедшая
Замена меняет проницаемость для ионов Са
У мышей удалили ген ADAR, в следствии чего они стали подвержены
Эпелептическим припадкам и умирали вскоре после отнятия от
Груди. Но если сделать мутацию гена ионного канала, чтобы
Экспрессировалась уже отредактированная форма, то при удалении
ADAR, мыши развивались нормально.
18.
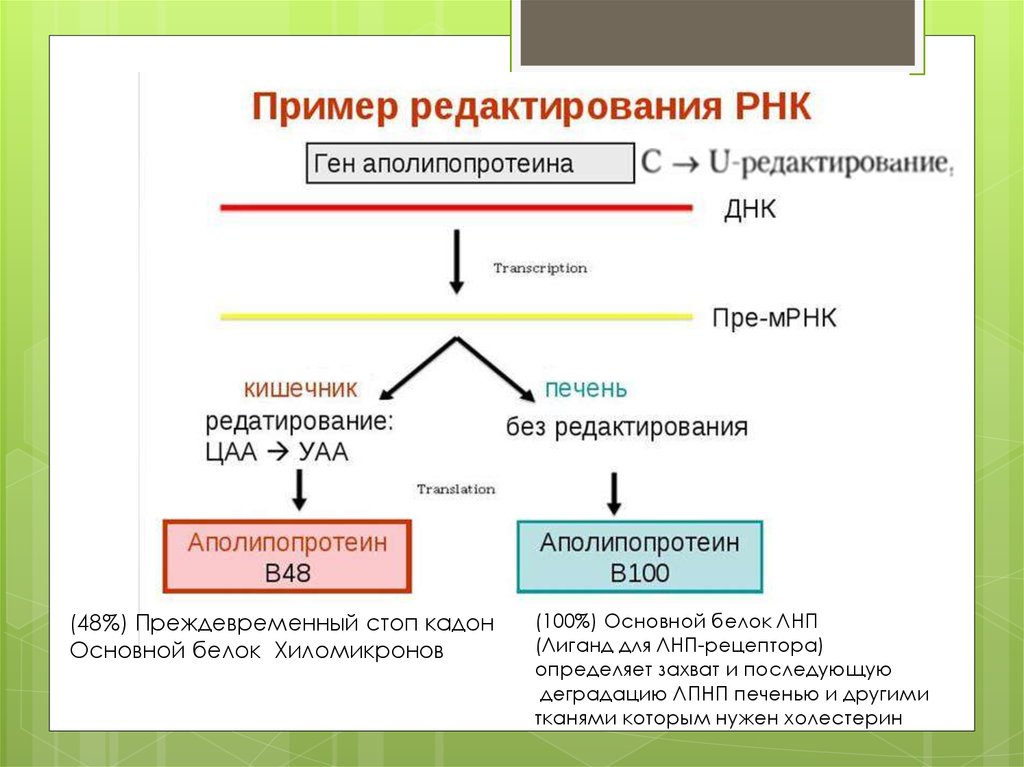
(48%) Преждевременный стоп кадонОсновной белок Хиломикронов
(100%) Основной белок ЛНП
(Лиганд для ЛНП-рецептора)
определяет захват и последующую
деградацию ЛПНП печенью и другими
тканями которым нужен холестерин
19.
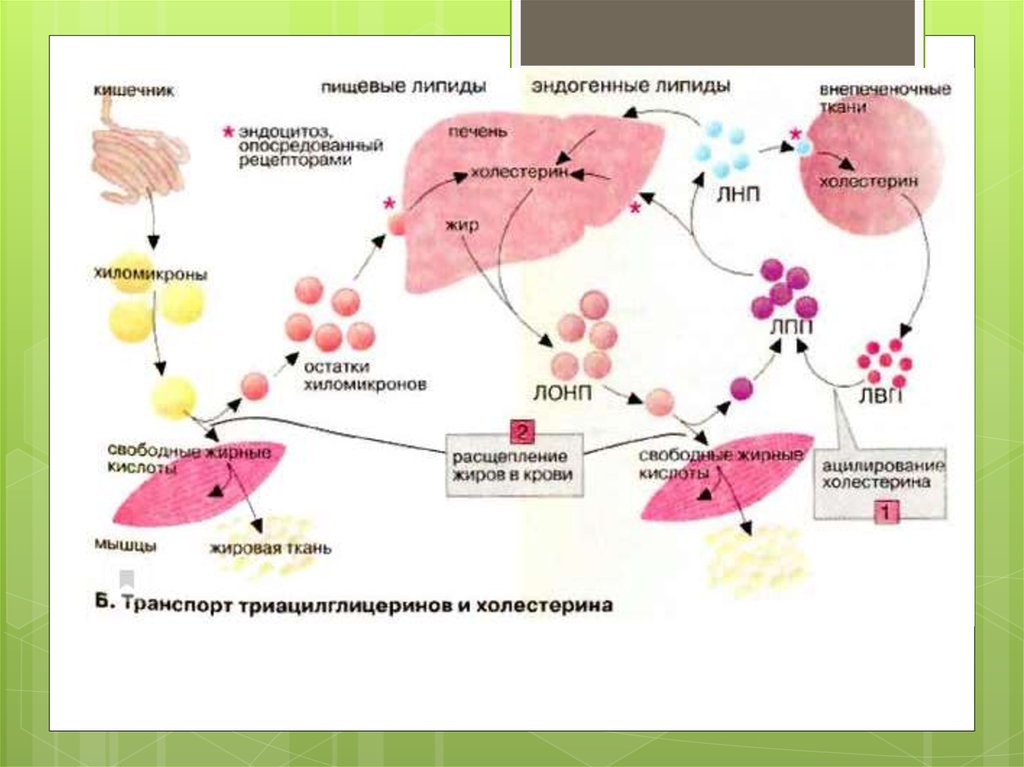
Апопротеин-В,Е-рецепторы не распознают апопротеин В48,поэтому остаточные компоненты хиломикронов удаляются из
крови в печени с помощью рецептора апопротеина Е .
В крови апоЕ определяет поглощение остатков хиломикронов
и остатков ЛПОНП печенью. В мозге апоЕ синтезируется
астроцитами и микроглией, а рецепторы к нему
экспрессируются нейронами. Таким образом апоЕ
осуществляет доставку холестерина к месту миелинизации. В
настоящий момент у млекопитающих идентифицировано
семь рецепторов, лигандом которых является АпоЕ.
20.
21.
22.
23.
Почему вообще существует редактирование РНК,остается загадкой. Одна из идей состоит в том, что оно
возникло в ходе эволюции для исправления «ошибок» в
геноме. Другое предположение, что оно появилось как
своего рода небрежный способ образования клеткой
слегка различающихся белков от одного гена. Третья
возможность — что редактирование РНК первоначально
развивалось как защитный механизм против
ретровирусов и ретротранспозонов, а позже было
адаптировано клеткой, чтобы изменять смысл
определенных мРНК. Действительно, редактирование
РНК до сих пор играет важную роль в защите клетки.
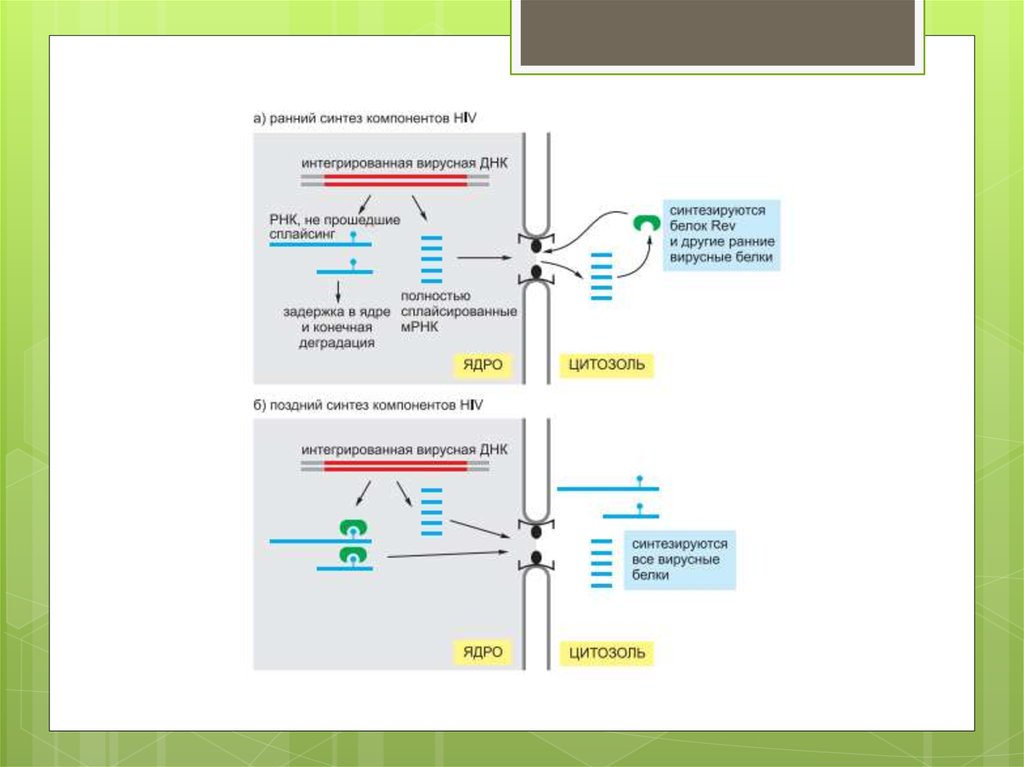
Некоторые ретровирусы, включая HIV (см. рис. 5.71),
подвергаются существенному редактированию после
того, как заразят клетки. Это гиперредактирование
порождает множество вредных мутаций в вирусном РНКгеноме, а также приводит к тому, что вирусные мРНК
задерживаются в ядре, где в итоге деградируют.
Несмотря на то что некоторые современные
ретровирусы защищают себя от действия этого
механизма, он, повидимому, помогает держать многие
вирусы под контролем.
24.
У приматов частота А → I-редактированиязначительно выше, чем у других
млекопитающих, и в большинстве случаев оно
происходит на РНК, транскрибируемых с
представленных в большом изобилии Aluэлементов. Было выдвинуто предположение, что
А → I-редактирование остановило эти
мобильные элементы от полного «захвата»
нашего генома благодаря инактивации
необходимых для их пролиферации
транскриптов РНК (см. рис. 5.74). Если эта идея
верна, то редактирование РНК, возможно,
глубоко повлияло на формирование
современного генома человека.
25. 5. Регуляция экспорт зрелой мРНК из ядра в цитоплазму.
По подсчетам, пределы клеточного ядра умлекопитающих покидает только около одной
двадцатой части от всей массы синтезируемых
РНК.
Не до конца процессированные или
поврежденные иным путем РНК в итоге
разрушаются как часть системы контроля
качества образования РНК
экспорт молекул РНК из ядра откладывается до
момента окончания процессинга.
Однако для регуляции экспрессии генов могут
использоваться механизмы, которые
преднамеренно игнорируют эту контрольную точку.
26.
1.2.
3.
4.
5.
Поли А связывающие белки
СВС- КЭП связывающий белок
EJC- Комплекс соединения экзонов
Белки hnРНП
Рецептор ядерного экспорта
27.
28.
29.
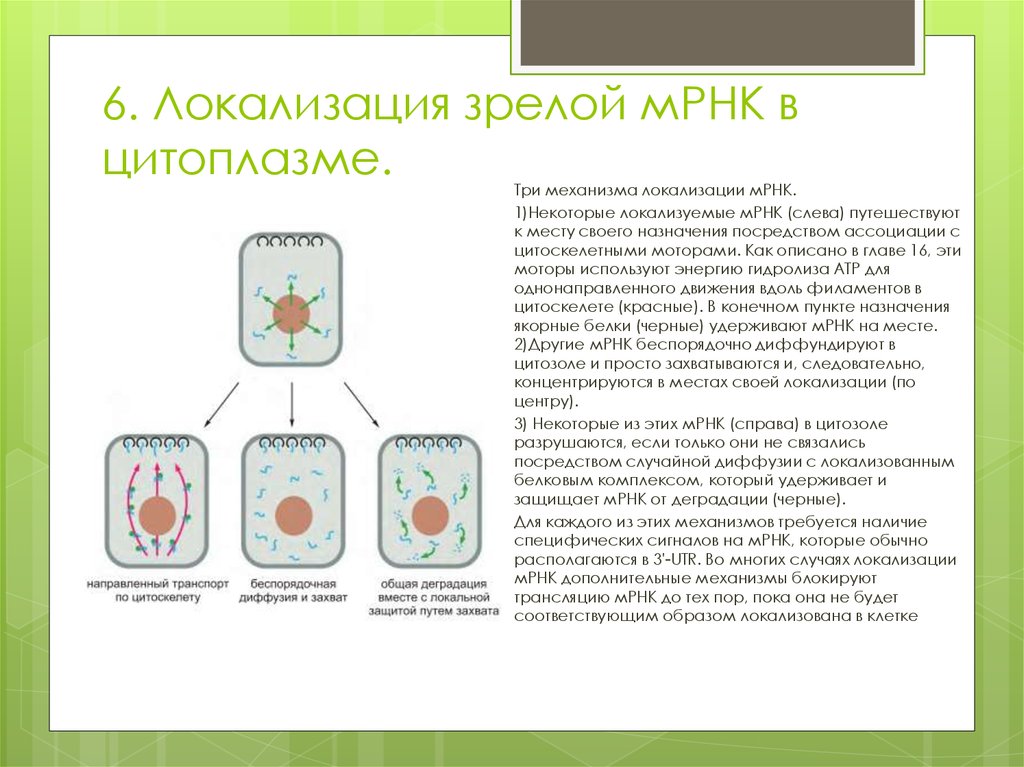
30. 6. Локализация зрелой мРНК в цитоплазме.
Три механизма локализации мРНК.1)Некоторые локализуемые мРНК (слева) путешествуют
к месту своего назначения посредством ассоциации с
цитоскелетными моторами. Как описано в главе 16, эти
моторы используют энергию гидролиза ATP для
однонаправленного движения вдоль филаментов в
цитоскелете (красные). В конечном пункте назначения
якорные белки (черные) удерживают мРНК на месте.
2)Другие мРНК беспорядочно диффундируют в
цитозоле и просто захватываются и, следовательно,
концентрируются в местах своей локализации (по
центру).
3) Некоторые из этих мРНК (справа) в цитозоле
разрушаются, если только они не связались
посредством случайной диффузии с локализованным
белковым комплексом, который удерживает и
защищает мРНК от деградации (черные).
Для каждого из этих механизмов требуется наличие
специфических сигналов на мРНК, которые обычно
располагаются в 3'-UTR. Во многих случаях локализации
мРНК дополнительные механизмы блокируют
трансляцию мРНК до тех пор, пока она не будет
соответствующим образом локализована в клетке
31.
Если мРНК кодирует белок, который предназначендля секреции или экспрессирования на клеточной
поверхности, то сигнальная последовательность на
аминоконце белка направит его к
эндоплазматическому ретикулуму (ER;
endoplasmic reticulum). Компоненты
сортирующего белки аппарата клетки распознают
сигнальную последовательность сразу же, как она
появляется из рибосомы, и направляют весь
комплекс, состоящий из рибосомы, мРНК и
растущего белка, к мембране ER, где
синтезируется оставшаяся часть полипептидной
цепи В других случаях свободные рибосомы
полностью синтезируют белок в цитозоле, а
сигналы, содержащиеся в законченной
полипептидной цепи, затем могут направлять
белок к другим участкам в клетке.
32.
Некоторые мРНК сами направляются к специфическим местам внутриклетки перед началом своей эффективной трансляции, что позволяет
клетке расположить молекулы мРНК близко к местам, где существует
потребность в кодируемом ими белке. Такая стратегия предоставляет
клетке множество преимуществ. Например, позволяет создавать
асимметрию в цитозоле клетки, а это ключевой этап на многих стадиях
развития. Локализованная мРНК в сочетании с контролем трансляции
также позволяет клетке осуществлять независимую регуляцию
экспрессии генов в различных частях клетки. Это свойство является
особенно важным в больших, сильно поляризованных клетках, например
нейронах, где конусы роста должны реагировать на сигналы, не ожидая
ответа от отдаленного ядра. Локализация РНК встречается у многих
организмов, включая одноклеточные грибы, растения и животных, и,
вероятно, является обычным механизмом, используемым клетками, чтобы
сконцентрировать интенсивный синтез белков в определенных местах.
Открыто несколько различных механизмов локализации мРНК (рис.
7.104), но для них всех необходимо наличие специальных сигналов в
самой мРНК. Эти сигналы обычно сосредоточены в 3'-нетранслируемой
области (UTR; untranslated region) — области РНК, которая тянется от стопкодона, терминирующего синтез белка, до начала поли-A хвоста (рис.
7.105). Такая локализация мРНК обычно сопряжена с механизмами
контроля трансляции, чтобы гарантировать, что мРНК останется
неактивной, пока не попадет на свое место.
33.
Одна РНК (меченная краснымфлуорохромом) содержит кодирующую
область белка Hairy (волосатости) дрозофилы
вместе со смежной 3’-UTR Другая РНК
(меченная зеленым флуорохромом) содержит
кодирующую область белка Hairy без 3’-UTR.
Две РНК смешали и ввели в эмбрион
дрозофилы на стадии развития, при которой
множество ядер находится в общей
цитоплазме. Когда спустя 10 минут
визуализировали флуоресцентные РНК, полная
РНК белка Hairy (красная) располагалась на
передней стороне ядер (голубые), а
локализации транскрипта без 3'-UTR (зеленый),
не произошло. Белок Hairy является одним из
многих регуляторных белков, определяющих
позиционную информацию в развивающемся
эмбрионе дрозофилы
Яйцо дрозофилы представляет
особенно яркий пример
локализации РНК. Локализация
мРНК, кодирующей регуляторный
белок bicoid, происходит путем
прикрепления ее к цитоскелету на
переднем конце развивающегося
яйца. Когда оплодотворение
запускает трансляцию этой мРНК,
то создается градиент
концентрации белка bicoid,
играющего ключевую роль в
направлении развития передней
части эмбриона (показано на рис.
7.53 и более подробно
обсуждается в главе 22). Многие
мРНК в соматических клетках
локализуются похожим способом.
Например, в фибробластах
млекопитающих мРНК,
кодирующая актин, посредством
сигнала в 3’-UTR располагается в
богатом актиновыми
филаментами кортексе клетки.
34.
Молекулы мРНК, выходя из ядра, несут многочисленныеметки в виде модификаций РНК (5’-кэп и 3’-поли-A хвост)
и связанных белков (например, комплексов соединения
экзонов), отмечающих успешное завершение различных
этапов процессинга пре-мРНК. Только что было описано,
что 3’-UTR мРНК можно рассматривать как «почтовый
индекс», направляющий мРНК в различные места в
клетке.
мРНК несут информацию, устанавливающую их
среднюю продолжительность жизни в цитозоле и
эффективность, с которой с них транслируется белок. В
широком смысле нетранслируемые области
эукариотических мРНК напоминают контролирующие
области генов при транскрипции: их нуклеотидная
последовательность содержит информацию,
определяющую «способ применения» РНК, и белки
интерпретируют эту информацию, связываясь
специфически с этими последовательностями. Таким
образом, помимо сведений об аминокислотной
последовательности белков, молекулы РНК насыщены
многими дополнительными видами информации.
35. Регуляция трансляции.
1.2.
3.
Контроль инициации трансляции
Регулируемая деградация мРНК в
цитоплазме.
Микро РНК.
36.
1. выбор кодона AUG как сайта началатранскрипции во многом определяется его
близостью к кэп-структуре на 5'-конце молекулы
мРНК — участке, где малая рибосомная субчастица
связывается с мРНК и начинает поиск
инициирующего кодона AUG.
2. репрессоры трансляции связываются с 5'-концом
мРНК и тем самым ингибируют инициацию
трансляции.
3. Другие репрессоры распознают нуклеотидные
последовательности в 3'-UTR специфических молекул
мРНК и снижают интенсивность инициации
трансляции, препятствуя коммуникации между 5'кэпом и 3'-поли-A хвостом
4. Чрезвычайно важный тип контроля трансляции у
эукариот зависит от малых РНК (называемых
микроРНК, или miРНК), которые связываются с мРНК и
снижают выход белка.
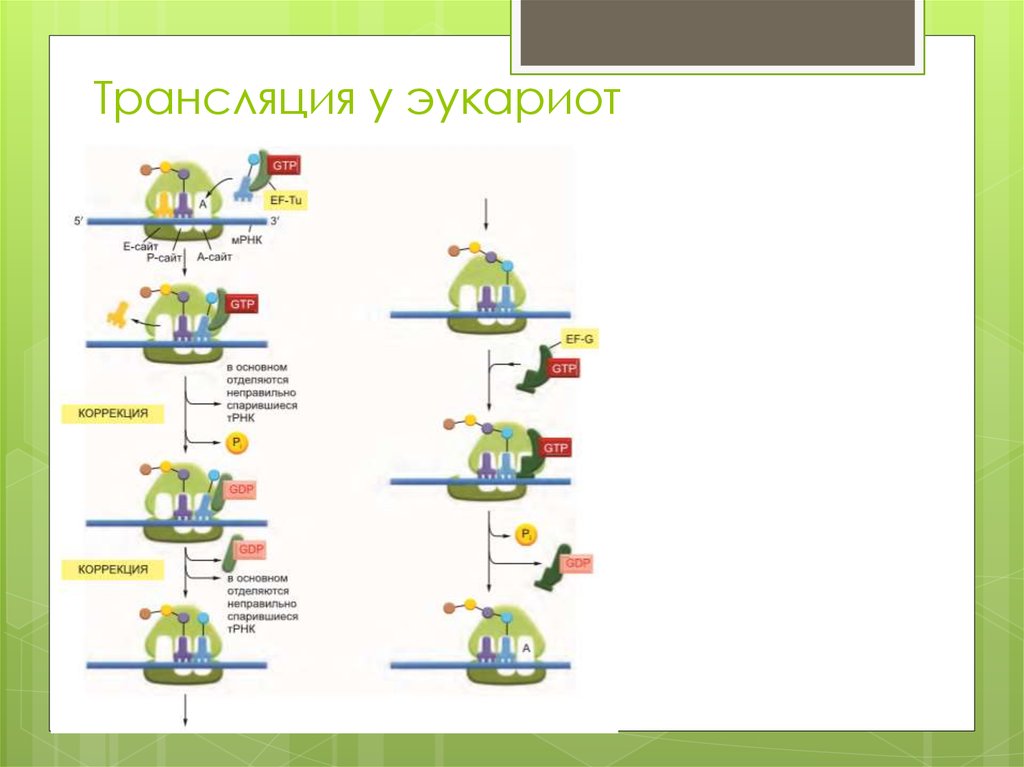
37. Трансляция у эукариот
38.
1.2.
У эукариот существуют два основных механизма
нахождения рибосомой стартового AUG: кэпзависимый
(сканирующий) и кэпнезависимый (внутренняя
инициация).
При сканирующем механизме рибосома (точнее, её
малая субъединица) садится на 5'-конец мРНК в
области кэпа и двигается вдоль молекулы мРНК,
«сканируя» один кодон за другим, пока не наткнётся
на инициаторный AUG. Для привлечения рибосомы к
5'-концу мРНК требуется специальная
структура, кэп — 7-метилгуанин, прикреплённый к 5'концевому нуклеотиду мРНК.
При механизме внутренней инициации, называемом у
эукариот также IRES-зависимым механизмом,
рибосома садится на внутренний участок мРНК,
называемый IRES (англ. Internal Ribosomal Entry Site,
участок внутренней посадки рибосомы) — участок
мРНК, обладающий выраженной вторичной
структурой, позволяющей ему направлять рибосомы
на стартовый AUG. По IRES-зависимому механизму
инициируется синтез лишь на небольшой части
клеточных мРНК, а также на РНК некоторых вирусов.
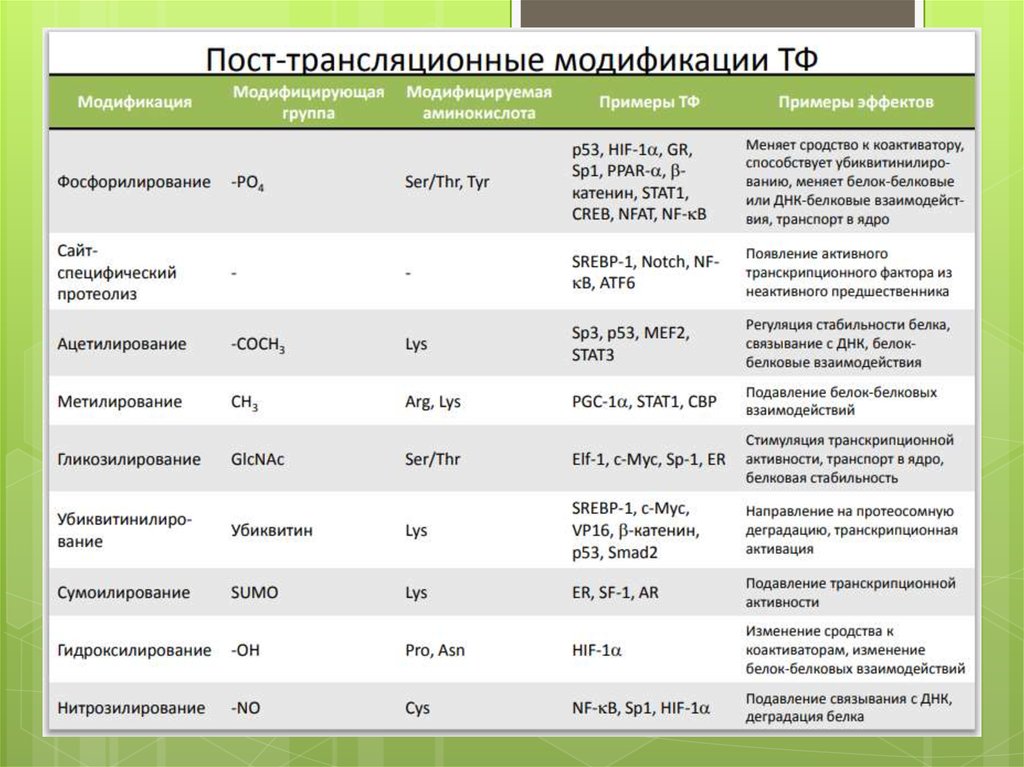
39. Посттрансляционная модификация белка
1)2)
3)
4)
5)
6)
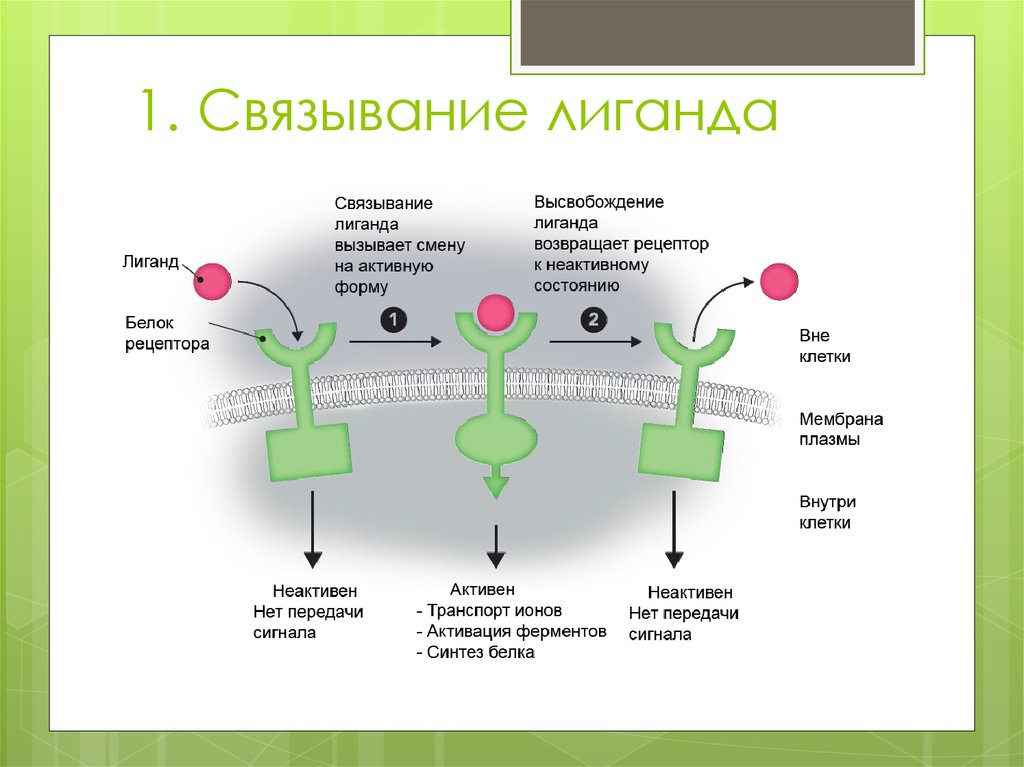
Связывание лиганда
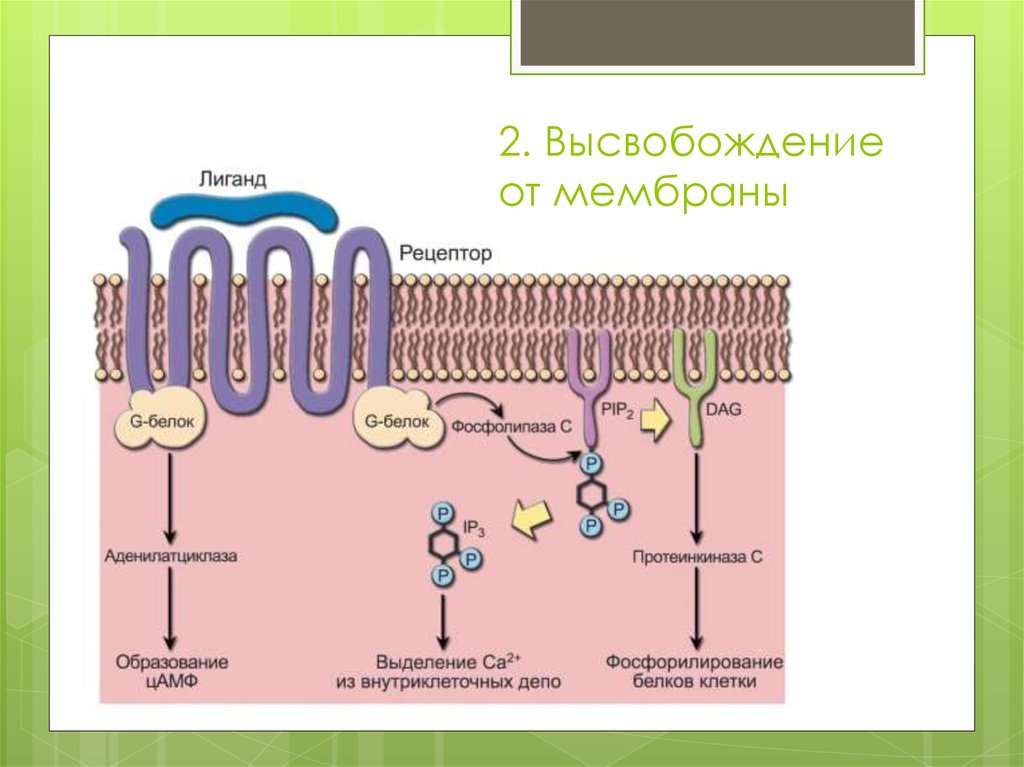
Высвобождение от мембраны
Ковалентная модификация
Добавление 2-й субъединицы
Стимулирование переноса в ядро
Демаскировка
40.
41. 1. Связывание лиганда
42. 2. Высвобождение от мембраны
43. 3. Ковалентная Модификация
Фосфорилирование• Транспорт в ядро фофорилирование
сигнала ядерной
локализации - регуляция
связывания с
цитоплазматическим
«якорем»
• Изменение сродства
к ДНК (повышение или
снижение)
• Изменение
трансактивационных
свойств (повышение
или снижение) • и
44.
45.
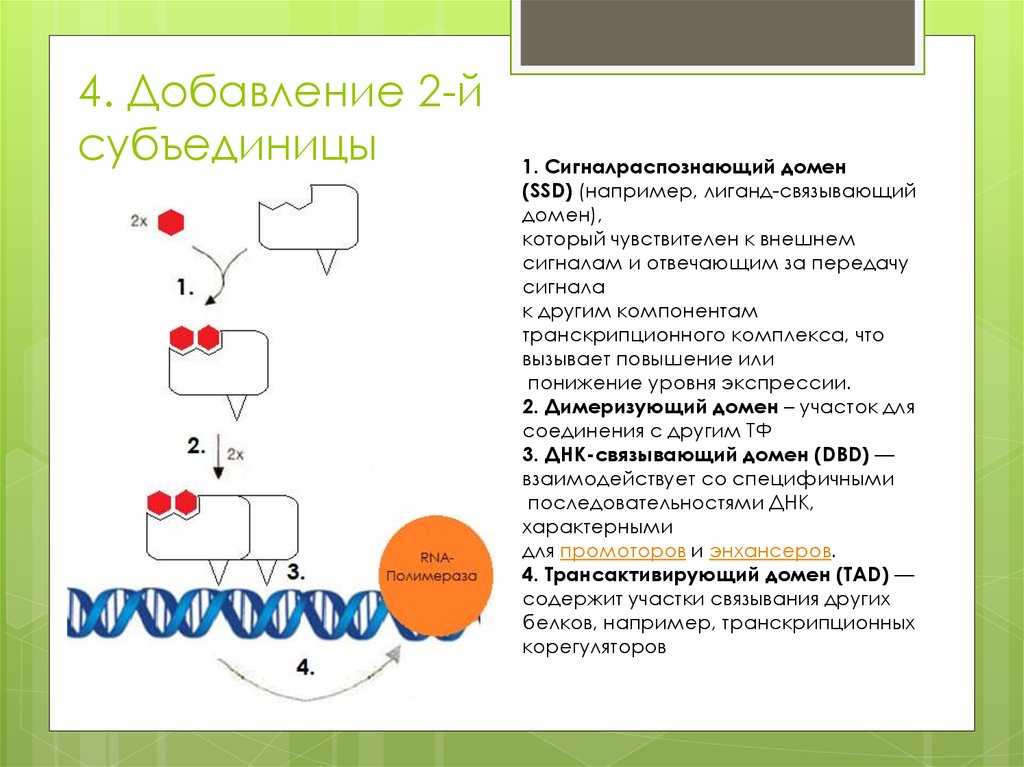
4. Добавление 2-йсубъединицы
1. Сигналраспознающий домен
(SSD) (например, лиганд-связывающий
домен),
который чувствителен к внешнем
сигналам и отвечающим за передачу
сигнала
к другим компонентам
транскрипционного комплекса, что
вызывает повышение или
понижение уровня экспрессии.
2. Димеризующий домен – участок для
соединения с другим ТФ
3. ДНК-связывающий домен (DBD) —
взаимодействует со специфичными
последовательностями ДНК,
характерными
для промоторов и энхансеров.
4. Трансактивирующий домен (TAD) —
содержит участки связывания других
белков, например, транскрипционных
корегуляторов
46. Лейциновая молния (leucine zipper)
4. Добавление 2-йсубъединицы
Состоит из двух α-спиралей,
По одной от каждого мономера
При комбинации различных альфаСпиралей, они могут взаимодействовать
С разными специфическими последовательностями
Это явление: Гетеродимеризация является примером
Комбинаторного контроля
47.
5. Стимулирование переноса в ядро6. Демаскировка


































 Биология
Биология








