Похожие презентации:
Глобальные загрязнения. Факторы глобального экологического кризиса
1. Физическая экология
Занятие 10Глобальные загрязнения
2. Факторы глобального экологического кризиса
«Назначение человечества, похоже, заключается втом, чтобы уничтожить свой род, предварительно
сделав Землю непригодной для обитания»
Жан Батист Пьер Антуан де Моне Ламарк (Lamarck),
1809 г.
К глобальные антропогенным загрязнениям относят четыре
явления, а именно:
1. глобальные загрязнения экологическими токсинами,
2. кислотные дожди (с pH < 5 и до 2.5),
3. озоновые дыры в атмосфере,
4. антропогенный климатический (парниковый) эффект.
3. Экологические токсины
Так условились называть вещества искусственногопроисхождения, обладающие особой опасностью для
природной среды. К ним относят стойкие органические
загрязнители
(СОЗ):
хлорсодержащие
диоксины
и
полициклические ароматические углеводороды, а также
тяжелые металлы.
В настоящее время в Российской Федерации в наибольшей
степени применяется комплекс показателей предельно
допустимых концентраций (ПДК). Действуют более 1900 ПДК
вредных химических веществ для водоемов, более 500 для
атмосферного воздуха и более 130 для почв.
4. Диоксины
Группа хлорорганических соединений – полихлорированныедибензо-п-диоксины (ПХДД) и диоксиноподобные соединения.
Чужеродные живым организмам вещества (ксенобиотики),
поступающие в живую и неживую природу с продукцией или
отходами. Пример: 2,3,7,8-тетрахлордибензо-пара-диоксин.
Диоксины – это глобальные экотоксины, обладающие мощным
мутагенным, иммунодепрессантным и канцерогенным
действием. Они накапливаются как в организме человека, так и
глобально в биосфере. Величина летальной дозы этих веществ
достигает 10−6 г/кг живого веса, что меньше аналогичной
величины для боевых отравляющих веществ, например, зомана,
зарина и табуна (порядка 10−3 г/кг). Токсичность диоксинов
заключается в способности точно вписываться в рецепторы
живых организмов и подавлять или изменять их жизненные
функции. Для диоксинов не существует ПДК – они токсичны при
любых концентрациях.
5. Пример диоксина: ДДТ
ДДТ (ДихлорДифенилТрихлорметилметан) – примерклассического инсектицида.
Синтезирован в 1873 г. австрийским химиком Отмаром
Цейдлером (Othmar Zeidler).
Инсектицидные свойства открыл в 1939 г. швейцарский химик
Пауль Мюллер (Paul Müller).
В 1943 г. успешно применен для борьбы с распространителями
эпидемии тифа – вшами
В 1948 г. П. Мюллер получил Нобелевскую премию по
физиологии и медицине с формулой «За открытие высокой
эффективности ДДТ как контактного яда».
С 1950 г. по 1970 г. в мире было произведено более миллиона
тонн ДДТ.
После 1976 г. запрещен к производству и
сельскохозяйственному употреблению в большинстве стран.
6. Полициклические ароматические углеводороды (ПАУ)
ПАУ – это химические соединения, состоящие из двух иболее сцепленных бензольных колец (нафталин, антрацен,
пирен и др.). ПАУ встречаются в нефти, каменном угле,
отложениях смолы. В основе практически всех техногенных
источников ПАУ лежат термические процессы, связанные со
сжиганием и переработкой органического сырья:
нефтепродуктов, угля, древесины, мусора и др.
Как загрязняющий агент ПАУ являются предметом большой
обеспокоенности потому, что многие соединения были
идентифицированы как канцерогенные, мутагенные и
тератогенные.
7. Пример ПАУ: бенз(а)пирен (С20Н12)
Бенз(а)пирен является наиболее типичнымхимическим канцерогеном окружающей
среды, он опасен для человека даже при
малой концентрации, поскольку обладает
свойством аккумуляции. Будучи химически
сравнительно устойчивым, бенз(а)пирен
может долго мигрировать из одних
объектов в другие. В результате объекты,
сами не обладающие способностью
синтезировать бенз(а)пирен, становятся его
вторичными источниками. Бенз(а)пирен
оказывает также мутагенное воздействие
на биологические системы.
8. Тяжелые металлы
Термин тяжёлые металлы чаще рассматривается не с химической,а с медицинской и природоохранной точек зрения (формально,
металлы с плотностью большей, чем плотность железа) и, таким
образом, при включении в эту категорию учитываются не только
химические свойства элемента, но и его биологическая
активность и токсичность, а также объём использования в
хозяйственной деятельности.
Тяжёлые металлы выделяются высокой токсичностью, многие способностью к накоплению в живых организмах. Они поступают
в окружающую среду со стоками и пылью промышленных
предприятий. Образуют стойкие органические соединения с
хорошей растворимостью и способностью к миграции в
природных водах. К тяжёлым металлам относят более 40
элементов, но при учёте токсичности, стойкости, способности
накапливаться во внешней среде и масштабов распространения,
контроля требуют около 10.
9. Тяжелые металлы: ртуть
Ртуть (Hg) переносится со стоками промышленных вод и черезатмосферу. В составе атмосферной пыли содержится около 12
тыс. тонн ртути. До трети от этого количества образуется при
выветривании пород, содержащих ртуть. Ртуть антропогенного
происхождения попадает в атмосферу в первую очередь при сжигании
угля на электростанциях. Около половины годового промышленного
производства (910 тыс. т) попадает в океан. Соединения ртути
накапливается многими морскими и пресноводными организмами в
концентрациях, во много раз превышающих её содержание в воде.
Соединения ртути высоко токсичны для человека. Употребление в
пищу рыбы и морепродуктов неоднократно приводило к ртутному
отравлению населения. Так, к 1977 году насчитывалось 2800
жертв болезни Минамата, причиной которой послужило поступление
в со сточными водами отходов предприятий, на которых в качестве
катализатора использовалась хлористая ртуть.
10. Тяжелые металлы: свинец
Свинец (Pb) -- рассеянный элемент, содержащийся во всехкомпонентах окружающей среды: в горных породах, почвах,
природных водах, атмосфере, живых организмах. Содержание в
коре: 1,6·10-5, естественный цикл 0,2·1012 г/год.
Помимо того, свинец поступает в окружающую среду в результате
хозяйственной деятельности человека, производство 2,5·1012 г/год.
До запрета на использование в топливе тетраэтилсвинца (ТЭС)
Pb(CH3CH2)4 в конце XX века, выхлопные газы транспорта были
самым заметным источником свинца в атмосфере.
С континентальной пылью из атмосферы океан получает 20—30
тысяч тонн свинца в год.
В организм человека свинец попадает как с пищей и водой, так и
из воздуха в количестве 70 – 400 мкг/сутки. Свинец может
выводиться из организма, однако малая скорость выведения
может приводить к накоплению в костях, печени и почках.
11. Экологические риски
Источник рискаРиск, человек/год
Смерть от болезни
8,5·10-3
Смерть от природных
катастроф
Смерть от
профессиональной
деятельности
мужчины
женщины
Смерть от техногенных
факторов (экотоксинов)
10-5
10-2
2,6·10-3
10-5
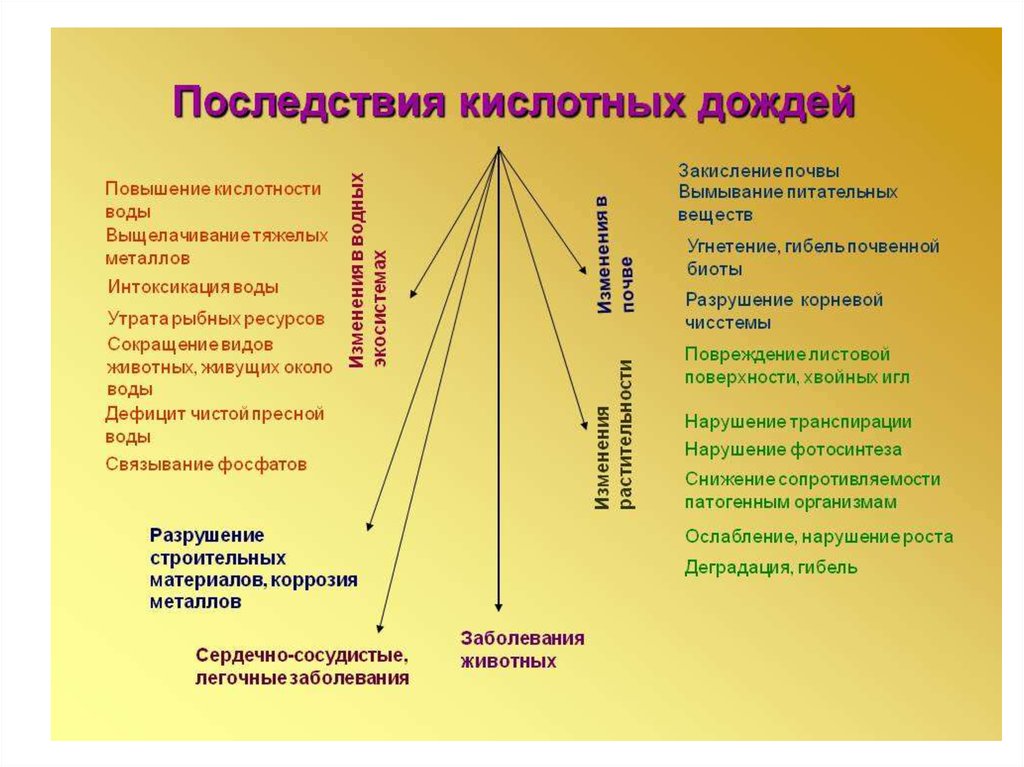
12. Кислотные дожди (КД)
«Чистый» дождь имеет слегка кислую реакцию с рН 5,6, чтосоответствует равновесию между СО2 воды и атмосферы. Из-за
постоянного присутствия в атмосфере различных примесей,
реальный рН дождя варьирует от 4,9 до 6,5, со средним
значением около 5,0 для зоны умеренных лесов. «Кислотным»
считают дождь с рН ниже 5,0. Загрязнение атмосферы большим
количеством оксидов серы и азота увеливает кислотность
осадков за пределы значений, переносимых большинством
организмов.
Негативное влияние КД а окружающую среду наиболее остро
проявляется в озерах и крупных реках. Смещение рН
показателя в кислую сторону вызывает гибель организмов и
экосистем. Закисление водоемов приводит к масштабным
потерям растений и животных, утрате рыбных ресурсов,
миграции видов и нарушению пищевых цепей.
13.
14.
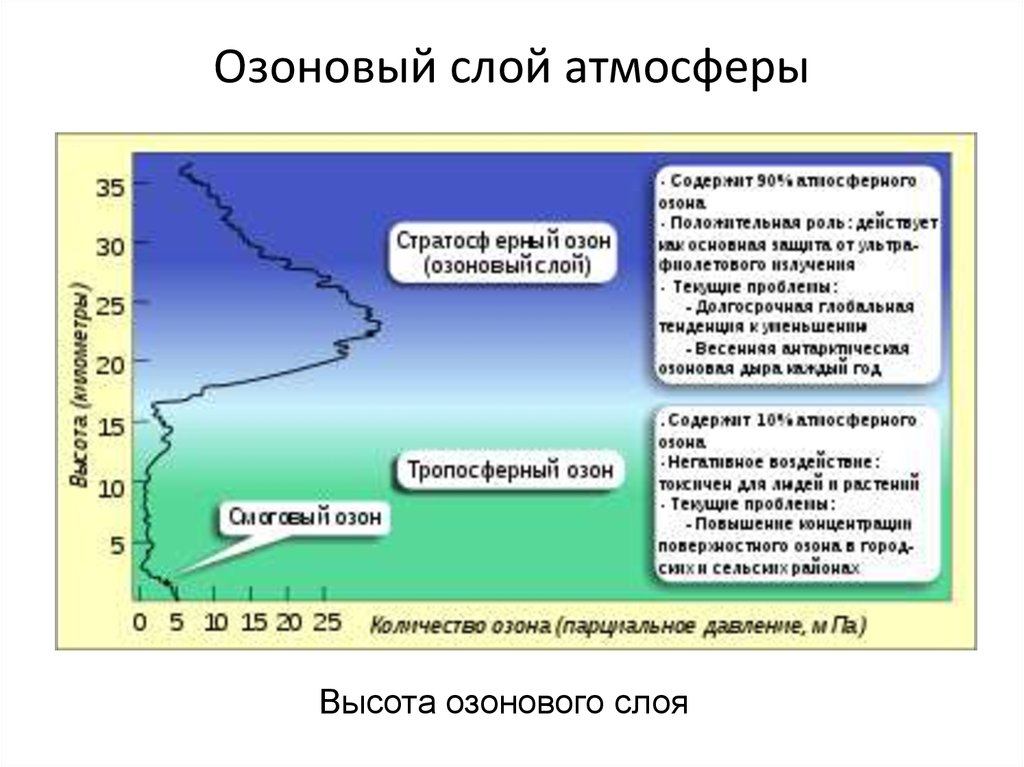
Озоновый слой атмосферыВысота озонового слоя
15. Динамика озонового слоя
Озон (молекула O3), газ тяжелее воздуха с характернымзапахом, в тропосфере является микропримесью, в
стратосфере играет уникальную роль поглотителя жесткого
ультрафиолетового излучения. Среднее планетарное
содержание составляет 8·1018 молекул на см-2, доля по
массе – 6·10-7, а суммарная толщина слоя при стандартных
условиях – около 3 мм. Для измерения толщины слоя озона
была введена специальная Добсоновская единица (DU)
интегральной по высоте концентрации:
1 DU = 2,69·1016 мол·см-2;
100 DU = 1 мм O3 = 2,69·1018 мол·см-2.
Среднее время жизни молекулы озона в стратосфере
меняется от минут и часов на высотах 40 – 50 км и суток на
30 км, до месяцев и единиц лет в слое максимальной
концентрации 15 – 20 км.
16. Цикл Чепмена (Sydney Chapman)
Образование озона:O2 + hν → 2 O
при длине волны < 240 нм
O + О2 + M → O3 + M
Диссоциация молекулярного кислорода на атомарный
сопровождается изменением энтальпии на 498 кДж·моль-1.
Проверим требуемую длину волны фотона:
hcN (6,6 10 34 Дж с)(3 108 м с 1 )(109 нм м 1 )(6 1023 моль 1 )
240нм
1
E
498000 Дж моль
Разрушение озона:
O3 + hν → O2 + O(1D) при длине волны 250 < hν < 300 нм
O(1D) + M → O + M
O + O + M → O2 + M
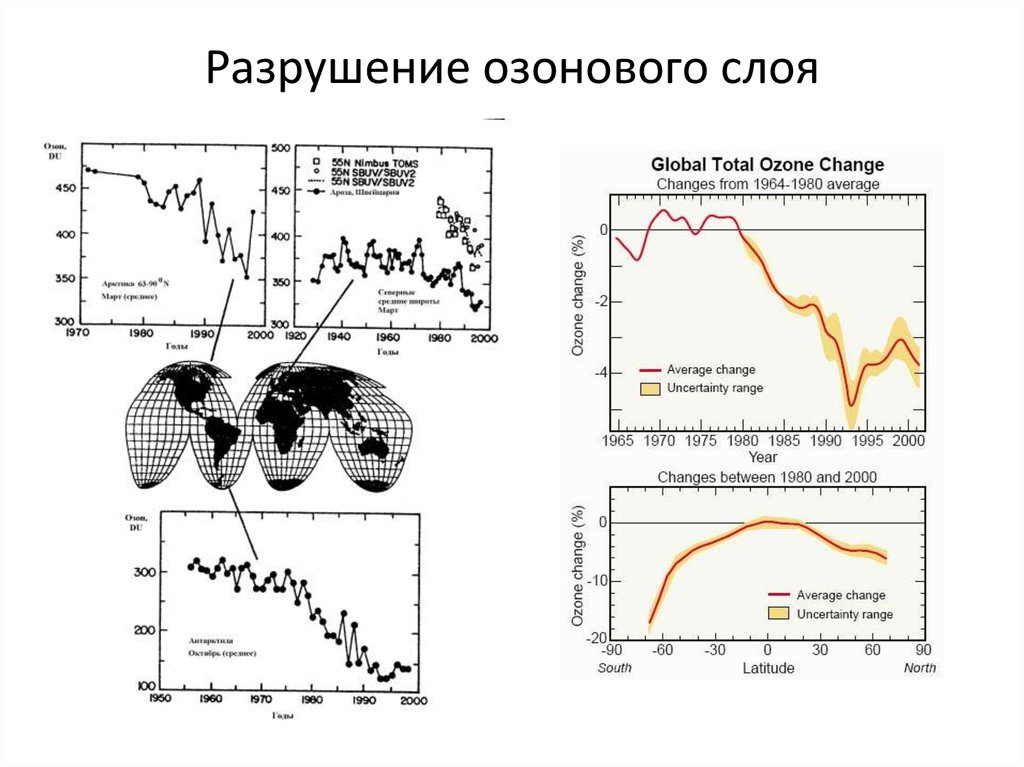
17. Разрушение озонового слоя
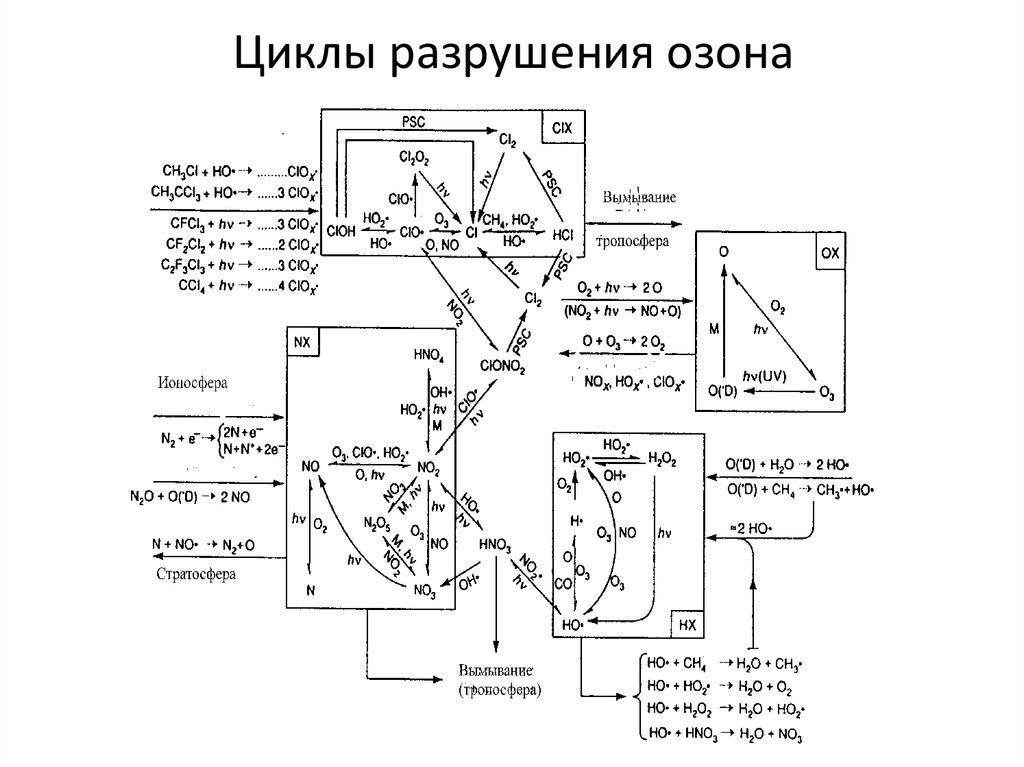
18. Циклы разрушения озона
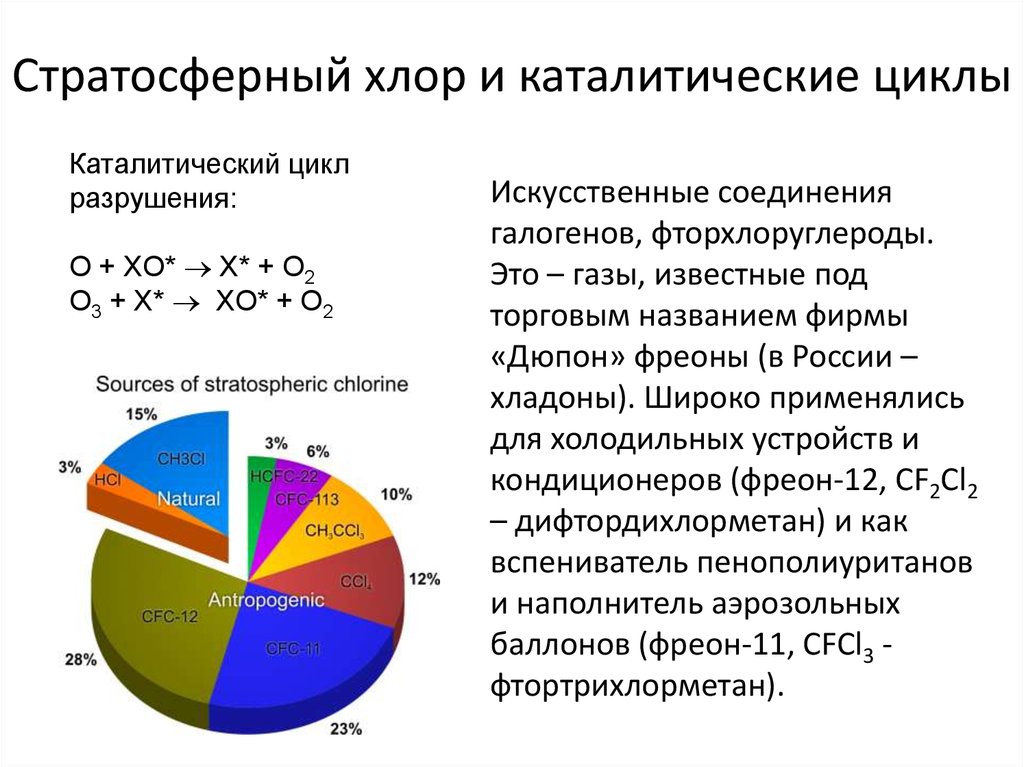
19. Стратосферный хлор и каталитические циклы
Каталитический циклразрушения:
O + XO* X* + O2
O3 + X* XO* + O2
Искусственные соединения
галогенов, фторхлоруглероды.
Это – газы, известные под
торговым названием фирмы
«Дюпон» фреоны (в России –
хладоны). Широко применялись
для холодильных устройств и
кондиционеров (фреон-12, CF2Cl2
– дифтордихлорметан) и как
вспениватель пенополиуританов
и наполнитель аэрозольных
баллонов (фреон-11, CFCl3 фтортрихлорметан).
20. Озоновая дыра
Локальное падение концентрацииозона в антарктической
стратосфере. Площадь озоновой
дыры составляла в 2018 году в
среднем 22,8 млн квадратных
километров (в 2010—2017 годах
среднегодовые величины
колебались от 17,4 до 25,6 млн
квадратных километров, в 2000—
2009 годах — от 12,0 до 26,6 млн
квадратных километров, в 1990—
1999 годах — от 18,8 до 25,9 млн
квадратных километров).
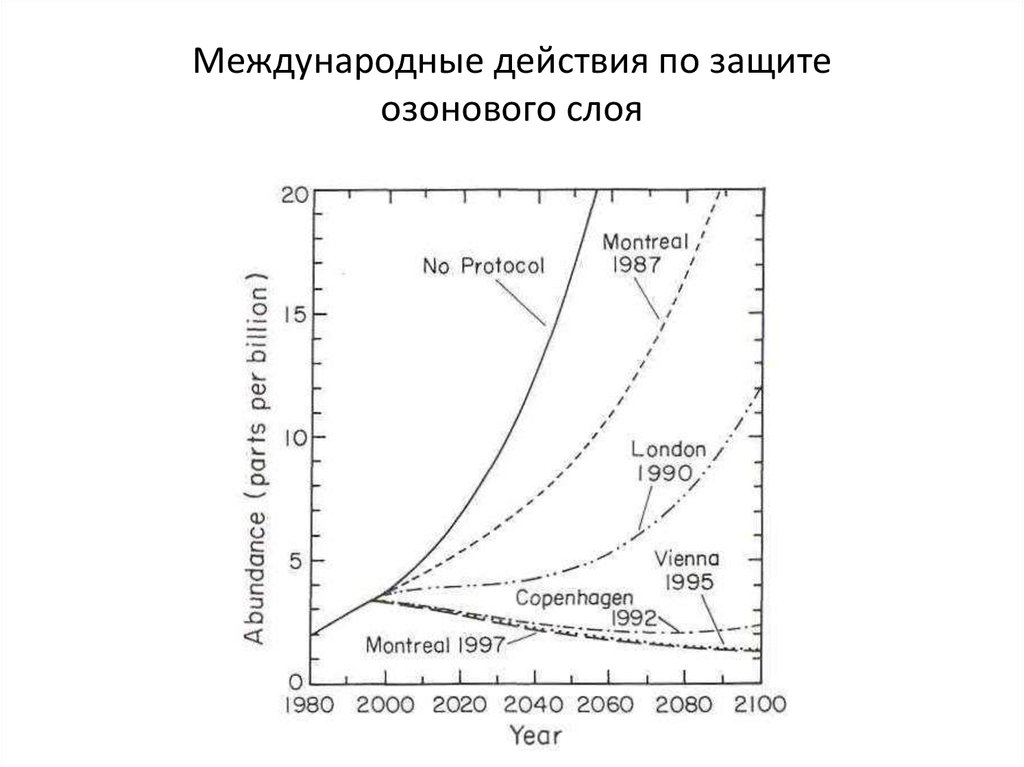
21. Международные действия по защите озонового слоя
1985 г. Венской конвенции об охране озонового слоя1986 г. Монреальский Протокол, участники взяли на себя
обязательство не превышать уровень производства
1990 г. Лондонский Протокол, рекомендация полного
прекращения производства фреонов к 2000 г.
В 1995 г. присуждена Нобелевская премия по химии за
работы по химии атмосферы, в частности, за механизмы
образования и разрушения атмосферного озона.
Премии удостоены Пауль Крутцен (Paul Crutzen), Фрэнк
Роуланд (Frank Rowland) и Марио Молина (Mario Molina)
22.
Международные действия по защитеозонового слоя
23.
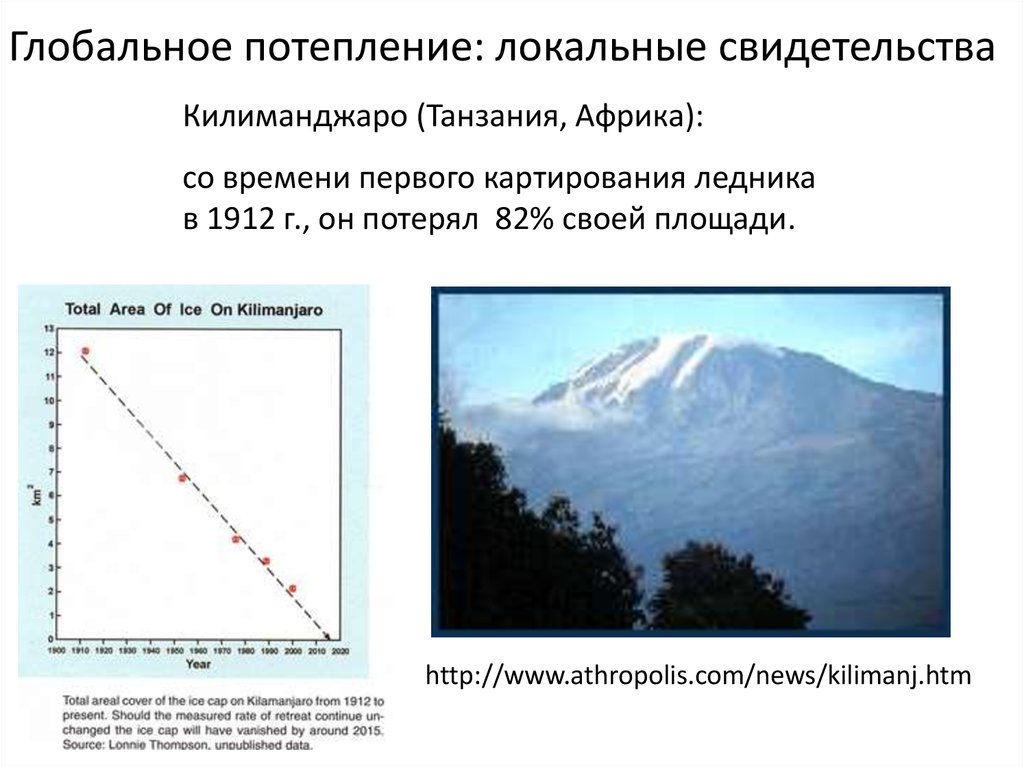
Глобальное потепление: локальные свидетельстваКилиманджаро (Танзания, Африка):
со времени первого картирования ледника
в 1912 г., он потерял 82% своей площади.
http://www.athropolis.com/news/kilimanj.htm
24.
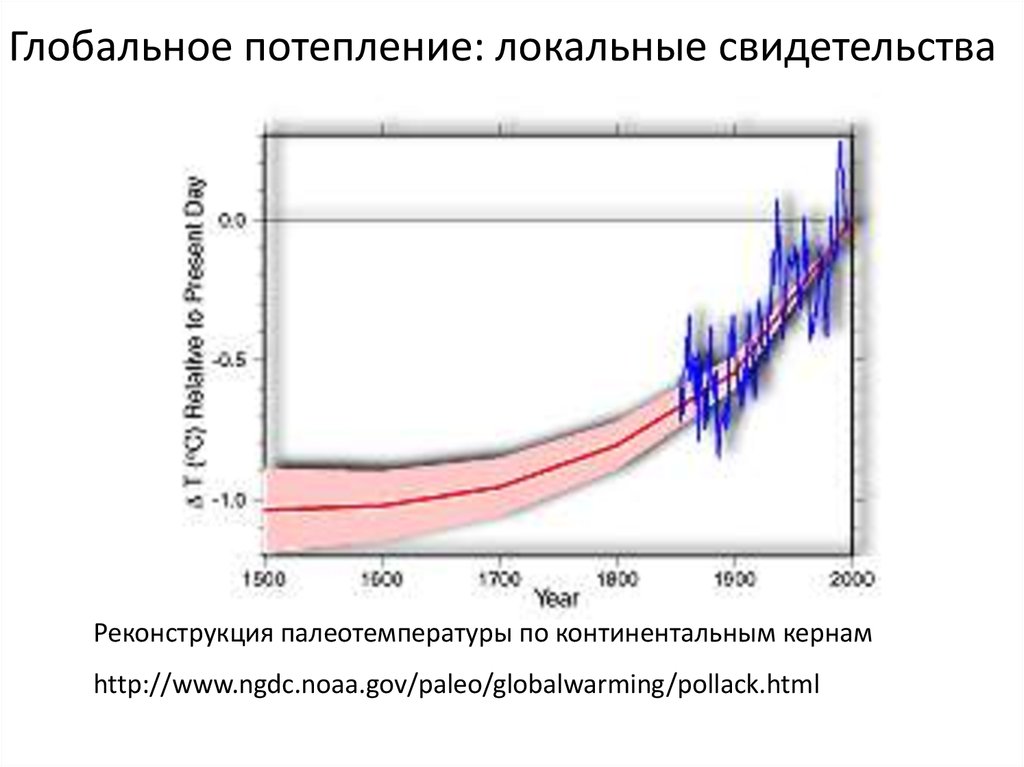
Глобальное потепление: локальные свидетельстваРеконструкция палеотемпературы по континентальным кернам
http://www.ngdc.noaa.gov/paleo/globalwarming/pollack.html
25.
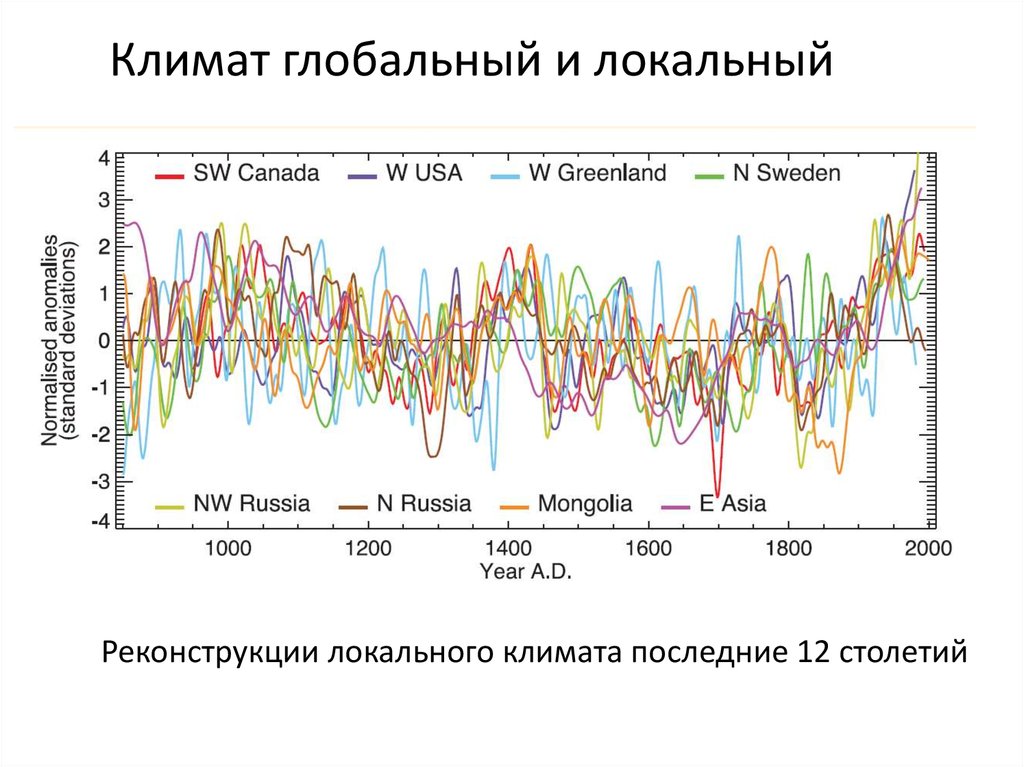
Климат глобальный и локальныйРеконструкции локального климата последние 12 столетий
26.
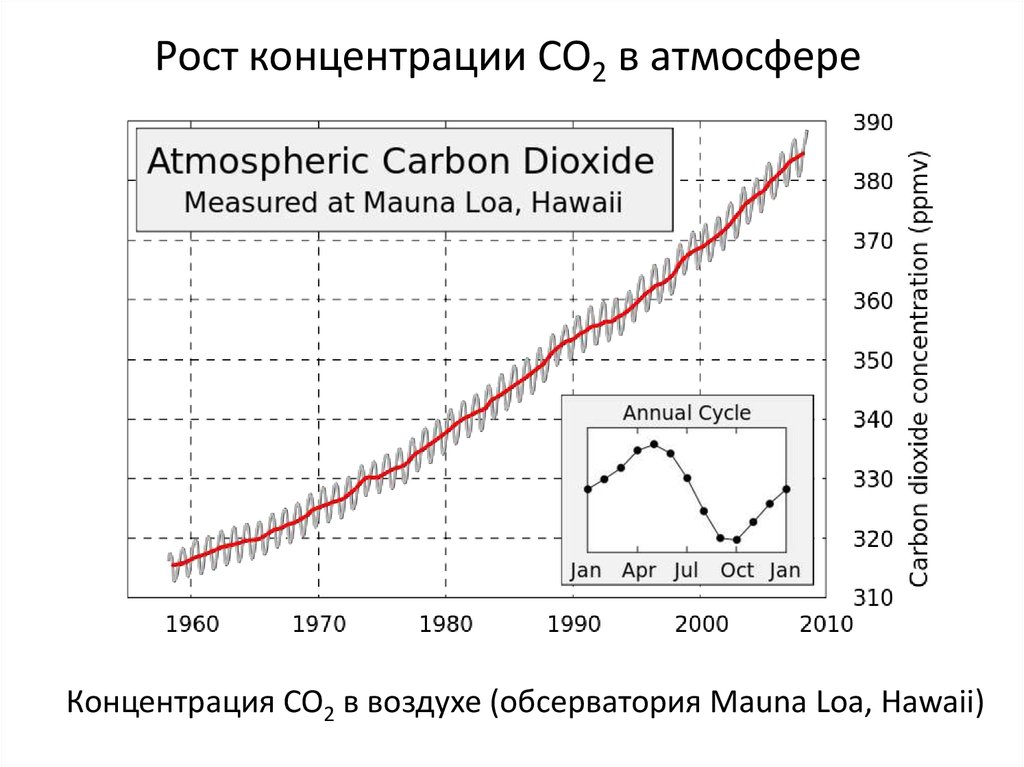
Рост концентрации CO2 в атмосфереКонцентрация CO2 в воздухе (обсерватория Mauna Loa, Hawaii)
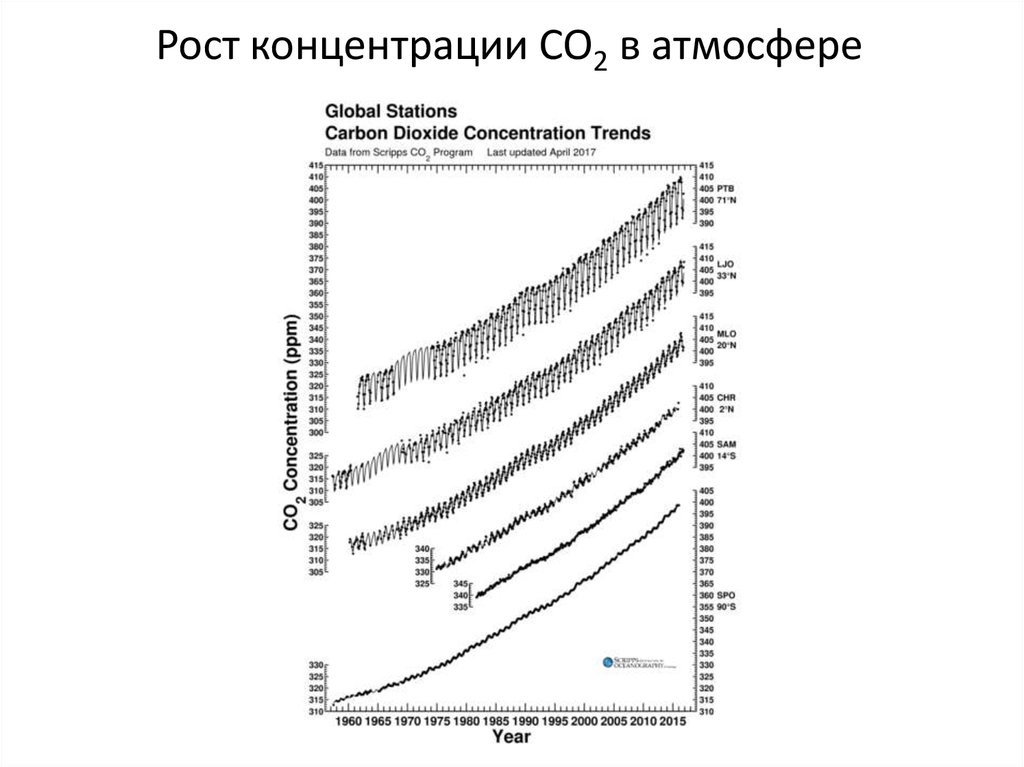
27.
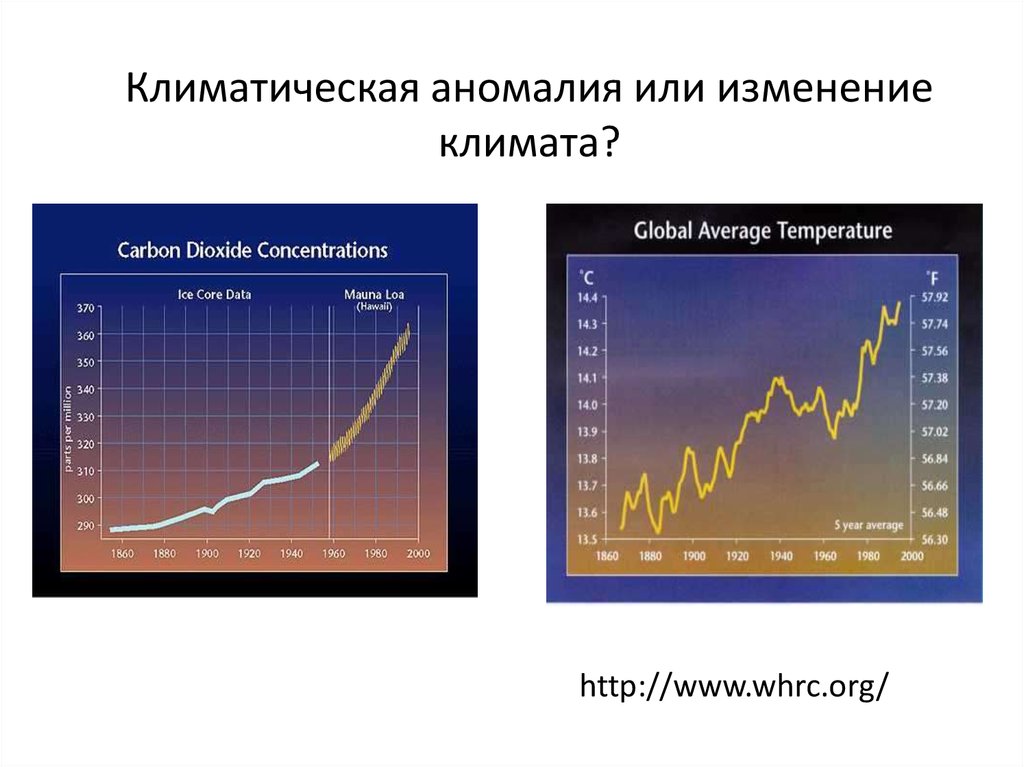
Рост концентрации CO2 в атмосфере28. Климатическая аномалия или изменение климата?
http://www.whrc.org/29.
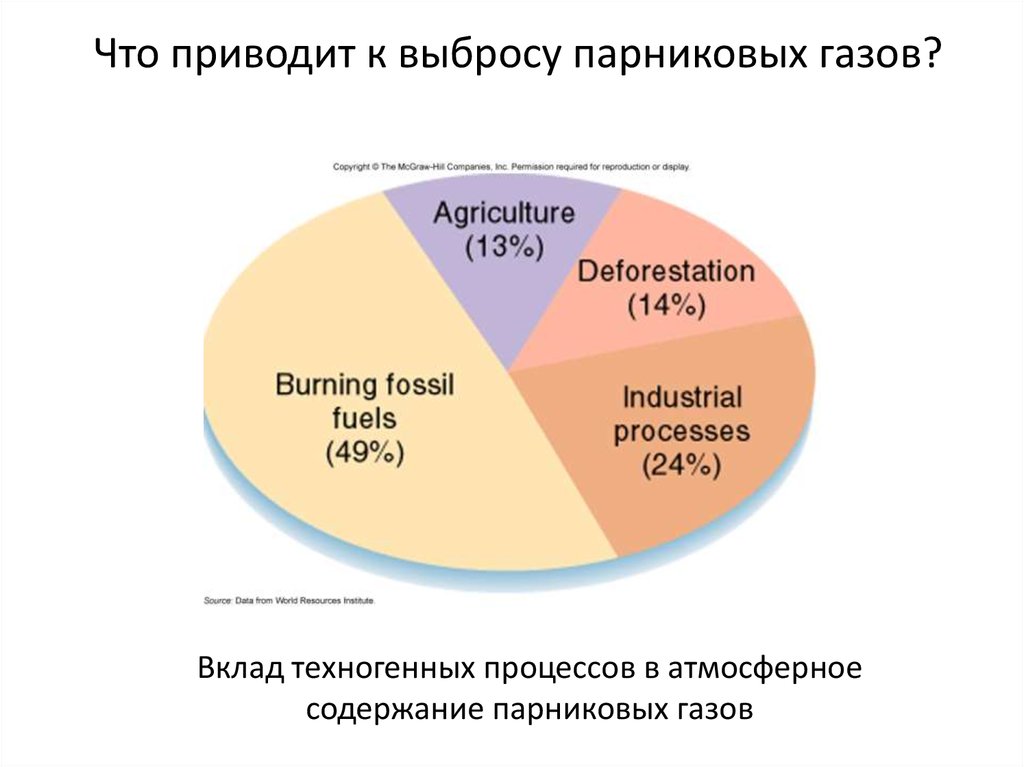
Что приводит к выбросу парниковых газов?Вклад техногенных процессов в атмосферное
содержание парниковых газов
30.
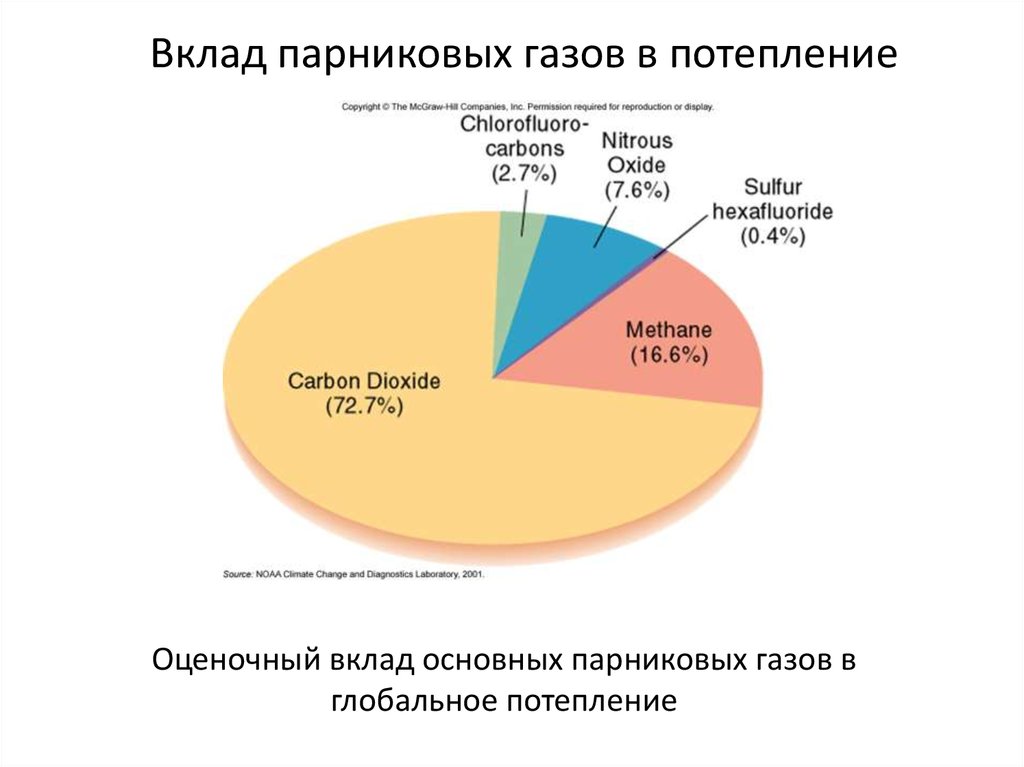
Вклад парниковых газов в потеплениеОценочный вклад основных парниковых газов в
глобальное потепление
















 Экология
Экология








