Похожие презентации:
Ионная связь и степень окисления. 8 класс
1.
Урок 8 классаИонная связь и степень
окисления.
12.05.2016
1
2.
Ионная связь.Ионная связь образуется при взаимодействии
атомов
элементов,
электроотрицательности
которых резко различаются.
Электроны почти полностью переходят от одного
атома к другому.
+
Na
12.05.2016
e
Cl
Na Сl
2
3.
Ионная связь.Химическую связь, возникающую между ионами в
результате действия электростатических сил
притяжения, называют ионной связью.
NaCl, KF, LiCl.
+
Na
12.05.2016
e
F
Na F
3
4.
Степени окисленияСтепень окисления –условный заряд атома в
молекуле, вычисленный в предположении, что все
связи имеют ионный характер.
Величину степени окисления определяет число
электронов, смещенных от атома менее
электроотрицательного элемента к атому более
электроотрицательного элемента.
12.05.2016
4
5.
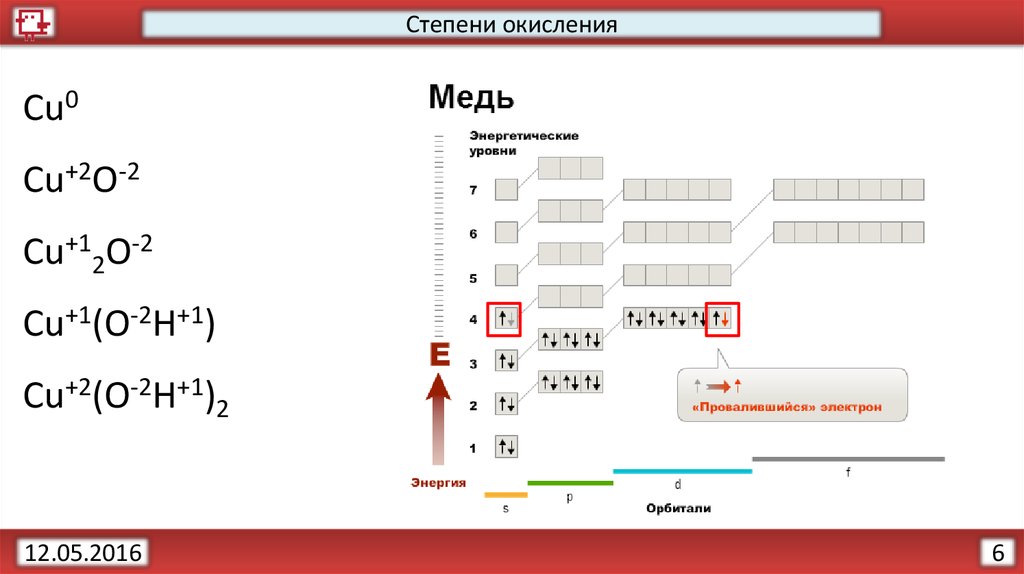
Степени окисленияОпределим степени окисления:
Cu
CuO
Cu2O
Cu(OH)
Cu(OH)2
12.05.2016
5
6.
Степени окисленияCu0
Cu+2O-2
Cu+12O-2
Cu+1(O-2H+1)
Cu+2(O-2H+1)2
12.05.2016
6
7.
Степени окисленияОпределим степени окисления:
Li
Li2O
Li(OH)
12.05.2016
7
8.
Степени окислениястепень окисления определяет число электронов,
смещенных от атома менее электроотрицательного
элемента к атому более электроотрицательного
элемента
Li0
Li+12O-2
Li+1(O-2H+1)
12.05.2016
8
9.
Степени окисления12.05.2016
9
10.
Степени окисления12.05.2016
10
11.
Степени окисленияЗапись степени окисления и заряда иона различаются.
Li0
Li+
Li+12O-2
OH-
Li+1(O-2H+1)
[AlCl6]3-
Степени
окисления
12.05.2016
Заряд ионов
11
12.
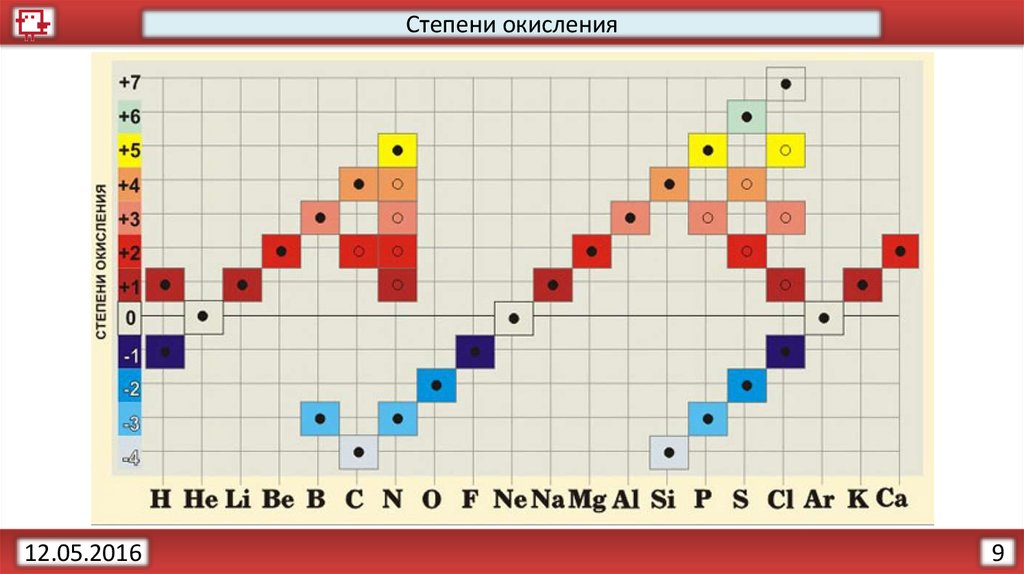
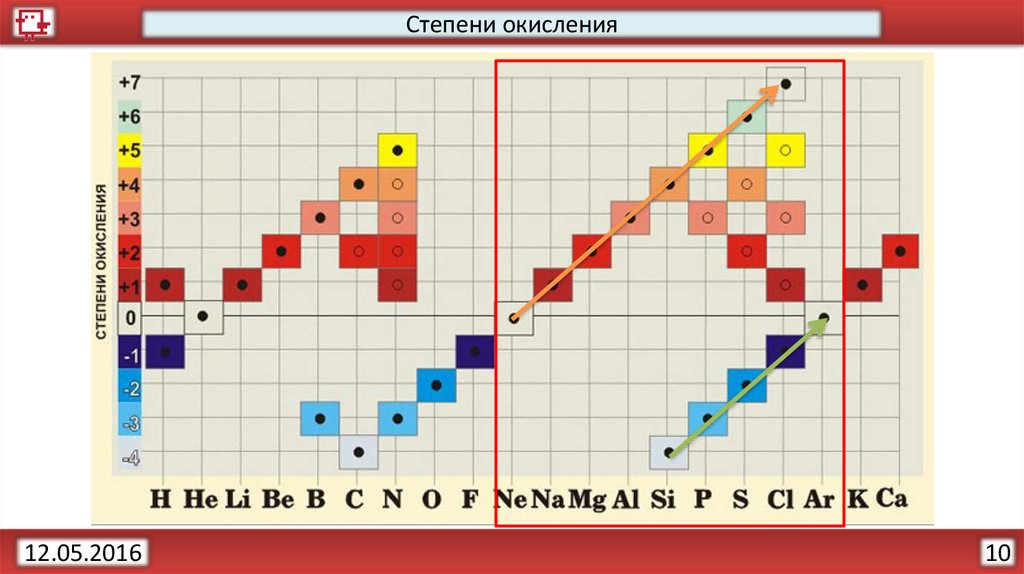
Правила вычисления степени окисления элементовСумма степеней окисления атомов в соединении всегда равна
нулю, в сложном ионе – его заряду. Li+1(O-2H+1)
Степень окисления равна нулю у свободных атомов и у атомов,
входящих в состав неполярных молекул. Н02
Если элемент находится в главной подгруппе периодической
системы, то высшая положительная степень окисления элемента,
как правило, равна номеру группы.
Степень окисления F, как наиболее электроотрицательного
элемента, во всех соединениях равна -1.
Степень окисления кислорода обычно равна -2 за исключением
OF и пероксидов H2O2.
12.05.2016
12
13.
Степени окисления versus валентностьСтепень окисления не всегда совпадает с валентностью.
Например, молекула H2.
12.05.2016
12
14.
Окислительно-восстановительные реакцииОкислительно-восстановительные реакции – такие реакции, в
которых меняется степень окисления элементов.
С + О2 = СО2
CO2 + Ca(OH)2 = CaCO3 + H2O
Na2CO3 + Ca(OH)2 = CaCO3 + 2NaOH
12.05.2016
14
15.
Окислительно-восстановительные реакцииОкислительно-восстановительные реакции – такие реакции, в
которых меняется степень окисления элементов.
e-
С + О2 = СО2
Процесс отдачи электронов называют окислением, а процесс
присоединения – восстановлением.
С – окисляется, но является восстановителем.
О – восстанавливается, но является окислителем.
12.05.2016
15
16.
Метод электронно-ионного балансаОкислительно-восстановительные реакции бывает сложно уровнять.
K2Cr2O7 + H2SO4 + H2S = Cr2(SO4)3 + H2O + S + K2SO4
Метод электронно-ионного баланса
а) записывают формулы реагентов данной реакции и устанавливают химическую
функцию каждого из них (окислитель, кислотная среда реакции, восстановитель);
б) записывают формулы реагентов в ионном виде, указывая только те ионы, молекулы и
формульные единицы, которые примут участие в реакции в качестве окислителя, среды и
восстановителя
в) определяют восстановленную форму окислителя и окисленную
форму восстановителя, составляют электронно-ионные уравнения полуреакций
восстановления и окисления
г) суммируя уравнения полуреакций, составляют ионное уравнение данной реакции,
д) на основе ионного уравнения составляют молекулярное уравнение данной реакции
е) проводят проверку подобранных коэффициентов
12.05.2016
16
17.
Метод электронно-ионного баланса2e-
K2Cr2O7 + 4H2SO4 + 3H2S = Cr2(SO4)3 + 7H2O + 3S(т) + K2SO4
Метод электронно-ионного баланса
а) записывают формулы реагентов данной реакции и устанавливают
химическую функцию каждого из них (окислитель, кислотная среда реакции,
восстановитель)
б) записывают формулы реагентов в ионном виде, указывая только те ионы, молекулы и формульные единицы,
которые примут участие в реакции в качестве окислителя, среды и восстановителя
в) определяют восстановленную форму окислителя и окисленную форму восстановителя, составляют электронноионные уравнения полуреакций восстановления и окисления
г) суммируя уравнения полуреакций, составляют ионное уравнение данной реакции,
д) на основе ионного уравнения составляют молекулярное уравнение данной реакции
е) проводят проверку подобранных коэффициентов
12.05.2016
17
18.
Метод электронно-ионного балансаK2Cr2O7 + 4H2SO4 + 3H2S = Cr2(SO4)3 + 7H2O + 3S(т) + K2SO4
Cr2O72− + H+ + H2S
б) записывают формулы реагентов в ионном виде, указывая только те ионы,
молекулы и формульные единицы, которые примут участие в реакции в качестве
окислителя, среды и восстановителя
в) определяют восстановленную форму окислителя и окисленную форму восстановителя,
составляют электронно-ионные уравнения полуреакций восстановления и окисления
г) суммируя уравнения полуреакций, составляют ионное уравнение данной реакции,
д) на основе ионного уравнения составляют молекулярное уравнение данной реакции
е) проводят проверку подобранных коэффициентов
12.05.2016
18
19.
Метод электронно-ионного балансаK2Cr2O7 + 4H2SO4 + 3H2S = Cr2(SO4)3 + 7H2O + 3S(т) + K2SO4
Cr2O72− + 14H+ + 6e− = 2Cr3+ + 7H2O
H2S − 2e− = S(т) + 2H+
в) определяют восстановленную форму окислителя и окисленную
форму восстановителя, составляют электронно-ионные уравнения полуреакций
восстановления и окисления
г) суммируя уравнения полуреакций, составляют ионное уравнение данной реакции,
д) на основе ионного уравнения составляют молекулярное уравнение данной реакции
е) проводят проверку подобранных коэффициентов
12.05.2016
19
20.
Метод электронно-ионного балансаK2Cr2O7 + 4H2SO4 + 3H2S = Cr2(SO4)3 + 7H2O + 3S(т) + K2SO4
Cr2O72− + 8H+ + 3H2S = 2Cr3+ + 7H2O + 3S(т)
K2Cr2O7 + 4H2SO4 + 3H2S = Cr2(SO4)3 + 7H2O + 3S(т) + K2SO4
г) суммируя уравнения полуреакций, составляют ионное уравнение данной
реакции,
д) на основе ионного уравнения составляют молекулярное уравнение данной
реакции
е) проводят проверку подобранных коэффициентов
12.05.2016
20

















 Химия
Химия








