Похожие презентации:
Окислительно-восстановительные процессы
1.
ОКИСЛИТЕЛЬНОВОССТАНОВИТЕЛЬНЫЕПРОЦЕССЫ
2.
СТЕПЕНЬ ОКИСЛЕНИЯ, ЗАРЯД ИОНА, ФОРМАЛЬНАЯ ВАЛЕНТНОСТЬСостояние окисления атома элемента в молекуле определяется
смещением электронной плотности от одного атома к другому из-за их
различной электроотрицательности. Тот атом, от которого
электронная
плотность
оттянута,
становится
положительно
окисленным; атом, к которому электронная плотность притянута,
приобретает отрицательную окисленность.
Количественно
состояние
окисления
определяется
степенью окисления - числом электронов, (якобы) отданных или
принятых атомом в соединении.
Степень окисления серы в сероводороде H2S2–, сернистой кислоте
H2S4+O3 и серной кислоте H2S6+O4.
H2S ⇄ 2H+ + S2–
H2SO3 ⇄ 2H+ + SO32–
H2SO4 ⇄ 2H+ + SO42–
K4[Fe (CN)6]
K4+[Fe2+ (CN)6–]4–
{гексацианоферрат (II) калия}
Вывод: степень окисления, заряд иона и валентность (численно)
совпадают только в случае простых ионов.
3.
ОСНОВНЫЕ ПОНЯТИЯ.ВЕЩЕСТВ
Окисление – процесс отдачи электронов атомом, молекулой или
ионом. При этом степень окисления атома элемента (в молекуле
или ионе) повышается. Окисляются восстановители.
Восстановление - процесс присоединения электронов атомом,
молекулой или ионом. При этом степень окисления элемента
понижается. Восстанавливаются окислители.
Принцип электронного баланса:
процессы окисления и
восстановления неразрывно связаны друг с другом, причем
количество электронов, отданное восстановителем, всегда равно
количеству электронов, принятых окислителем.
Основные восстановители: металлы в чистом виде и низших
степенях окисления, углерод, водород, СО, NH3, HNO2, H2S, H2SO3 и
их соли, HCl, HBr, HI.
Основные окислители: F2 и галогены, O2 и O3, Н2О2, HNO3, H2SO4
(конц.), Mn+7 (HMnO4 и ее соли), Mn+6 (H2MnO4 и ее соли), MnO2↓,
Cr+6 (H2CrO4, H2Cr2O7 и их соли), HClO, HClO3, HClO4 и их соли,
NOCl.
4.
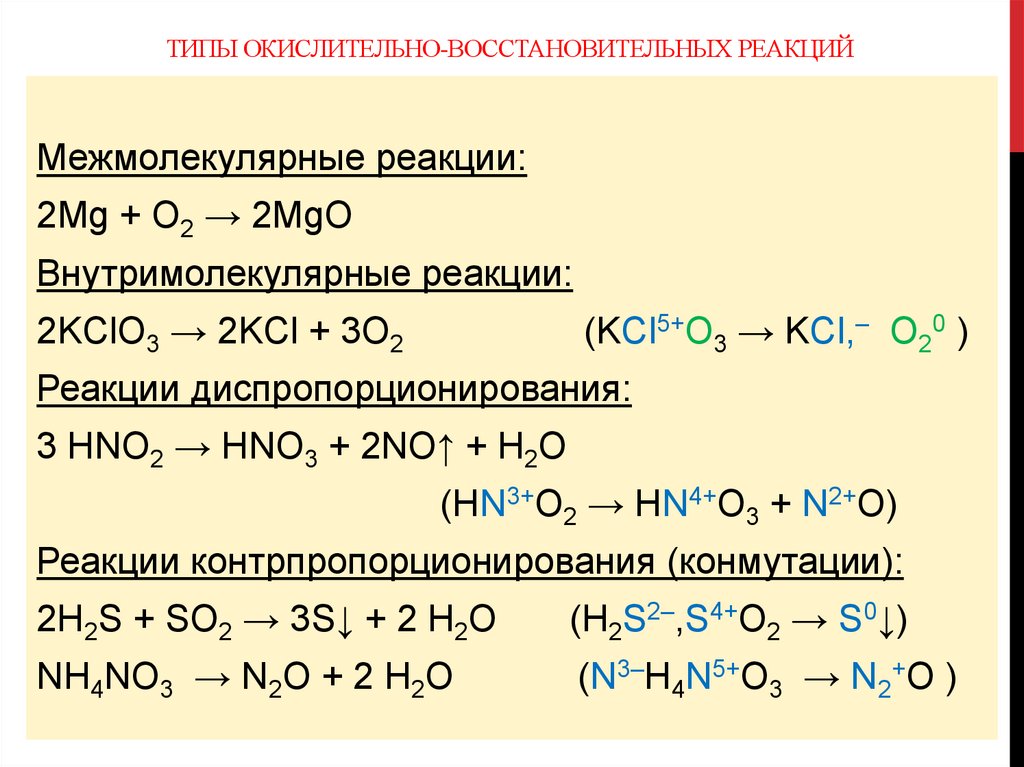
ТИПЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙМежмолекулярные реакции:
2Mg + O2 → 2MgO
Внутримолекулярные реакции:
2KClO3 → 2KCl + 3O2
(KCl5+O3 → KCl,– O20 )
Реакции диспропорционирования:
3 HNO2 → HNO3 + 2NO↑ + H2O
(HN3+O2 → HN4+O3 + N2+O)
Реакции контрпропорционирования (конмутации):
2H2S + SO2 → 3S↓ + 2 H2O
(H2S2–,S4+O2 → S0↓)
NH4NO3 → N2O + 2 H2O
(N3–H4N5+O3 → N2+O )
5.
МЕТОДЫ ПОСТАНОВКИ КОЭФФИЦИЕНТОВ В УРАВНЕНИЯ ОКИСЛИТЕЛЬНОВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ1. Метод электронного баланса.
K2Cr2O7 + H2S + H2SO4 → S↓ + Cr2(SO4)3 + K2SO4 +H2O
2Cr6++ 6e → 2Cr3+ │
S2– - 2e → S0
- восстановление
│ × 3 - окисление
K2Cr2O7 + 3H2S + 4H2SO4 → 3S↓ + Cr2(SO4)3 + K2SO4 +7H2O
2. Метод ионно-электронных схем (метод полуреакций).
K2Cr2O7 + H2S + H2SO4 → S↓ + 2Cr3+ + …
2K+ + Cr2O72- + H2S + 2H+ + SO42- → S0↓ + 2Cr3+ + …
Cr2O72- + 6e + 14Н+ → 2Cr3+ + 7 H2O │ - восстановление
Н2S - 2e → S0 + 2H+
│ × 3 - окисление
Cr2O72- + 6e + 14Н+ + 3Н2S - 6e → 2Cr3+ + 7 H2O + 3S0 + 6H+
Cr2O72- + 8Н+ + 3Н2S → 2Cr3+ + 3S0 + 7 H2O – краткое ионномолекулярное уравнение
K2Cr2O7 + 3H2S + 4H2SO4 → 3S↓ + Cr2(SO4)3 + K2SO4 +7H2O
6.
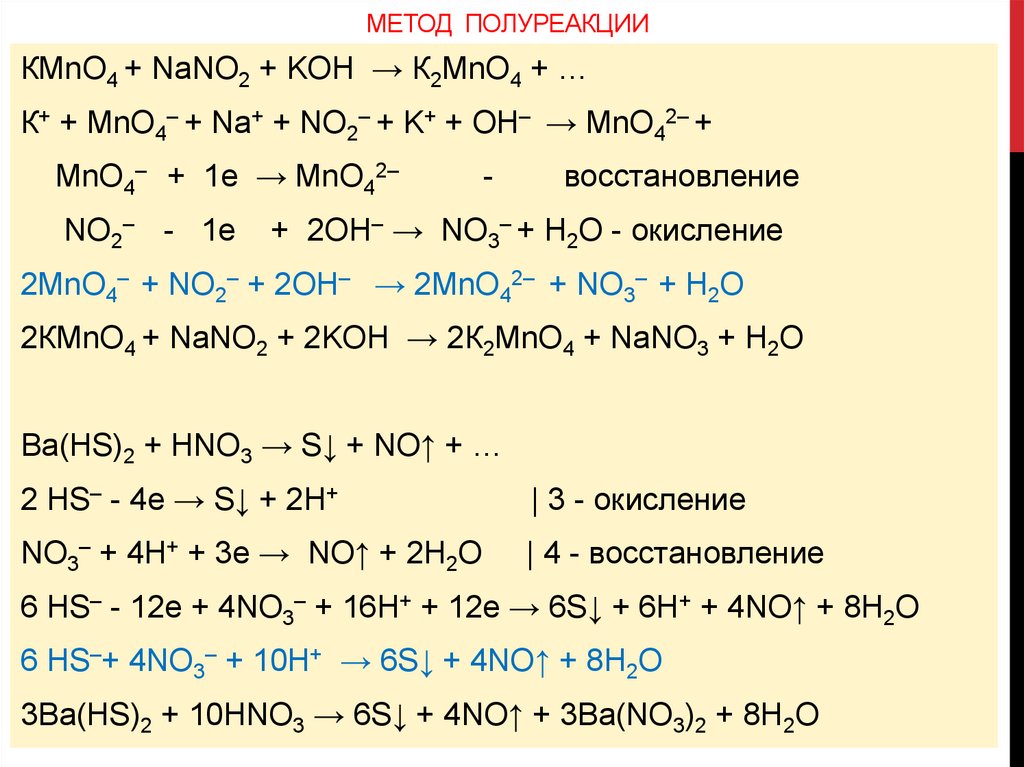
МЕТОД ПОЛУРЕАКЦИИКМnO4 + NaNO2 + KOH → К2МnO4 + …
К+ + МnO4– + Na+ + NO2– + K+ + OH– → МnO42– +
МnO4– + 1e → МnO42–
NO2– - 1e
-
восстановление
+ 2OH– → NO3– + H2O - окисление
2МnO4– + NO2– + 2OH– → 2МnO42– + NO3– + H2O
2КМnO4 + NaNO2 + 2KOH → 2К2МnO4 + NaNO3 + H2O
Ba(HS)2 + HNO3 → S↓ + NO↑ + …
2 HS– - 4e → S↓ + 2H+
| 3 - окисление
NO3– + 4H+ + 3e → NO↑ + 2H2O
| 4 - восстановление
6 HS– - 12e + 4NO3– + 16H+ + 12e → 6S↓ + 6H+ + 4NO↑ + 8H2O
6 HS–+ 4NO3– + 10H+ → 6S↓ + 4NO↑ + 8H2O
3Ba(HS)2 + 10HNO3 → 6S↓ + 4NO↑ + 3Ba(NO3)2 + 8H2O
7.
НАПРАВЛЕННОСТЬ ПРОЦЕССОВ ОКИСЛЕНИЯ-ВОССТАНОВЛЕНИЯПри p,T=const возможен только такой процесс, для которого ∆G<0; при этом
система может совершить работу Амах = – ∆G.
aA + bB ⇄ dD + eE
A + ne → D (1 сопряженная пара)
B – ne → E (2 сопр. пара)
[ox1] + ne → [red1]
[red2] – ne → [ox2]
ок1+ ne → восст1
восст2– ne → ок2













 Химия
Химия








