Похожие презентации:
Атомның кванты ~ механикалық моделі. Квант сандары
1. Оңтүстік Қазақстан Мемлекеттік Фармацевтика акдемиясы Фармакогнозия химия кафедрасы
Оңтүстік Қазақстан Мемлекеттік Фармацевтикаакдемиясы
Фармакогнозия химия кафедрасы
ПРЕЗЕНТАЦИЯ
Тақырып: Атомның кванты ~ механикалық
моделі. Квант сандары.
Қабылдаған:
Тобы: 103 ФК «А»
Орындаған: Құрбан: М.Б.
2. Жоспар
КіріспеНегізгі бөлім
Атомның кванты ~ механикалық
моделі
Квант сандары
Қорытынды
Пайдаланылған әдебиеттер
3. Кіріспе
Кванттық ұғымдарды алғаш рет 1900 жылыМ. Планк қызған денелердің жылулық сәуле
шығаруын толық түсіндіретін еңбектерінде
жариялады. Бұл теория бойынша жарық үздіксіз
түрде емес белгілі бір үлеспен үздікті кванттар
түрінде шығарылады немесе жұтылады. Бұл
кванттың энергиясын Планк: =h 10-34 Джс h=6,62 –
Планк тұрақтысы– , шығарылатын (жұтылатын)
жарықтың жиілігі. Планктың осы еңбегін ескере
отырып 1905 жылы Альберт Эйнштейн фотоэффект
теориясын ашты. Бұл теориясында Эйнштейн
Планк идеясын дамыта отырып, мынадай болжам
ұсынды: жарық тек үздікті түрде шығарылып
(жұтылып) қана қоймай, ол кеңістікте үздікті
кванттар ағыны түрінде тарайды.
4. Негізгі бөлім
Кванттық механика, толқындықмеханика – микробөлшектердің яғни
(элементар бөлшектердің, атомдарды ң,
молекулалардың, атом ядроларының)
және олардың жүйелерінің қозғалу
заңдылықтарын анықтайтын, сондай-ақ,
бөлшектер мен жүйелерді сипаттайтын
физикалық шамаларды макроскопиялы қ
тәжірибеде тікелей өлшенетін
шамалармен байланыстыратын теория
болып табылады.
5. Квант
Квант(нем. Quant, лат. quantum – қанша) –1) табиғаты дискретті (үзілісті) физикалық
шаманың мүмкін болатын өзгеруінің ең
кіші мөлшері; 2) әсер кванты – негізгі
физикалық тұрақтылардың бірі; 3) қандай
да бір физикалық өрістің қасиетін тасушы
бөлшек. (мысалы, электрмагниттік өрістің
кванты – фотон, дыбыс тербелістері
өрісінің кванты – фонон)
6.
Атом құрылысыныңквантты механикалық
теориясы.
Электронды сипаттау үшін квантты
механикалық (деңгейде орналасқан
электрон) теория бойынша 4 квант
саны қолданылады.
7.
Атомдағы электронның кез келгентұрақты күйі белгілі квант
сандарының мәнімен сипатталады.
Квант сандарының белгілі
мәндеріне сәйкес келетін электрон
күйі атомдық электрондык
орбиталь ( АО) деп аталады. n –
(бас квант саны ) атомдағы
электронның энергиясын және
энергетикалық деңгейін, яғни АО
өлшемін анықтайды.
8.
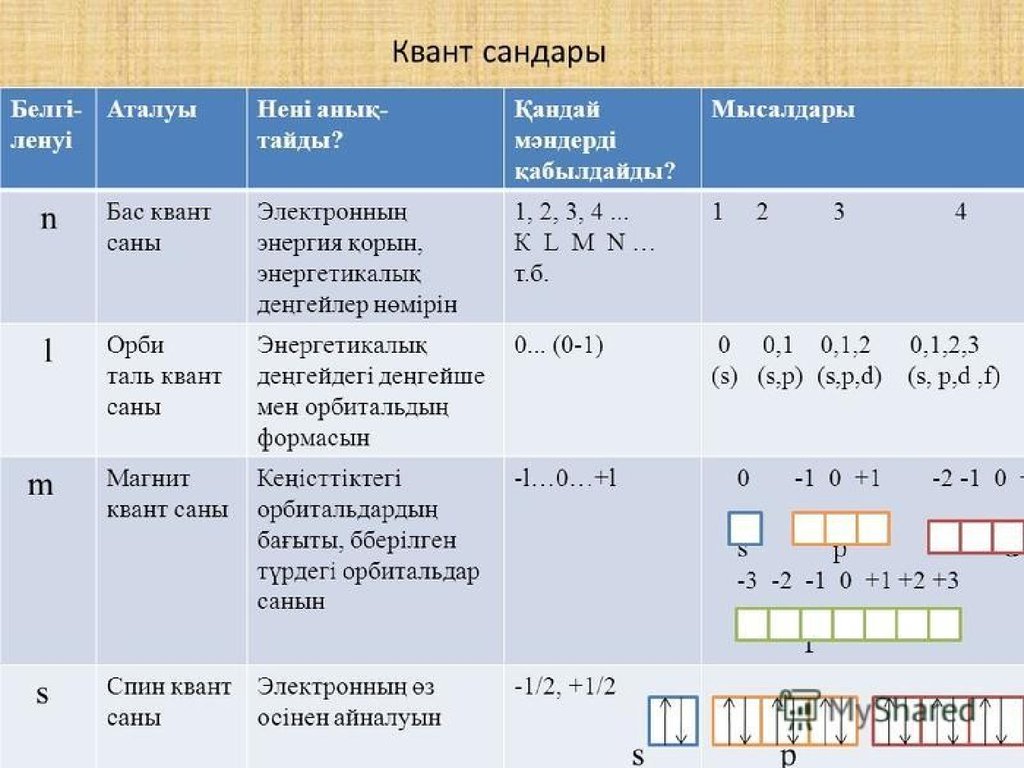
Бас квант саныБас квант саныn-- кез-келген
энергетикалық деңгейде
орналасқан элетронның энергиясын
сипаттайды немесе атомның
радиусын көрсетеді.
N=1,2,3….7
9.
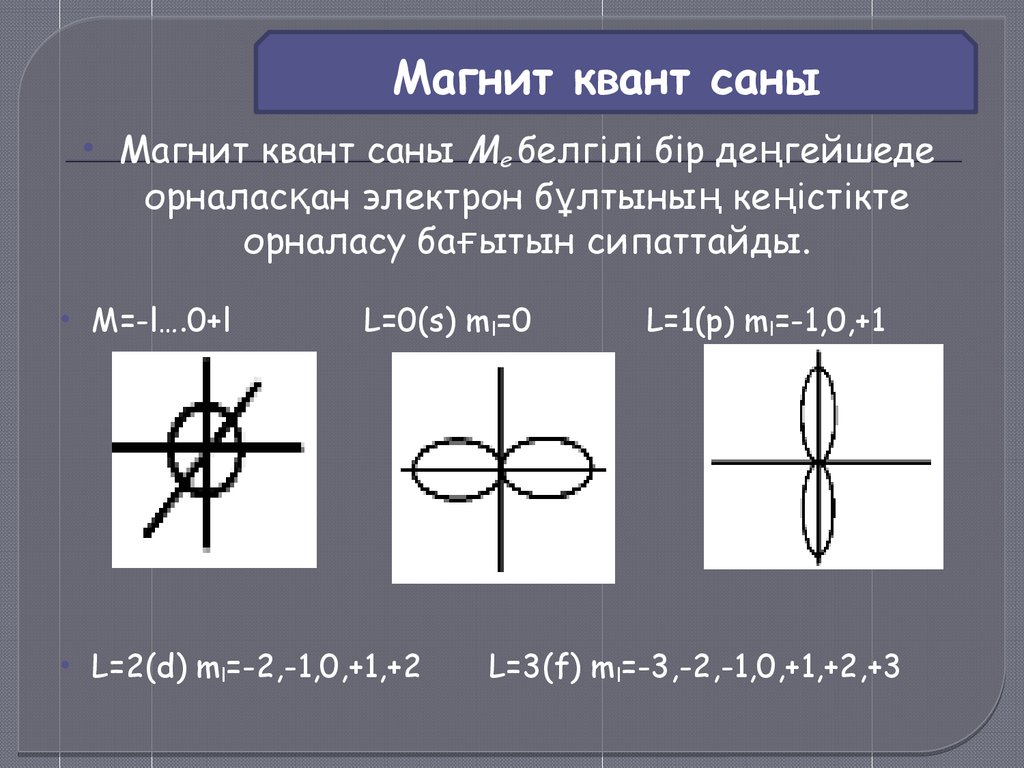
Магнит квант саныМагнит квант саны Me белгілі бір деңгейшеде
орналасқан электрон бұлтының кеңістікте
орналасу бағытын сипаттайды.
M=-l….0+l
L=0(s) m l=0
L=2(d) ml=-2,-1,0,+1,+2
L=1(p) ml=-1,0,+1
L=3(f) m l=-3,-2,-1,0,+1,+2,+3
10.
Спин квант саны ms –электронның ішкі
қозғаласын сипаттайды.
Оның мәні: +1/2 және -1/2.
11.
12. Кванттық механика
Атомдық деңгейдегі бөлшектердіңқозғалысы мен əсерлесулерінің
жалпы заңдылықтарын зерттейді жəне
осы заңдылықтарға сүйене отырып
атом ядросының, атомның,
молекулалар мен қатты денелердің
құрылысы теориялары мен
қасиеттерін тағайындайды.
13.
Кванттық механиканың көмегіменкөптеген физикалық құбылыстарды
түсіндіруге болады. Оны негізге ала
отырып, атомдық спектрлердің,
молекулалар құрылысының,
элементтердің периодтық жүйесінің,
металдың өткізгіштік, химиялық
байланыс және т.б. теориялары
жасалды. Осы сияқты өрістің кванттық
теориясы да біз қарастыратын
кванттық механикаға негізделген.
14. Элементтер атомдарындағы электрондардың атомдық орбитальдарда орналасуы үш жағдаймен анықталады:
Клечков
ский
и
л
у
Па ипі
ц
н
и
пр
да
н
у
Х
рі.
е
л
е
ж
е
р
е
15. Паули принципі
Атомды квант сандарының мәндері бірдейболып келген екі электрон болмайды, ең
келгенде бір квант саны басқаша болу керек,
яғни бір орбитальда болатын екі
электронның спиндері қарама-қарсы болу
тиіс. М: n=1. L=0 болса осындағы
электрондарды тек спиндері ғана әр түрлі
болады.
1-электрон:n=1, L=0, m=0, s=+1/2
2электрон:n=1, , L=0, m=0, , s=-1/2 мұндағы 3ші электрон болмайды.
16. Клечковский ережелері
Клечковкийдің бірінші ережесі.Энергетикалық деңгейлер
энергияның жоғарылау бағытында
толтырылады.
Е=n+1 E1s=1+0=1
E2s=2+0=2 1<2
17. Клечковскийдің екінші ережесі.
Егер деңгейшелердің энергияларыбірдей болса толтырылу реті бас квант
саны бойынша анықталады.
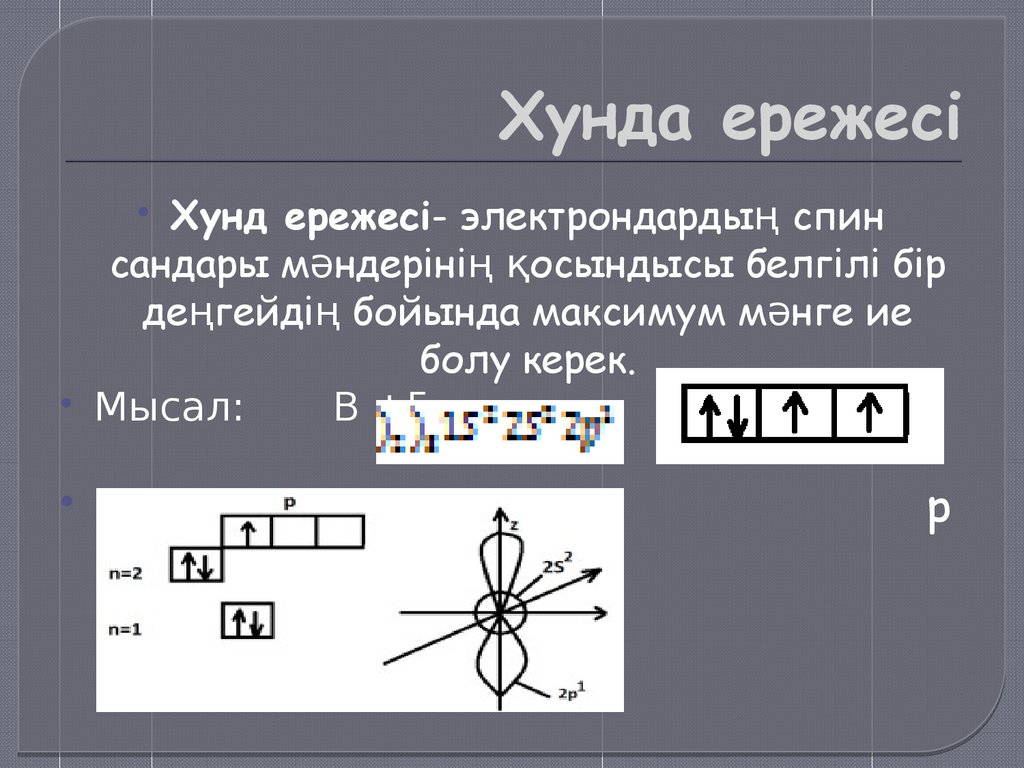
18. Хунда ережесі
Хунд ережесі- электрондардың спинсандары мәндерінің қосындысы белгілі бір
деңгейдің бойында максимум мәнге ие
болу керек.
Мысал:
В +5
р
19. Элементтердің S - және p- топтамалары.
Элементтердің S - және pтоптамалары.Атом құрылысының s-элементтерде
сыртқы деңгейдің s-орбиталіне
электрон тола бастайды. S-Орбиталіне
тек электрон сиятындықтан, sэлементтердің де сыртқы деңгеінде не
1, не 2-электрон болады. Сонымен sэлементтер период жүйесінің 1А және
2А
20. Элементтердің d-және f- топтамалары.
Элементтердің d-және fтоптамалары.d-элементтер сырттан санағанда 2-ші
деңгейдің d-орбитальдары электронға
тола басталады. Периодтық жүйеде
қазір барлығы 35- d элемент бар. Топ
бойынша 3-ші В мен 2-ші В топшаны
құрайды.
21. Қорытынды
Атомның энергия деңгейлері әр түрліфизикалық шамалармен сипатталатын
төрт кванттық сандармен таныстып
білдім және электрондар Паули
принципін сақтай отырып әр энергия
деңгейінде тек бір бірден ғана
орналасатынын анықтадым.
22. Пайдаланылған әдебиеттер
https://kk.wikipedia.org/wiki/%D0%9A%D0%B2%D0%B0%D
0%BD%D1%82%D1%82%D1%8B%D2%9B_%
D0%BC%D0%B5%D1%85%D0%B0%D0%BD%D0%B8%D0%
BA%D0%B0
http://lektsii.com/1-51282.html

















 Физика
Физика








