Похожие презентации:
Физическая химия. Химическая термодинамика
1.
ФИЗИЧЕСКАЯ ХИМИЯХимическая термодинамика
07.09.16
2016
2. Общий план работы в семестре
• Лекции – 60 час.• Лабораторные занятия – 68 час.
• Практические занятия – 34 час.
К.х.н., доцент О.В. Магаев
07.09.16
2
3. Физическая химиия
«Физическая химия – наука, которая должна на основанииположений и опытов физических объяснить причину того, что
происходит через химические операции в сложных телах»
М.В. Ломоносов
(1752 г.)
Физическая химия – наука о применении теоретических и
экспериментальных методов физики для решения химических
проблем
Физическая химия изучает химические свойства веществ на
основе физических свойств составляющих их атомов и молекул
07.09.16
3
4. Рекомендуемая литература (основная)
1. Попова А.А., Попова Т.Б. Физическая химия. Учебное пособие. М.: Лань, 2015. – 496 с.Касаткина И.В., Прохорова Т.М., Федоренко Е.В. Физическая химия. Учебное пособие. М.:
РИОР, 2013. – 256 с.
2. Коган В.А., Луков В.В. Физическая химия. Ростов: Издательство Ростовского университета,
2011. - 254 с.
3. Горшков В.И., Кузнецов И.А. Основы физической химии. М.: БИНОМ. Лаборатория
знаний, 2014. – 408 с.
4. Еремин В.В., Каргов С.И., Успенская И.А., Кузьменко Н.Е., Лунин В.В. Физическая химия.
Т1., Т2. М.: БИНОМ. Лаборатория знаний. 2013. – 584 с.
5. Беляев А.П. Физическая и коллоидная химия. практикум обработки экспериментальных
результатов. Учебное пособие. М.: ГЭОТАР-Медия, 2015. – 112 с.
6. Основы физической химии: учебное пособие: в 2 ч. Теория и задачи / В.В.Еремин [и др.].
2-е изд. перераб. и доп. М.: БИНОМ. Лаборатория знаний. 2013. – 493 с.: ил. (Учебник для
высшей школы)
7. Стромберг А.Г., Семченко Д.П. Физическая химия. М.: Высшая школа, 1999. – 528 с.
Физическая химия / под ред. Краснова К.С. М.: Высшая школа, 1998. кн.1 и 2. – 512 с. и 319с.
Курс физической химии / под ред. Герасимова Я.И. М.: Химия, 1970. Т.1. – 502 с. и 1973. Т.2.
– 623 с.
07.09.16
4
5. Рекомендуемая литература (дополнительная)
1. Романовский Б.В. Основы химической кинетики. М.: «Экзамен». 2006. – 415 с.2. Эткинс П., де Паула Дж. Физическая химия. М.: Мир, 2007. Т.1. –494 с.
3. Дамаскин Б.Б., Петрий О.А., Цирлина Г.А. Электрохимия. М.: Химия. КолосС, 2008. – 672
с.
4. Бирон Е.В. О взаимодействии веществ в растворе. М.: Книга по требованию. 2012. – 18
с.
5. Вальден П.И. Теория растворов в их исторической последовательности. М.: Книга по
требованию. 2012. – 202 с.
6. Лукомский Ю.Я., Гамбург Ю.Д. Физико-химические основы электрохимии.
Долгопрудный: Издат. дом «Интеллект», 2008. – 424 с.
7. Байрамов В.М. Основы химической кинетики и катализа. М.: Издательский центр
«Академия», 2003. – 256 с.
8. Ягодовский В.Д. Статистическая термодинамика в физической химии. М: Бином.
Лаборатория знаний, 2005. – 490 с.
9. Полторак О.М. Термодинамика в физической химии. М.: Высшая школа, т.2, 1991. – 319
с.
10. Еремин Е.Н. Основы кинетики химических реакций. М.: Высшая школа, 1976. – 541с.
07.09.16
5
6. Рекомендуемая литература (дополнительная)
11. Эммануэль Н.М., Кнорре Д.Г. Курс химической кинетики. М.: Высшая школа, 1982. –401 с.
12. Даниэль Ф., Олберти Р. Физическая химия. М.: Мир, 1978. – 645 с.
Мелвин-Хьюз Э.А. Физическая химия. М.: ИЛ, 1962 г., Кн.1 и 2. – 519 с. и 623 с.
13. Эмануэль Н.М., Кнорре Г.Д. Курс химической кинетики. М.: Высшая школа, 1984. – 590
с.
14. Эйринг Г., Лин С.М. Основы химической кинетики. М.: 1983. – 528 с.
15. Розовский А.Я. Гетерогенные химические реакции. Кинетика и макрокинетика. М.:
Наука, 1980. – 323 с.
16. Розовский А.Я. Кинетика топохимических реакций. М.: Мир, 1988. – 311 с.
17. Дельмон Б. Кинетика гетерогенных реакций. М.: Химия, 1972. – 554 с.
18. Дамаскин Б.Б., Петрий О.А. Введение в электрохимическую кинетику. М.: Высшая
школа, 1975. – 416 с.
19. Практикум по физической химии / Под редакцией профессора Е.П. Агеева, академика
20Лунин В.В., М.: «Академия». 2010. – 219 с.
21. ЕреминВ.В. , Каргов С.И. , Успенская И.А., Кузьменко Н.Е. , Лунин В.В., . Задачи по
физической химии. М.: «Экзамен». 2002. – 318 с.
07.09.16
6
7.
Физическая химия – краткаяисторическая справка
07.09.16
www.lcr.tsu.ru
7
8.
Историческое развитиеКонец XIX века – ряд крупнейших открытий в области физикохимических явлений
Начало XX века – физическая химия определена как наука
Период 1940 – 2012 Г.К. Боресков, Л.Онзагер, П.Флори, Дж. Натта, К. Циглер
П.А. Ребиндер, Дж. Поляни, Р. Маркус, Ян Ли, Р. Хофман,
Гольданский,
Шехтман:
В. И.
Ю.М. Кисилев, Р. Маккиннон, К. Вютрих, Г. Эртль, Д.
теоретические
и
практические
достижения
в
катализе,
электрохимии, биофизике, радиохимии и т.д.;
07.09.16
8
9.
Историческое развитие•К. Шееле (Швеция - 1773), Фόнтан (Франция - 1777) – адсорбция газов;
•Т.Е. Ловиц (Россия - 1785) – адсорбция из растворов;
•Лавуазье, Лаплас (Франция – 1779/1784) – изучение теплоемкости веществ
тепловые эффекты реакций;
• Г. Дэви (Англия - 1825), Л. Тенар (Франция - 1830) – открытие каталитических
реакций;
• Гальвани, Вольт (Италия - 1799) – гальванический элемент, основы
электрохимии;
•М.В. Ломоносов (Россия - 1750) - описание химии через
физико-математический аппарат
•И. Берцелиус (Швеция - 1835) – развитие основ катализа;
07.09.16
9
10.
Историческое развитие•Д. Дальтон (Англия 1801-1803), Л. Гей-Люссак (Франция - 1802),
А. Авагадро (Италия - 1811) – открытие газовых законов, развитие
атомистических представлений;
•В.В. Петров (Россия - 1802) – открытие явления электрической дуги;
•Г. Дэви (Англия – 1800-1834) – электрохимическая теория взаимодействия
веществ;
•Г.И. Гесс (Россия - 1820) – работы по термохимии;
•Д. Гиббс (США – 1873-1878) – термодинамическое учение о
химическом равновесии;
•М. Фарадей (Англия -1833-1834) – количественные законы электролиза;
•Б.С. Якоби (Россия - 1836) – гальванопластика;
07.09.16
10
11.
Историческое развитие•С. Аррениус (Швеция – 1883-1887) – теория электролитической диссоциации;
•И. Гитторф, Ф. Кольрауш (Германия - 1870) – перенос электричества в растворах;
•Д.И. Менделеев (Россия – 1834-1907) – открытие существования критической
температуры, химическая теория растворов (1887), вывод уравнения состояния
газов (1874);
•Д.П. Коновалов (Россия – 1889) – теория растворов;
• Ле Шателье (Франция - 1884) – общий принцип смещения равновесия при
изменении внешних условий;
•Я. Вант-Гофф (Голландия – 1885-1889) термодинамическая теория химического
равновесия, теория разбавленных растворов
07.09.16
11
12.
ВВЕДЕНИЕПредмет и задачи физической
химии
07.09.16
www.lcr.tsu.ru
12
13. Предмет и задачи физической химии
Объектами изучения физической химии являются любыесистемы, в которых могут протекать химические
превращения.
Основная задача физической химии – изучить и
объяснить закономерности протекания химических
процессов, определить скорость химического процесса во
времени, определить их направленность, изучить влияние
на них среды, примесей, а также условия получения
максимального выхода продуктов.
07.09.16
13
14. Предмет и задачи физической химии
При решении задач физической химии используются 2-а основныхметода теоретической физики:
Термодинамический метод –
химического и фазового равновесия
направленность
процессов
Метод МКТ – определение свойств систем (газы, кристаллы,
твердые вещества)
07.09.16
14
15.
ОСНОВНЫЕ РАЗДЕЛЫ ФИЗИЧЕСКОЙ ХИМИИТЕРМОДИНАМИКА –
изучает вопросы энергетики
химических процессов,
определяет условия
протекания химических
реакций и равновесных
состояний, которых они
достигают
СТАТИСТИЧЕСКАЯ МЕХАНИКА
– изучает свойства и
поведение макроскопических
физических тел, состоящих из
большого числа частиц
(атомов, молекул, ионов,
электронов и др.) К таким
телам или системам относятся
газы, жидкости, твердые тела,
плазма, полимеры
КВАНТОВАЯ ХИМИЯ –
раздел теоретической
химии, в котором строение
и свойства химических
соединений, их
взаимодействия и
превращения в химических
реакциях рассматриваются
на основе представлений и
с помощью методов
квантовой механики.
КИНЕТИКА – изучает
механизмы химических
превращений и влияние на
них и на скорость
превращения внутренних и
внешних параметров
07.09.16
15
16.
СОДЕРЖАНИЕ КУРСА:Строение вещества
(учение о строении атомов, молекул, агрегатных состояниях вещества, включая вопросы о природе
химической связи)
Химическая термодинамика
(энергетические эффекты в химических процессах; возможность, направление и глубина протекания,
химического процесса)
Учение о растворах (теория растворов)
(процессы образования растворов, их внутренняя структура и важнейшие свойства в зависимости от
природы компонентов раствора)
Химическая кинетика
(скорость и механизм протекания химических процессов в различных средах при различных условиях)
Электрохимия
(свойства растворов электролитов; явления электропроводности, электролиза, коррозии; работа
гальванических элементов)
Коллоидная химия
(поверхностные явления; свойства мелкодисперсных гетерогенных систем)
07.09.16
16
17.
2. Химическая термодинамикаОсновные понятия и определения
07.09.16
www.lcr.tsu.ru
17
18. 2. Химическая термодинамика Основные понятия
Термодинамика – часть теоретической физики изучающаямакроскопические тела и изменение их свойств (взаимные
переходы различных форм энергии)
Основатель ТЕРМОДИНАМИКИ – Сади Карно
(Франция – 1796-1832).
Термин ТЕРМОДИНАМИКА определен Томсоном (Англия - 1854).
07.09.16
18
19. 2. Химическая термодинамика Основные понятия
Химическая термодинамика – раздел физической химии, вкотором термодинамические методы применяются для
анализа химических и физических явлений: химических
реакций, фазовых переходов и процессов в растворах.
Изучение тепловых эффектов, сопровождающих
химические реакции – термохимия
Определение возможности самопроизвольного течения
процесса, а также условия положения равновесия и его
смещения под влиянием изменения внешних условий
Свойства веществ в растворах
07.09.16
19
20. 2. Химическая термодинамика Основные понятия
Анализ физических явлений и установление соотношений междуразличными свойствами веществ в термодинамике осуществляют
через:
Метод Циклов – применение закономерностей термодинамики к
воображаемым циклам;
Метод
Потенциалов
(Гиббс)
–
получение
необходимых
соотношений используя основные уравнения термодинамики
07.09.16
20
21. 2. Химическая термодинамика Основные понятия
Особенности термодинамики:Универсальность термодинамического аппарата (т/д аппарат основан на
законах и закономерностях общего плана – закон сохранения энергии,
газовые законы);
Термодинамика – феноменологическая наука (макрофизический уровень
рассмотрения системы, вещество-среда с макропараметрами описывающими
состояние системы P, V, T);
В т/д отсутствует понятие «ВРЕМЯ», т.е все процессы протекают независимо
от времени и пространства.
Термодинамика органична (не прибегая к данным опыта можно получить
информацию о свойствах изучаемых систем);
07.09.16
21
22. 2. Химическая термодинамика Основные понятия
Общая классификация термодинамикиI. По характеру используемых параметров системы:
макроскопические/микроскопические
II. По типу процессов: равновесные/неравновесные
III. По типу явлений, к которым применима термодинамика
07.09.16
22
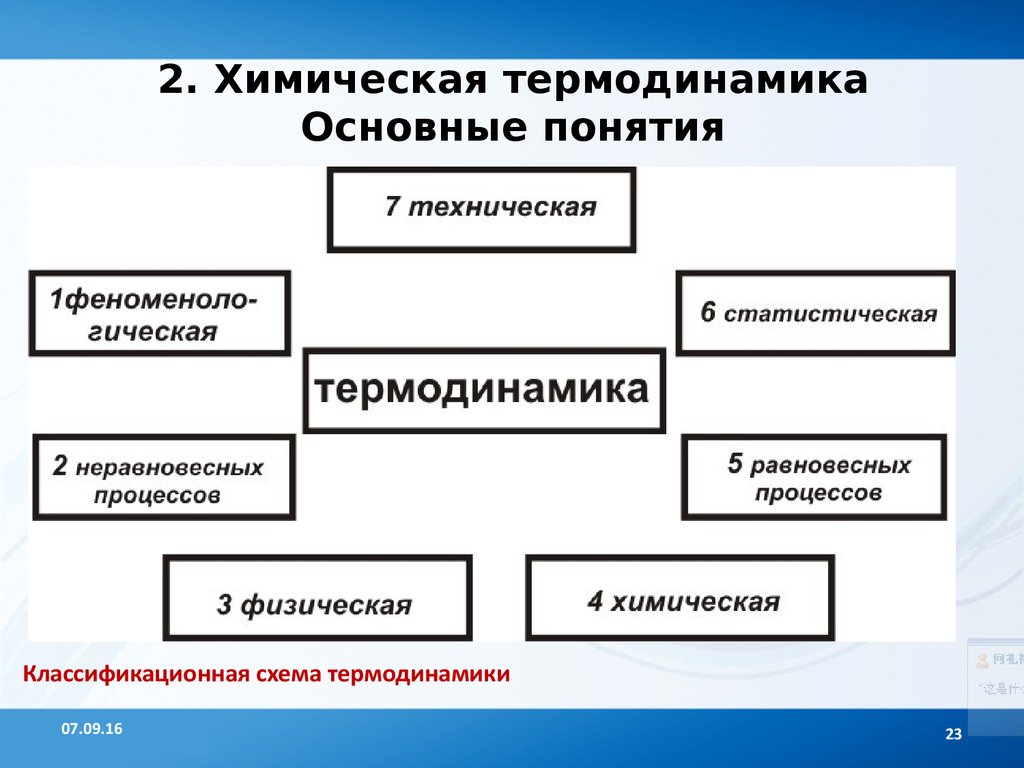
23. 2. Химическая термодинамика Основные понятия
Классификационная схема термодинамики07.09.16
23
24. 2. Химическая термодинамика Основные понятия
Задачи химической термодинамики:• Получение термодинамических данных для новых соединений;
• Изучение стабильности соединений и фаз;
• Предсказание направления химической реакции;
• Расчет состава реакционной смеси и выхода химических реакций;
• Изучение возможности получение энергии из химических реакций
в виде теплоты и работы;
Применение
термодинамических
подходов
в
химической
кинетике.
07.09.16
24
25. 2. Химическая термодинамика Основные понятия
Термодинамика основывается на двух постулатах (исходныхположениях) и трех законах:
Основной постулат термодинамики (постулат о равновесии)
Нулевой закон термодинамики (второе исходное положение), нулевое
(общее) начало термодинамики, постулат о существовании температуры
Первый закон (первое начало) термодинамики или закон сохранения
энергии
Второй закон (второе начало) термодинамики
Третий закон (третье начало) термодинамики или закон Нернста
Для химической реакции термодинамика позволяет рассчитать конечный результат –
равновесный состав реакционной смеси, оценить максимально возможный выход продуктов
реакции и подобрать оптимальные условия (давление, температура) её проведения .
25
26.
2. Химическая термодинамикаОсновные понятия и определения
Состояние системы характеризуется совокупностью всех её физических и
химических свойств (объём, давление, температура, химический состав, масса и
др.)
Эти свойства системы связаны уравнением состояния и другими уравнениями,
поэтому, для однозначной характеристики состояния системы достаточно знать не
все свойства, а лишь некоторые из них.
Эти свойства выбирают в качестве независимых переменных и называют
параметрами состояния.
Т/Д параметры – свойства системы, которые однозначно определяют состояние
системы (V, m, S, Cp).
Независимые переменные фиксированы условиями существования системы и не
могут изменяться в пределах рассматриваемой задачи.
Количество параметров, необходимое для определения состояния системы,
зависит от степени её сложности. Например, для газа в качестве параметров
состояния могут быть выбраны любые два из трёх: давление, объём и
температура.
07.09.16
26
27.
2. Химическая термодинамикаОсновные понятия и определения
Термодинамические параметры (состояния) или свойства:
Внешние параметры: определяются свойствами и координатами тела в окружающей
среде и зависят от контактов системы с окружающей средой (например, массы и
количества компонентов, напряженность электрического поля); их число ограничено
Внутренние параметры: зависят только от свойств самой системы (например, плотность,
внутренняя энергия); их число не ограничено
Экстенсивные параметры (выражают количественные характеристики
системы) – их численное значение для системы постоянного химического состава
пропорционально массе системы (V, m, e, U, S, G, F, H, теплоемкость(C)). Обладают
аддитивностью. (additivus — прибавляемый, т.е. любое экстенсивное свойство системы
равно сумме соответствующих свойств её частей).
Интенсивные параметры (выражают качественные характеристики
системы) – их численное значение для системы постоянного химического состава не
зависит от массы системы (Т, плотность (p), P, поверхностное натяжение, концентрация,
Vm, электрический потенциал). Не обладают аддитивностью.
07.09.16
27
28.
ДОПОЛНЕНИЕЕсли одну экстенсивную Т/Д величину (Y1) отнести к единице другой
экстенсивной величины (Y2), то получается интенсивная величина (X):
Y1/Y2 = X
По определению:
на единицу объема
на единицу массы
на единицу кол-ва вещества
плотности (плотность)
удельные величины (Удельный объем)
мольные величины (Молярный объем)
Экстенсивные величины – аддитивны (Y1+Y2+Y3+…+Yn)=Yсист.
Интенсивные величины аддитивностью не обладают!
07.09.16
28
29.
ДОПОЛНЕНИЕАддитивная физическая величина — физическая величина, разные
значения которой могут быть суммированы, умножены на числовой
коэффициент, разделены друг на друга. Например, физическая величина
масса - аддитивная физическая величина.
Неаддитивная физическая величина — физическая величина, для которой
суммирование, умножение на числовой коэффициент или деление друг на
друга её значений не имеет физического смысла. Например, физическая
величина температура - неаддитивная физическая величина.
07.09.16
29
30.
ДОПОЛНЕНИЕОбобщенные силы – P, А мех, φ, μ, σ (поверхностное
двумерное давление) При равновесии эти величины равны
независимо от размера системы
Обобщенные координаты – геометрическая координата
l, объем V, заряд e, mi- масса i – ого компонента.
При этом обобщенная работа имеет вид:
dAмех= Fdl – есть произведение двух величин – обобщенных
сил на изменение координат
dAмех= Fdl=pdV
dAхим= Σ μdni
dAэл= φde
dAпов= σdΩ
07.09.16
30
31.
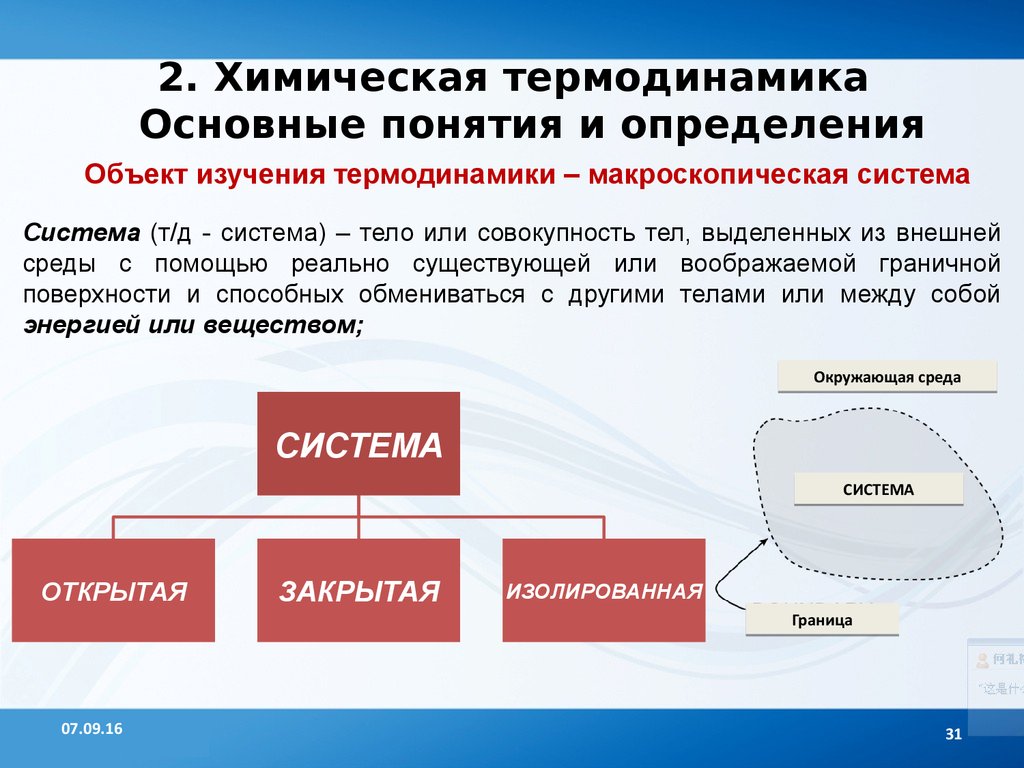
2. Химическая термодинамикаОсновные понятия и определения
Объект изучения термодинамики – макроскопическая система
Система (т/д - система) – тело или совокупность тел, выделенных из внешней
среды с помощью реально существующей или воображаемой граничной
поверхности и способных обмениваться с другими телами или между собой
энергией или веществом;
Окружающая среда
СИСТЕМА
СИСТЕМА
ОТКРЫТАЯ
ЗАКРЫТАЯ
ИЗОЛИРОВАННАЯ
Граница
07.09.16
31
32.
2. Химическая термодинамикаОсновные понятия и определения
Примеры:
открытые системы — люди, животные, растения, водоемы;
закрытые системы — герметично упакованные продукты (бутылки с газированной
водой, любая система, ограниченная физической границей раздела (емкость));
изолированные системы, такие системы в природе практически не встречаются,
однако, к ним можно с небольшим допущением отнести термос (сосуд Дьюара),
кабина космического корабля.
открытая
http://www.nscience.ru/
закрытая
изолированная
32
33.
2. Химическая термодинамикаОсновные понятия и определения
«ЧАСТИЧНО ОТКРЫТЫЕ» СИСТЕМЫ
Адиабатическая
сисмтеа – система с отсутствием теплообмена с
окружающей средой, но с осуществлением массообмена;
Диатермическая
система
–
система
с
отсутствием
массообмена, но с осуществлением теплообмена.
Передача энергией между системой и внешней средой
осуществляться двумя путями: Q – теплота; A (W) – работа.
07.09.16
может
33
34.
2. Химическая термодинамикаОсновные понятия и определения
По «структурообразованию» системы:
Гомогенная система – система между отдельными частями которой нет
поверхности раздела. Система однородна. (во всех ее частях свойства
одинаковы или меняются без скачков, между частями системы нет
поверхностей раздела). Составные части гомогенной системы нельзя
обнаружить ни визуально, ни с помощью оптических приборов, нельзя
отделить друг от друга механическим путем.
Примеры: смеси газов (воздух), смесь нефтепродуктов, оптическое
стекло, истинные растворы.
Гетерогенная система – система состоящая из отдельных частей (двух и
более фаз), разграниченных поверхностями раздела. При переходе через
поверхность раздела, хотя бы одно свойство меняется скачкообразно.
Примеры: сплавы, насыщенный пар, смеси органических неполярных веществ
с водой.
07.09.16
34
35.
2. Химическая термодинамикаОсновные понятия и определения
Простая система – система, состоящая из одного
вещества.
Пример: вода - насыщенный пар, тающий лёд
Сложная система – система, состоящая из нескольких
веществ.
Пример: воздух, раствор поваренной соли, сплавы.
07.09.16
35
36.
2. Химическая термодинамикаОсновные понятия и определения
Термодинамическая фаза - однородная по составу и свойствам часть
термодинамической системы, отделенная от других фаз поверхностями
раздела, на которых скачком изменяются некоторые свойства системы.
Иначе: Фаза — гомогенная часть гетерогенной системы. В однокомпонентной
системе разные фазы могут быть представлены различными агрегатными
состояниями или разными полиморфными модификациями вещества. В
многокомпонентной системе фазы могут иметь различный состав и структуру.
Фаза – совокупность гомогенных частей гетерогенной системы,
одинаковых по физическим и химическим свойствам,
отделенная от других частей системы видимыми поверхностями
раздела.
07.09.16
36
37.
2. Химическая термодинамикаОсновные понятия и определения
Термодинамика
дает
определение
фазы,
как
термодинамически
равновесное состояние вещества, отличающееся по физическим свойствам
от других возможных состояний того же вещества.
Пример:
твердое,
жидкое,
газообразное
агрегатные
состояния,
парамагнитное и магнитоупорядоченные состояния магнетика, состояния
одного и того же вещества с различным типом кристаллической структуры и
т. д.
Макроскопическая часть среды (вещества), имеющая однородный физико-химиче
ский состав, называется фазой
.
37
38.
ДОПОЛНЕНИЕНабор термодинамических фаз вещества обычно значительно богаче набора агрегатных состояний,
т.е. одно и то же агрегатное состояние вещества может находиться в различных
термодинамических фазах. Именно поэтому описание вещества в терминах агрегатных
состояний довольно огрублённое, и оно не может различить некоторые физические разные
ситуации.
Набор термодинамических фаз связан с различными вариантами порядка, которые допускаются в
том или ином агрегатном состоянии. Порядок - упорядоченное в пространстве расположение
объектов, часто атомов или молекул. Более точно, порядок — это состояние системы, с
достаточной степенью точности инвариантное относительно некоторых определённых сдвигов в
пространстве.
• Газообразное состояние в-ва не обладает никаким порядком. Соответственно, в газообразном
состоянии любое вещество обладает только одной термодинамической фазой.
• Жидкость обладает ориентационным порядком. В результате у одной и той же жидкости могут
быть разные термодинамические фазы, однако количество их редко превышает единицу. Так,
например, существование новой жидкой фазы обнаружено в переохлаждённой воде. Другой,
специфический, пример: сверхтекучее состояние в жидком гелии.
• Кристаллическое твёрдое тело обладает как трансляционным, так и ориентационным
порядком. В результате возникает большое число возможных вариантов ориентации соседних
молекул друг относительно друга. В результате твёрдые тела обладают, как правило, достаточно
сложной фазовой диаграммой. Например, фазовая диаграмма льда, насчитывает порядка 12
термодинамических фаз, реализующихся при различных температурах и давлениях.
07.09.16
38
39.
2. Химическая термодинамикаОсновные понятия и определения
Состояние системы – совокупность всех физических и
химических свойств системы.
07.09.16
39
40.
2. Химическая термодинамикаОсновные понятия и определения
Параметры состояния (термодинамические переменные)
– макроскопические величины, которые можно
экспериментально измерить:
p – давление
T – температура
V – объем
n - количество вещества
07.09.16
40
41.
2. Химическая термодинамикаУравнение состояния
Параметры системы связаны между собой уравнением
состояния
Уравнение состояния термодинамической системы
связывает внутренние переменные с внешними
переменными и температурой или внутренней энергией:
f(a,b,T)=0 или a=a(b,T)
a – совокупность внутренних параметров
b – совокупность внешних параметров
T – температура
07.09.16
41
42.
2. Химическая термодинамикаУравнение состояния
Термическое уравнение состояния:
p=p(V,n,T)
p (давление) – внутренний параметр
V (объем) – внешний параметр
Калорическое уравнение состояния:
U=U(V,n,T)
U (энергия) – внутренний параметр
V (объем) – внешний параметр
Если известны термическое и калорическое уравнения состояния, то
можно определить все термодинамические свойства системы, т.е.
получить ее полное описание
07.09.16
42
43.
2. Химическая термодинамикаУравнение состояния
Уравнение состояния в диф.
форме
Термические коэффициенты
коэф. термического
расширения
Уравнение состояния
через термич. коэф.
коэф. возрастания
давления
коэф. изотермического
сжатия
07.09.16
43
44.
2. Химическая термодинамикаУравнение состояния
Термическое уравнение состояния:
p=p(V,n,T)
p (давление) – внутренний параметр
V (объем) – внешний параметр
Калорическое уравнение состояния:
U=U(V,n,T)
U (энергия) – внутренний параметр
V (объем) – внешний параметр
Если известны термическое и калорическое уравнения состояния, то
можно определить все термодинамические свойства системы, т.е.
получить ее полное описание
07.09.16
44
45.
2. Химическая термодинамикаУравнение состояния
Уравнение состояния идеального газа
07.09.16
45
46.
2. Химическая термодинамикаУравнение состояния
Уравнения состояния реального газа
Уравнение Ван-дер Ваальса
Уравнение Бертло
Уравнение Дитеричи
первое уравнение
второе уравнение
Вириальное уравнение состояния
В2, В3, … - второй, третий и т.д. вириальные коэффициенты, зависят от природы газа и
температуры. В1=1
07.09.16
46
47.
Состояния термодинамическихсистем
07.09.16
www.lcr.tsu.ru
47
48.
2. Химическая термодинамикаОсновные понятия и определения
Набор интенсивных термодинамических параметров определяет
состояние системы.
Для характеристики термодинамической системы необходимо,
чтобы среди параметров состояния был бы один экстенсивный.
Состояния термодинамических систем:
• Равновесное
• Неравновесное (неустойчивое, лабильное)
• Стационарное
07.09.16
48
49.
2. Химическая термодинамикаОсновные понятия и определения
Равновесное состояние – такое состояние системы, при котором её параметры
(давление, объём, температура и др.) не изменяются во времени и в ней
отсутствуют потоки вещества и энергии.
В равновесном состоянии не может быть таких явлений как диффузия, фазовые
превращения и т.п.
Необходимым условием для того, чтобы процесс был
равновесным, является равенство интенсивных параметров,
действующих на систему со стороны окружающей среды и со
стороны системы на окружающую среду.
Механическое равновесие означает равенство давления внутри системы и внешнего
давления.
Тепловое равновесие означает равенство температуры во всех частях системы и в
окружающей среде.
Химическое равновесие – термодинамическое равновесие в системе, между компонентами
которой происходят химические реакции. Параметры состояния системы при химическом
равновесии не зависят от времени; состав такой системы называется равновесным.
07.09.16
49
50.
2. Химическая термодинамикаОсновные понятия и определения
Стационарное состояние - такое состояние системы, при
котором её параметры (давление, объём, температура и др.) не
изменяются во времени, но имеются потоки вещества или
энергии.
Если на границе системы со стороны окружающей среды
поддерживаются одинаковые значения интенсивных
параметров, то система с течением времени обязательно придет
в состояние равновесия.
Если значения интенсивных параметров неодинаковы, то
система придет в стационарное состояние.
07.09.16
50
51.
2. Химическая термодинамикаОсновные понятия и определения
Неравновесное состояние – состояние , при котором хотя бы
один параметр не имеет определённого значения (т.е. система
настолько далека от равновесного состояния, что её нельзя
охарактеризовать определёнными значениями температуры,
давления и концентрации частиц).
Пример: система с различной температурой в разных точках.
Если такую систему изолировать, то температура во всех точках
системы постепенно выровняется, т.е. система придёт в
равновесное состояние.
07.09.16
51
52.
Термодинамические процессы07.09.16
www.lcr.tsu.ru
52
53.
2. Химическая термодинамикаОсновные понятия и определения
Если в т/д системе изменяется хотя бы один параметр, это означает,
что в системе протекает термодинамический процесс
07.09.16
53
54.
2. Химическая термодинамикаОсновные понятия и определения
Термодинамический процесс – последовательность состояний
системы, ведущих от одного начального набора термодинамических
переменных к другому – конечному.
Самопроизвольные процессы – для их осуществления не надо
затрачивать энергию
Несамопроизвольные процессы – происходят только при затрате
энергии
Обратимые процессы – процессы, в которых переход системы из
одного состояния в другое и обратно может происходить через
последовательность одних и тех же состояний, и после возвращения в
исходное состояние в окружающей среде не остается
макроскопических изменений
Необратимые (неравновесные) процессы – процессы, в результате
которых невозможно возвратить систему в первоначальное состояние
07.09.16
54
55.
2. Химическая термодинамикаОсновные понятия и определения
а
A21> A12
б
в
A21≥ A12
а) Уменьшаем массу и число груза
б) Уменьшаем массу и число груза в несколько раз
в) Уменьшаем массу и число груза в десятки тысяч раз
07.09.16
55
56.
2. Химическая термодинамикаОсновные понятия и определения
В пределе когда грузы бесконечно
малы, а их число бесконечно велико,
система непрерывно проходит через
состояние равновесия как в прямом,
так и в обратном направлениях –
ОБРАТИМЫЙ
ПРОЦЕСС.
Система
совершая равновесный процесс может
вернуться в исходное состояние,
пройдя в обратном процессе те же
равновесные состояния, которые она
проходила в прямом – это свойство
равновесного процесса называется
ОБРАТИМОСТЬЮ.
07.09.16
56
57.
ДОПОЛНЕНИЕ07.09.16
57
58.
2. Химическая термодинамикаОсновные понятия и определения
Т/д процесс, при котором система проходит через ряд равновесных состояний,
называется равновесным и такой процесс может быть обратимым.
Обратимость предполагает возвращение системы в первоначальное состояние
без изменения в окружающей среде.
Обратимый процесс возможен, если и в системе, и в окружающей среде он
протекает РАВНОВЕСНО!
Скорость установления равновесия
рассматриваемого процесса
07.09.16
должна
быть
больше
скорости
58
59.
ДОПОЛНЕНИЕ07.09.16
www.tpu.ru
59
60.
ДОПОЛНЕНИЕ07.09.16
www.tpu.ru
60
61.
Постулат о равновесии07.09.16
www.lcr.tsu.ru
61
62.
3. Химическая термодинамикаПостулат о равновесии
Основной постулат термодинамики
(первое исходное положение):
Любая изолированная система с течением времени приходит в
равновесное состояние и самопроизвольно не может из него выйти.
Термодинамическое равновесие — предельное состояние, к которому
стремится термодинамическая система, изолированная от внешних
воздействий, то есть в каждой точке системы устанавливается
термическое, механическое и химическое равновесие, происходит
выравнивание температуры и давления, и все возможные химические
реакции достигают состояния, когда в каждом элементарном
химическом процессе скорость прямой реакции равна скорости
обратной.
07.09.16
62
63.
3. Химическая термодинамикаПостулат о равновесии
Основной постулат термодинамики
(первое исходное положение):
Иначе, любая макроскопическая система находящаяся в постоянных внешних
условиях приходит в состояние термодинамического равновесия и прибывает
в нем сколь угодно долго.
Время необходимое для достижения равновесия называется временем
РЕЛАКСАЦИИ.
Релаксация – самопроизвольный переход системы из неравновесного
состояния в равновесное.
Это положение не выполняется для систем астрономического масштаба
(галактик) и микроскопических систем с малым числом частиц.
07.09.16
63
64.
Постулат о температуре(Нулевой закон термодинамики)
Рольф Г. Фаулер 1931 г.
07.09.16
www.lcr.tsu.ru
64
65.
4. Химическая термодинамикаПостулат о температуре
Нулевой закон термодинамики (второе
исходное положение):
Если система А находится в тепловом
равновесии с системой В, а та, в свою
очередь, находится в равновесии с
системой С, то системы А и С также
находятся в тепловом равновесии; при
этом их температуры равны
Иначе: Если 2-е системы находятся в
термическом равновесии с 3-ей системой, то
они находятся в термическом равновесии между
собой
Нулевой закон
ТЕМПЕРАТУРА!
07.09.16
Т/Д
определяет
понятие
B – термометр
А, С – т/д система
65
66.
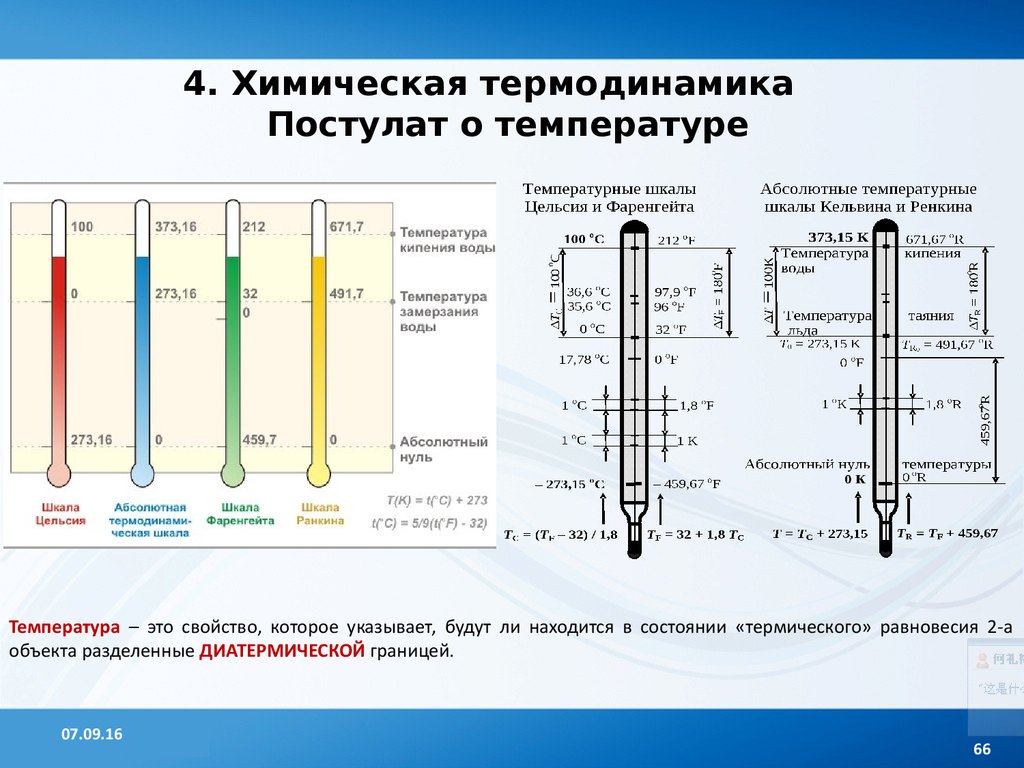
4. Химическая термодинамикаПостулат о температуре
Температура – это свойство, которое указывает, будут ли находится в состоянии «термического» равновесия 2-а
объекта разделенные ДИАТЕРМИЧЕСКОЙ границей.
07.09.16
66






























































 Физика
Физика Химия
Химия Образование
Образование








