Похожие презентации:
Катализ и катализаторы
1. Лекция 10
Катализ икатализаторы
2.
План10.1 Катализ и
катализаторы.
10.2 Кинетика
ферментативных
реакций.
3.
10.1 Катализ – этоявление изменения
скорости реакции под
влиянием веществ,
называемых
катализаторами.
4.
Катализаторы –это вещества, изменяющие
скорость химической реакции,
но не изменяющиеся в ходе
процесса ни качественно, ни
количественно. Они не входят
в состав продуктов реакции.
5.
Небольшие количествакатализаторов
способны существенно
изменить скорость
взаимодействия
большого количества
реагирующих веществ.
6.
Катализаторыгомогенные
гетерогенные
в одной фазе
с реагирующими
веществами
в разных
фазах с
реагирующим
и веществами
7.
Пример гетерогенногокатализа
.... N + 3H
2
2
Pt
2NH3
8.
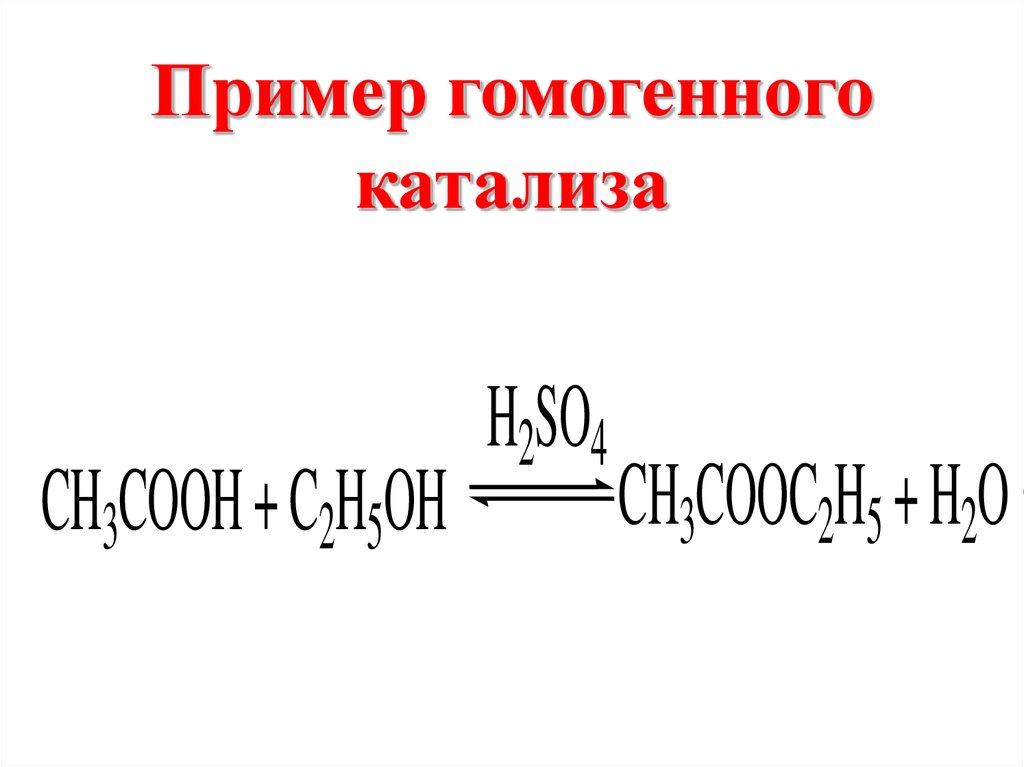
Пример гомогенногокатализа
CH3COOH + C2H5OH
H2SO4
.
CH3COOC2H5 + H2O
9.
Катализаторыположительные
отрицательные
увеличивают
скорость
реакции
уменьшают
скорость
реакции
10.
Вещества, усиливающиедействие катализаторов,
называются
промоторами, а
ослабляющие каталитическими ядами.
11.
Ингибаторы –вещества,
уменьшающие
скорость реакции,
но расходующиеся
при этом сами.
12.
С точки зрения теорииактивного комплекса
механизм действия
катализаторов в том, что
они изменяют высоту
энергетического барьера
химической реакции.
13.
Без катализатора:А + В ↔ А...В → АВ
В присутствии катализатора:
А + В + К↔ А...К...В →
→ АВ + К
14.
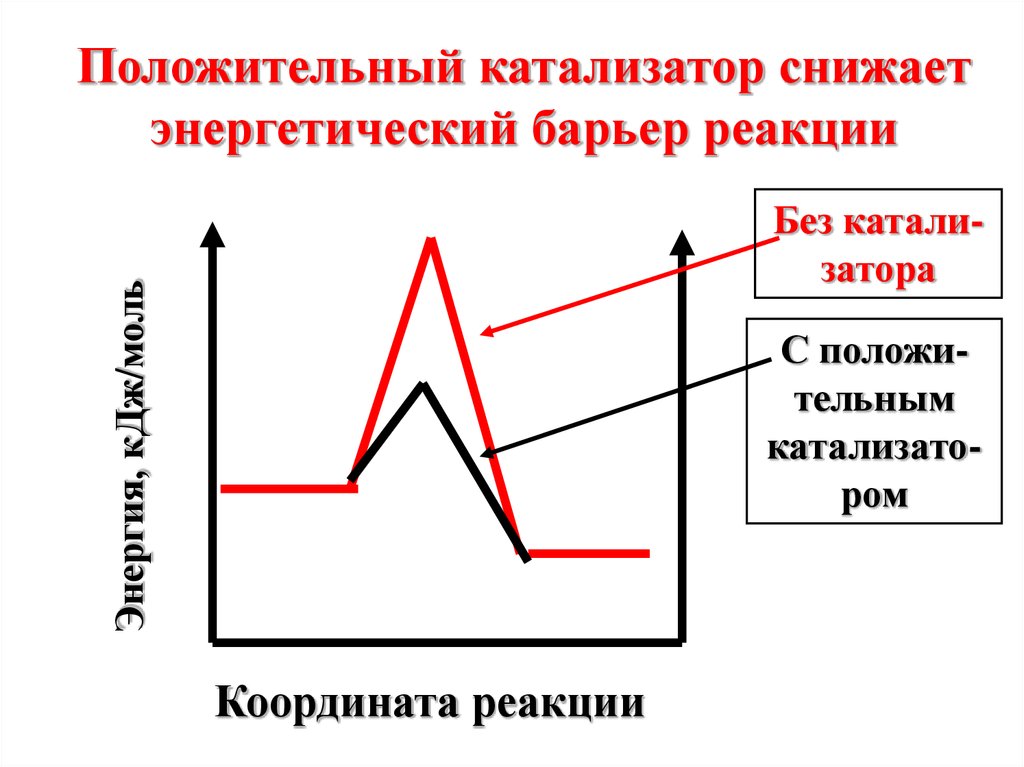
Положительный катализатор снижаетэнергетический барьер реакции
Энергия, кДж/моль
Без катализатора
С положительным
катализатором
Координата реакции
15.
Под воздействиемположительного
катализатора в
реакционной смеси
возрастает доля активных
молекул при данной
температуре. Скорость
реакции увеличивается.
16.
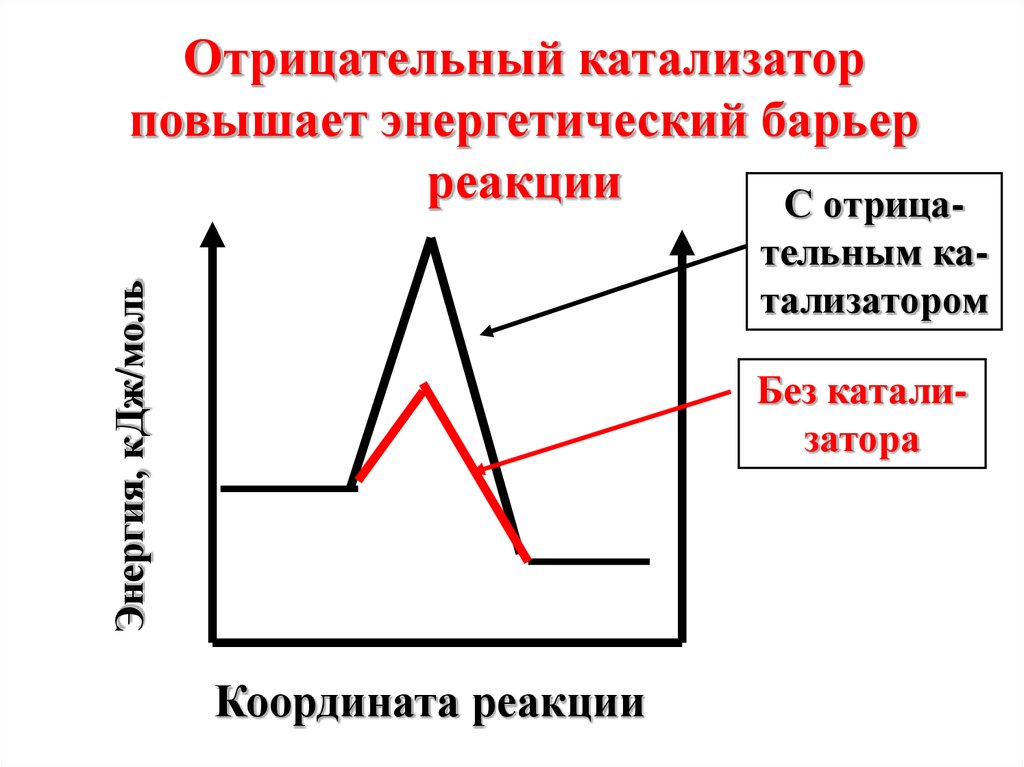
Отрицательный катализаторповышает энергетический барьер
реакции
С отрицаЭнергия, кДж/моль
тельным катализатором
Без катализатора
Координата реакции
17.
Под воздействиемотрицательного
катализатора в
реакционной смеси
снижается доля активных
молекул при данной
температуре. Скорость
реакции уменьшается.
18.
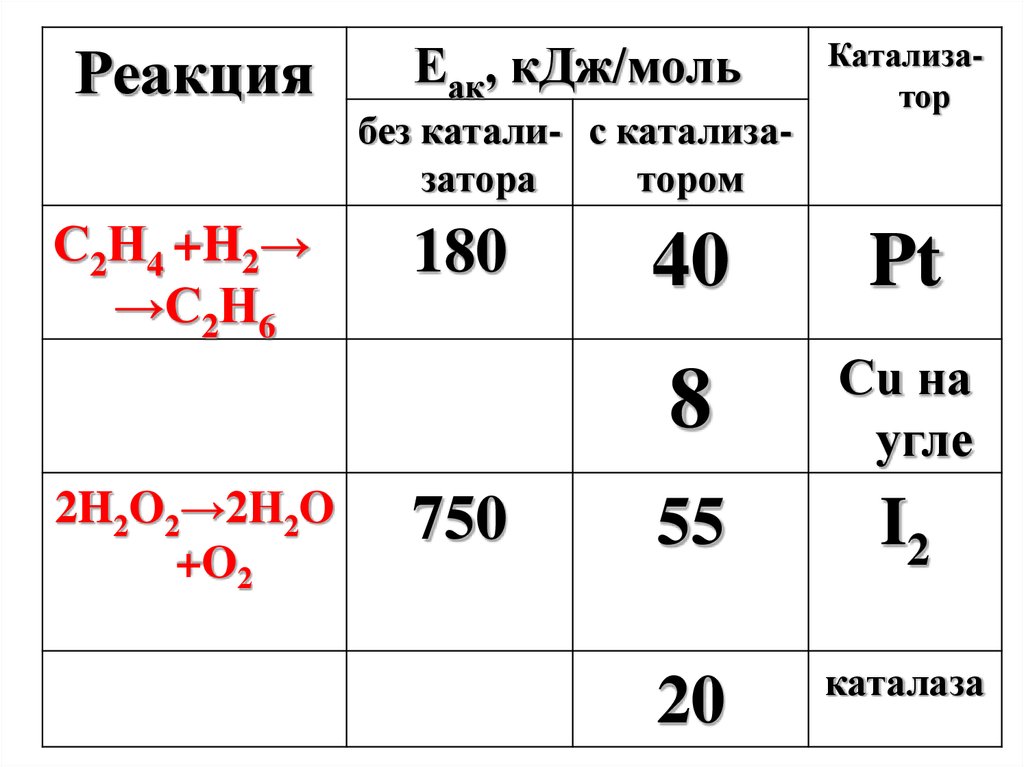
РеакцияЕак, кДж/моль
без катали- с катализазатора
тором
С2Н4 +H2→
→С2Н6
2H2O2→2H2O
+O2
180
750
Катализатор
40
Pt
8
Cu на
угле
55
I2
20
каталаза
19.
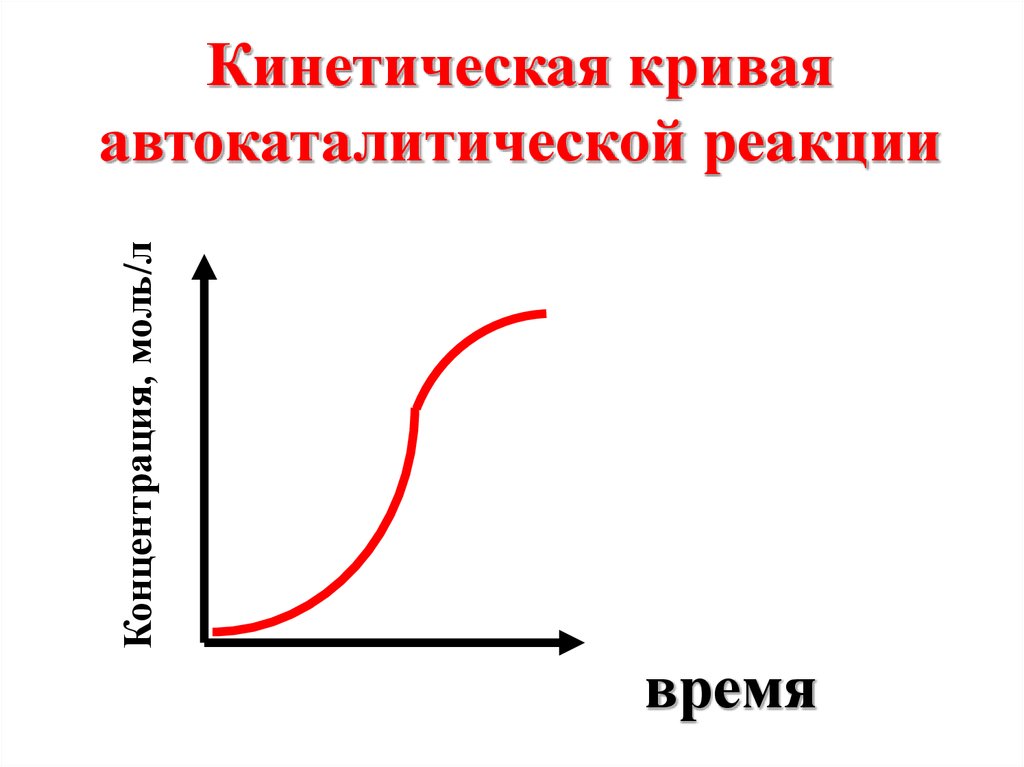
Частным случаемкатализа является
автокатализ:
катализатором
служит один из
продуктов реакции.
20.
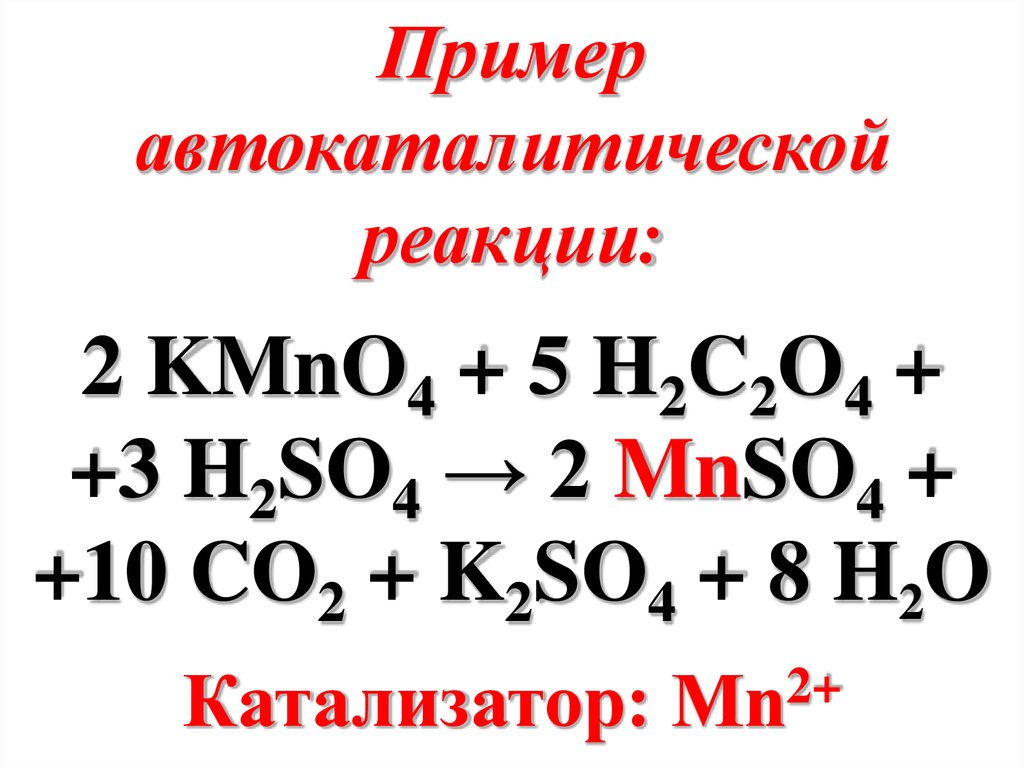
Примеравтокаталитической
реакции:
2 KMnO4 + 5 H2C2O4 +
+3 H2SO4 → 2 MnSO4 +
+10 CO2 + K2SO4 + 8 H2O
Катализатор:
2+
Mn
21.
Концентрация, моль/лКинетическая кривая
автокаталитической реакции
время
22.
Катализаторы широкоприменяются в
химической
промышленности. В
США рынок
катализаторов
составляет ~2 млрд. $.
23.
Однако некоторыекаталитические
процессы в природе
оказываются
разрушительными для
окружающей среды.
24.
Разрушение озоновогослоя Земли
– пример гомогенного
катализа, протекающего
в атмосфере под
воздействием фреонов.
25.
Жизнь наЗемле
немыслима
без озонового
слоя,
предохраняю
щего все
живое от вредного ультрафиолетового
излучения Солнца.
26.
Исчезновение озоносферыпривело бы к
непредсказуемым
последствиям - вспышке
рака кожи, уничтожению
планктона в океане,
мутациям растительного и
животного мира.
27.
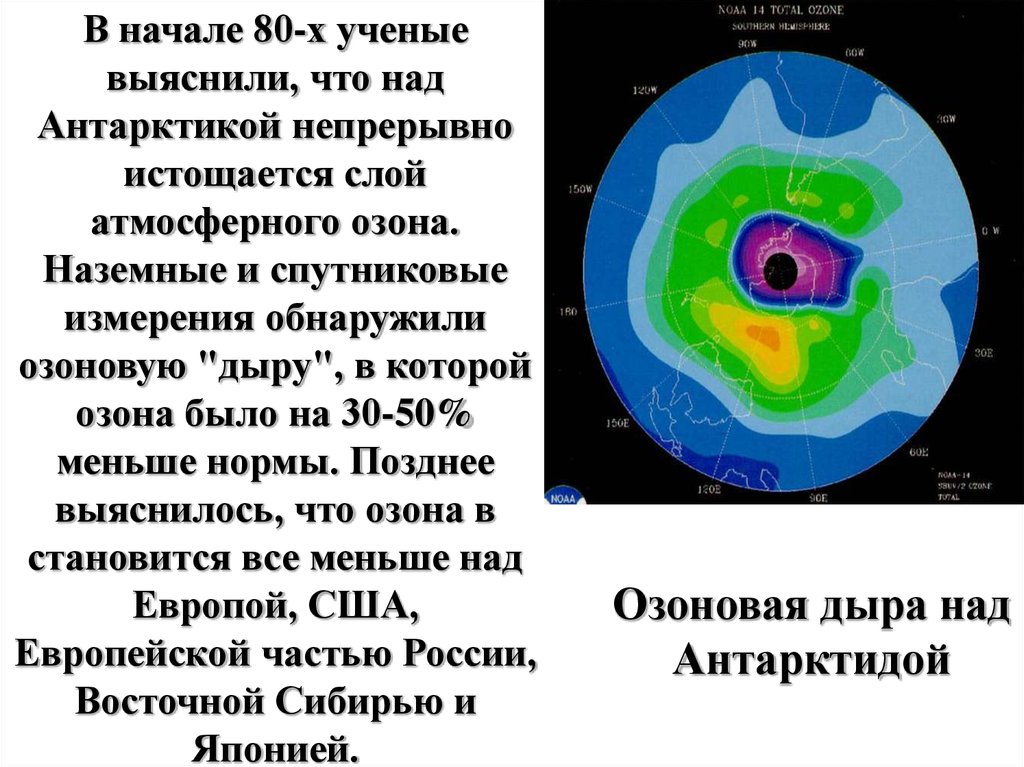
В начале 80-х ученыевыяснили, что над
Антарктикой непрерывно
истощается слой
атмосферного озона.
Наземные и спутниковые
измерения обнаружили
озоновую "дыру", в которой
озона было на 30-50%
меньше нормы. Позднее
выяснилось, что озона в
становится все меньше над
Европой, США,
Европейской частью России,
Восточной Сибирью и
Японией.
Озоновая дыра над
Антарктидой
28.
Фреоны – это фторохлороуглеводороды (СF2Cl2),применяемые как
хладагенты. При обычных
условиях они отличаются
высокой устойчивостью к
разложению.
29.
В атмосфере происходитразложение фреонов под
воздействием
ультрафиолетового излучения
солнца:
CF2Cl2 CF2
Cl
+
Cl
Cl - катализатор
разложения озона
30.
Без катализаторапроцесс протекает по
схеме:
O3 + O 2 O2
Eак = 17,1 кДж/моль
31.
В присутствии катализатора:O3 + Cl ClO + O2
Eак= 2,1 кДж/моль
ClO + O Cl + O2
Eак = 0,4 кДж/моль
O3 + O 2 O2
Cl
32.
Присутствие катализатора существенноснижает энергетический барьер реакции,
увеличивая скорость разложения озона.
О3+ О
2О2
Координата реакции
33.
1987 году в Монреалесостоялась Международная
конференция, посвященная
угрозе озоновому слою.
Промышленно развитые
страны договорились о
сокращении производства
хлорированных и
фторированных углеводородов.
34.
К 1992 году замена этих веществна безопасные проходила так
успешно, что было принято
решение о полном их
уничтожении к 1996 году.
Сегодня ученые верят, что лет
через пятьдесят озоновый слой
восстановится полностью.
35.
10.2 Практическивсе биохимические
реакции являются
ферментативными.
36.
Ферменты(биокатализаторы) –
это вещества
белковой природы,
активированные
катионами металлов.
37.
Известно около 2000различных ферментов,
~150 из них выделены,
причем некоторые
используются в качестве
лекарственных
препаратов.
38.
Трипсин и химотрипсин– лечение бронхитов и
пневмонии;
пепсин – лечение гастрита;
плазмин – лечение
инфаркта;
панкреатин – лечение
поджелудочной железы.
39.
Ферменты отличаются отобычных катализаторов:
а) более высокой
каталитической
активностью;
б) высокой
специфичностью, т.е.
избирательностью действия.
40.
Механизм односубстратнойферментативной реакции можно
представить схемой:
R1KR
R
R
R
k
2
1
2
2
2
M
EPP
+
ЕЕ ++ЕSS+ S ES
ES ES P+ EE++
Лимитирующая
стадия
41.
Е–
S
–
ЕS –
Р
фермент,
субстрат,
ферментсубстратный
комплекс,
–
продукт
42.
Характеристикой первойстадии ферментативной
реакции является КМ –
константа Михаэлиса.
КМ является величиной,
обратной константе
равновесия.
43.
[ S ][ E ]KÊMÌ [ ES ]
KM =
5
3
10‾ –10‾
моль/л
44.
КМ характеризуетустойчивость
фермент-субстратного
комплекса (ES). Чем
меньше КМ, тем
устойчивее комплекс .
45.
Кинетическое уравнение:= k2 [ES],
(1)
где k2 – константа
скорости, называемая
числом оборотов или
молекулярной
активностью фермента.
46.
k2 равна числу молекулсубстрата, претерпевающих
превращения под
воздействием одной
молекулы фермента за 1
0
минуту при 25 С
4
1·10
< k2 <
6
6·10
1
мин‾
47.
Дляуреазы,
ускоряющей
гидролиз мочевины:
k2 =
6
1,85∙10
1
мин‾
Для
аденозинтрифосфатазы,
ускоряющей гидролиз АТФ:
k2 = 6,24∙106 мин‾1
Для каталазы, ускоряющей
разложение Н2О2:
k2 = 5∙106 мин‾1
48.
Существеннымнедостатком
уравнения (1) является
невозможность
экспериментального
определения [ES].
49.
Выразив [ES] через другиевеличины, получаем
кинетическое уравнение
ферментативных реакций,
называемое уравнением
Михаэлиса-Ментен (1913)
50.
Уравнение МихаэлисаМентен= k2
E общ S
KM + S
51.
Произведение k2 E общявляется величиной
постоянной, которую
обозначают max
(максимальная
скорость).
52.
Соответственно:=
max S
KM + S
53.
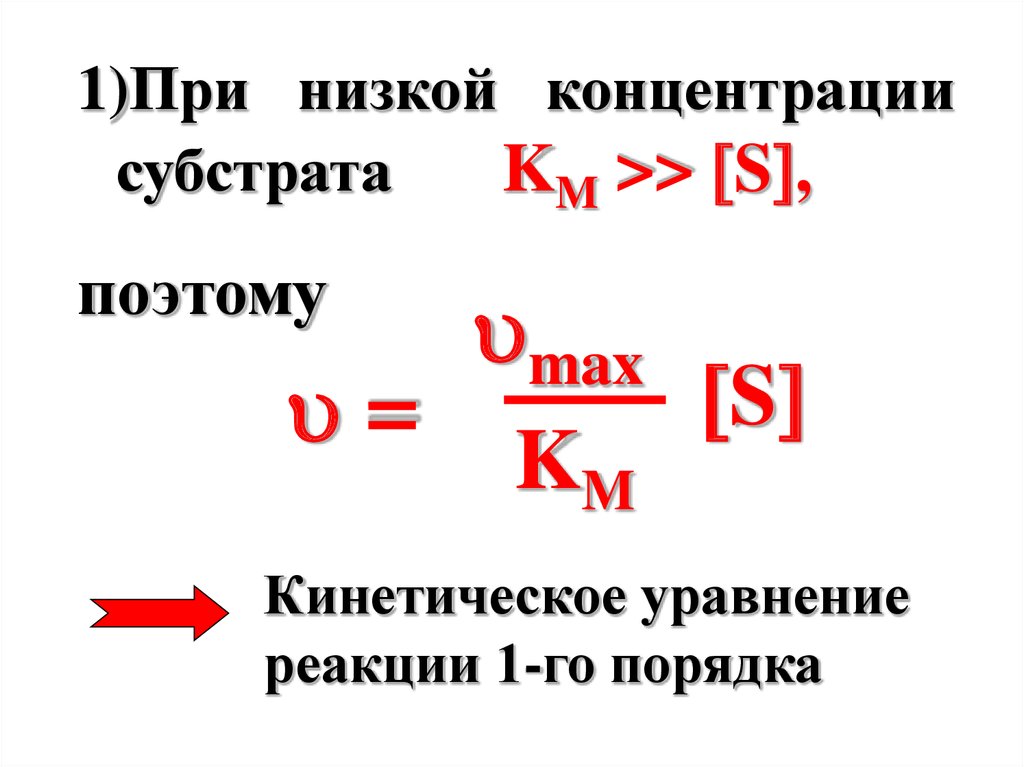
1)При низкой концентрациисубстрата
KM >> S ,
поэтому
=
max
KM
S
Кинетическое уравнение
реакции 1-го порядка
54.
2) При высокойконцентрации субстрата
Км << [S], поэтому
= max
Кинетическое уравнение
реакции 0-го порядка
55.
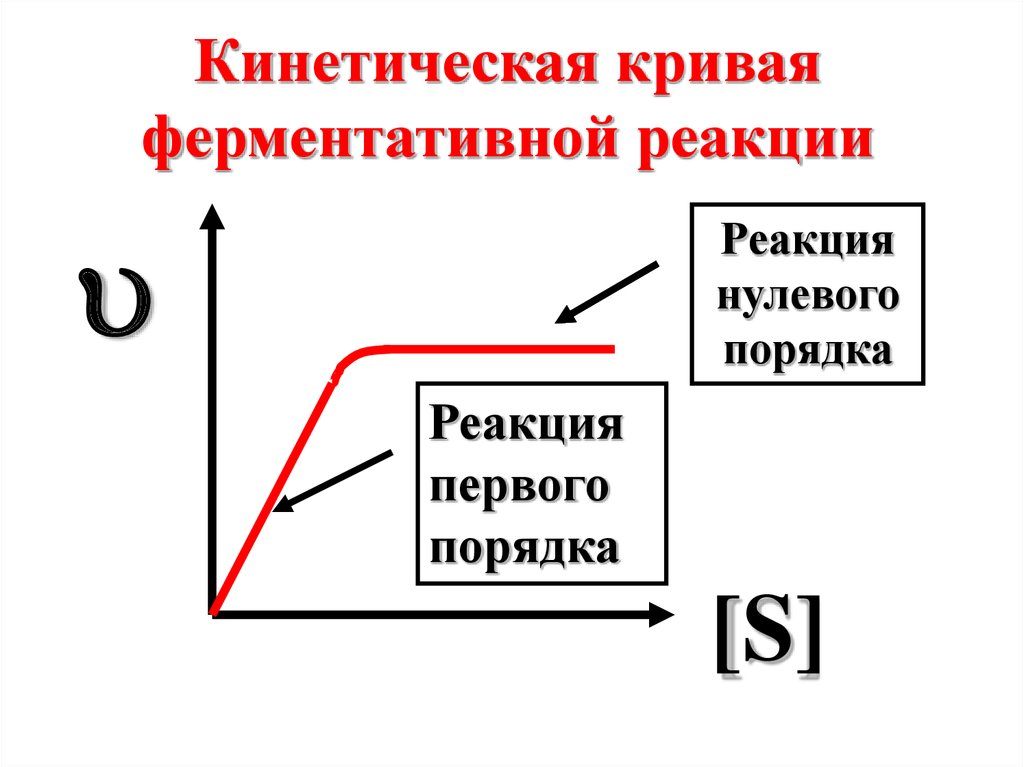
Кинетическая криваяферментативной реакции
Реакция
нулевого
порядка
Реакция
первого
порядка
[S]
56.
3) Если=
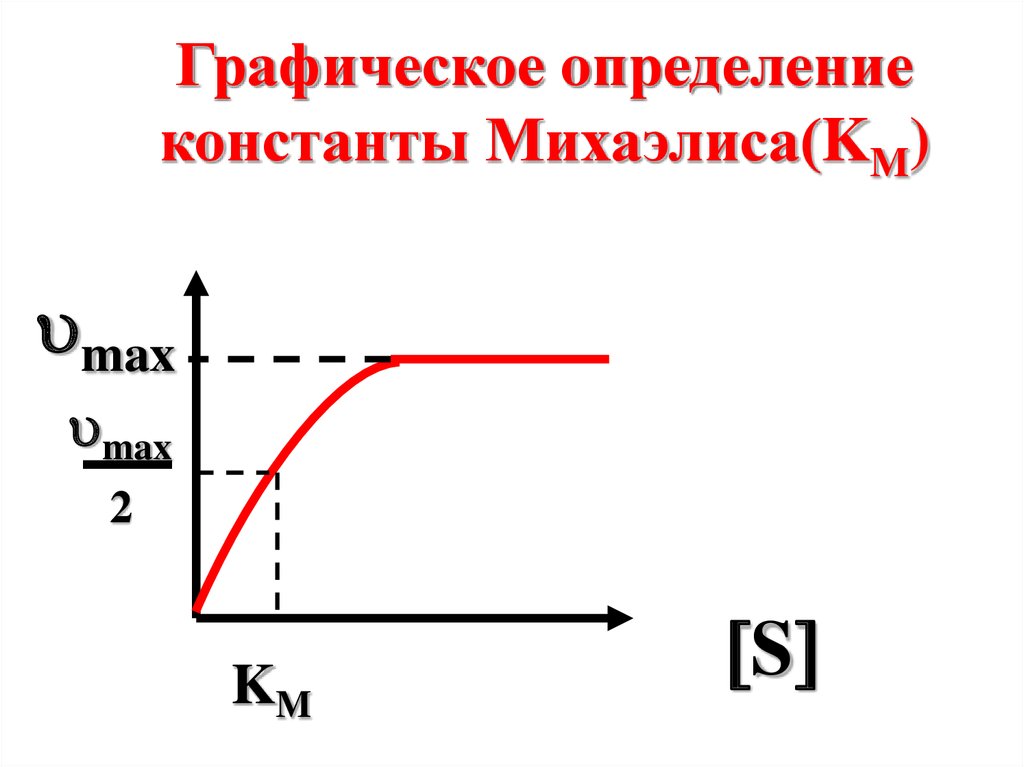
[S] = КМ, то
max
2
,
что позволяет графически
определять Км
57.
Графическое определениеконстанты Михаэлиса(KM)
max
max
2
KM
S
58.
Ферменты, как правило,катализируют реакции с участием
двух или нескольких субстратов.
Для изображения двухсубстратных
реакций используют схемы, в
которых обозначены
промежуточные стадии, а также
стадии ввода субстратов и вывода
продуктов.
59.
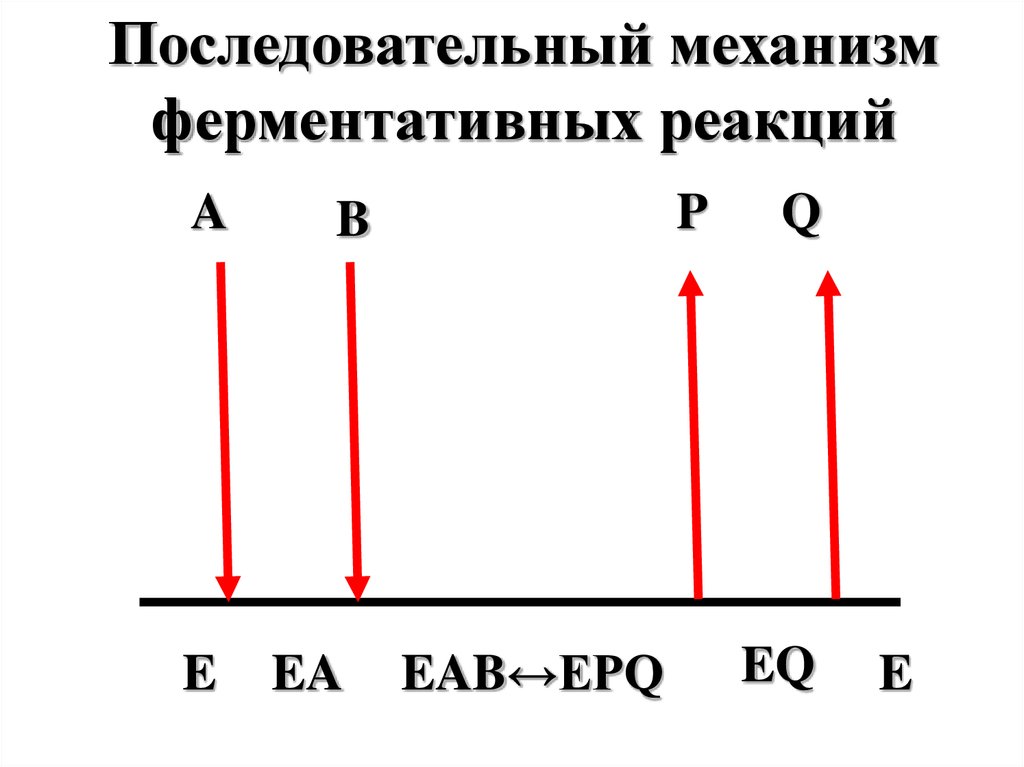
Последовательный механизмферментативных реакций
A
E
P
B
EA
EAB↔EPQ
Q
EQ
E
60.
Пинг-понговый механизмферментативной реакции
A
E
P
EA
B
E*
Q
E*B E
61.
На активностьферментов
оказывают влияние:
а) температура,
б) кислотность среды,
в) наличие ингибиторов
62.
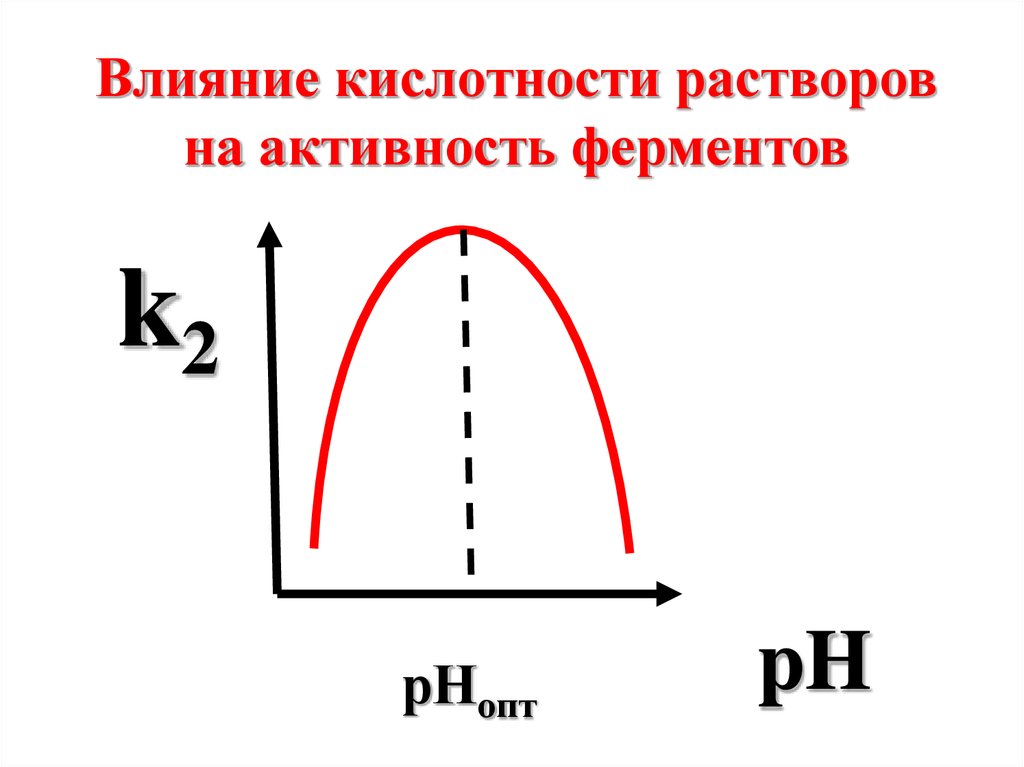
Влияние кислотности растворовна активность ферментов
k2
рНопт
pH
63.
Для большинстваферментов
оптимальные значения
рН совпадают с
физиологическими
значениями (7,3-7,4).
64.
Однако существуютферменты, для нормального
функционирования которых
нужна сильнокислая
(пепсин – 1,5-2,5) или
достаточно щелочная среда
(аргиназа – 9,5-9,9).
65.
Ингибиторы ферментов –это вещества,
занимающие часть
активных центров
молекул фермента, в
результате чего скорость
ферментативной реакции
уменьшается.
66.
В роли ингибиторов выступаюткатионы тяжелых металлов,
органические кислоты и другие
соединения.
67.
"Ключ к познаниюферментов лежит в
изучении скоростей
реакций".
Дж.Холдейн
68.
Благодаримза
внимание!!!

































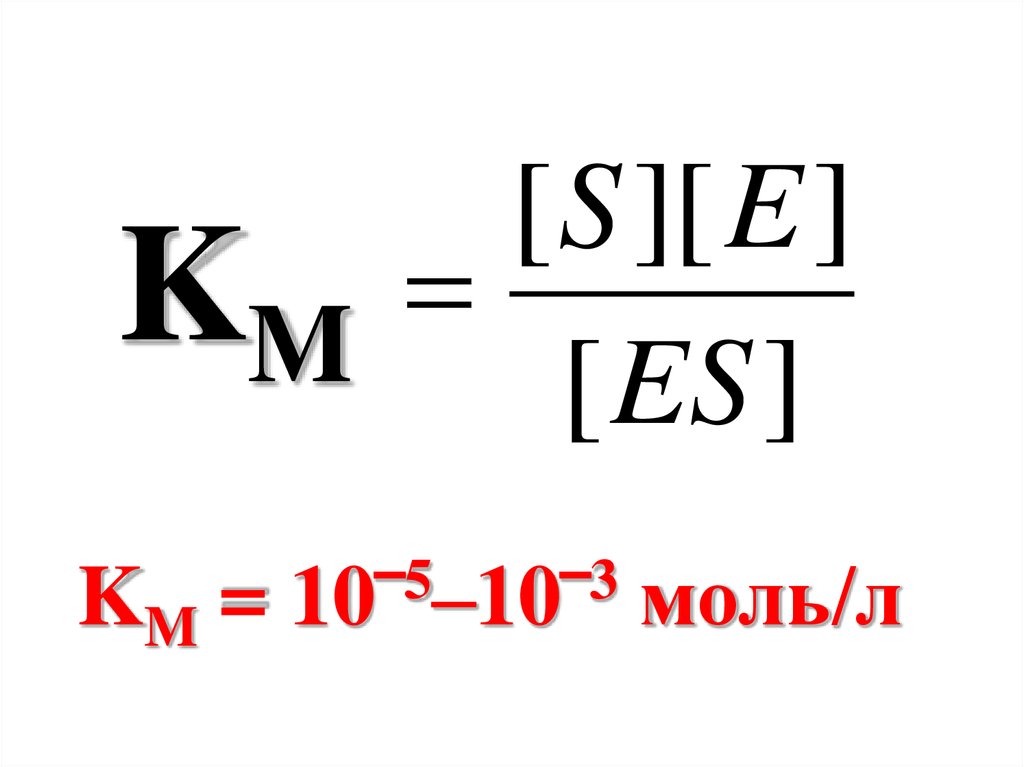




















 Химия
Химия








