Похожие презентации:
Катализ и катализаторы. (Лекция 10)
1. Лекция 10
Катализи
катализаторы
2.
План10.1
Катализ
и
катализаторы
10.2 Кинетика ферментативных
реакций.
3.
10.1 Катализ – этоявление изменения
скорости
реакции
под влиянием веществ, называемых
катализаторами.
4.
Катализаторы– это вещества, изменяющие
скорость химической реакции, но не изменяющиеся в
ходе процесса ни качественно, ни количественно. Они
не входят в состав продуктов
реакции.
5.
Небольшие количествакатализаторов способны существенно изменить скорость взаимодействия большого количества реагирующих
веществ.
6.
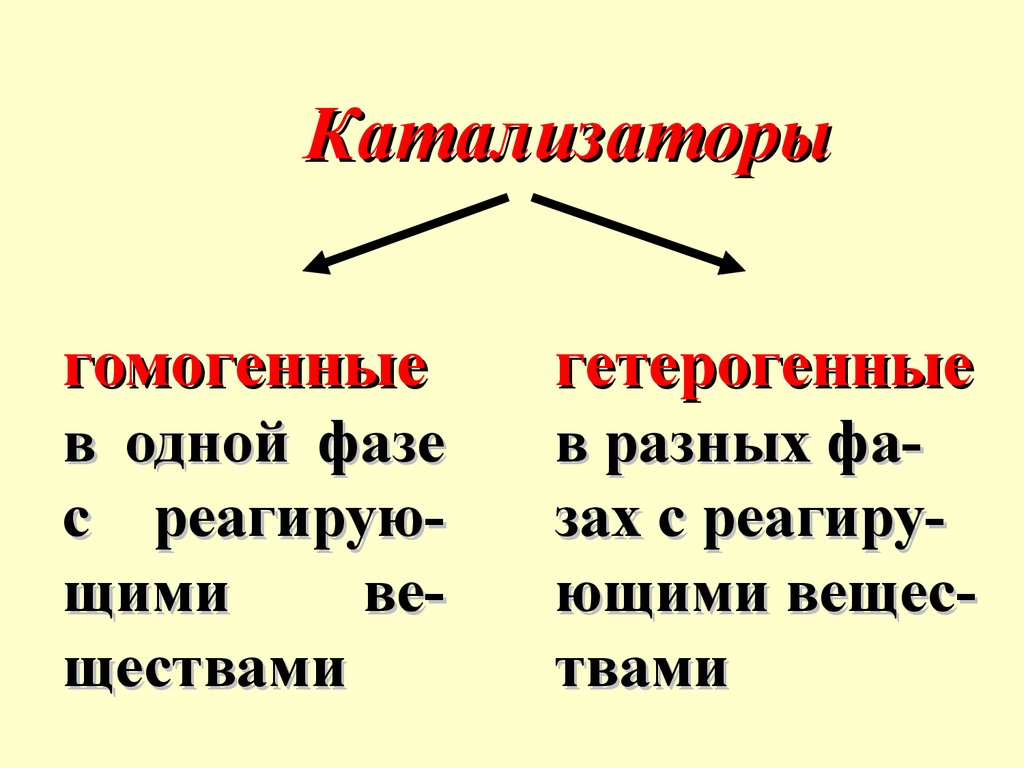
Катализаторыгомогенные
гетерогенные
в одной фазе
с реагирующими
веществами
в разных фазах с реагирующими веществами
7.
Пример гетерогенногокатализа
8.
Пример гомогенногокатализа
9.
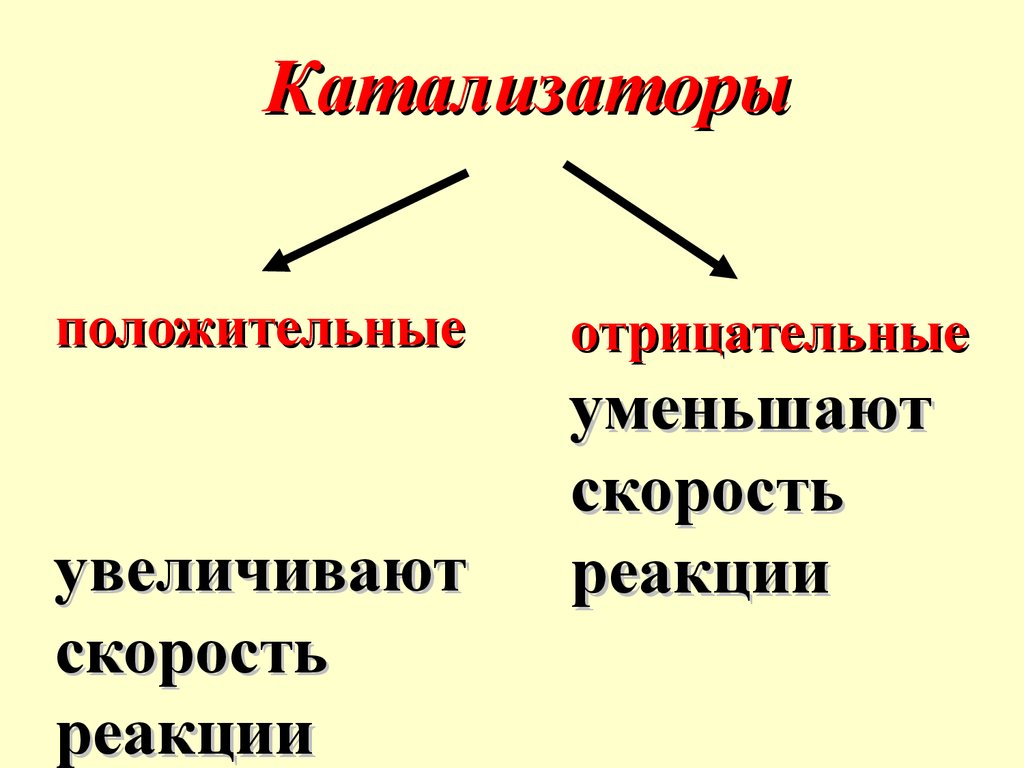
Катализаторыположительные
увеличивают
скорость
реакции
отрицательные
уменьшают
скорость
реакции
10.
Ингибаторы–
вещества,
уменьшающие скорость реакции, но расходующиеся при этом сами.
11.
С точки зрения теорииактивного
комплекса
механизм
действия
катализаторов в том, что
они изменяют высоту
энергетического барьера
химической реакции.
12.
Без катализатора:А + В ↔ А...В → АВ
В присутствии
затора:
катали-
А + В + К↔ А...К...В →
→ АВ + К
13.
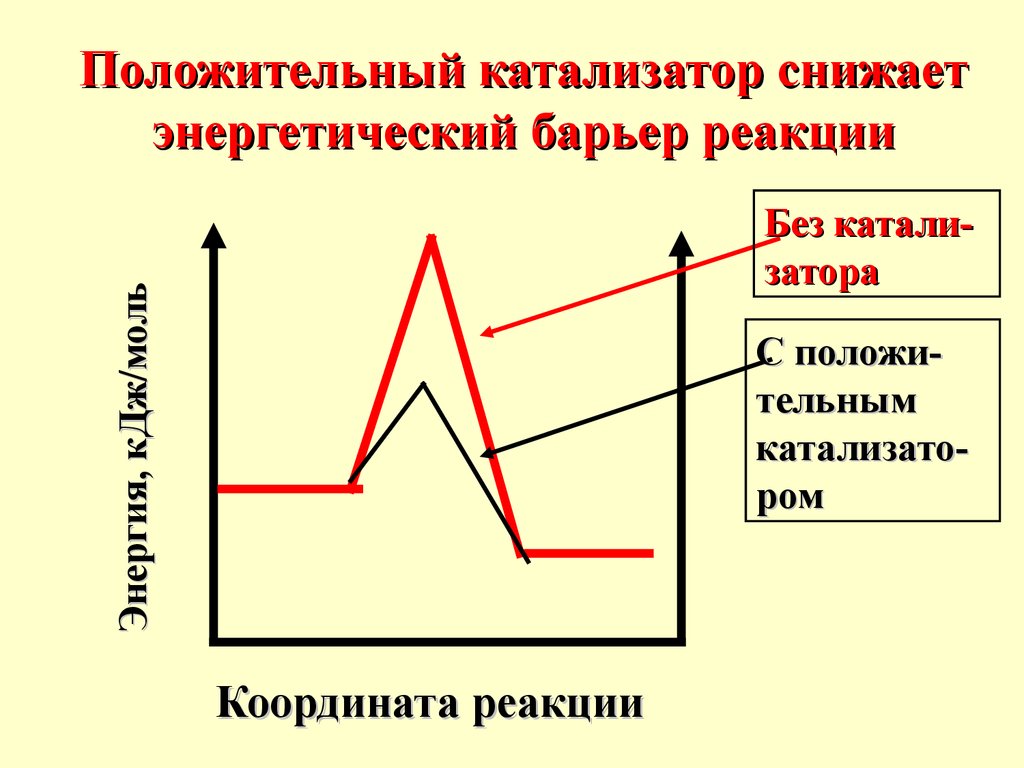
Положительный катализатор снижаетэнергетический барьер реакции
Энергия, кДж/моль
Без катализатора
С положительным
катализатором
Координата реакции
14.
Под воздействием положительного катализаторав реакционной смеси
возрастает доля активных молекул при данной
температуре.
Скорость
реакции увеличивается.
15.
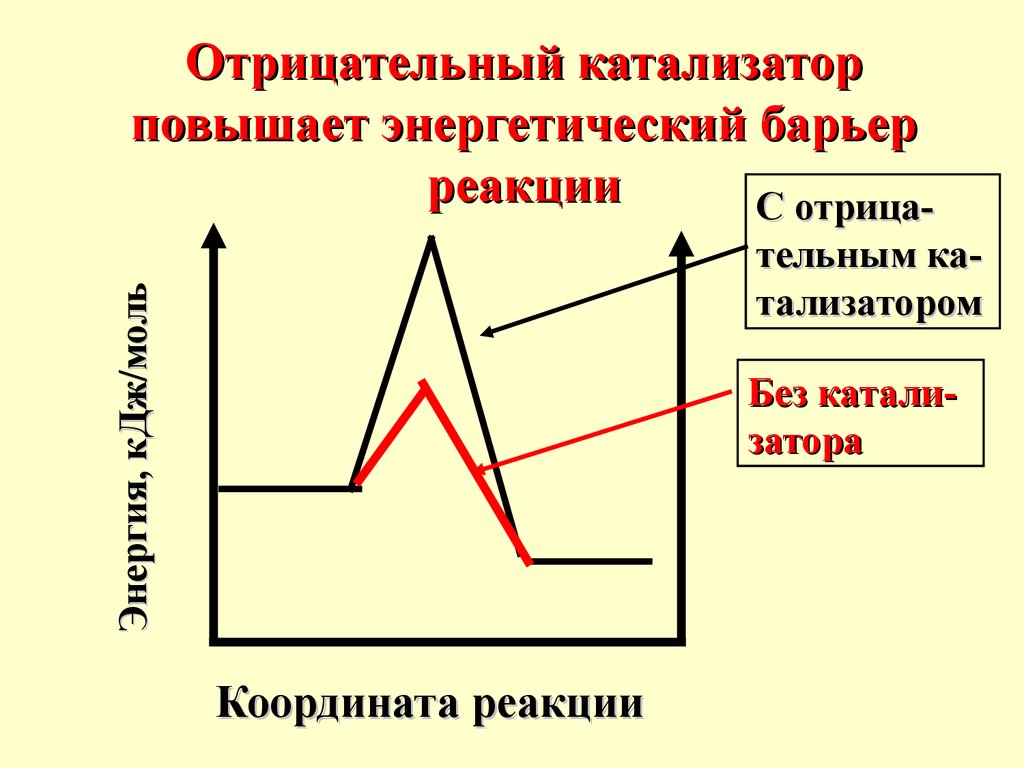
Отрицательный катализаторповышает энергетический барьер
реакции
С отрицаЭнергия, кДж/моль
тельным катализатором
Без катализатора
Координата реакции
16.
Под воздействием отрицательного катализаторав реакционной смеси
снижается доля активных молекул при данной
температуре.
Скорость
реакции уменьшается.
17.
РеакцияЕак, кДж/моль
Катализатор
без катали- с катализазатора
тором
С2Н4 +H2→
→С2Н6
2H2O2→2H2O
+O2
180
750
40
Pt
8
Cu на
угле
55
I2
20
каталаза
18.
Частнымслучаем
катализа является
автокатализ: катализатором служит
один из продуктов
реакции.
19.
Пример автокаталитической реакции:2 KMnO4 + 5 H2C2O4 +
3 H2SO4 → 2 MnSO4 +
10 CO2 + K2SO4 + 8 H2O
Катализатор: Mn
2+
20.
Концентрация, моль/лКинетическая кривая
автокаталитической реакции
время
21.
Разрушение озонового слоя Земли –пример
гомогенного
катализа,
протекающего в атмосфере под
воздействием фреонов.
22.
Фреоны– это фторохлороуглеводороды (СF2Cl2),
применяемые как хладагенты. При обычных условиях
они отличаются высокой
устойчивостью к разложению.
23.
Ватмосфере
происходит
разложение
фреонов
под
воздействием
ультрафиолетового излучения солнца:
CF2Cl2 CF2Cl + Cl
Cl - катализатор
разложения озона
24.
Без катализаторапроцесс протекает по
схеме:
O3 + O 2 O 2
Eак = 17,1 кДж/моль
25.
В присутствии катализатора:катализатора
O3 + Cl ClO + O2
Eак= 2,1 кДж/моль
ClO + O Cl + O2
Eак = 0,4 кДж/моль
Cl
O3 + O 2 O 2
26.
Энергия,кДж/моль
Присутствие катализатора существенно снижает энергетический барьер
реакции, увеличивая скорость разложения озона.
О3+ О
2О2
Координата реакции
27.
Вещества,усиливающие действие катализаторов, называются промоторами, а ослабляющие - каталитическими
ядами.
28.
10.2Практически
все
биохимические реакции
являются ферментативными.
Ферменты (биокатализаторы) – это вещества белковой
природы,
активированные
катионами металлов.
29.
Известно около 2000различных ферментов,
~150 из них выделены,
причем
некоторые
используются в качестве
лекарственных
препаратов.
30.
Трипсин и химотрипсин– лечение бронхитов и пневмонии;
пепсин – лечение гастрита;
плазмин – лечение инфаркта;
панкреатин – лечение поджелудочной железы.
31.
Ферменты отличаются отобычных катализаторов:
а)
более
высокой
каталитической
активностью;
б)
высокой
специфичностью, т.е. избирательностью действия.
32.
Механизм ферментативной реакцииможно представить схемой:
KM
k2
P+
Лимитирующая
стадия
33.
Е–
S –
ЕS –
Р
фермент,
субстрат,
ферментсубстратный
комплекс,
–
продукт
34.
Характеристикой первой стадии ферментативной реакции является КМ – константаМихаэлиса. КМ является
величиной,
обратной
константе равновесия.
35.
KMKM = 10‾ –10‾ моль/л
5
3
36.
КМ характеризует устойчивость ферментсубстратногокомплекса
(ES).
Чем
меньше КМ, тем устойчивее комплекс .
37.
Кинетическое уравнение:= k2 [ES],
(1)
где
k2 –
константа
скорости,
называемая
числом оборотов или
молекулярной
активностью фермента.
38.
k2 равна числу молекулсубстрата,
претерпевающих превращения под
воздействием одной молекулы фермента за 1 ми0
нуту при 25 С .
1·10 < k2 < 6·10 мин‾
4
6
1
39.
Дляуреазы,
ускоряющей
гидролиз мочевины:
k2 = 1,85∙10 мин‾
6
1
Для
аденозинтрифосфатазы,
ускоряющей гидролиз АТФ:
k2 = 6,24∙10 мин‾
6
1
Для каталазы, ускоряющей
разложение Н2О2:
k2 = 5∙106 мин‾1
40.
Существеннымнедостатком
уравнения (1) является невозможность
экспериментального
определения [ES]. Выразив [ES]
через другие величины, получаем
кинетическое уравнение
фермен-тативных
реакций,
называемое
уравнением
Михаэлиса-Ментен
(1913
41.
Уравнение МихаэлисаМентен= k2
E общ S
K M + S
42.
Произведение k2 E общявляется
величиной
постоянной,
которую
обозначают max (максимальная скорость).
43.
Соответственно:=
max S
K M + S
44.
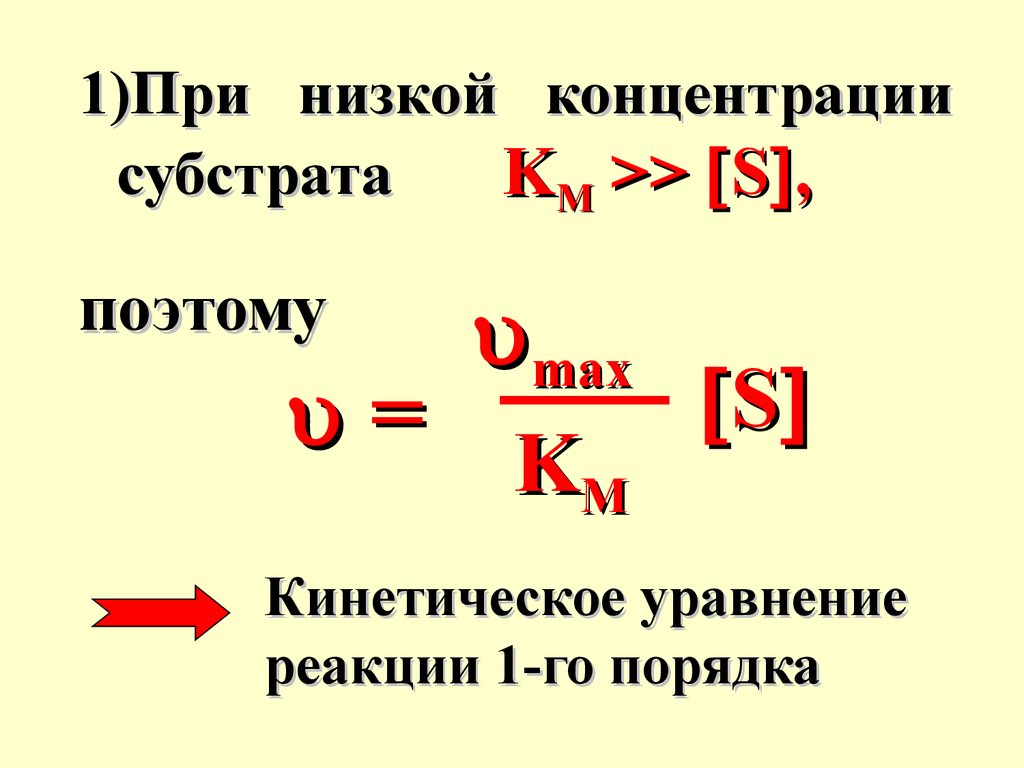
1)При низкой концентрациисубстрата
KM >> S ,
поэтому
max
S
=
KM
Кинетическое уравнение
реакции 1-го порядка
45.
2) При высокой концентрации субстрата Км << [S],поэтому
= max
Кинетическое уравнение реакции 0го порядка
46.
Кинетическая криваяферментативной реакции
Реакция
нулевого
порядка
Реакция
первого
порядка
[ S]
47.
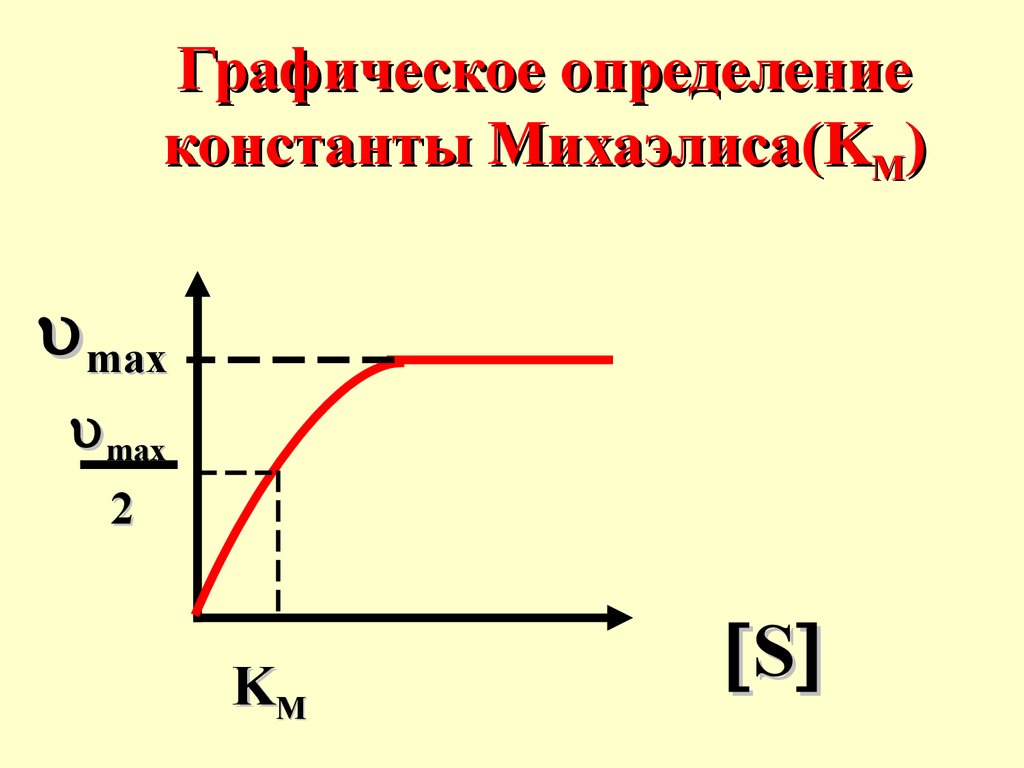
3) Если=
[S] = КМ, то
max
2
что позволяет
определять Км
,
графически
48.
Графическое определениеконстанты Михаэлиса(KM)
max
max
2
KM
S
49.
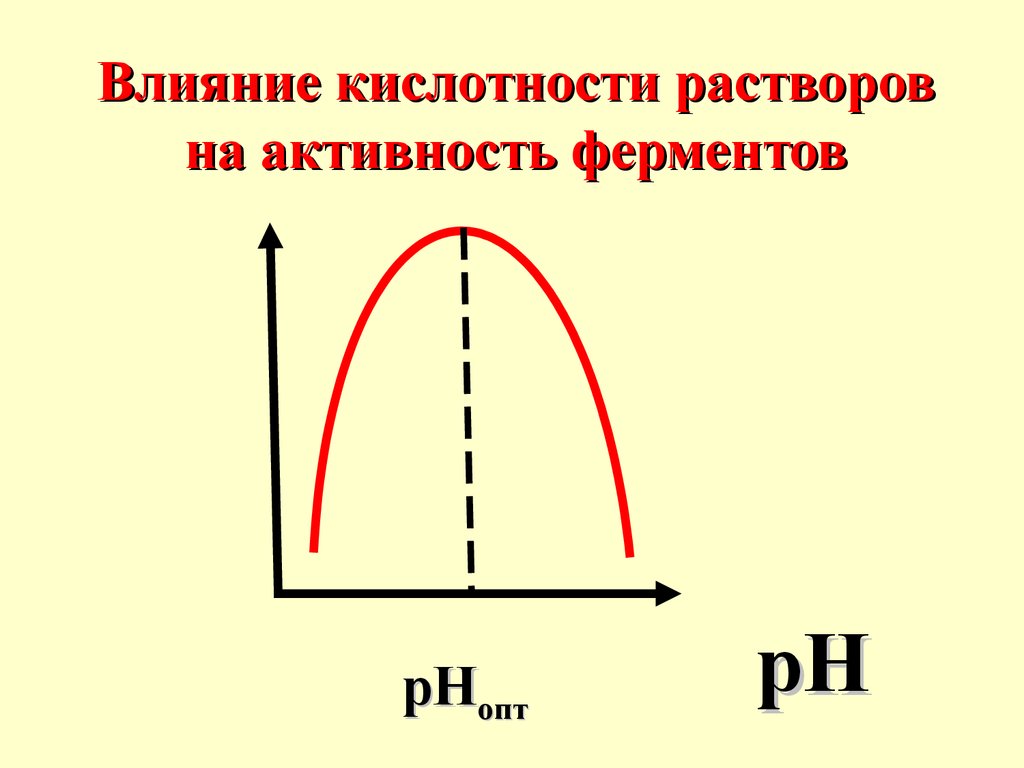
На активность ферментов оказывают влияние:а) температура,
б) кислотность среды,
в) наличие ингибиторов
50.
Влияние кислотности растворовна активность ферментов
рНопт
pH
51.
Длябольшинства
ферментов
опти-
мальные значения
рН совпадают с
физиологическими
значениями (7,3-7,4).
52.
Однако существуют ферменты, для нормальногофункционирования которых нужна сильнокислая
(пепсин – 1,5-2,5) или
достаточно
щелочная
среда (аргиназа – 9,5-9,9).
53.
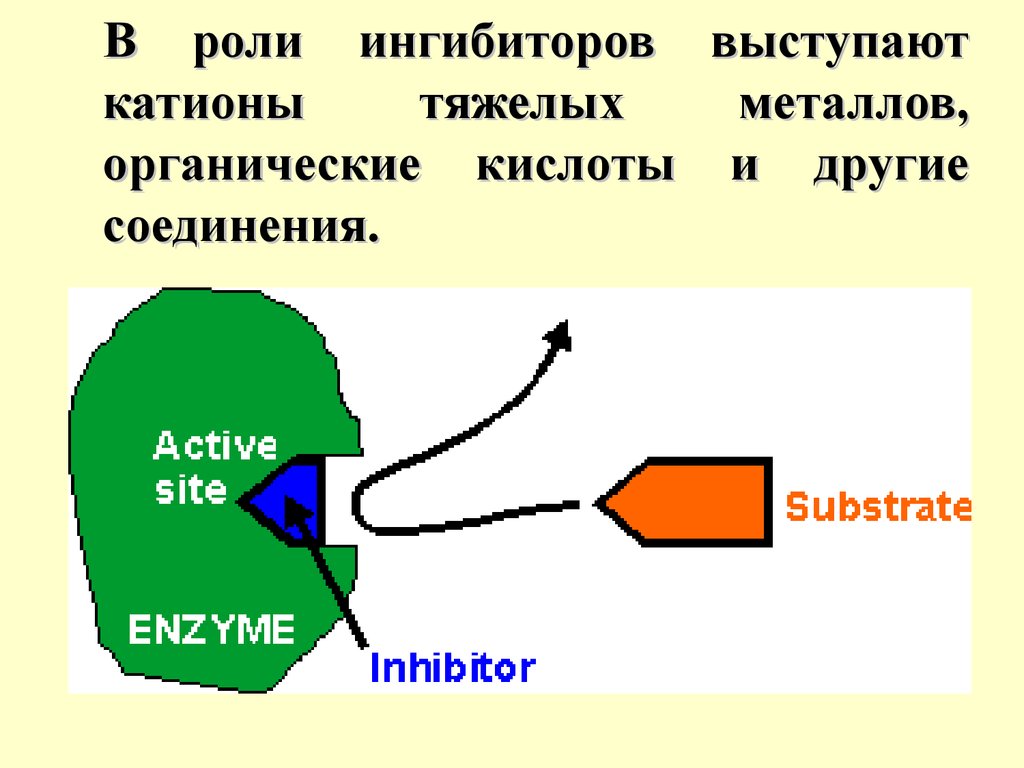
Ингибиторы ферментов –это вещества, занимающие часть активных
центров молекул фермента, в результате чего
скорость ферментативной
реакции уменьшается.
54.
В роли ингибиторов выступаюткатионы
тяжелых
металлов,
органические кислоты и другие
соединения.
55.
"Ключ к познаниюферментов лежит в
изучении скоростей
реакций".
Дж.Холдейн
56.
Благодаримза
внимание!!!
















































 Химия
Химия








