Похожие презентации:
Анестезиология и реаниматология. Кислотно-щелочное равновесие. Клинические варианты нарушений
1. Кафедра анестезиологии и реаниматологии РостГМУ
Кислотно – щелочноеравновесие.
Клинические варианты
нарушений
Профессор Женило В.М.
2. КОС – сбалансированный процесс образования, буферирования и выделения кислот.
3. Буферные системы.
Буферные системы – это биологические жидкостиорганизма.
Любая буферная система – это смесь слабой
кислоты
и
ее
соли,
образованной
сильным
основанием. Добавление к буферу кислоты либо
основания не вызывает изменения рН.
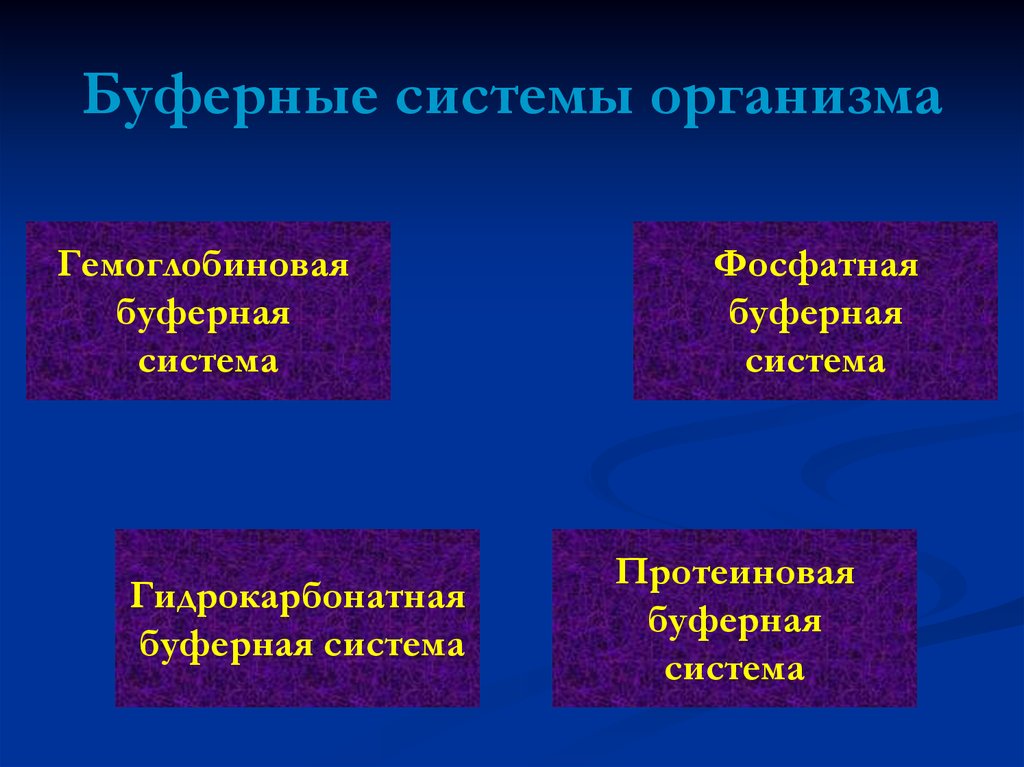
4. Буферные системы организма
Гемоглобиноваябуферная
система
Гидрокарбонатная
буферная система
Фосфатная
буферная
система
Протеиновая
буферная
система
5. Гидрокарбонатная буферная система
(53 % буферной ёмкости крови) – главная иединственная система интерстициальной жидкости.
Н2О + СО2 Н2СО3 Н+ + НСО3 -
Выделение СО2 происходит через легкие, ионы Н+
и НСО3 – выделяются через почки.
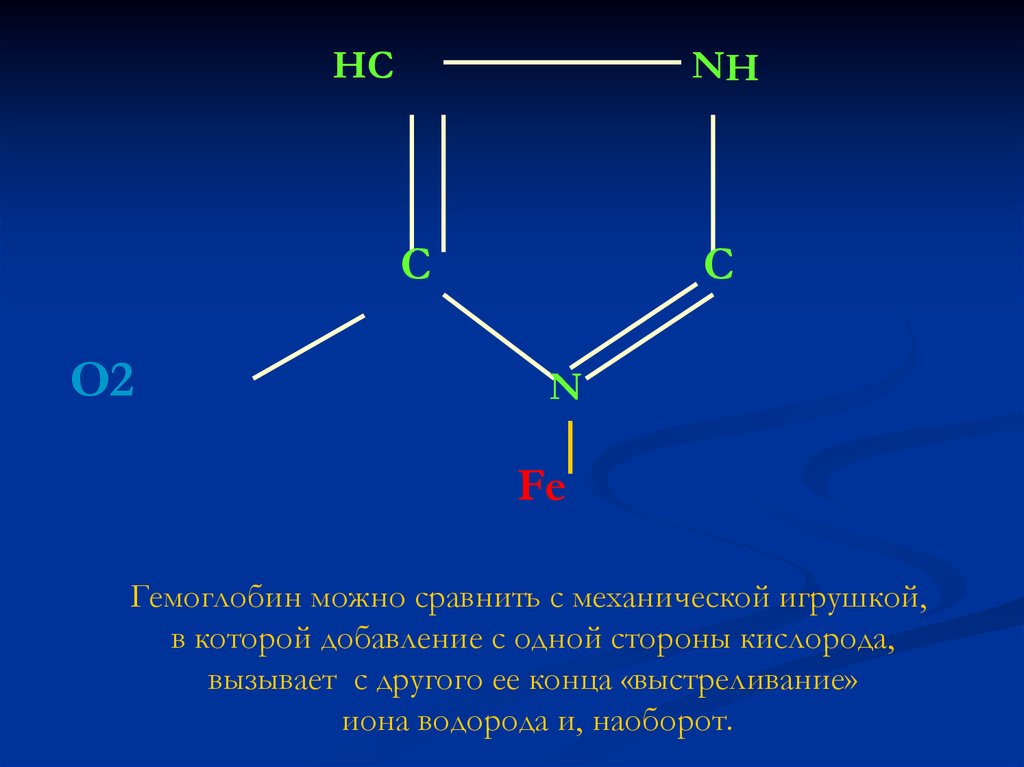
6. Гемоглобиновая буферная система
(35% буферной способности крови)Буферное
происходит
гистидина,
действие
за
молекулы
счет
которая
гемоглобина
имидазольной
может
группы
присоединять
или
отдавать ионы водорода, в зависимости от того
присоединяет или отдает другая часть молекулы
кислорода.
7.
HCNH
C
O2
C
N
Fe
Гемоглобин можно сравнить с механической игрушкой,
в которой добавление с одной стороны кислорода,
вызывает с другого ее конца «выстреливание»
иона водорода и, наоборот.
8. Протеиновая система
(7 % буферной способности крови)Н+
Поскольку концентрация белков в плазме невелика,
+ белок Нбелок
их буферная мощность в плазме незначительна.
Однако в клетках они играют существенную роль
при переносе ионов между вне- и внутриклеточным
пространством.
Белки составляют наибольшую часть пула анионов
плазмы
9. Фосфатная система
(5 % буферной способности крови)Н+
Эта система – первичный и вторичный фосфат (НРО4,
+ НРО4
Н2РО4
Н2РО4) имеет значение для внутриклеточного
пространства и при забуферировании мочи .
Анионы РО4, как и органические кислоты, относятся к
группе неизмеряемых анионов, играющих важную
роль в изменениях метаболического компонента КОС
10.
Показатели КОС можно определить по концентрацииводородных ионов (Н+ ) – ммоль, нмоль. Интегральный
показатель КОС
pH = - lg (H+)
Н+ - 20 – 120 нмоль/л или 6,8 – 7,7 по шкале pН.
В свою очередь, содержание ионов Н+ в плазме крови
определяется соотношением РСО2 и концентрацией ионов
НСО3.
Н+(ммоль/л) = 24 (РСО2/НСО3 -)
11.
Изменение концентрации Н+ на 1 ммоль приводит кизменению рН на 0,01. Отношение РСО2/НСО3указывает на то, что содержание Н+ в плазме крови
прямо пропорционально концентрации РСО2.
Биологический смысл компенсаторных процессов
состоит в поддержании указанного соотношения на
постоянном уровне. В случае изменения одного из
компонентов соотношения происходят изменения
другого компонента в соответствующем направлении.
Эти изменения направлены на ограничение изменений
рН, но не всегда предотвращают их.
12. Роль почек в регуляции КОС
Н+ изПочки непосредственно экскретируют
кислой среды и НСО3-- из щелочной. При
снижении
уровня
гидрокарбоната
в
плазме
проксимальные канальцы реабсорбируют
его до
концентрации 25 ммоль/л , в результате чего
гидрокарбонатный буфер восстанавливается
13. Стадии почечного механизма компенсации
+ НРО4 Н 2РО4буферирование: при преобразовании монофосфата в дифосфат с
последующим его соединением с ионами натрия или хлора и выделением в
мочу, при этом экскретируется 20 – 30 ммоль ионов водорода в день.
Вторая – Н+ + NН3+ NН4+
при соединении аммиака с ионами Н+ формируется аммоний, который
соединяется с ионами натрия или хлора и выделяется с мочой , в день
экскретируется 30 – 50 ммоль водородных ионов. В условиях выраженного
метаболического ацидоза таким образом может выводится до 700 ммоль ионов
Н+ в день
Третья – Н2О+ СО2 Н2СО3 Н+ + НСО3–
реабсорбция бикарбоната. В почках с помощью фермента карбоангидразы
углекислый газ соединяется с водой, образующаяся угольная кислота
диссоциирует на ионы водорода и бикарбоната
Ионы водорода нейтрализуются путями, указанными в первой и второй
стадиях, а ионы бикарбоната остаются в организме
Первая – Н+
14. Роль легких в регуляции КОС
СО2Ткани
Кровь
Лёгкие
Образование СО2
Гидрокарбонатный
буфер
Элиминация СО2
За сутки в клетках образуется от 13000 до 20000
ммоль СО2.
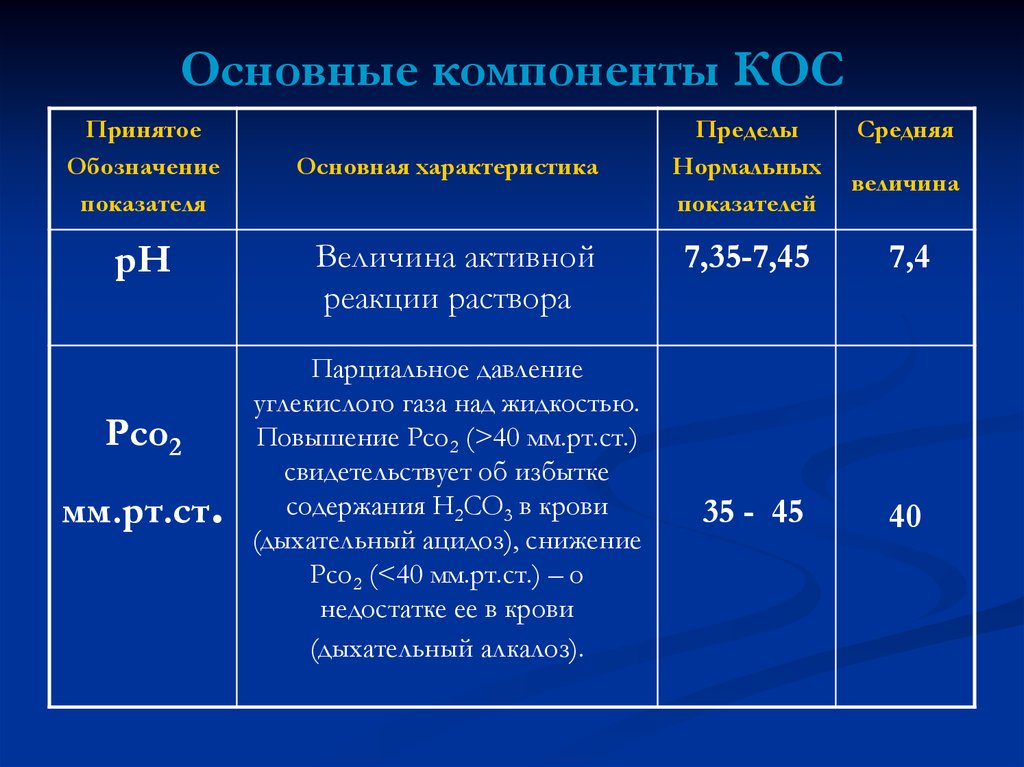
15. Основные компоненты КОС
ПринятоеОбозначение
показателя
рН
Рсо2
мм.рт.ст.
Основная характеристика
Величина активной
реакции раствора
Парциальное давление
углекислого газа над жидкостью.
Повышение Рсо2 (>40 мм.рт.ст.)
свидетельствует об избытке
содержания Н2СО3 в крови
(дыхательный ацидоз), снижение
Рсо2 (<40 мм.рт.ст.) – о
недостатке ее в крови
(дыхательный алкалоз).
Пределы
Нормальных
показателей
Средняя
величина
7,35-7,45
7,4
35 - 45
40
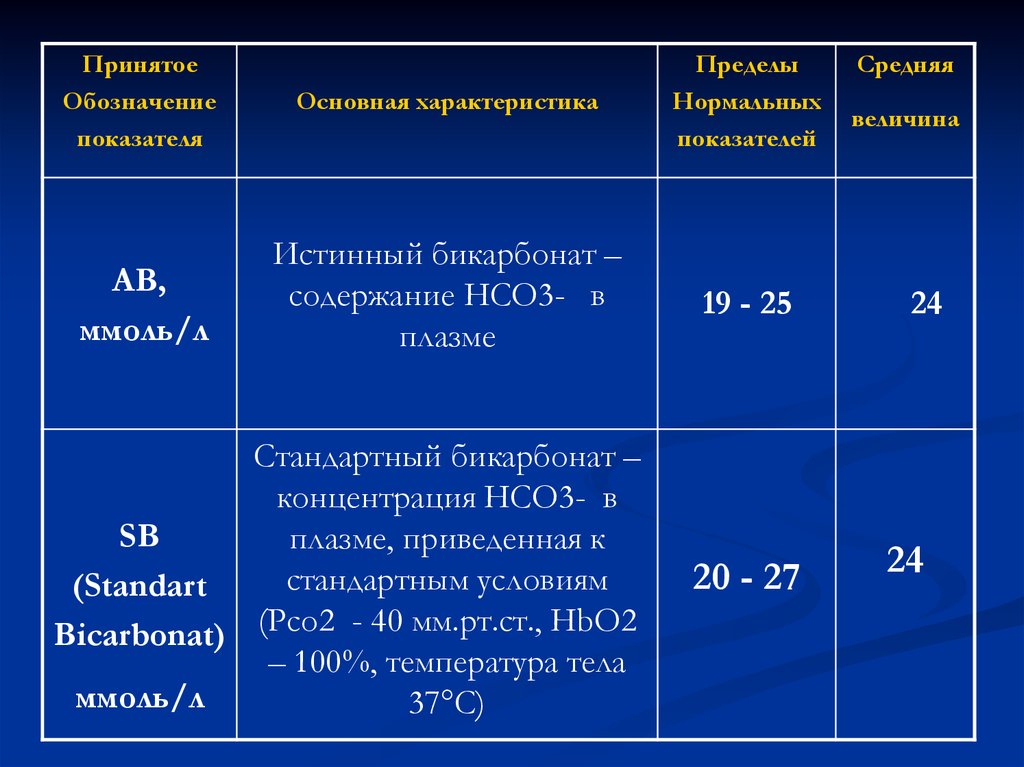
16.
ПринятоеОбозначение
показателя
Основная характеристика
Пределы
Нормальных
показателей
АВ,
ммоль/л
Истинный бикарбонат –
содержание НСО3- в
плазме
19 - 25
Стандартный бикарбонат –
концентрация НСО3- в
SB
плазме, приведенная к
стандартным условиям
(Standart
Bicarbonat) (Рсо2 - 40 мм.рт.ст., HbO2
– 100%, температура тела
ммоль/л
37°С)
20 - 27
Средняя
величина
24
24
17.
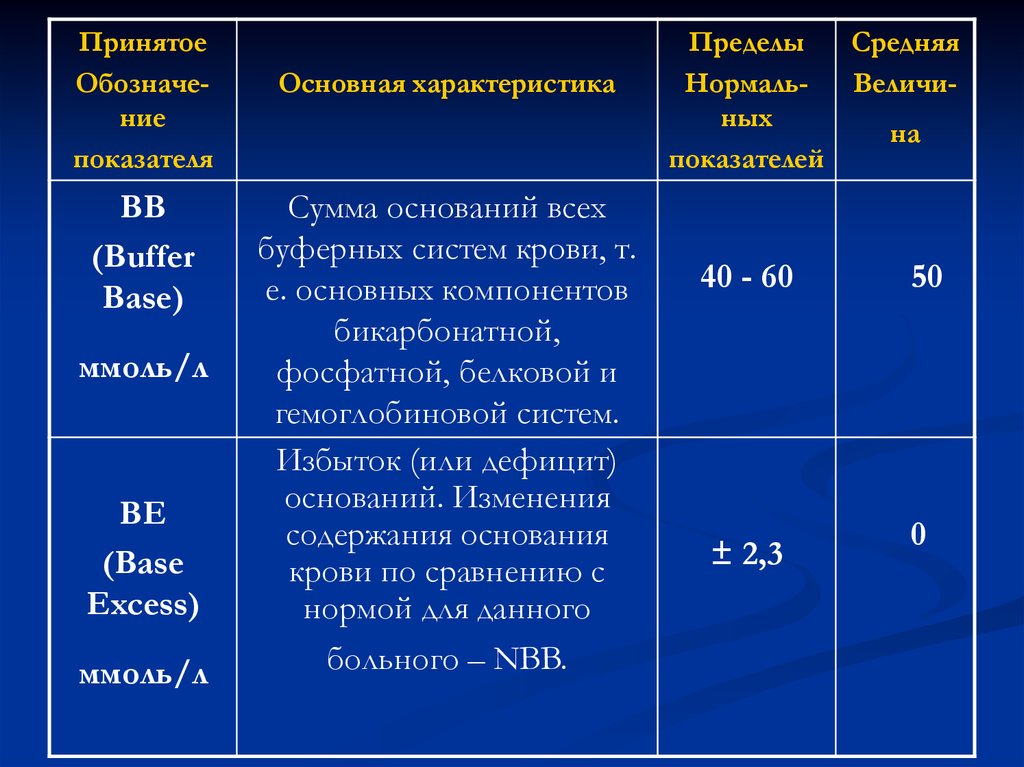
ПринятоеОбозначение
показателя
BB
(Buffer
Base)
ммоль/л
BE
(Base
Excess)
ммоль/л
Основная характеристика
Сумма оснований всех
буферных систем крови, т.
е. основных компонентов
бикарбонатной,
фосфатной, белковой и
гемоглобиновой систем.
Избыток (или дефицит)
оснований. Изменения
содержания основания
крови по сравнению с
нормой для данного
больного – NBB.
Пределы
Средняя
НормальВеличиных
на
показателей
40 - 60
± 2,3
50
0
18.
ПринятоеОбозначене
показателя
Основная характеристика
Это
сумма
всех
основных
компонентов
буферных
систем
взятой
у
больного
крови,
приведенной
к
стандартным
условиям (Рсо2 - 40 мм.рт.ст., HbO2
– 100%, температура тела 37°С).
Зависимость выражается формулой
BE = BB – NBB. Другими словами,
ВЕ показывает, какое количество
сильного основания (в ммолях)
следует добавить (или условно
удалить), чтобы рН стал 7,4 при
(Рсо2 - 40 мм.рт.ст., температура
тела 37°С). Положительное значение
ВЕ указывает на избыток оснований
(или на дефицит кислот).
Пределы
Нормальных
показателей
Средняя
величина
19. В зависимости от величины рН, нарушения КОС крови существуют в двух видах:
нарушения КОСАЦИДОЗ
при снижении рН менее 7,35
АЛКАЛОЗ
при увеличении рН более 7,45
20. Причины возникновения нарушения КОС крови:
Метаболические, когда изменяетсяконцентрация оснований при сохранной
скорости образования и выведения СО2
Респираторные, характеризующиеся
нарушением соотношения между количеством
образованного и выведенного СО2 , при
неизмененной метаболической концентрации
ионов бикарбоната.
21. Кислотно – основное равновесие нельзя рассматривать отдельно от водно – электролитного баланса, поскольку они тесно связаны
тремя основными законами.организм всегда стремится к поддержанию постоянной
величины рН
сумма положительных зарядов – катионов всегда должна
быть равна сумме отрицательных зарядов – анионов (закон
электронейтральности )
осмолярность во всех жидкостных средах должна быть
одинаковой ( закон изоосмолярности) 285-295 мосм/л
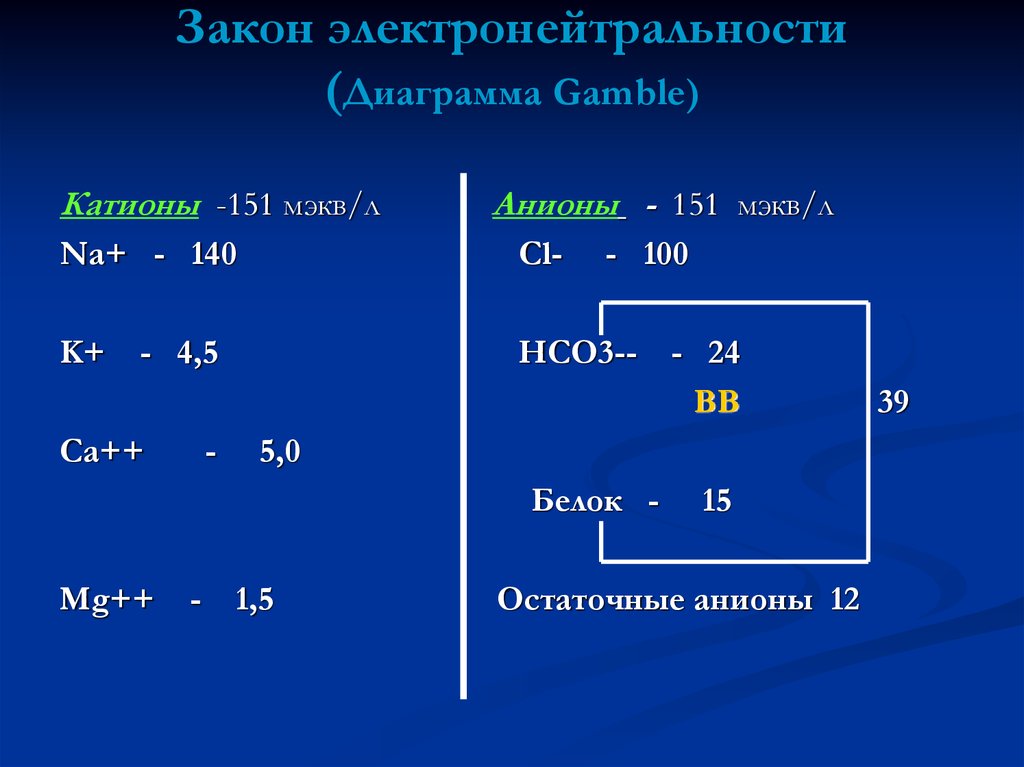
22. Закон электронейтральности (Диаграмма Gamble)
Катионы -151 мэкв/лАнионы - 151 мэкв/л
Na+ - 140
Cl-
K+
HCO3--
- 4,5
Ca++
-
- 100
5,0
Белок Mg++
-
- 24
ВВ
1,5
15
Остаточные анионы 12
39
23. Нарушения КОР
НарушенияНарушения КОР
КОР
Метаболические
Метаболические
Ацидоз
Респираторные
Алкалоз
24. Метаболический ацидоз
этосостояние
означает
накопление
метаболических
кислот,
которые
не
выводятся почками в свободном виде или
при потере оснований из организма. Его
характерными признаками являются низкое
рН с отрицательной с отрицательной
величиной ВЕ, при нормальном уровне
рСО2 и, практически одинаковой, низкой
концентрации актуального и стандартного
бикарбоната
25. Метаболический ацидоз
Метаболический ацидозМетаболический ацидоз, без увеличения
остаточных анионов, гиперхлоремический
Метаболический ацидоз, с увеличением
остаточных анионов
26. Причины развития метаболического ацидоза, без увеличения остаточных анионов
Введение растворов, содержащих ионы хлораВведение ингибиторов карбоангидразы
Ацидоз вследствие разведения
Диарея или желудочно – кишечные фистулы
Проксимальный или дистальный канальцевый
ацидоз
Трансплантация мочеточника в кишечный тракт
(сигмовидную кишку)
27. примеры:
рН = 7,2РСО2 = 40 мм.рт.ст.
АВ = 15 ммоль/л
SB = 15,0 ммоль/л
BE = (-13,5 ммоль/л)
Встречается у больных в критическом состоянии и в условиях
оперативного вмешательства
рН = 7,3
РСО2 = 20 мм.рт.ст.
АВ = 11,5 ммоль/л
SB = 13,5ммоль/л
BE = (-11,5 ммоль/л)
Встречается у больных с хронической почечной
недостаточностью
28. Метаболический ацидоз, с увеличением остаточных анионов
1. Шок любой этиологии, определяющийувеличение лактата
пример: пациент с геморрагическим шоком
рН = 7,27
РСО2 = 26,4 мм.рт.ст.
АВ = 12 ммоль/л
SB = 15,0 ммоль/л
BE = (-13,5 ммоль/л)
Na = 135 ммоль/л
K = 5,5 ммоль/л
Акт НСО3 = 12,0 ммоль/л
Cl = 87 ммоль/л
R = (135 + 5,5) – (12+87) = 41,5 ммоль/л
В данном случае причиной увеличения остаточных анионов,
способствующих развитию метаболического ацидоза явилось
накопление продуктов обмена, а именно молочной кислоты.
29. 2. Диабетический или недиабетический кетоз
рН = 7,20РСО2 = 12,5 мм.рт.ст.
АВ = 5,0 ммоль/л
SB = 8,6 ммоль/л
BE = (-22,5 ммоль/л)
Na = 134 ммоль/л
K = 4,7 ммоль/л
Акт НСО3 = 5,0 ммоль/л
Cl = 100,0 ммоль/л
R = (134 + 4,7) – (5+100) = 33,7 ммоль/л
Причиной увеличения остаточных анионов, способствующих
развитию метаболического ацидоза, явилось накопление
кетокислот.
30. 3. Острая или хроническая почечная недостаточность
рН = 7,28РСО2 = 28 мм.рт.ст.
АВ = 14,0 ммоль/л
SB = 17,0 ммоль/л
BE = (-10,0 ммоль/л)
Na = 132 ммоль/л
K = 6,0 ммоль/л
Акт НСО3 = 14,0 ммоль/л
Cl = 91 ммоль/л
R = (132 + 6) – (14+91) = 33,0 ммоль/л
увеличения остаточных анионов, определялось накоплением
сульфатов, фосфатов и других метаболических кислот.
31. 4. Интоксикация салицилатами
рН = 7,4РСО2 = 22.0 мм.рт.ст.
АВ = 14.0 ммоль/л
SB = 16.0 ммоль/л
BE = (-10.5 ммоль/л)
Na = 14 ммоль/л
K = 4,0 ммоль/л
Акт НСО3 = 14,0 ммоль/л
Cl = 106 ммоль/л
R = (140 + 4) – (14+106) = 24,0 ммоль/л
Причиной увеличения остаточных анионов,
способствующих развитию метаболического ацидоза,
явился высокий уровень метаболических кислот
32. Клинические осложнения, обусловленные метаболическим ацидозом
Снижение сердечного выбросаНарушение ритма, вплоть до остановки сердца
Олигурия
Увеличение циркуляции эндогенных
катехоламинов
Психоз
33. Терапия метаболического ацидоза
Введение бикарбоната натрия различнойконцентрации.
1 г. NaНСО3 содержит 12 ммоль НСО3. Необходимое количество ионов НСО3
можно рассчитать по формуле:
Моль НСО3 = вес больного * 0,2 * (BEизм. – BE норм.)
34. Терапия метаболического ацидоза
лактат натрияможно вводить при условии адекватного кислородного
баланса и нормальной функции печени, поскольку лактат
метаболизируется в печени и для нормального метаболизма
необходим кислород
ацетат натрия
можно вводить в отсутствии нарушении периферической
циркуляции, поскольку ацетат метаболизируется в
периферических тканях
35. Осложнения, развивающиеся при введении гипертонических растворов бикарбоната натрия
Увеличение осмоляльности концентрации натрияУвеличение артериального рСО2
Снижение концентрации кальция
На фоне гипокалиемии резкое снижение калия
Ухудшение кислородного снабжения тканей
36. Для предотвращения указанных усложнений необходимо помнить:
Введение гипертонических растворов NaHCO3,проводить только при рН < 7,20 ед
Скорость введения не должна превышать 100 мл/час
Контроль за показателями кислородного баланса,
КОР
крови,
осмоляльности
электролитного
баланса
и
37. Метаболический алкалоз
это состояние, при котором отмечается накоплениеоснований или избыточная потеря кислот из
организма.
Признаки:
-высокое рН с положительной величиной ВЕ
-нормальный уровень рСО2
-одинаково высокие концентрации актуального
и стандартного бикарбоната
38. Основные причины развития метаболическою алкалоза:
Потеря ионов водорода и хлора вследствие рвоты, отсасыванияжелудочного содержимого, диуретической терапии
Потеря ионов калия в результате рвоты, диарреи,
гиперальдостеронизма. терапии диуретиками, цироза печени и
т.д
Увеличение концентрации ионов бикарбоната, обусловленное
избыточным введением щелочных растворов, метаболизации
лактата, ацетата или
цитрата, введенного с донорской кровью
Увеличение концентрации ионов бикарбоната вследствие
гиперкомпенсации респираторного ацидоза
Увеличение концентрации ионов бикарбоната в результате
острого снижения экстрацеллюлярной жидкости
39.
Пример I. Острый метаболический алкалозрН = 7.70
рСО2 = 40 мм. рт. ст.
АВ = 38,0 ммоль/л
SB = З8,0 ммоль/л
BE = + 15.0 ммоль/л
Данное нарушение можно наблюдать, главным образом:
-при переливании больших количеств щелочных растворов
-при оперативных вмешательствах, сопровождающихся
большой кровопотерей с последующей ее коррекцией
40.
Пример 2. Частично компенсированный метаболический алкалозрН
= 7.52
рСО2 = 47 мм. рт. ст.
АВ = 37,0 ммоль/л
SB = 34,5 ммоль/л
BE
= + 12,5 ммоль/л
Данный пример свидетельствует о том, что в действие вступили
не только буферные системы, но и легочный
механизм
компенсации, направленный на задержку СО2 в организме.
Такое состояние можно
характеризоватькак хронический
метаболический алкалоз, оно достаточно часто встречается
при заболеваниях желудочно-кишечного тракта и после крупных
хирургических вмешательств.
41.
Пример 3. Полностью компенсированный метаболический алкалозрН = 7.40
рСО2 = 52 мм рт.ст.
АВ = 39,0 ммоль/л
SB
= 34,5 ммоль/л
BE = + 12,5 ммоль/л
Данное нарушение КОР крови свидетельствует о полноценной легочной и
почечной компенсации метаболического алкалоза, так как рН равно 7.40,
Обычно причиной такого метаболического алкалоза служат хронические
заболевания желудочно - кишечного тракта, он также может быть
следствием переливания большого количества донорской крови
или растворов лактата, ацетатa или цитрата (с донорской кровью),
при метаболизации которых образуются ионы бикарбоната.
42. Основные причины развития метаболическою алкалоза:
Потеря ионов водорода и хлора вследствие рвоты, аспирациижелудочного содержимого, диуретической терапии
Потеря ионов калия в результате рвоты, диарреи,
гиперальдостеронизма. терапии диуретиками, цироза печени
Увеличение концентрации ионов бикарбоната,
обусловленное избыточным введением щелочных растворов,
метаболизма лактата, ацетата или цитрата, введенных при
инфузионной терапии
Увеличение концентрации ионов бикарбоната вследствие
гиперкомпенсации респираторного ацидоза
Увеличение концентрации ионов бикарбоната в результате
острого снижения экстрацеллюлярной жидкости
43.
Пример: пациент с непрекращающейся рвотойрН
рСО2
АВ
BE
акт.НСО3
SB
Na+
К+
С1R
=
=
=
=
=
=
=
=
=
=
7.58
44 мм. рт.ст.
38.0 ммоль/л
+ 15.2 ммоль/л
38.0 ммоль/л
37.0 ммоль/л
137 ммоль/л
3.5 ммоль/л
89 ммоль/л
(137+3.5) - (38+89) = 13.5 ммоль/л
44. Клинические осложнения, обусловленные метаболическим алкалозом:
Тетания, симптомы Труссо и Хвостека при рН более 7.55Гипокапническая вазоконстрикция
Ухудшение кислородного снабжения тканей вследствие
сдвига кривой диссоциации оксигемоглобина влево
(упрочение связи гемоглобина с кислородом)
Психозы
Гипокалиемия
Гипокалиемия
45. Терапия метаболического алкалоза:
Восстановить объем экстрацеллюлярной жидкости (плазма,кровь, растворы хлоридов, если нет противопоказаний к
введению натрия целесообразно введение изотоническою
раствора хлористого натрия)
Восстановить нормальный объем общего калия и его
концентрации в плазме (растворы хлористого калия,
калийсохраняющие диуретики)
Использовать ингибиторы альдостерона (альдактон,
верошпирон)
Снизить активность фермента карбоангидразы
(апетазоланид)
При необходимости быстрого снижения рН крови вводятся
10% раствор соляной кислоты (HCI) или 0.9% раствор
хлористого аммония (NH4Cl).
46. Необходимо помнить:
при метаболическом алкалозе рСО2 артериальнойкрови компенсаторно увеличено и для его
нормализации требуемся определенное время,
поэтому искусственно снижать его не рекомендуется
если пациенту проводится искусственная вентиляция
легких, то в условиях метаболического алкалоза
целесообразно поддерживать режим умеренной
гиповентиляции
pacтворы хлористого аммония можно вводить при
условии нормальной функции печени.
47. Респираторные нарушения КОР
Респираторные нарушенияРеспираторный ацидоз
Респираторный алкалоз
48. Респираторный ацидоз
- это состояние характеризуется низким pН,высоким рСО2,
нормальными значениями
стандартного бикарбоната и BE, тогда как
величина истинного бикарбоната увеличена
49. Основные причины респираторного ацидоза:
Хронические заболевания легких (фиброз, эмфизема, астма)Депрессия дыхательного центра (например, передозировка
наркотиков);
Ослабление нервно- мышечной функции (например, при
введении блокирующих препаратов)
Неадекватная работа аппарата ИВЛ, способствующая
увеличению концентрации СО2, во вдыхаемой газовой смеси
Увеличенная продукция СО2 (при лихорадке, метаболизации
растворов, используемых в качестве энергетических субстратов
при парентеральном питании)
Травматическое повреждение грудной клетки
Тромбоэмболия легочной артерии
Oтек легких, диффузионные нарушении проницаемости
легочных капилляров
50.
Пример I.Острый (некомпенсированный) респираторный ацидоз
рН
= - 7.25
рСО2 = 82 мм. рт.ст.
АВ
= 34.0 ммоль/л
SB
= 26.5 ммоль/л
BE
= + 2.5 ммоль/л
Na+ = 145 ммоль/л
К = 6.0 ммоль/л
С1 = 105 ммоль/л
акт. НСО3 = 34 ммоль/л
R = (145 + 6) - (34 + 105) = 12 ммоль/л
Указанное нарушение наиболее часто можно наблюдать при острой
дыхательной недостаточности или в условиях работы аппарата
искусственной вентиляции легких (ИВЛ). Острый респираторный
ацидоз всегда сопровождается увеличением концентрации калия,
однако остаточные анионы при этом о стаются в пределах нормы.
51.
Пример 2.Частично компенсированный респираторный ацидоз
рН
= 7.32
Рсо2
= 81 мм. рт. ст.
АВ
= 34.0 ммоль/л
SB
= 29.0 ммоль/л
BE
= + 6.0 ммоль/л
Na+
= 140 ммоль/л
K+
= 4.7 ммоль/л
акт.НСО2 = 34.0 ммоль/л
СL= 90 ммоль/л
R
= (140+ 4.7) - (34 + 90) = 20.7 ммоль/л
Данный пример свидетельствует о включении буферных систем в
компенсацию нарушения КОР крови. При этом концентрация
калия нормализуется, однако, за счет снижения ионов хлора,
остаточные анионы умеренно увеличиваются.
52.
Пример 3.Полностью компенсированный респираторный ацидоз
рН = 7.41
рСО2 = 68 мм pi.ci.
АВ = 39.5 ммоль/л
SB = 31.0 ммоль/л
BE = +8.0 ммоль/л
Na+ = 143 ммоль/л
К = 5.2 ммоль/л
акт. НСО3 = 39.5 ммоль/л
Сl- = 85 ммоль/л
R = (143 + 5.5) - (39.5 + 85) = 24 ммоль/л
Полностью
компенсированный
респираторный
ацидоз встречается у пациентов с хроническими заболеваниями
легких. Он свидетельствует о полнойбуферной (снижение
ионов хлора) почечной (усиление реабсорбции ионов
бикарбоната) компенсацииэтого нарушения
53. Клинические осложнения, обусловленные острым респираторным ацидозом:
синдром углекислого наркоза (Carbon-DioxideNarcosis)
угнетение ЦНС ( вплоть до глубокой комы)
нарушения ритма сердца (тахикардия, фибрилляция
желудочков)
нестабильный уровень артериального давления
гиперкалиемия
54. Терапия острого респираторного ацидоза
Постоянная санация дыхательных путей.Введение дополнительного количества жидкости, что, наряду с
улучшением гемодинамики, способствует также снижению
вязкости бронхиального секрета и лучшему его удалению
Введение щелочных растворов: NaHCO3 (при рН < 7,20)
Кондиционирование газовой смеси
Введение препаратов, предупреждающих развитие
бронхоспазма
Своевременный перевод на ИВЛ
55. Респираторный алкалоз
-это
состояние,
которое
характеризуется
увеличением рН, снижением рСО2 при нормальной
величине стандартного бикарбоната и ВЕ крови,
тогда как актуальный бикарбонат снижен
56. Основные причины развития респираторного алкалоза:
Избыточная гипервентиляция при проведении ИВЛИстерическая гипервентиляция (страх, боль, стресс )
Повреждение центральной нервной системы
(черепно-мозговая травма, энцефалит)
Тканевая гипоксия (анемия, шок. сепсис, острая
сердечная недостаточность)
Повреждение интерстиция легких
Отек легких
Печеночная недостаточность
Интоксикация салицилатами
Гиперкомпенсация метаболического ацидоза
57. Пример I. Острый (некомпенсированный) респираторный алкалоз
рН= 7.55
Рсо2
= 20 мм. рт. ст.
АВ
= 16.5 ммоль/л
SB
= 24.0 ммоль/л
BE
= 0.0 ммоль/л
Na+
= 135 ммоль/л
K+
= 4.5 ммоль/л
акт.НСО3 = 16.5 ммоль/л
СL= 109 ммоль/л
R
= (135+ 4.5) - (16.5 + 109) = 12 ммоль/л
Данное состояние возникает при острой дыхательной недостаточности,
при переливании больших количеств щелочных растворов, при
избыточной гипервентиляции на аппарате ИВЛ. Стандартный
бикарбонат выше нормы.
58. Пример 2. Частично компенсированный респираторный алкалоз
рН= 7.49
Рсо2
= 21 мм. рт. ст.
АВ
= 18.0 ммоль/л
SB
= 22.0 ммоль/л
BE
= (-3.5 ммоль/л)
Na+
= 136 ммоль/л
K+
= 4.0 ммоль/л
акт.НСО3 = 18.0 ммоль/л
СL= 104 ммоль/л
R
= (136 + 4) - (18 + 104) = 18 ммоль/л
Данный пример свидетельствует о включении в действие буферных
компенсаторных механизмов крови, о чем свидетельствует умеренное
снижение стандартного бикарбоната и ВЕ крови, вместе с тем,
актуальный бикарбонат по- прежнему ниже стандартного
59. Пример 3. Полностью компенсированный респираторный алкалоз
рН= 7.42
Рсо2
= 26 мм. рт. ст.
АВ
= 16.5 ммоль/л
SB
= 20.0 ммоль/л
BE
= (-5,5 ммоль/л)
Na+
= 140 ммоль/л
K+
= 4.5 ммоль/л
акт.НСО3 = 16.5 ммоль/л
СL= 100 ммоль/л
R
= (140+ 4.5) - (16.5 + 100) = 28 ммоль/л
Такое состояние называют хроническим респираторным алкалозом. Оно
свидетельствует о вступлении в действие не только буферных, но и почечных
механизмов компенсации, в этом случае почки снижают скорость реабсорбции
ионов бикарбоната, так, что увеличивается их выделение с мочой.
60. Клинические осложнения, обусловленные респираторным алкалозом:
ухудшение кровоснабжение тканей вследствиесдвига кривой диссоциации оксигемоглобина
влево и усиления связи гемоглобина с кислородом
предсердная и желудочковая тахикардия
тетания
психические расстройства при рН крови выше
7.54
нарушения электролитного баланса
61. Терапия респираторною алкалоза
Изменение режима работы аппарата ИВЛИспользование седативных препаратов
Использование вдыхаемой смеси с повышенным
содержанием СО2
Выведение избыточной жидкости
Введение препаратов, коррегирующих тканевую
гипоксию
Использование препаратов, улучшающих
функциональные свойства
печени
Строгое ограничение щелочных растворов,
вводимых для коррекции метаболических
нарушений





















































 Медицина
Медицина








