Похожие презентации:
Органические вещества клетки. Белки. Строение белков
1.
КОСАТКА (Orcinus orca)2. Млекопитающие / Китообразные / Дельфиновые / КОСАТКА
Млекопитающие / Китообразные / Дельфиновые /КОСАТКА
Mammalia / Cetacea / Delphinidae /
Orcinus orca
У кита косатки открывают пасть, впиваются зубами
в его горло, кромсают массивный язык, кусают
плавники, топят жертву, не позволяя ей
выныривать на поверхность для дыхания. Если
они рвут добычу, то делают это, резко гребя
назад грудными плавниками.
3. Птицы/ Пингвины / Пингвиновые ПИНГВИН ВЕЛИКОЛЕПНЫЙ
Птицы/ Пингвины / ПингвиновыеПИНГВИН ВЕЛИКОЛЕПНЫЙ
Рост великолепного пингвина
достигает 55 см, вес в период
размножения и зимой 5-6 кг, во
время линьки до 8,5 кг. Один из
наиболее редких пингвинов в
мире. Мировая популяция
насчитывает 1200-1600 пар, из
которых только 500 гнездится по
восточному побережью южного
острова Новой
Зеландии. Предпочитают
гнездиться в лесу, кустарнике и,
как не странно, вне пределов
видимости других пингвинов,
забираясь от побережья вглубь
суши до 1 км. Гнезда, состоящие из
веточек, листьев, травы и т.п.,
располагаются на поверхности
почвы. В норах не гнездятся.
4. Птицы / Пингвины / Пингвиновые / ПИНГВИН ЗОЛОТОВОЛОСЫЙ
Птицы / Пингвины / Пингвиновые /ПИНГВИН ЗОЛОТОВОЛОСЫЙ
Распространены
золотоволосые пингвины
по всей южной части
Атлантического и
Индийского океанов.
Гнездятся золотоволосые
пингвины на земле,
устраивая очень
примитивные гнезда.
Откладывается 2 яйца/
5. Птицы / Пингвины / Пингвиновые ПИНГВИН ГАЛАПАГОССКИЙ
Птицы / Пингвины / ПингвиновыеПИНГВИН ГАЛАПАГОССКИЙ
Это единственный пингвин,
гнездящийся на экваторе. У
этого вида самый маленький
ареал и наименьшая
численность среди пингвинов.
Мировая популяция
насчитывает менее 1000 пар/
Его длина меньше 50 см, в
вес – менее 2,5 кг.
6. Как называется эта наука?
7.
Тема урока:Органические вещества клетки. Белки.
Строение белков.
«Жизнь есть способ существования
белковых тел, существенным моментом
которого является постоянный обмен
веществ с окружающей их внешней
природой, причем с прекращением этого
обмена веществ прекращается и жизнь, что
приводит к разложению белка» Ф.Энгельс
8.
Впервые термин белковый(albumineise) применительно ко всем
жидкостям животного организма
использовал, по аналогии с яичным
белком, французский физиолог
Франсуа Кене в 1747 г., и именно в
таком толковании термин вошел в
1751 г. в «Энциклопедию» Дидро и
Ж. Д'Аламбера.
9.
Джон Дальтон- английскийхимик
(6.09. 1766 — 27.07 1844
В 1803 г. дает
первые формулы
белков - альбумина и
желатина - как
веществ,
содержащих азот
Жозеф Луи
Гей-Люссак –
французский химик
(6.12.1778-9.05.1850
Проводит химические
анализы белков фибрина крови, казеина и
отмечает сходство их
элементного состава
Браконно Анри –
французский химик
(29.05. 1780–
13.01.1855)
Впервые выделил
(1820) из
гидролизата белка
аминокислоты
глицин и лейцин.
Геррит Ян Мульдер
Голландский химик —
органик, который описал
химический состав
белков
Удостоен в 1910 году
Нобелевской премии по
физиологии и медицине
за создание одной из
первых теорий строения
белков.
10. История открытия белков
Данилевский АлександрЯковлевич – русский
биохимик
1838–1923
Автор теории
полипептидного
строения белков
ЛЮБАВИН Николай
Николаевич –
русский химик
Разработал способ синтеза
аминокислот
Лайнус Карл Полинг –
американский химик
Первый
учёный,
который смог
успешно
предсказать
вторичную
структуру
белков
Фредерик Сенгеранглийский биохимик
Дважды лауреат
Нобелевской премии по
химии:
1958- «за работы по
определению структур
белков, особенно инсулина»,
1980- «за вклад в
установлении основных
последовательностей в
нуклеиновых кислотах»
11.
Белки, или протеины ( от греческого protos-первый).Белки - обязательная составная часть всех клеток.
В состав этих биополимеров входят мономеры 20- ти типов
(аминокислоты). Молекулы различных белков могут
отличаться друг от друга по числу аминокислотных
звеньев, составу аминокислот и порядку их следования
друг за другом.
12. Состав белка
13.
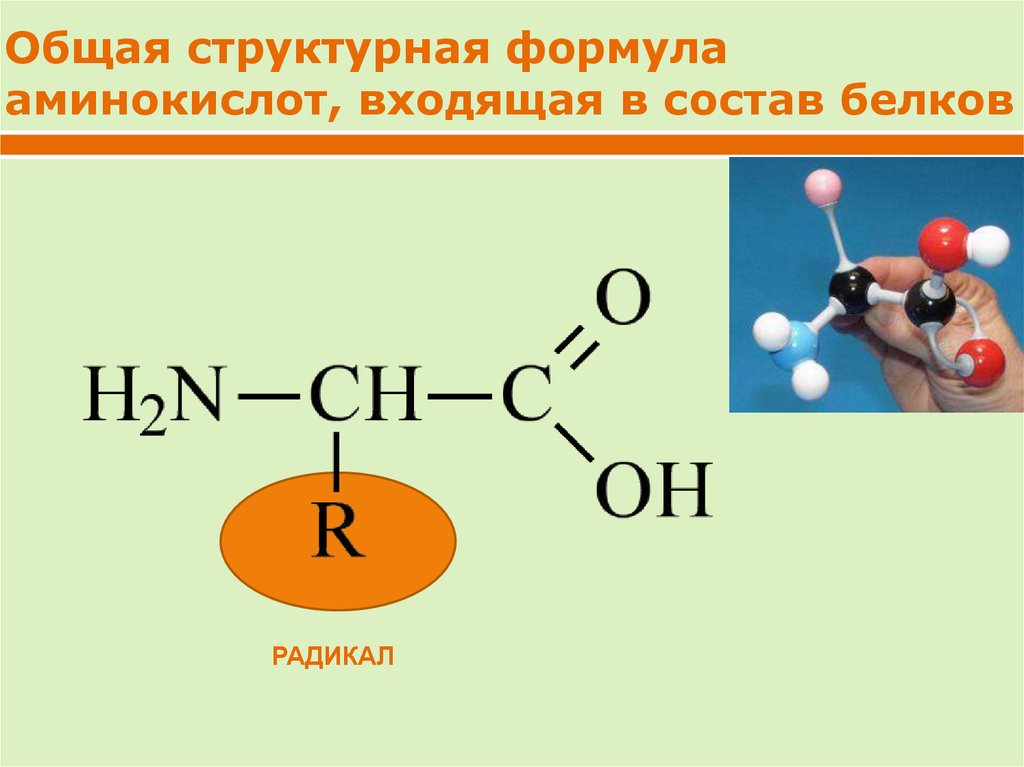
Общая структурная формулааминокислот, входящая в состав белков
РАДИКАЛ
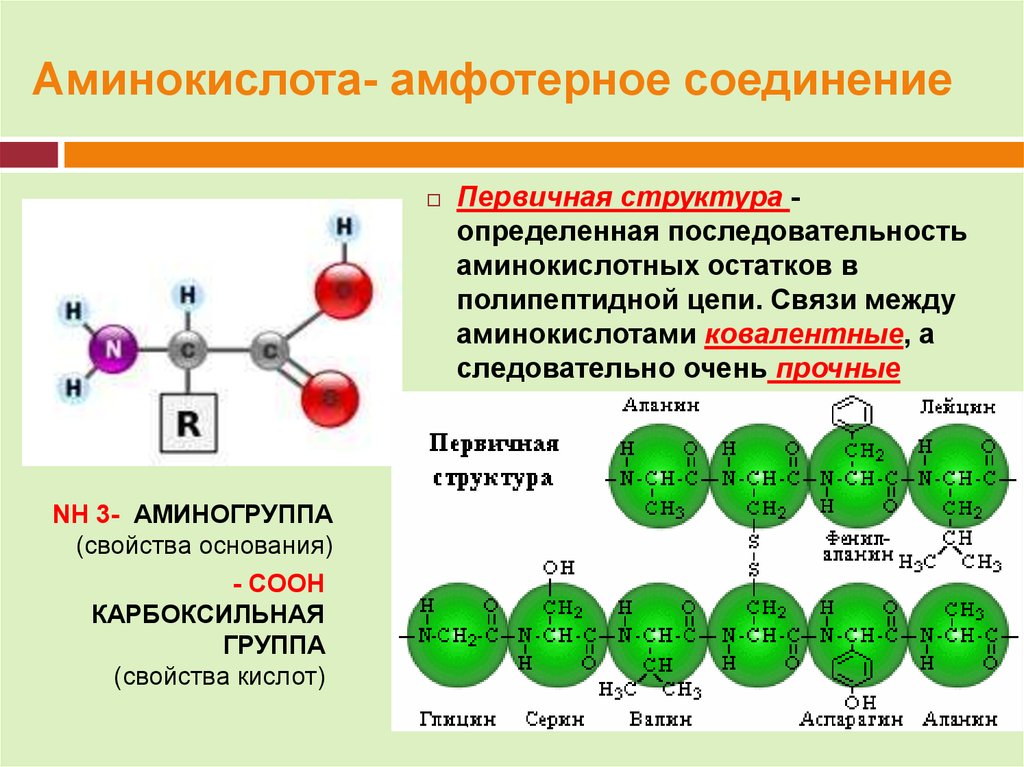
14. Аминокислота- амфотерное соединение
NH 3- АМИНОГРУППА(свойства основания)
- COOH
КАРБОКСИЛЬНАЯ
ГРУППА
(свойства кислот)
Первичная структура определенная последовательность
аминокислотных остатков в
полипептидной цепи. Связи между
аминокислотами ковалентные, а
следовательно очень прочные
15.
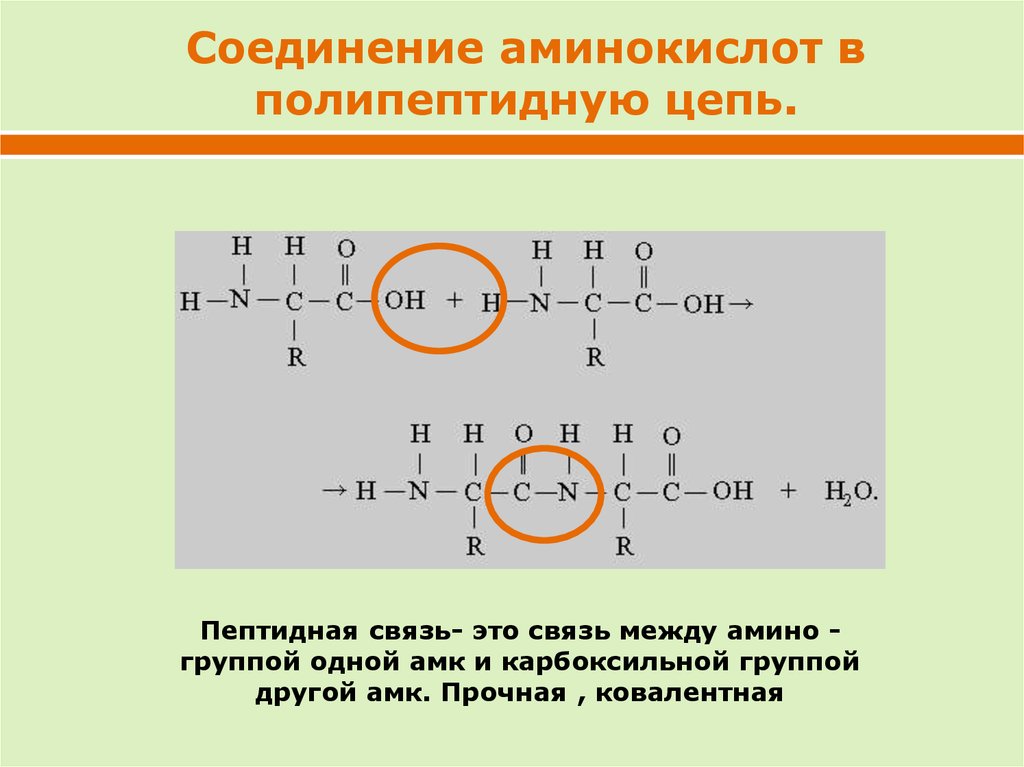
Соединение аминокислот вполипептидную цепь.
Пептидная связь- это связь между амино группой одной амк и карбоксильной группой
другой амк. Прочная , ковалентная
16.
Строение аминокислот17.
Незаменимые аминокислотыЛейцин. При недостатке этой аминокислоты может развиться анемия,
проблемы с печенью и другие заболевания. Лейцин содержится в сое
(2,8 г в 100 г продукта), твердом сыре (2,2 г), морепродуктах (1,4-1,8),
бобовых (1,6-1,9), орехах (1,1-1,7), мясе (1,2–1,8), рыбе (1,4-1,6), крупах
(0,6-1,5) и яйцах (1-1,1).
Изолейцин участвует в энергетических процессах организма и
необходима для синтеза гемоглобина, помогает справиться с
усталостью и стрессом. Содержится в сое (1,8 г на 100 г продукта),
твердом сыре (1,5), бобовых (1-1,1), мясе (0,8-1,1), рыбе (0,8-0,9), орехах
(0,5-0,7).
Валин оказывает стимулирующее действие на весь организм, эта
незаменимая кислота необходима для укрепления и поддержания
тонуса мускулатуры. Содержится в сое (2,1), бобовых (1,2-1,3), мясе
(0,8-1,1), орехах (0,7-1,2), яйцах (0,9), рыбе и морепроуктах (0,8-1),
крупах (0,5-0,7).
Лизин способствует росту костей и выработке коллагена, укрепляет
иммунитет и помогает организму бороться с вирусами, в том числе с
герпесом. Содержится в сое (2,1 г на 100 г продукта), твердом сыре
(1,95), мясе (1,4-1,9), рыбе (1,5-1,9), бобовых (1,5-1,7), твороге (1),
мягком сыре (0,9) и яйцах (0,9).
18.
Метионин обладает сильной дезинтоксикационной способностью (способенобезвреживать некоторые яды), препятствует отложению избыточного
количества жира (в том числе в печени), повышает уровень антиоксидантов
в крови. Содержится в сыре (0,5-0,6 г на 100 г продукта), мясе (0,4-0,6), рыбе
и морепродуктах (0,5-0,6), сое (0,5), яйцах (0,4) и бобовых (0,3-0,4).
Треонин выводит токсины, участвует в синтезе коллагена и эластина,
укрепляет иммунитет. Содержится в сое (1,4 г в 100 г продукта), рыбе (0,91,1), бобовых (0,8-1), твороге и сыре (0,8-1), мясе (0,7-0,9), морепродуктах
(0,8), яйцах (0,6) и орехах (0,6).
Триптофан усиливает выработку в головном мозге серотонина,
отвечающего за настроение, сон и восприятие боли и гормона мелатонина
(регулятора суточных ритмов). Эта незаменимая аминокислота содержится в
сыре моцарелла (0,5 г на 100 г продукта), сое (0,5), твердом сыре (0,3),
бобовых (0,3), рыбе, мясе и яйцах (по 0,2 г).
Фенилаланин способствует работе мозга, усиливает выработку
эндорфинов, улучшает память и умственные способности, входит в состав
коллагена. Содержится в сое (1,6), бобовых (1,3-1,5), орехах (1-1,3), рыбе
(0,8-1), сыре (1-1,2), мясе (0,7-1), яйцах (0,7).
Существуют также условно-незаменимые аминокислоты: аргинин,
гистидин, цистин, тирозин. В организме здорового взрослого человека они
синтезируются в достаточном количестве, а вот в организм детей,
подростков и пожилых людей должны дополнительно поступать с пищей.
19. Аминокислоты. У различных озмов встречается около 200 амк, в построении белков участвуют только 20 амк
ЗаменимыеЗаменимые аминокислоты
могут синтезироваться в
организме.
Потребность организма
осуществляется за счет
поступления белков пищи.
К заменимым аминокислотам
относятся аланин, аспарагин,
аспарагиновая кислота,
глицин, глютамин,
глютаминовая
кислота,тирозин, цистеин,
цистин и др.
Незаменимые
Незаменимыми для взрослого
здорового человека являются 8
аминокислот: валин, изолейцин,
лейцин, лизин, метионин, треони́ н,
триптофан и фенилалани́ н.
Для детей незаменимыми также
являются аргинин и гистидин.
Не могут быть синтезированы в
организме, поступают только с
пищей.
Растения все амк синтезируют сами
Чем больше содержится
незаменимых аминокислот, тем
полезнее данный белок для
организма.
20.
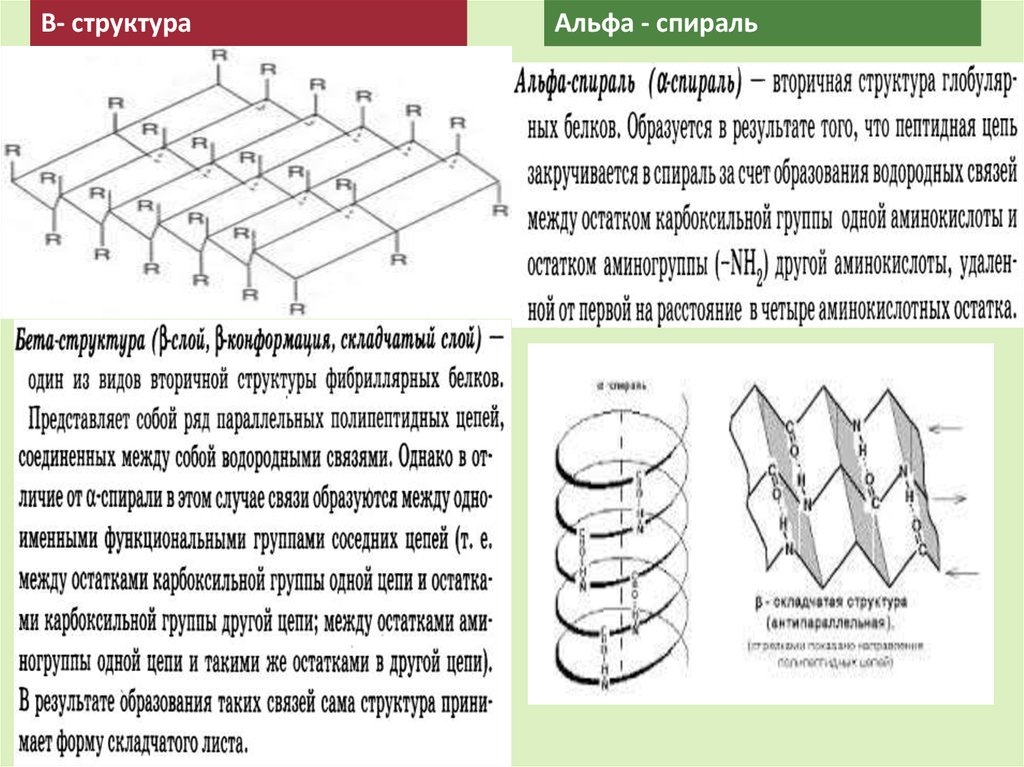
В- структураАльфа - спираль
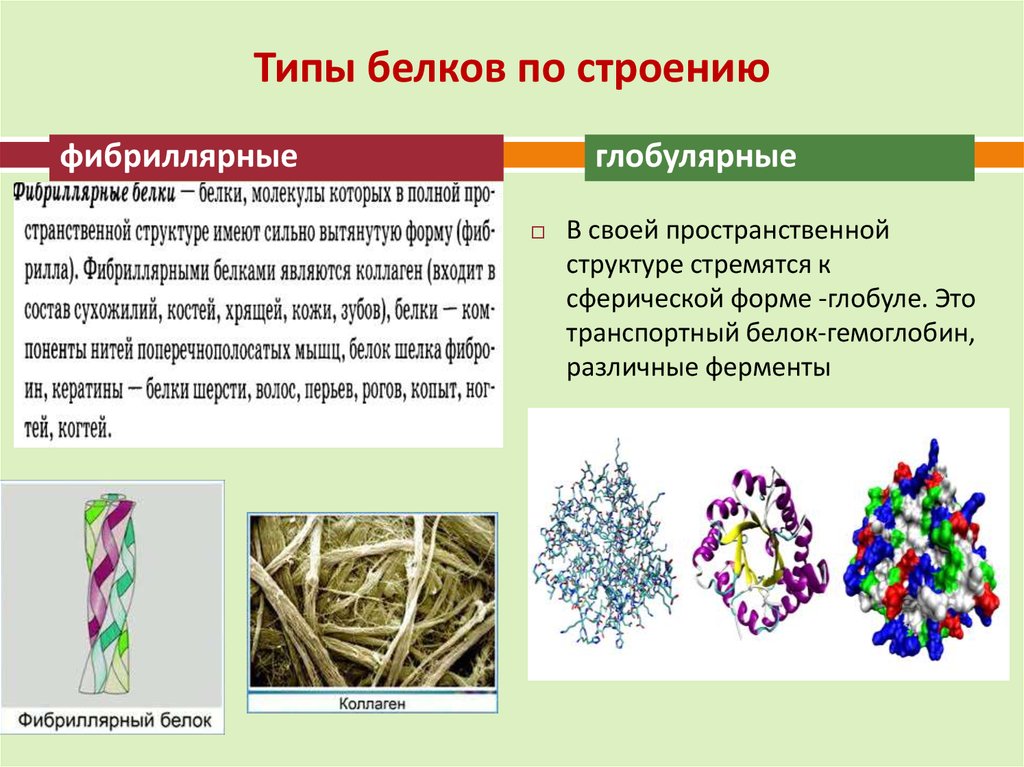
21. Типы белков по строению
фибриллярныеглобулярные
В своей пространственной
структуре стремятся к
сферической форме -глобуле. Это
транспортный белок-гемоглобин,
различные ферменты
22.
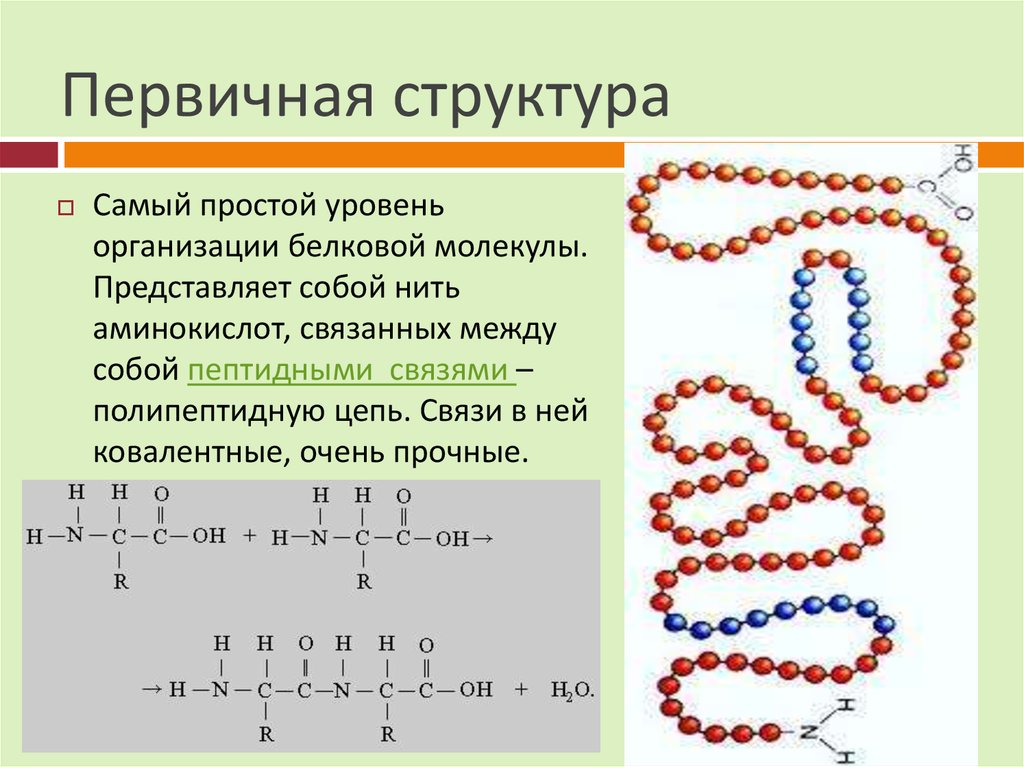
Схема строения белковой молекулы.23. Первичная структура
Самый простой уровеньорганизации белковой молекулы.
Представляет собой нить
аминокислот, связанных между
собой пептидными связями –
полипептидную цепь. Связи в ней
ковалентные, очень прочные.
24.
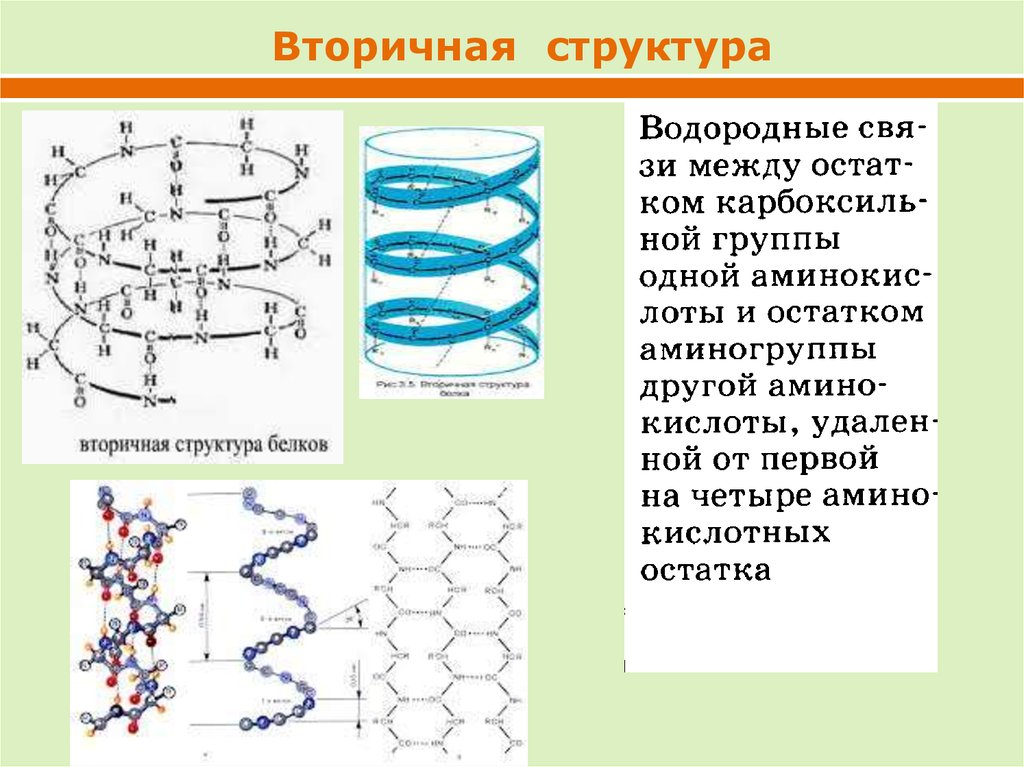
Вторичная структура25.
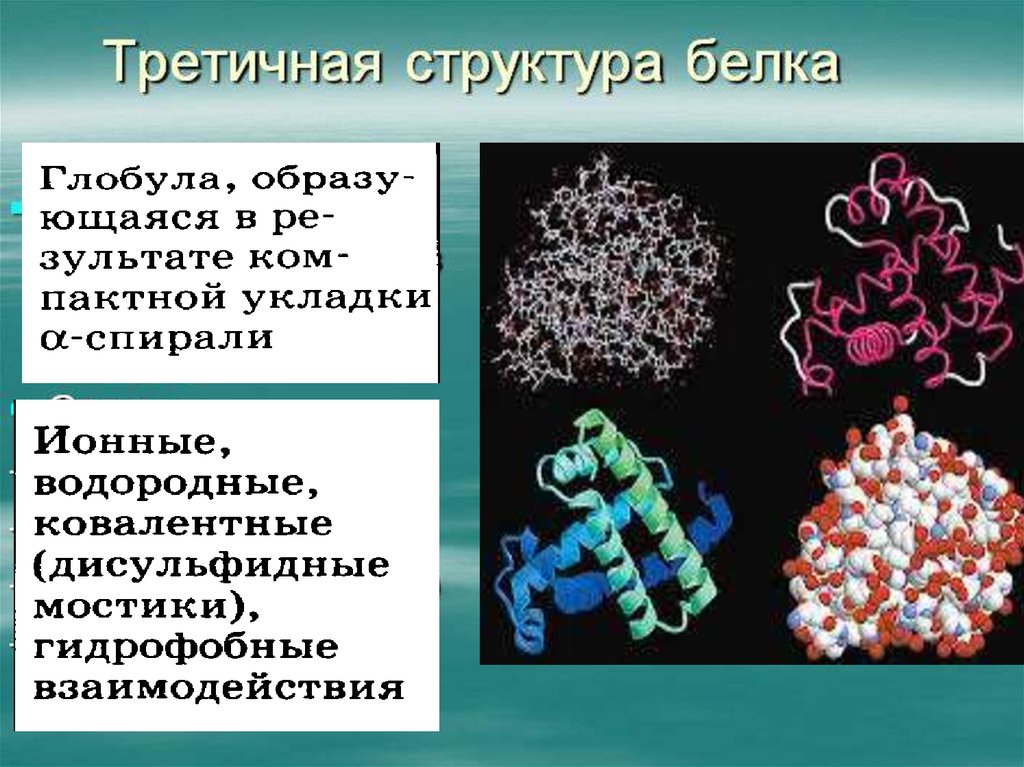
Третичная структура26.
27.
Четвертичная структура28.
1. Какие органические вещества в клетке на первом месте по массе?А) углеводы; б) белки; в) липиды; г) нуклеиновые кислоты.
2. Сколько аминокислот образует все многообразие белков?
А) 170; б) 26;
в) 20;
г) 10.
3. Первичная структура определяется аминокислотными остатками:
а) числом; б) последовательностью; в) числом и последовательностью; г)
видами.
4. Вторичную структуру белка поддерживают в основном связи:
а) пептидные; б) водородные; в) дисульфидные; г) гидрофобные.
5. Третичная структура белка определяется:
а) спирализацией полипептидной цепи;
б) пространственной конфигурацией спирализованной полипептидной цепи;
в) соединением нескольких полипептидных цепей;
г) спирализацией нескольких полипептидных цепей.
6. В поддержании четвертичной структуры белка не принимают участие связи:
а) пептидные; б) водородные; в) ионные; г) гидрофобные.
7. Физико– химические и биологические свойства белка определяет структура:
а) первичная; б) вторичная; в) третичная; г) четвертичная.
29.
1. Сколько аминокислот являются незаменимыми для человека?А) таких аминокислот нет; б) 20; в) 10; г) 7.
2. Между какими группировками аминокислот образуется пептидная связь?
А) между карбоксильными группами соседних аминокислот;
Б) между аминогруппами соседних аминокислот;
В) между аминогруппой одной аминокислоты и карбоксильной группой другой.
Г) между аминогруппой одной аминокислоты и радикалом другой.
3. Какую структуру имеет молекула гемоглобина?
А) первичную; б) вторичную;
в) третичную;
г) четвертичную.
4. Первичную структуру белка поддерживают связи:
а) пептидные; б) водородные;
в) дисульфидные; г) гидрофобные.
5. Вторичная структура белка определяется:
а) спирализацией полипептидной цепи;
б) пространственной конфигурацией полипептидной цепи;
в) числом и последовательностью аминокислот спирализованной цепи;
г). пространственной конфигурацией спирализованной цепи.
6. Третичную структуру белка поддерживают в основном связи:
а) ионные; б) водородные;
в) дисульфидные; г) гидрофобные.
7. Назовите белок, который первым был синтезирован искусственно:
а) инсулин;
б) гемоглобин;
в) каталаза;
г) интерферон.
30.
31.
32. Биуретовая реакция на белки
33. Ксантопротеиновая реакция
Если к раствору белка прилитьконцентрированную азотную кислоту и нагреть,
то образуется характерная желтая окраска
раствора.
34. Разрушение белка- денатурация. Действие серной кислоты на белок.
35. Денатурация белка сульфатом меди.
36. Проверьте свои знания!
1. Что такое белки?2. Какое строение имеют белки?
3. Что такое структуры белка?
4. С помощью каких связей соединены
структуры белка?
5. Как определить белок в растворе?
6. Что такое денатурация белка?
7. Какие виды денатурации существуют?




























 Биология
Биология








