Похожие презентации:
Теория электролитической диссоциации
1.
2. Вещества по отношению к электрическому току :
их растворыили расплавы
их растворы
или расплавы
ПРОВОДЯТ
НЕ ПРОВОДЯТ
электрический ток
электрический ток
Вид химической связи
Ионная или
ковалентная
сильно полярная
Ковалентная
неполярная
или мало полярная
3.
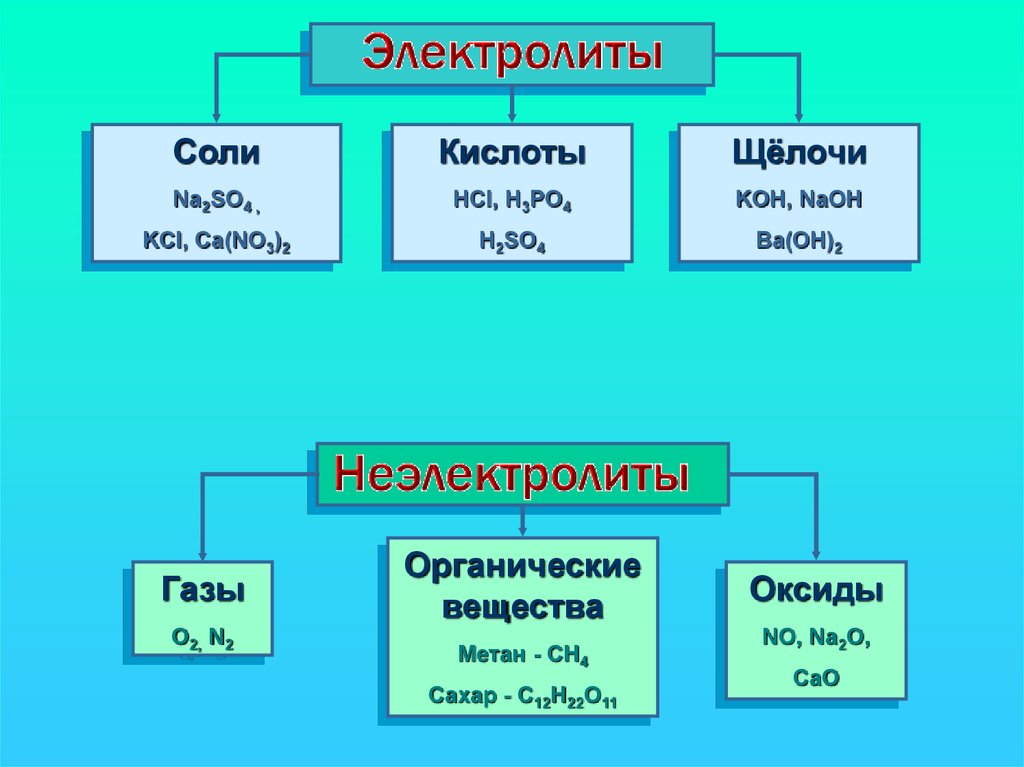
CолиКислоты
Щёлочи
Na2SO4 ,
HCl, H3PO4
KOH, NaOH
KCl, Ca(NO3)2
H2SO4
Ba(OH)2
Газы
O2, N2
Органические
вещества
Метан - CH4
Сахар - C12H22O11
Оксиды
NO, Na2O,
CaO
4.
5.
6.
7.
СТЕПЕНЬ ДИССОЦИАЦИИn
α
N
n
α% 100%
N
- степень электролитической диссоциации
n – число молекул, которые распались на
ионы в растворе
N – общее число молекул в растворе
8.
9.
10.
11.
12.
Все вещества по их способностипроводить электрический ток в
растворах или расплавах делятся
на электролиты и неэлектролиты
13.
В растворах электролиты диссоциируют( распадаются) на положительно заряженные
ионы (катионы ) и отрицательно заряженные
ионы (анионы)
NaOH Na OH
H 2SO 4 2H SO
2
2
4
MgCl 2 Mg 2Cl
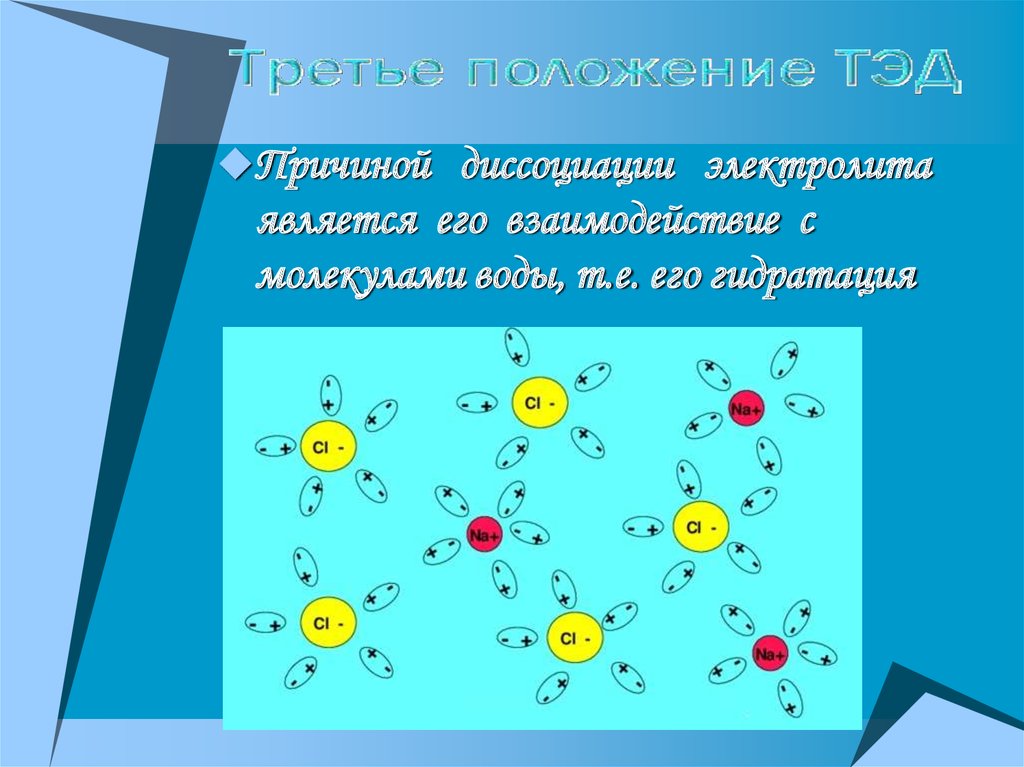
14.
Причиной диссоциации электролитаявляется его взаимодействие с
молекулами воды, т.е. его гидратация
15.
+-
NaCl+mH2O Na (H2O)x+ Cl (H2O)y
+
-
NaCl Na + Cl
+
-
HCl+mH2O H (H2O)x + Cl (H2O)y
+
-
HCl H + Cl
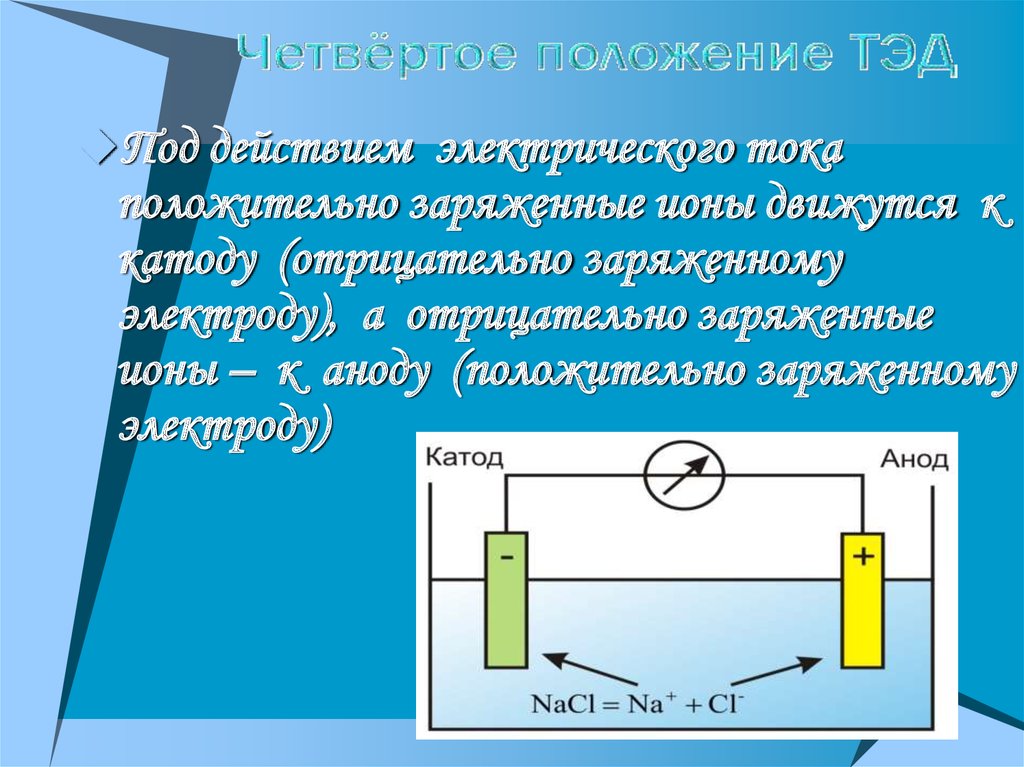
16.
Под действием электрического токаположительно заряженные ионы движутся к
катоду (отрицательно заряженному
электроду), а отрицательно заряженные
ионы – к аноду (положительно заряженному
электроду)
17.
Не все электролиты в одинаковой мередиссоциируют на ионы
Сильные
электролиты
Электролиты
средней силы
Слабые
электролиты
> 30%
3% 30%
< 3%
18.
19.
Сильные электролиты> 30%
Средние водорастворимые соли NaCl, K2SO4,
Ba(NO3)2 и т.д.
Гидроксиды щелочных и щелочноземельных
металлов: LiOH – CsOH, Ca(OH)2 – Ba(OH)2,;
Минеральные кислоты: H2SO4, HNO3, HClO3, HClO4,
HBrO3, HJO3, HCl, HBr, HJ
20.
Электролиты средней силы3% 30%
H3PO3
H3PO4
H4P2O7
H2SO3
HF
HClO2
Fe(OH)2
21.
Слабые электролиты< 3%
Органические кислоты: HCOOH, CH3COOH, C2H5COOH
Минеральные кислоты: HNO2, HClO, H2CO3, H2SiO3, H3BO3,
H3PO3, H2S
Гидроксиды малоактивных металлов: Cu(OH)2 , Fe(OH)3 ,
Al(OH)3 , Cr (OH)3 ,
Гидроксид аммония:
NH4OH
22.
Свойства растворов электролитовопределяются свойствами тех
ионов, которые они образуют при
диссоциации
23. Классы неорганических веществ с точки зрения ТЭД
24.
С точки зрения ТЭД , кислоты – этоэлектролиты, которые диссоциируют на
катионы водорода и
анионы кислотного остатка
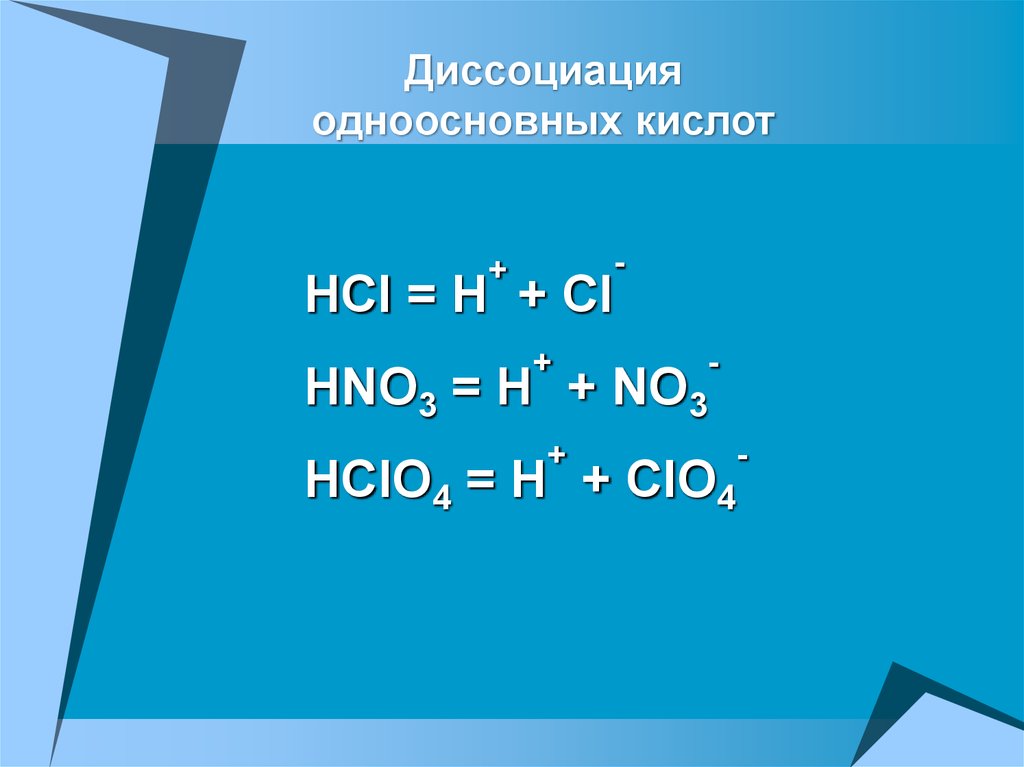
25.
Диссоциацияодноосновных кислот
-
+
HCl = H + Cl
+
HNO3 = H +
+
NO3
HClO4 = H +
ClO4
26.
Диссоциация многоосновныхкислот
Сильный электролит
+
-
H2SO4 H + HSO4 1
-
+
HSO4 H +
2SO4 2
1 2
+
H2SO4 2H + SO4
2-
Электролит средней
силы
+
H2SO3 H +
-
HSO3 1
+
2-
HSO3 H + SO3 2
1>> 2
+
H2SO3 H + HSO3
-
Многоосновные кислоты диссоциируют ступенчато. Каждая
последующая ступень диссоциации протекает хуже предыдущей
27.
С точки зрения ТЭД,основаниями называются
электролиты, которые в водном
растворе диссоциируют на ионы
металла и гидроксид ионы
28.
Диссоциация основанийNaOH = Na+ + OHBa(OH)2 = BaOH+ + OH- → Ba2+ + 2OHKOH = K+ + OH-
29.
С точки зрения ТЭД, соли – этоэлектролиты, которые
диссоциируют на катионы металла или
аммония NH4+ и анионы кислотных
остатков
30.
Классификация солейсредние
кислые
основные
Образованы
катионами
металла и
анионами
кислотного
остатка
Кроме
металла
и кислотного
остатка
содержат
водород
Кроме
металла
и кислотного
остатка
содержат
гидроксогруппу
31.
Диссоциация средних солейNa2SO4 = 2Na+ + SO42AlCl3 = Al3+ + 3ClFe2(SO4)3 = 2Fe3+ + 3SO42С точки зрения ТЭД, средними солями
называются электролиты, которые в водном растворе
диссоциируют на ионы металла и ионы кислотного
остатка
32.
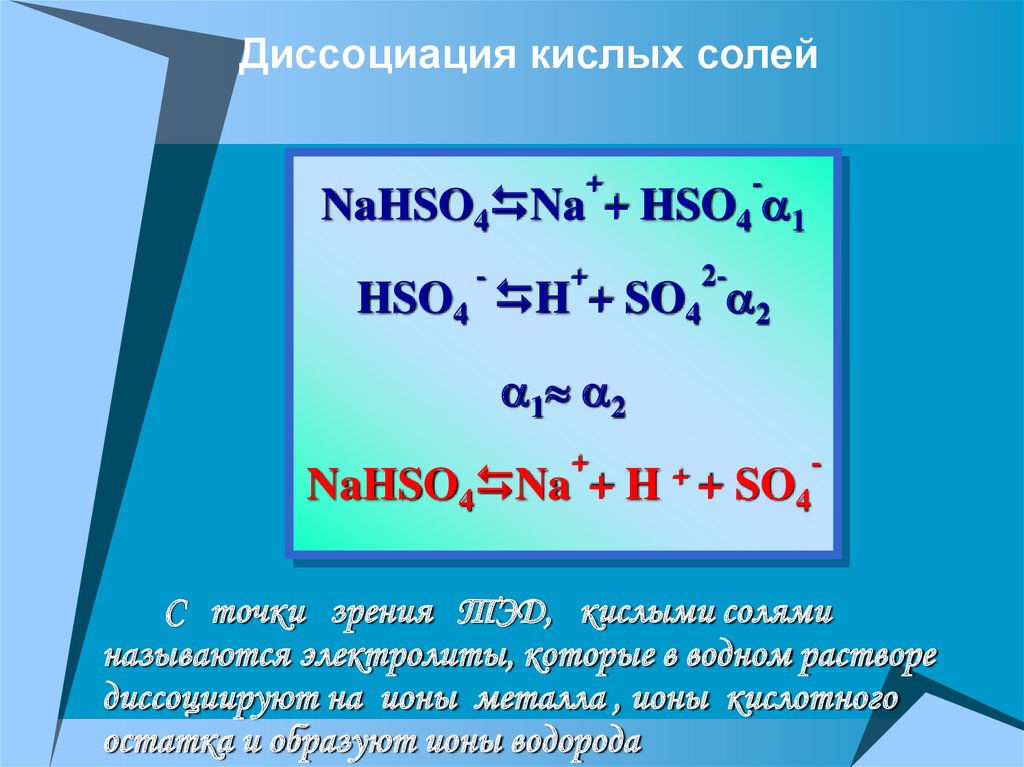
Диссоциация кислых солей+
-
NaHSO4 Na + HSO4 1
-
+
2-
HSO4 H + SO4 2
1 2
+
NaHSO4 Na + H
++
SO4
С точки зрения ТЭД, кислыми солями
называются электролиты, которые в водном растворе
диссоциируют на ионы металла , ионы кислотного
остатка и образуют ионы водорода
33.
Диссоциация основных солейBa(OH)Cl =
-
BaOH
BaOH+
Ba2+
+ Cl 1
-
+ OH 2
-
1 2
С точки зрения ТЭД, основными солями
называются электролиты, которые в водном растворе
диссоциируют на ионы металла , ионы кислотного
остатка и образуют гидроксид ионы




























 Химия
Химия








