Похожие презентации:
Теория электролитической диссоциации
1.
2. Вещества по отношению к электрическому току :
их растворыили расплавы
их растворы
или расплавы
ПРОВОДЯТ
НЕ ПРОВОДЯТ
электрический ток
электрический ток
Вид химической связи
Ионная или
ковалентная
сильно полярная
Ковалентная
неполярная
или мало полярная
3.
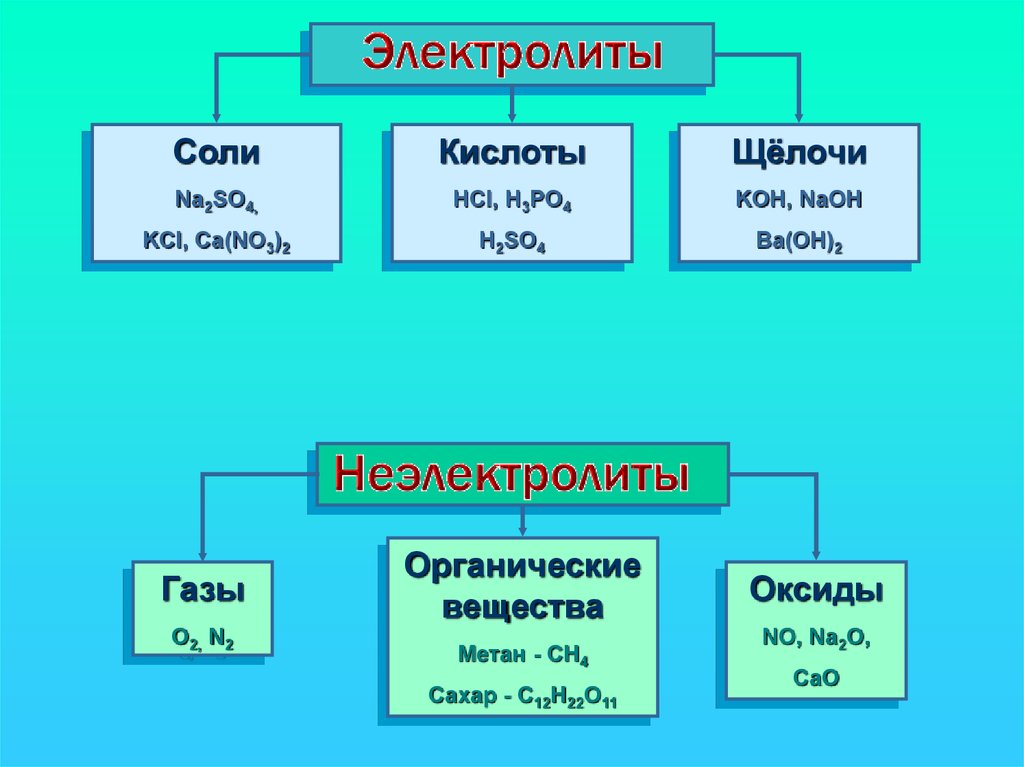
CолиКислоты
Щёлочи
Na2SO4,
HCl, H3PO4
KOH, NaOH
KCl, Ca(NO3)2
H2SO4
Ba(OH)2
Газы
O2, N2
Органические
вещества
Метан - CH4
Сахар - C12H22O11
Оксиды
NO, Na2O,
CaO
4.
5.
6.
7.
СТЕПЕНЬ ДИССОЦИАЦИИ- степень электролитической диссоциации
n – число молекул, которые распались на
ионы в растворе
N – общее число молекул в растворе
8.
9.
10.
11.
12.
Все вещества по их способностипроводить электрический ток в
растворах или расплавах делятся
на электролиты и неэлектролиты
13.
В растворах электролиты диссоциируют(распадаются) на положительно заряженные
ионы (катионы ) и отрицательно заряженные
ионы (анионы)
NaOH Na OH
H 2SO 4 2H SO
2
2
4
MgCl 2 Mg 2Cl
14.
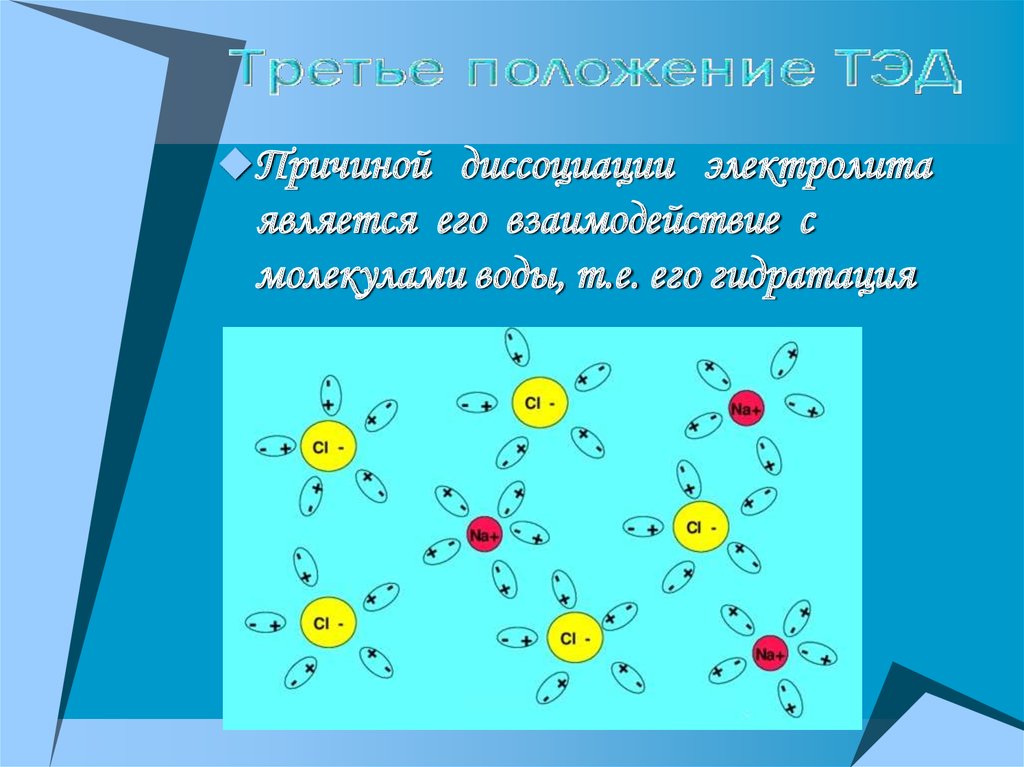
Причиной диссоциации электролитаявляется его взаимодействие с
молекулами воды, т.е. его гидратация
15.
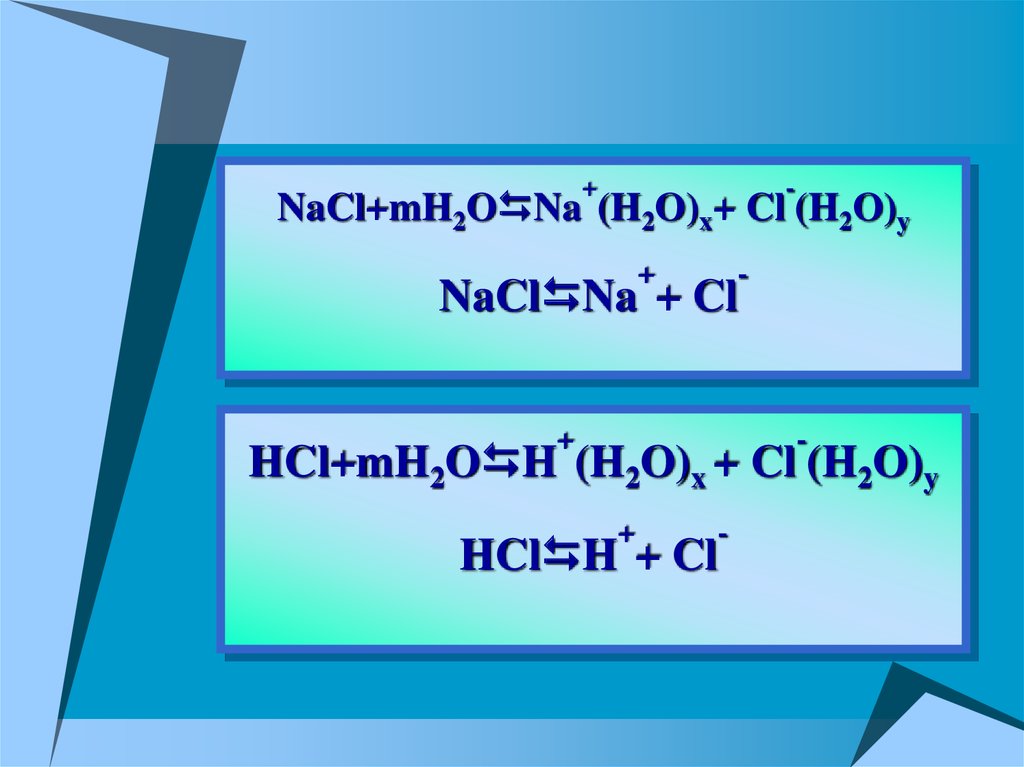
+-
NaCl+mH2O Na (H2O)x+ Cl (H2O)y
+
-
NaCl Na + Cl
+
-
HCl+mH2O H (H2O)x + Cl (H2O)y
+
-
HCl H + Cl
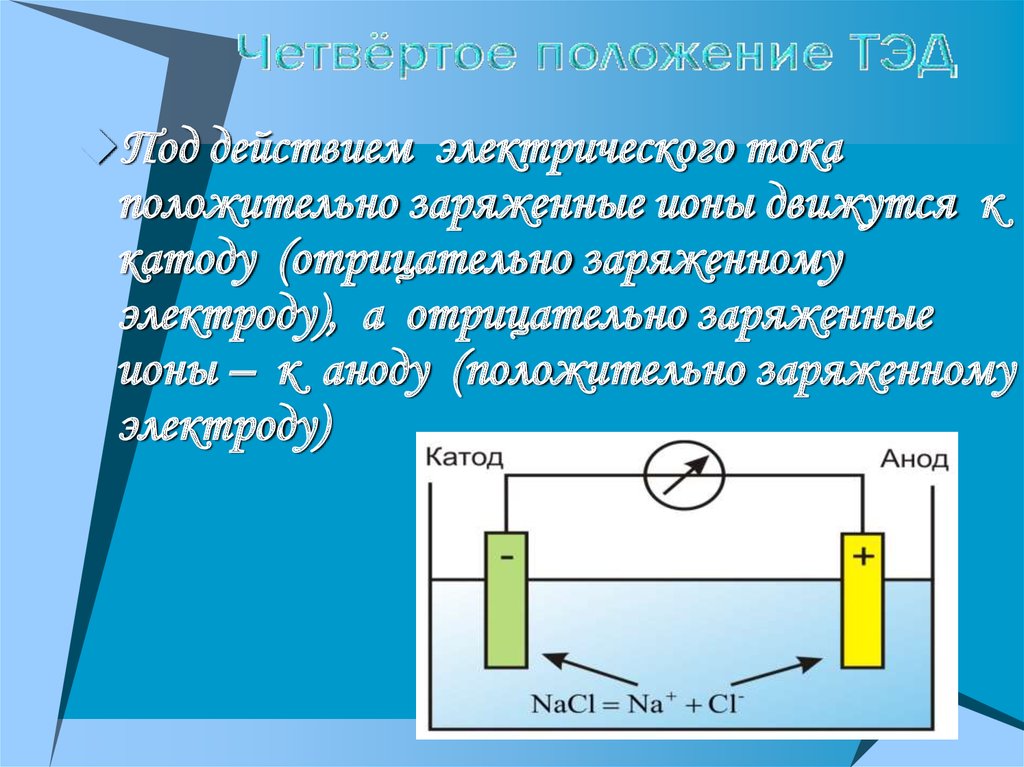
16.
Под действием электрического токаположительно заряженные ионы движутся к
катоду (отрицательно заряженному
электроду), а отрицательно заряженные
ионы – к аноду (положительно заряженному
электроду)
17.
Не все электролиты в одинаковой мередиссоциируют на ионы
Сильные
электролиты
Электролиты
средней силы
Слабые
электролиты
> 30%
3% 30%
< 3%
18.
19.
Сильные электролиты> 30%
Средние водорастворимые соли NaCl, K2SO4, Ba(NO3)2 и
т.д.
Гидроксиды щелочных и щелочноземельных металлов:
LiOH – CsOH, Ca(OH)2 – Ba(OH)2,;
Минеральные кислоты: H2SO4, HNO3, HClO3 (хлорноватая),
HClO4 (хлорная), HBrO3 (бромноватая), HJO3 (иодноватая),
HCl, HBr, HJ
20.
Электролиты средней силы3% 30%
H3PO3 (фосфористая)
H3PO4
H4P2O7 (дифосфорная)
H2SO3
HF
HClO2 (хлористая)
Fe(OH)2
21.
Слабые электролиты< 3%
Органические кислоты: HCOOH (муравьиная), CH3COOH
(уксусная), C2H5COOH (пропановая, пропионовая)
Минеральные кислоты: HNO2, HClO (хлорная), H2CO3,
H2SiO3, H3BO3 (борная), H3PO3 (фосфористая), H2S
Гидроксиды малоактивных металлов: Cu(OH)2, Fe(OH)3,
Al(OH)3, Cr(OH)3,
Гидроксид аммония:
NH4OH
22.
Свойства растворов электролитовопределяются свойствами тех
ионов, которые они образуют при
диссоциации
23. Классы неорганических веществ с точки зрения ТЭД
24.
С точки зрения ТЭД , кислоты – этоэлектролиты, которые диссоциируют на
катионы водорода и
анионы кислотного остатка
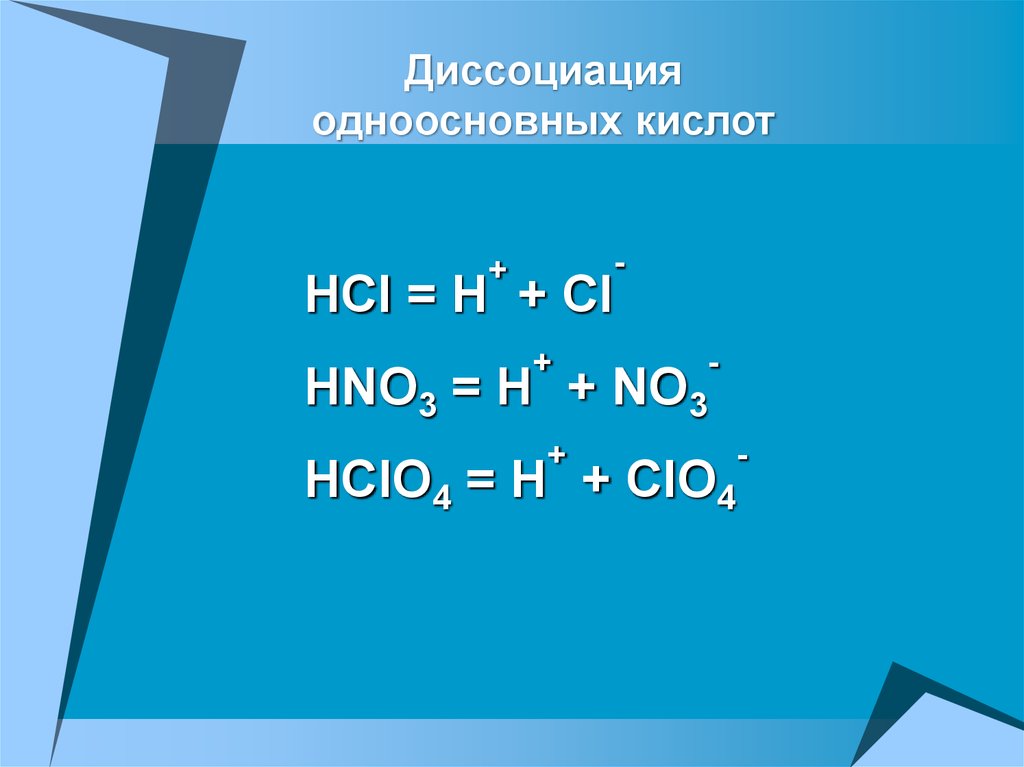
25.
Диссоциацияодноосновных кислот
-
+
HCl = H + Cl
+
HNO3 = H +
+
NO3
HClO4 = H +
ClO4
26.
Диссоциация многоосновныхкислот
Сильный электролит
+
-
H2SO4 H + HSO4 1
-
+
HSO4 H +
2SO4 2
1 2
+
H2SO4 2H + SO4
2-
Электролит средней
силы
+
H2SO3 H +
-
HSO3 1
+
2-
HSO3 H + SO3 2
1>> 2
+
H2SO3 H + HSO3
-
Многоосновные кислоты диссоциируют ступенчато. Каждая
последующая ступень диссоциации протекает хуже предыдущей
27.
С точки зрения ТЭД,основаниями называются
электролиты, которые в водном
растворе диссоциируют на ионы
металла и гидроксид ионы
28.
Диссоциация основанийNaOH = Na+ + OHBa(OH)2 = BaOH+ + OH- → Ba2+ + 2OHKOH = K+ + OH-
29.
С точки зрения ТЭД, соли – этоэлектролиты, которые
диссоциируют на катионы металла или
аммония NH4+ и анионы кислотных
остатков
30.
Классификация солейсредние
кислые
основные
Образованы
катионами
металла и
анионами
кислотного
остатка
Кроме
металла
и кислотного
остатка
содержат
водород
Кроме
металла
и кислотного
остатка
содержат
гидроксогруппу
31.
Диссоциация средних солейNa2SO4 = 2Na+ + SO42AlCl3 = Al3+ + 3ClFe2(SO4)3 = 2Fe3+ + 3SO42С точки зрения ТЭД, средними солями
называются электролиты, которые в водном растворе
диссоциируют на ионы металла и ионы кислотного
остатка
32.
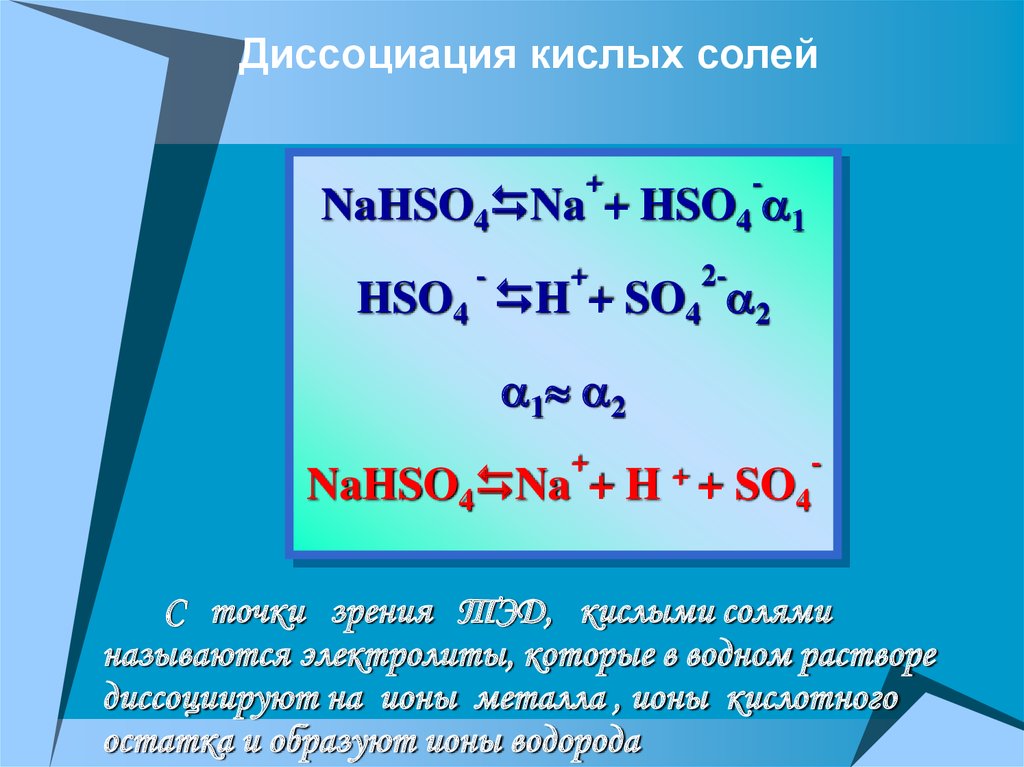
Диссоциация кислых солей+
-
NaHSO4 Na + HSO4 1
-
+
2-
HSO4 H + SO4 2
1 2
+
NaHSO4 Na + H
++
SO4
С точки зрения ТЭД, кислыми солями
называются электролиты, которые в водном растворе
диссоциируют на ионы металла , ионы кислотного
остатка и образуют ионы водорода
33.
Диссоциация основных солейBa(OH)Cl =
-
BaOH
BaOH+
Ba2+
+ Cl 1
-
+ OH 2
-
1 2
С точки зрения ТЭД, основными солями
называются электролиты, которые в водном растворе
диссоциируют на ионы металла , ионы кислотного
остатка и образуют гидроксид ионы



























 Химия
Химия








