Похожие презентации:
Белки. 9 класс
1.
Белки9 класс
2.
3.
ЧТО ТАКОЕ БЕЛОК?Белок – это органическое соединение,
состоящее из аминокислот, соединенных
пептидной связью.
Белок – это полимер, мономерами
которого являются аминокислоты,
соединенные пептидной связью.
4.
Основными структурными компонентамибелков являются аминокислоты
H
H
C
H
C
O
Аминокислоты различаются только
радикалом.
Существует 20 аминокислот.
C
H NH2
OH
- NH2 аминогруппа
- СООН карбоксильная группа
5.
Аминокислота - амфотерноесоединение
АМИНОГРУППА
(свойства основания)
Карбоксильная
группа
(свойства кислоты)
6.
История открытия белковДанилевский Александр Яковлевич –
русский биохимик
1838–1923
Автор теории
полипептидного
строения
белков
ЛЮБАВИН
Николай
Николаевич –
русский
химик
Разработал способ синтеза
аминокислот
Лайнус Карл Полинг –
американский химик
Первый учёный,
который смог
успешно
предсказать
вторичную
структуру белков
Фредерик Сенгер- английский
биохимик
7.
История открытиябелков
Впервые термин белковый (albumineise)
применительно ко всем жидкостям животного
организма использовал, по аналогии с
яичным белком, французский физиолог Ф.
Кене в 1747 г., и именно в таком толковании
термин вошел в 1751 г. в «Энциклопедию»
.Дидро и Ж. Д'Аламбера
Браконно Анри –
французский химик
(29.05. 1780–
13.01.1855)
Впервые выделил (1820) из гидролизата белка
аминокислоты глицин и лейцин.
.
Джон Дальтон- английский химик
(6 сентября 1766 — 27 июля 1844)
В 1803 г. дает первые формулы
белков - альбумина и желатина как веществ, содержащих азот
Жозеф Луи Гей-Люссак – французский
химик (6.12.1778-9.05.1850
Проводит химические анализы белков
- фибрина крови, казеина и отмечает
сходство их элементного состава
Геррит Ян
Мульдер
Голландский химик — органик,
который описал химический состав
белков.
Удостоен в 1910 году Нобелевской премии по
физиологии и медицине за создание
одной из первых теорий строения
белков. высказал предположение, что
аминокислоты служат
«строительными блоками» при
синтезе белков.
8.
СОСТАВ БЕЛКОВОтносительная молекулярная масса (Mr) белка может
составлять от 10 тысяч до многих миллионов:
инсулин – 6500
белок вируса гриппа – 320 000 000.
Элементарный состав белка колеблется незначительно (в % на
сухую массу):
C - 51 - 53%,
O - 21,5 - 23,5%,
N - 16,8 - 18,4%,
H - 6,5 - 7,3%,
S - 0,3 - 2,5%.
Некоторые белки содержат P, Se, Fe и др.
9.
Строение некоторых аминокислотНазвание кислоты
Глицин (аминоуксусная
кислота)
Сокращённое
обозначен
гли ие
Аланин ( аминоуксусная кислота)
ала
Цистеин ( -амино- тиолпропионовая
кислота)
Серин ( -амино- оксипропионовая
кислота)
Глутаминовая ( аминоглутаровая
кислота)
Лизин ( , диаминокапроновая
кислота)
Фенилаланин ( -амино -фенилпропионовая
кислота)
Тирозин ( -амино- -(nоксифенил)пропионовая кислота
цис
сер
глу
лиз
фен
тир
Формула
H2N-CH2-COOH
CH3-CH- COOH
|
NH2
HS-CH2-CH-COOH
|
NH2
HO-CH2-CH-COOH
|
NH2
HOOC-CH2-CH2-CH-COOH
|
NH2
NH2-CH2- CH2- CH2- CH2- CH-COOH
|
NH2
C6H5-CH2-CH-COOH
|
NH2
HO-C6H4-CH2-CH-COOH
|
NH2
10.
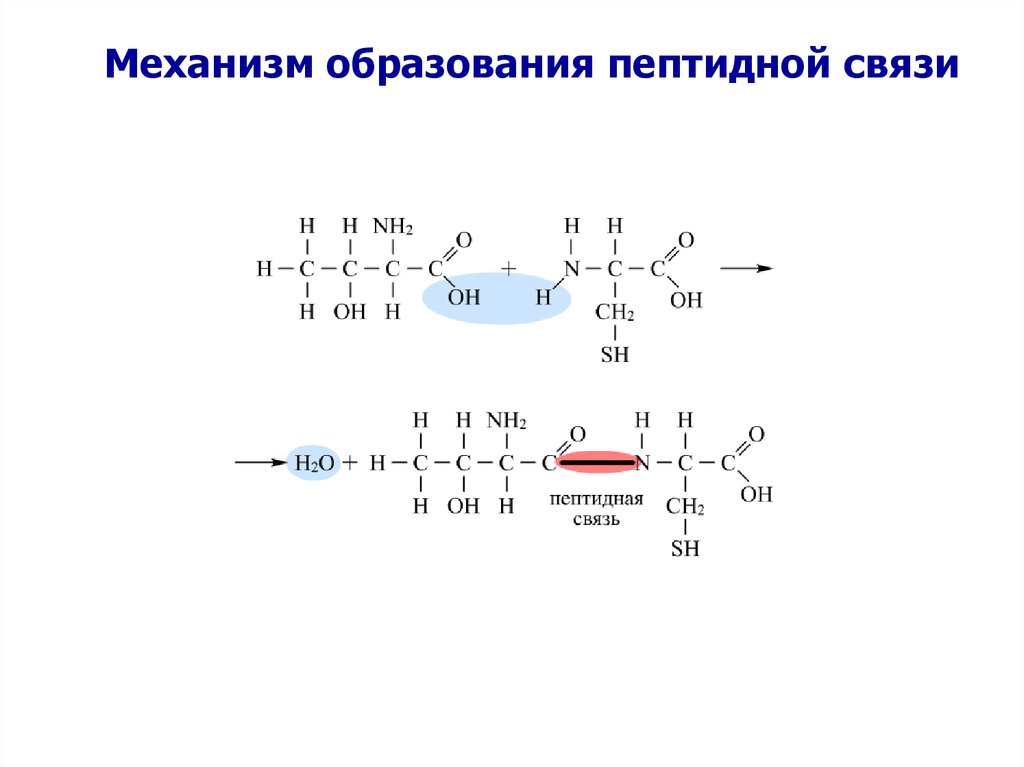
Образование пептидной связиАминокислоты могут реагировать друг с другом: карбоксильная
группа одной аминокислоты реагирует с аминогруппой другой
аминокислоты с образованием пептидной связи и молекулы
воды.
NH2 – CH2 – COOH + NH2 – CH2 – COOH =
NH2 – CH2 – CO – NH – CH2 – COOH + H2O
• Связь – CO – NH – между аминокислотами называется
пептидной.
11.
Механизм образования пептидной связи12.
Белковая молекула может образовать 4типа структур
четвертичная
третичная
вторичная
первичная
13.
СТРУКТУРА БЕЛКАПервичная структура белка – это полипептидная цепочка из аминокислот.
14.
СТРУКТУРА БЕЛКАВторичная структура белка - полипептидная цепь, скрученная в
спираль.
Виток – 3,6
аминокислотных
остатка
-CO-NH-
Шаг - 0,544 нм.
15.
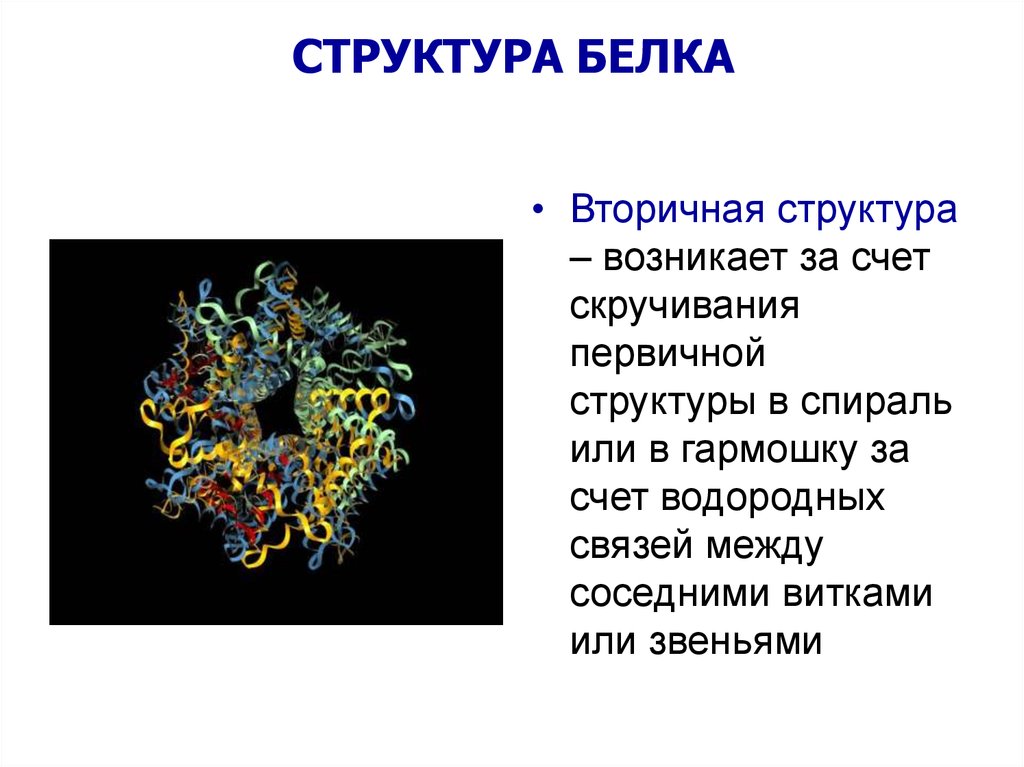
СТРУКТУРА БЕЛКА• Вторичная структура
– возникает за счет
скручивания
первичной
структуры в спираль
или в гармошку за
счет водородных
связей между
соседними витками
или звеньями
16.
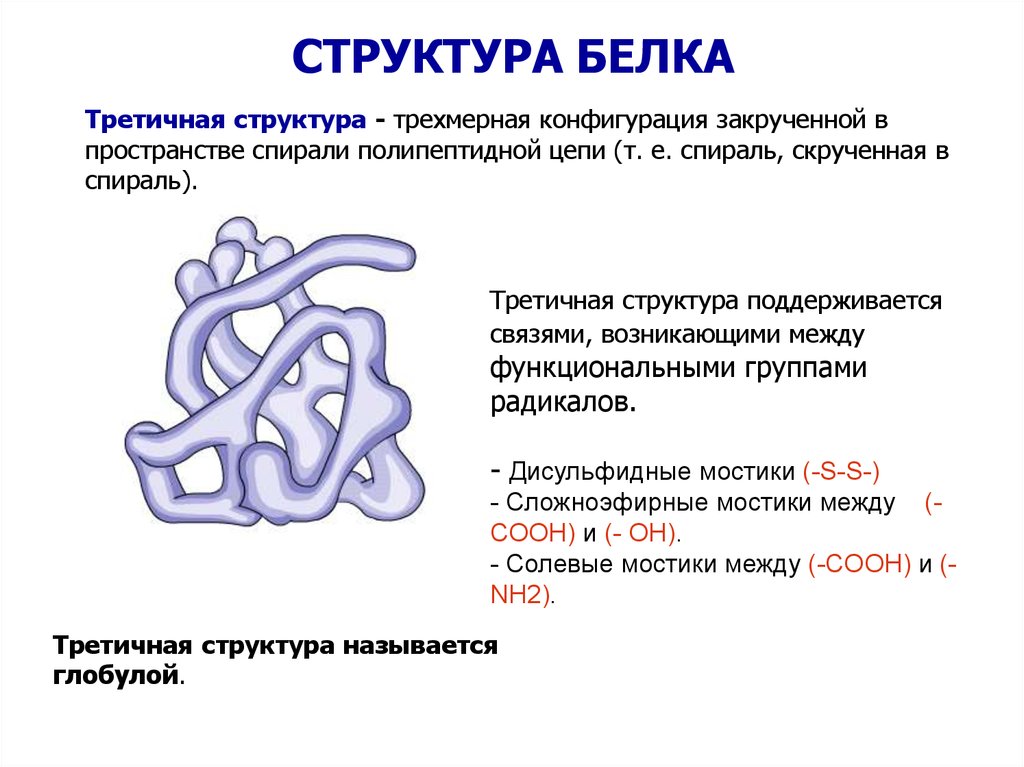
СТРУКТУРА БЕЛКАТретичная структура - трехмерная конфигурация закрученной в
пространстве спирали полипептидной цепи (т. е. спираль, скрученная в
спираль).
Третичная структура поддерживается
связями, возникающими между
функциональными группами
радикалов.
- Дисульфидные мостики (-S-S-)
- Сложноэфирные мостики между (COOH) и (- OH).
- Солевые мостики между (-COOH) и (NH2).
Третичная структура называется
глобулой.
17.
СТРУКТУРА БЕЛКА• Третичная структура
– это глобулярная
форма,
образующаяся за
счет гидрофобных
связей между
радикалами
аминокислот
вторичной структуры
18.
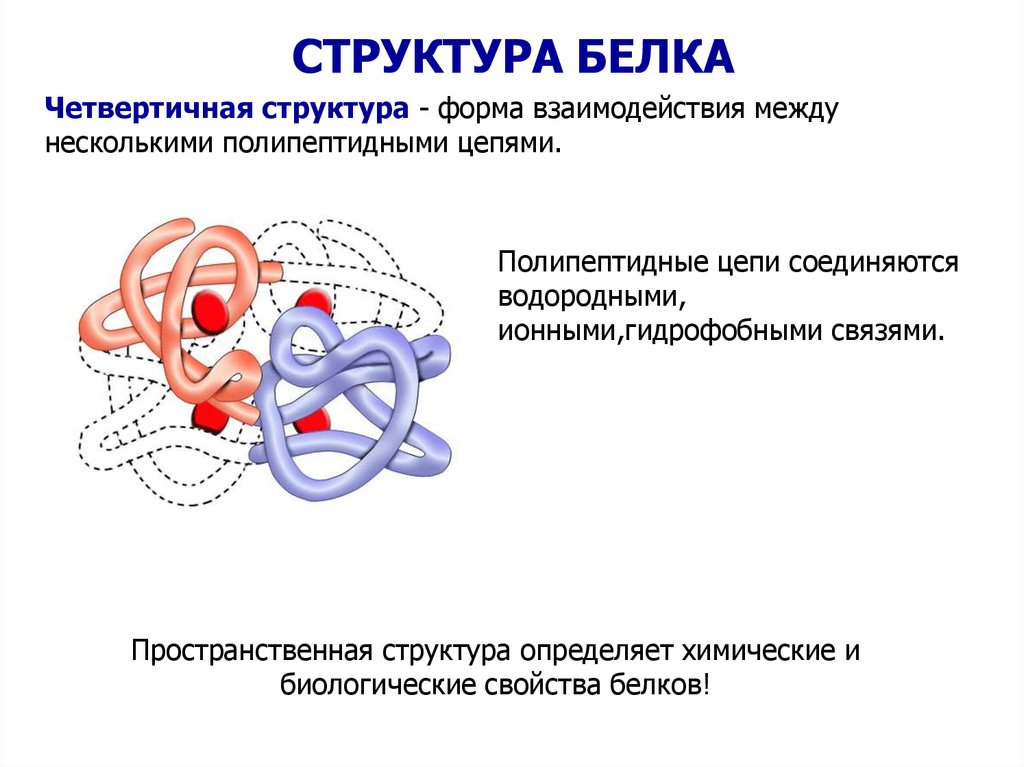
СТРУКТУРА БЕЛКАЧетвертичная структура - форма взаимодействия между
несколькими полипептидными цепями.
Полипептидные цепи соединяются
водородными,
ионными,гидрофобными связями.
Пространственная структура определяет химические и
биологические свойства белков!
19.
СТРУКТУРА БЕЛКА• Четвертичная
структура –
представляет собой
объединение
нескольких глобул с
третичной
структурой в единый
конгломерат
20.
Денатурация белка –нарушение природной структуры белка.
Факторы вызывающие денатурацию белка: высокая температура,
механическое воздействие, действие химических веществ и др.
ДЕНАТУРАЦИЯ – это необратимый процесс! При денатурации могут
нарушаться четвертичная, третичная. Вторичная структуры белка.
21.
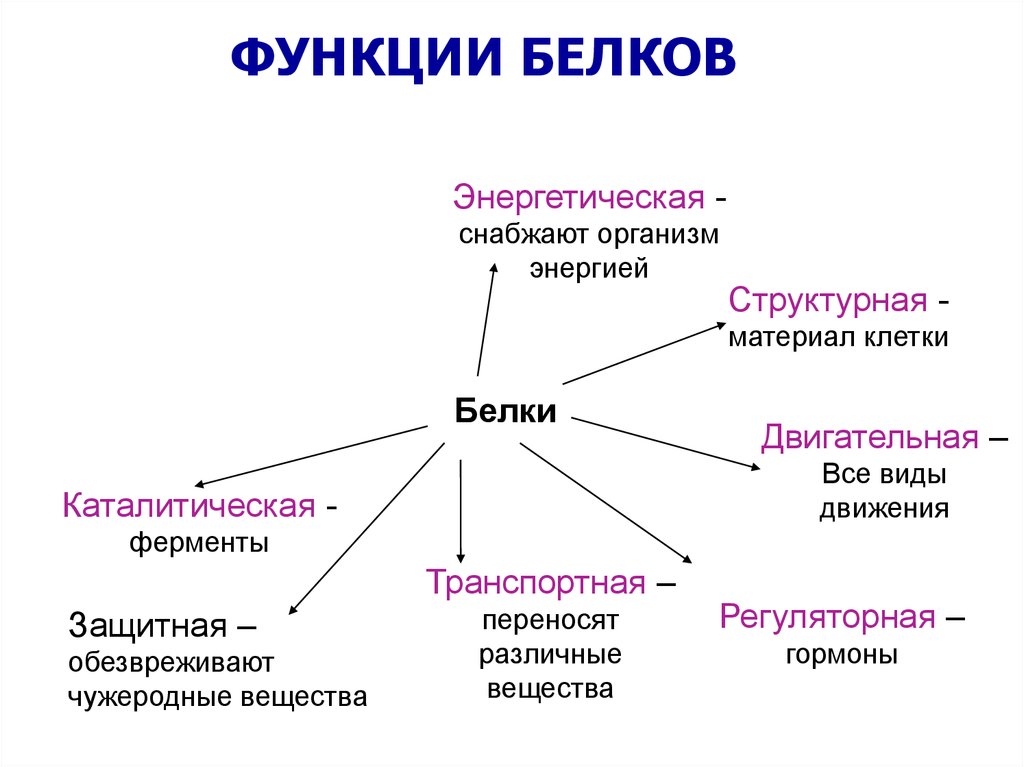
ФУНКЦИИ БЕЛКОВЭнергетическая снабжают организм
энергией
Структурная материал клетки
Белки
Двигательная –
Все виды
движения
Каталитическая ферменты
Транспортная –
Защитная –
обезвреживают
чужеродные вещества
переносят
различные
вещества
Регуляторная –
гормоны
22.
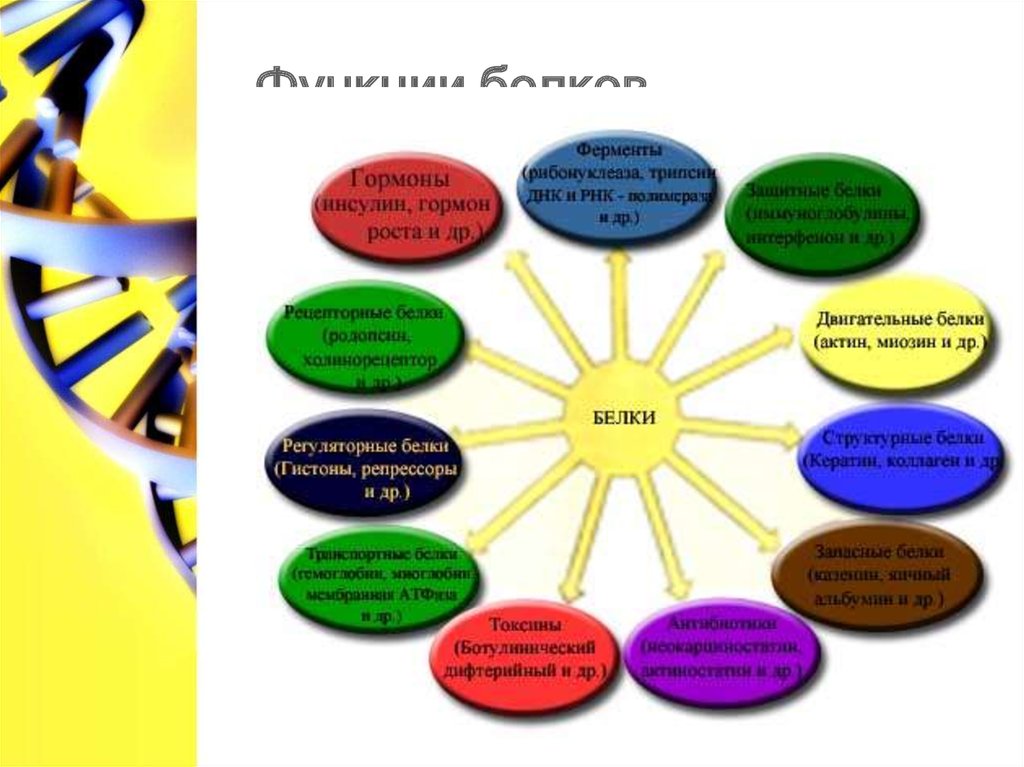
Функции белковТекст слайда
23.
Новые слова и выражения:Белок
Полимер
Мономер
Пептид
Пептидная связь
Полипептидная цепочка
Структура белка
Глобула
Денатурация
• Биологические функции
24.
КОНТРОЛЬНЫЕ ВОПРОСЫ1. Что такое белок?
2. Как называется химическая связь в
молекуле белка?
3. Что является мономером в белке?
4. Каким способом уменьшается размер
молекулы белка?
5. Что такое денатурация?
25.
КОНТРОЛЬНЫЕ ВОПРОСЫКакие структуры белка представлены на рисунках?


















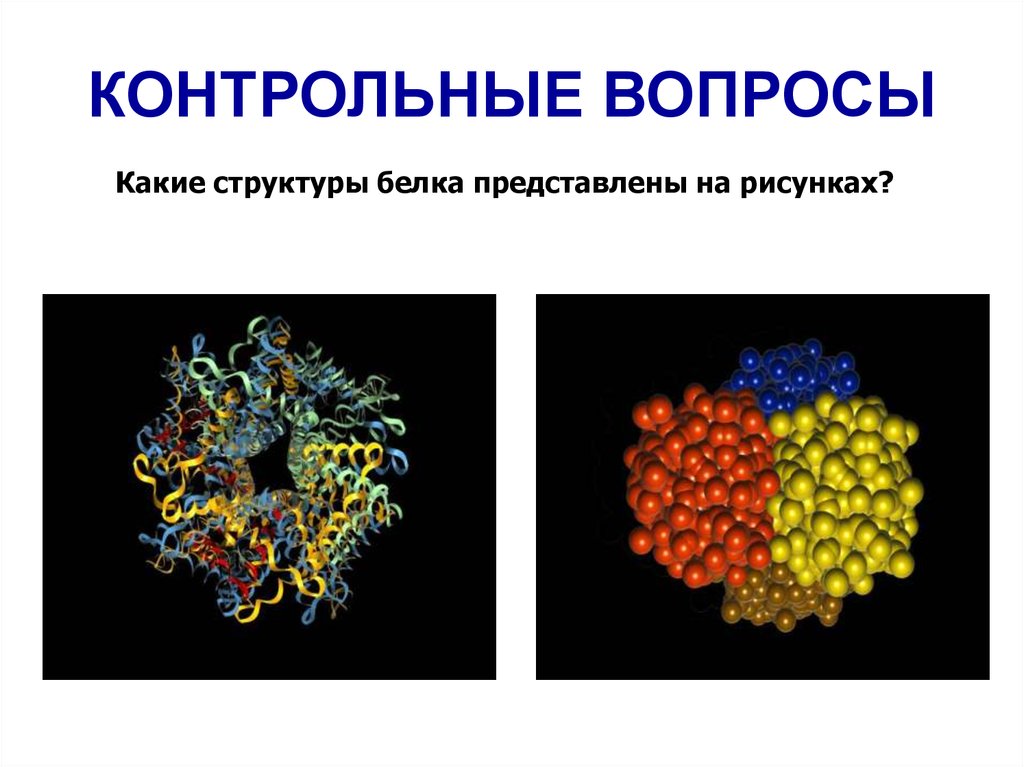
 Химия
Химия








