Похожие презентации:
Химическая связь и строение химических соединений
1.
Лекция № 10Химическая связь и
строение химических
соединений
2.
ВАЖНЕЙШИЕ ПОНЯТИЯ1. Химической связью называется совокупность
взаимодействий между электронами и ядрами,
приводящих к соединению атомов в молекулу.
2. В образовании химической связи между атомами
главную роль играют валентные электроны.
3. При образовании связи атомы стремятся к более
устойчивому энергетическому состоянию, которому
соответствует завершенный восьми- (или двух-),
электронный внешний уровень как у инертных
элементов.
3.
ВИДЫ И ТЕОРИИ ХИМИЧЕСКОЙ СВЯЗИРазличают следующие основные виды связей:
ковалентная, ионная, металлическая и
водородная.
Природа химической связи единая –
электростатическая.
Более универсальными для изучения химической
связи являются квантовомеханические теории:
метод валентных связей – метод ВС (Гайтлер и
Лондон) и метод молекулярных орбиталей – метод
МО (Гунд, Леннард-Джонс и Малликен).
4.
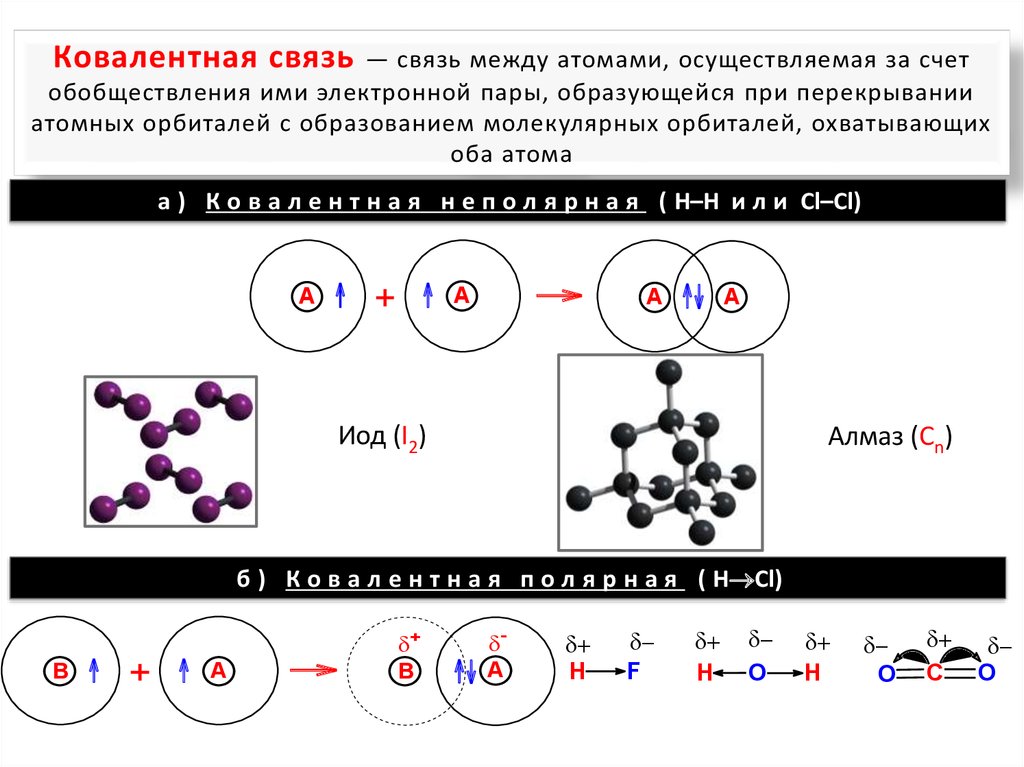
Ковалентная связь— связь между атомами, осуществляемая за счет
обобществления ими электронной пары, образующейся при перекрывании
атомных орбиталей с образованием молекулярных орбиталей, охватывающих
оба атома
а ) К о в а л е н т н а я н е п о л я р н а я ( H–H и л и Cl–Cl)
A
+
A
A
A
Иод (I2)
Алмаз (Cn)
б ) К о в а л е н т н а я п о л я р н а я ( H Cl)
B
+
A
+
B
A
H
F
H
O
H
O
C
О
5. Полярность связи
Полярность связи количественно оцениваетсядипольным моментом :
μ = lq , где q - абсолютная величина заряда, l –
расстояние между полюсами. Следует
различать полярность связи и полярность
молекул. Так, для 2-х атомных молекул μ-связи
равен μ- молекулы. А в 3-х и более атомных
молекулах μ может быть равен 0, несмотря на
полярность связей. Например, СО2- неполярная
молекула, хотя все связи С―О полярные.
Полярная связь является промежуточной между
неполярной и ионной связью, или ионную связь
можно представить как предельно
поляризованную связь.
6.
СПОСОБЫ ОБРАЗОВАНИЯ КОВАЛЕНТНОЙ СВЯЗИа) "Обменный" (объединение неспаренных
электронов)
H
H H H
H
1s
H
N
H N
2p
H
2s
H
N
1s
б) Донорно–акцепторный (передача электронной
пары)
H H H H
H
1s
H N
2p
H
2s
1s
N
H
+
H
H N H
H
7. Свойства ковалентной связи:
1. Длина связи – расстояние междуядрами атомов в молекуле (нм – 10-9 м);
2. Энергия связи – определяется энергией,
необходимой для разрыва связи (Дж/моль,
кДж/моль);
8. Свойства ковалентной связи
3. Насыщаемость связи – способностьатомов образовывать ограниченное число
ковалентных связей.
Благодаря насыщаемости молекулы имеют
определенный состав.
9.
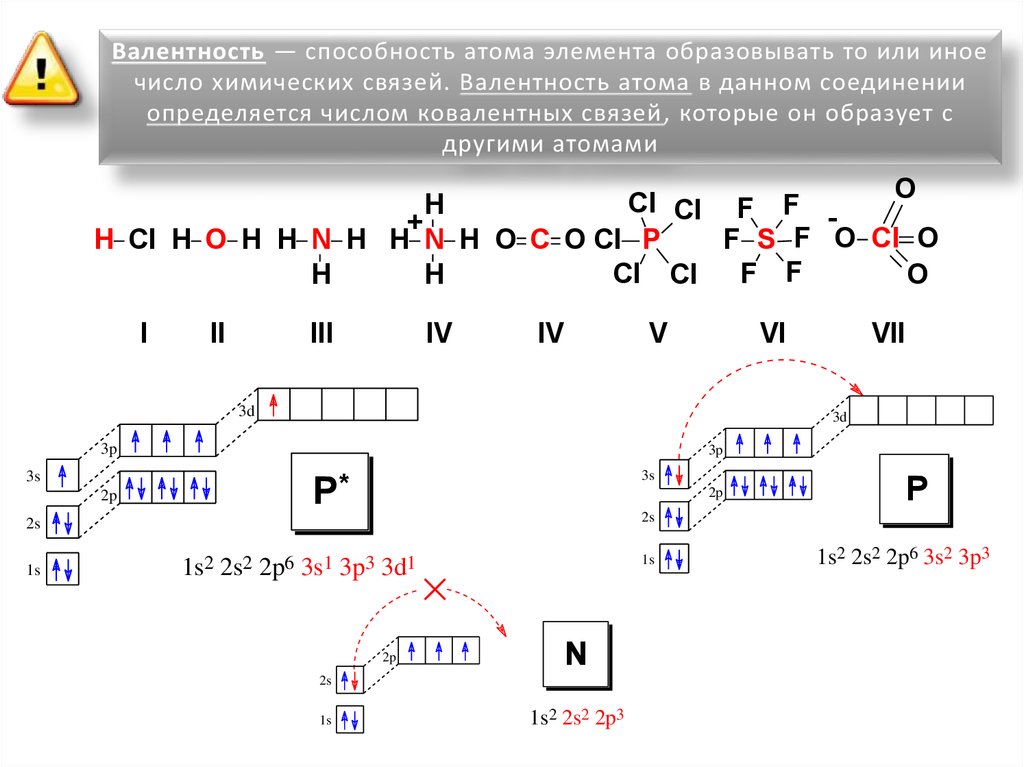
Валентность — способность атома элемента образовывать то или иноечисло химических связей. Валентность атома в данном соединении
определяется числом ковалентных связей, которые он образует с
другими атомами
O
Cl Cl F F
H
+
H Cl H O H H N H H N H O C O Cl P
F S F O Cl O
Cl Cl
F F
H
H
O
I
II
III
IV
IV
V
VI
3d
3d
3p
3s
2p
3p
3s
P*
2p
P
2s
2s
1s
VII
1s
1s2 2s2 2p6 3s1 3p3 3d1
2p
N
2s
1s
1s2 2s2 2p3
1s2 2s2 2p6 3s2 3p3
10.
ВА Л Е Н Т Н Ы Е В ОЗ М ОЖ Н ОС Т И АТОМ А ОПР ЕД ЕЛ Я ЮТС Я :1) Числом неспаренных электронов в основном или возбужденном состояниях
Основное состояние
17Cl
Валентность I
3s23p53d0
3s
3p
3d
H Cl
Возбужденные состояния:
17Cl
Валентность III
3s23p43d1
3s
17Cl
3d
3s23p33d2
3s
17Cl
3p
3p
3d
3s13p33d3
3s
3p
3d
H O Cl O
Валентность V
O
H O Cl
O
Валентность VII
O
H O Cl O
O
11.
2) Числом неподеленных пар электронов или вакантных орбиталей, способныхучаствовать в образовании связей по донорно-акцепторному механизму
7N
три неспаренных электрона _ валентность III (NH3)
2s22p3
2s
2p
три неспаренных электрона + неподеленная пара _ валентность IV (NH4+)
основное состояние:
2 1
13Al 3s 3p
3s
3p
возбужденное состояние:
13Al
3s13p2
3s
один неспаренный электрон _ валентность I, которую
алюминий практически не проявляет
три неспаренных электрона _ валентность III Al(OH)3
3p
три неспаренных электрона + вакантная орбиталь _ валентность IV [Al(OH)4]
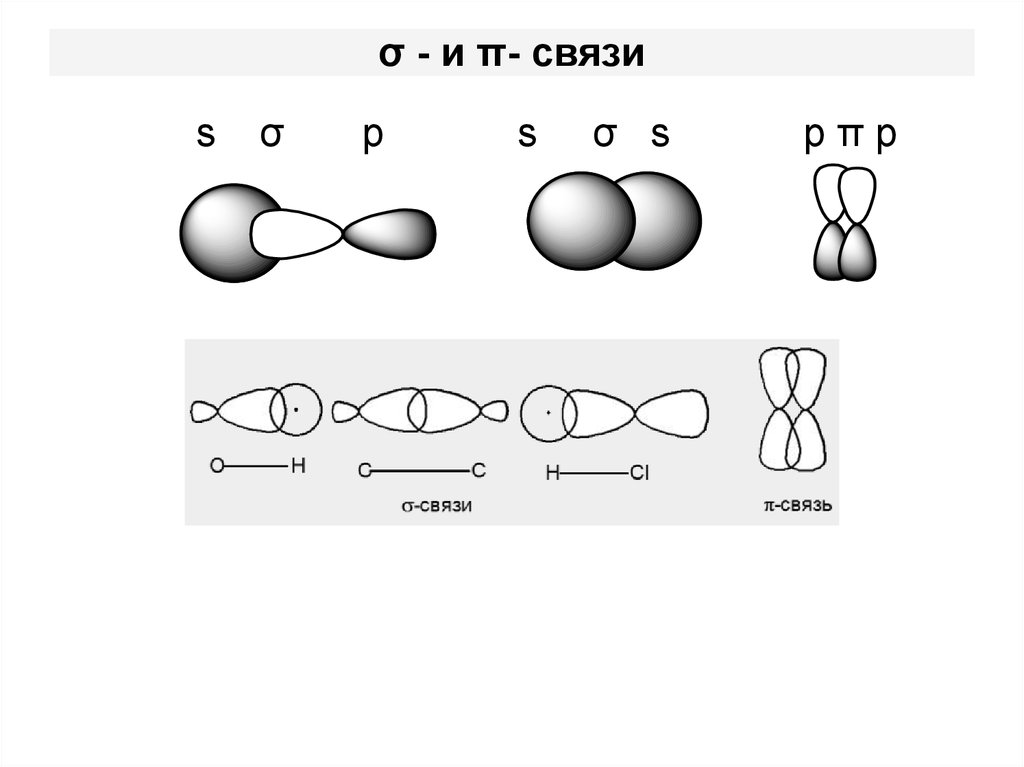
12. Свойства ковалентной связи
4. Ковалентная связь возникает в направлениимаксимального перекрывания орбиталей.
По степени перекрывания различают σ, π– связи
• σ – связь образуется вдоль линии,
соединяющей центры атомов.
• π – связь образуется перпендикулярно оси,
соединяющей центры атомов.
Направленность ковалентной связи обуславливает пространственную структуру
молекул.
13. σ - и π- связи
sσ
p
s
σ s
pπp
14.
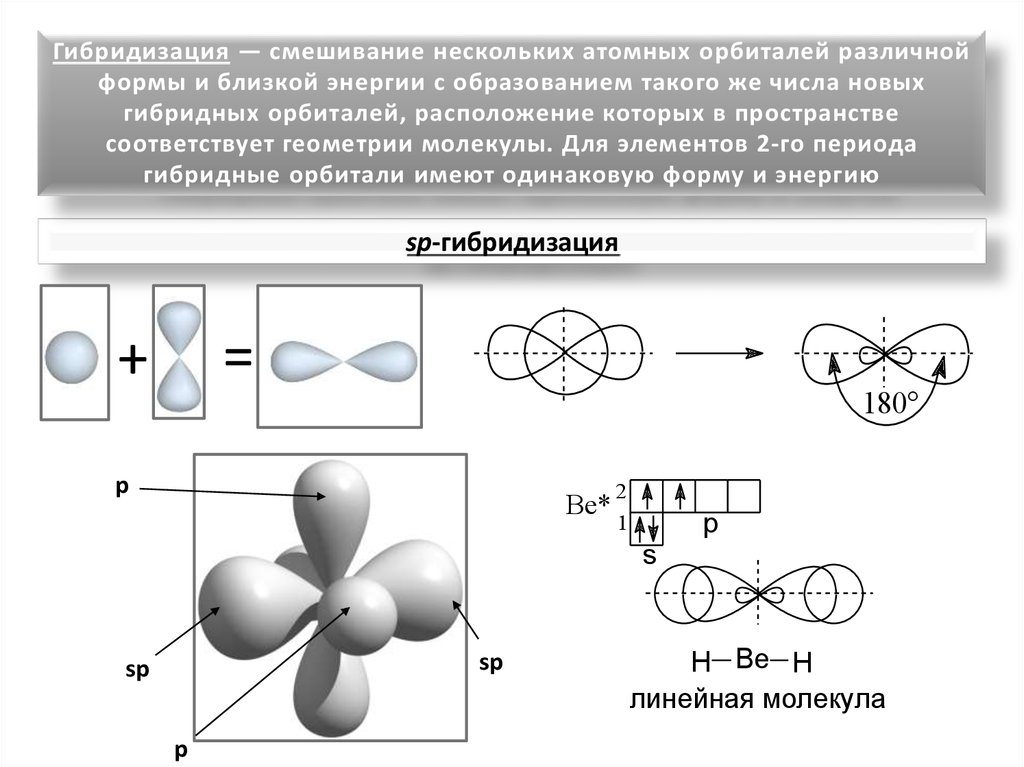
Гибридизация — смешивание нескольких атомных орбиталей различнойформы и близкой энергии с образованием такого же числа новых
гибридных орбиталей, расположение которых в пространстве
соответствует геометрии молекулы. Для элементов 2-го периода
гибридные орбитали имеют одинаковую форму и энергию
sp-гибридизация
=
+
180°
р
Be*
2
p
1
s
sp
sp
р
H Be H
линейная молекула
15.
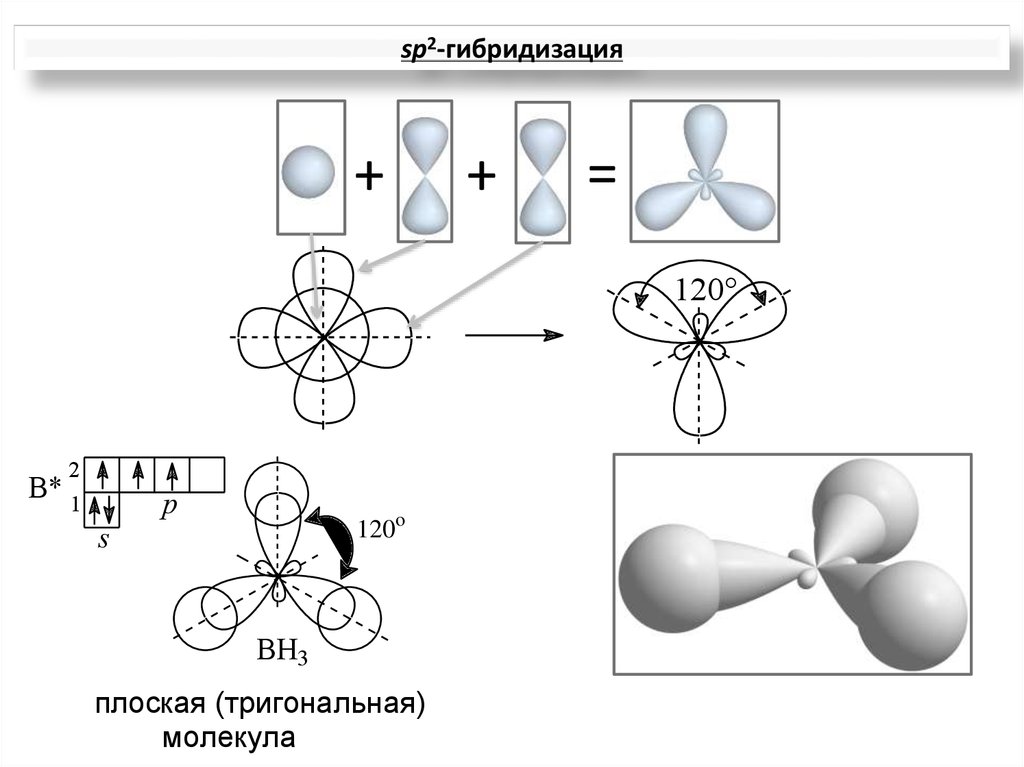
sp2-гибридизация+
+
=
120°
2
B* 1
p
120o
s
BH3
плоская (тригональная)
молекула
16.
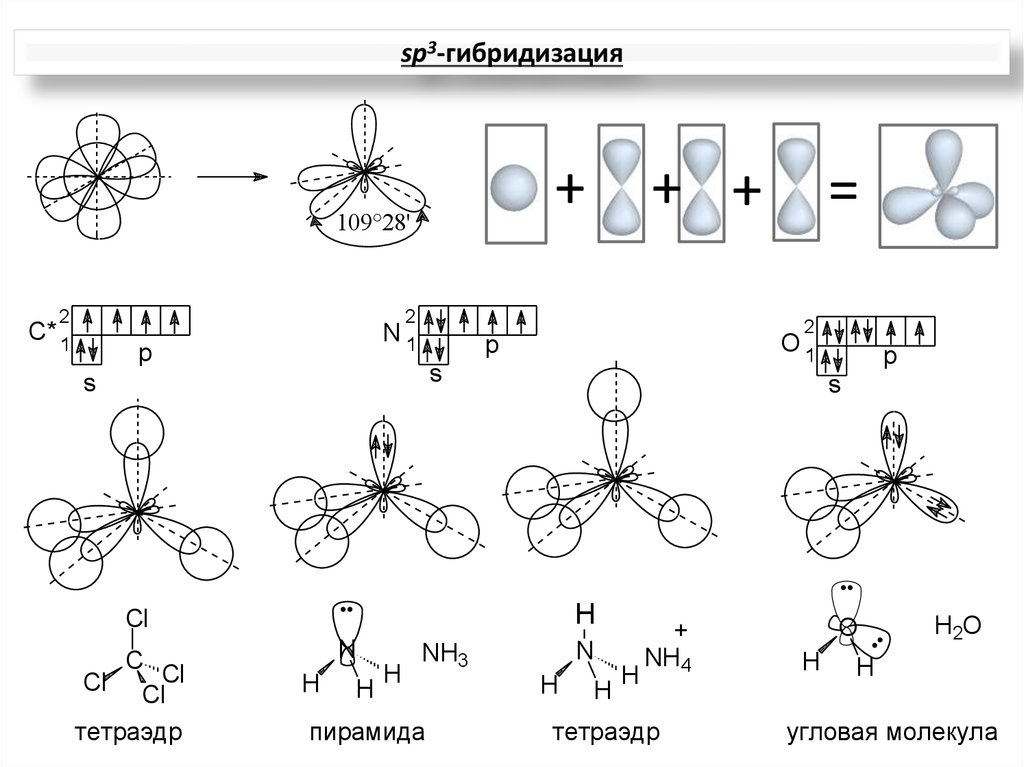
sp3-гибридизация+
109°28'
2
+ +
2
C* 1
N1
p
2
O1
p
s
s
Н
N
H
H
H
N
NH3
пирамида
p
s
Cl
C
Cl ClCl
тетраэдр
=
H
H
H
+
NH4
тетраэдр
O
H
H2O
H
угловая молекула
17.
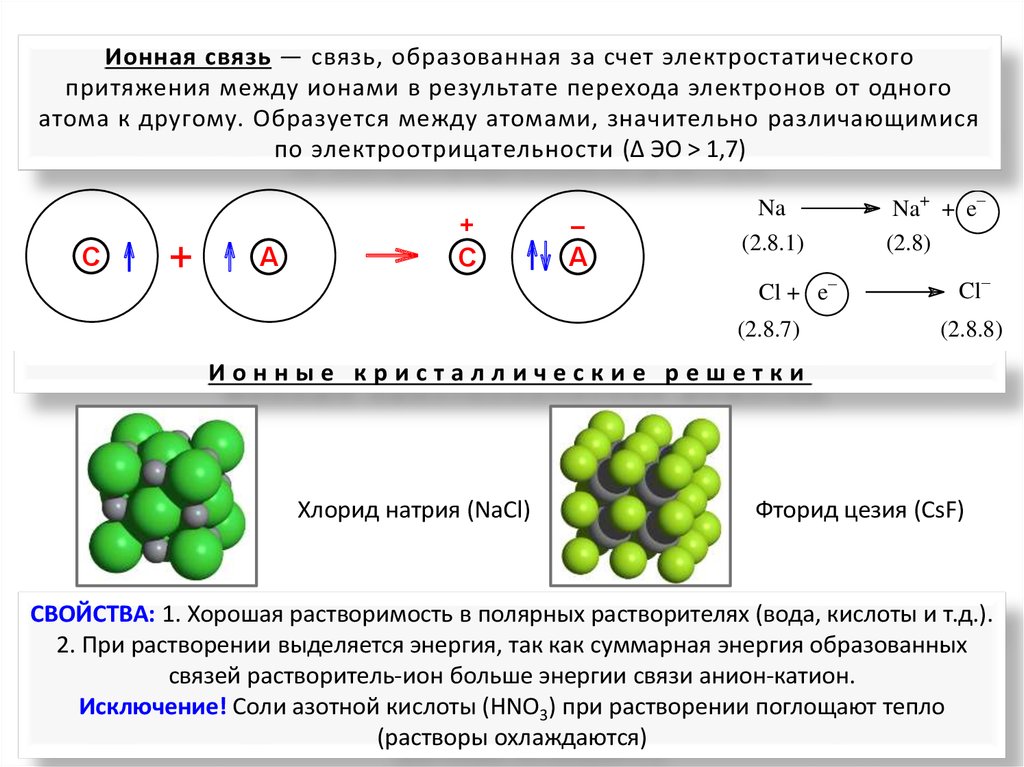
Ионная связь — связь, образованная за счет электростатическогопритяжения между ионами в результате перехода электронов от одного
атома к другому. Образуется между атомами, значительно различающимися
по электроотрицательности (Δ ЭО > 1,7)
C
+
A
+
–
C
A
Na
(2.8.1)
Cl + e–
(2.8.7)
Na+ + e–
(2.8)
Cl–
(2.8.8)
Ионные кристаллические решетки
Хлорид натрия (NaCl)
Фторид цезия (CsF)
СВОЙСТВА: 1. Хорошая растворимость в полярных растворителях (вода, кислоты и т.д.).
2. При растворении выделяется энергия, так как суммарная энергия образованных
связей растворитель-ион больше энергии связи анион-катион.
Исключение! Соли азотной кислоты (HNO3) при растворении поглощают тепло
(растворы охлаждаются)
18. Ионная связь
Соединения, которые образовались из ионов, называютгетерополярными или ионными.
Пример образования ионной связи:
2
2
6
1
ЭО 0,93
11Na 1s 2s 2p 3s
2 2s2 2p6 3s23p5
Cl
1s
ЭО 2,83
17
ΔЭО = 1,9 связь ионная:
Na -1е = Na+
Cl +1е = ClNa+ + Cl- = Na+ClИонные соединения состоят из отдельных молекул
только в парообразном состоянии. В кристаллическом
состоянии ионные соединения состоят из закономерно
расположенных положительных и отрицательных
ионов. В обычных условиях ионные соединения
представляют собой кристаллические вещества с
высокими температурами плавления и кипения.
19.
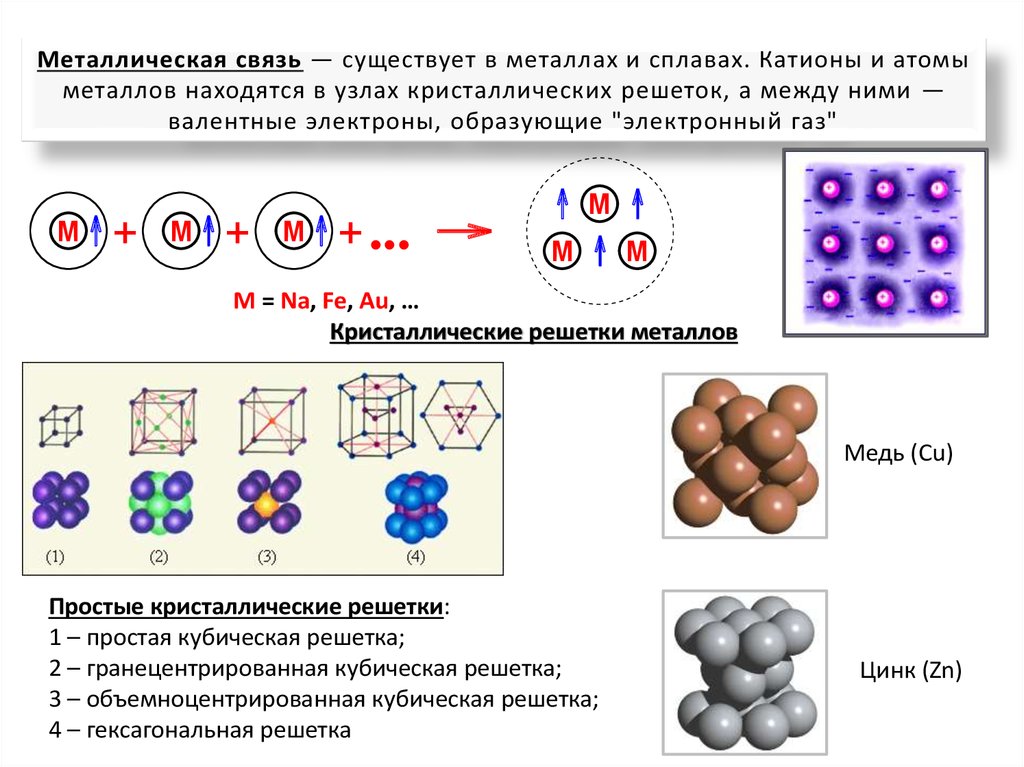
Металлическая связь — существует в металлах и сплавах. Катионы и атомыметаллов находятся в узлах кристаллических решеток, а между ними —
валентные электроны, образующие "электронный газ"
M
+
M
+
M
+ ...
M
M
M
M = Na, Fe, Au, …
Кристаллические решетки металлов
Медь (Cu)
Простые кристаллические решетки:
1 – простая кубическая решетка;
2 – гранецентрированная кубическая решетка;
3 – объемноцентрированная кубическая решетка;
4 – гексагональная решетка
Цинк (Zn)
20.
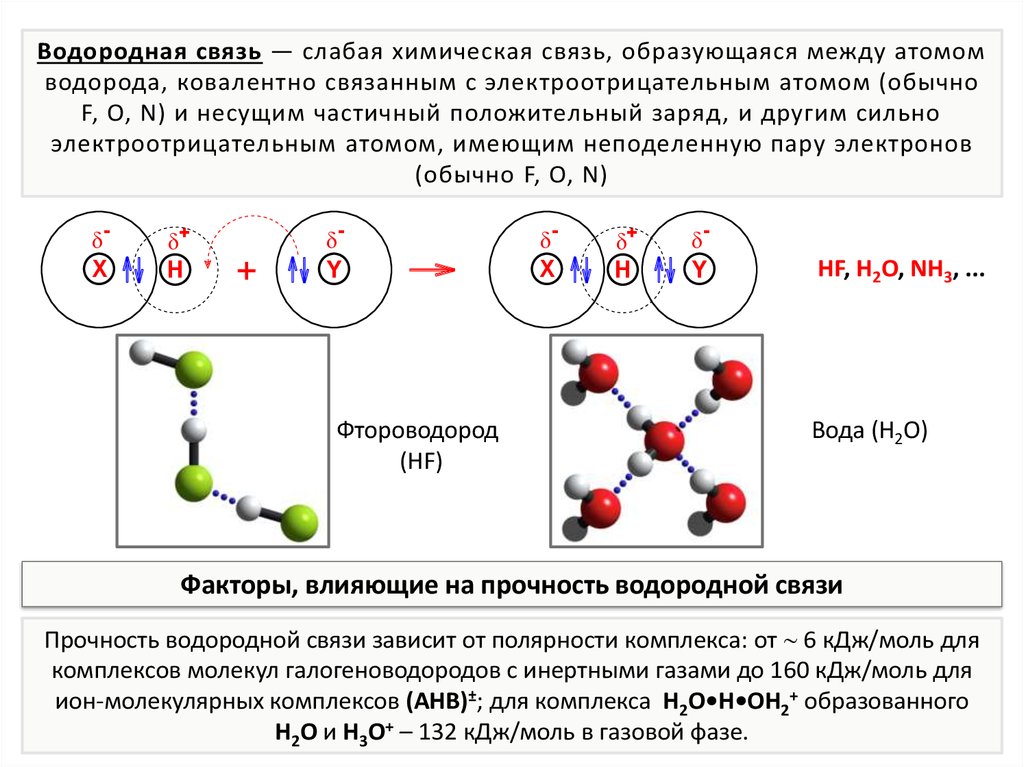
Водородная связь — слабая химическая связь, образующаяся между атомомводорода, ковалентно связанным с электроотрицательным атомом (обычно
F, O, N) и несущим частичный положительный заряд, и другим сильно
электроотрицательным атомом, имеющим неподеленную пару электронов
(обычно F, O, N)
X
+
H
+
Y
Фтороводород
(HF)
X
+
H
Y
HF, H2O, NH3, ...
Вода (H2O)
Факторы, влияющие на прочность водородной связи
Прочность водородной связи зависит от полярности комплекса: от 6 кДж/моль для
комплексов молекул галогеноводородов с инертными газами до 160 кДж/моль для
ион-молекулярных комплексов (AHB)±; для комплекса H2O•H•OH2+ образованного
H2O и H3O+ – 132 кДж/моль в газовой фазе.
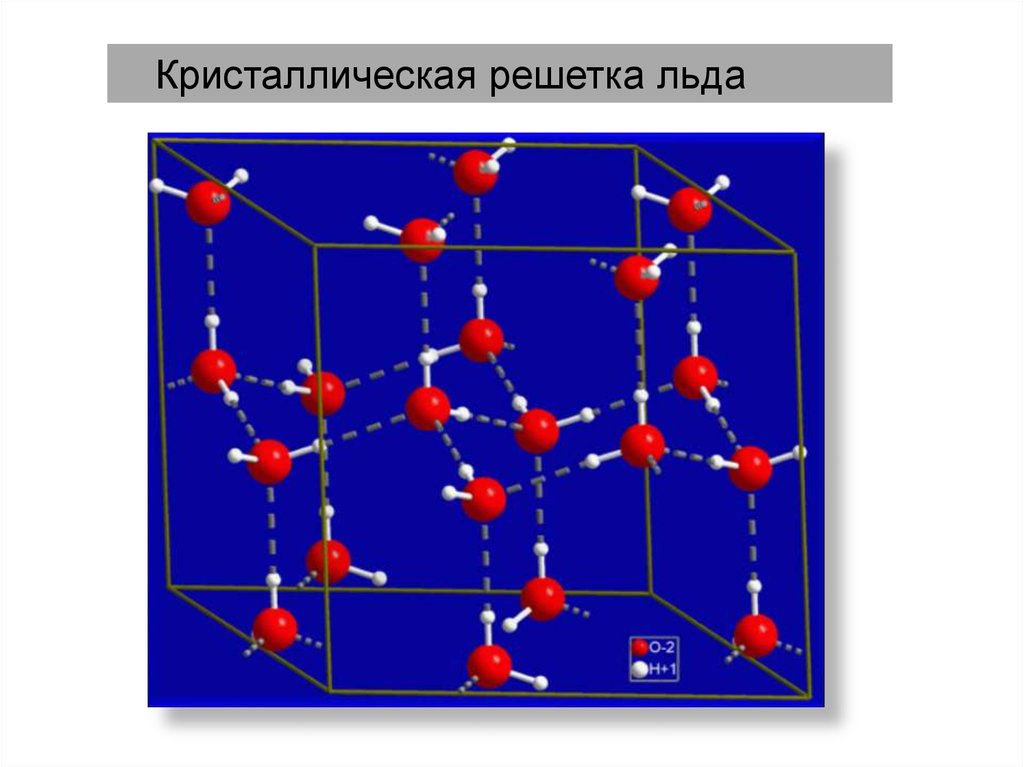
21.
Кристаллическая решетка льда22. Квантомеханические теории связи
Математическая сущность теории состоит в построении молекулярныхорбиталей на основе сложения или вычитания орбиталей атомов,
образующих молекулу.
Основной смысл метода МО ЛКАО можно свести к следующим положениям:
Электроны в молекуле распределены по МО, также как в атоме, по АО.
Число МО равно общему числу АО, которые участвуют в образовании связей.
Часть МО образуется сложением АО. Эти орбитали называются
связывающими. Энергия связывающих орбиталей ниже, чем энергия
исходных атомных орбиталей. Электронная плотность связывающей МО
сосредоточена между ядрами.
Другая часть образуется вычитанием. Такие МО имеют энергию выше
энергии исходных АО и называются разрыхляющими. Электронная плотность
в этом случае сосредоточена за ядрами связывающихся атомов.
Например: при сложении двух s-орбиталей образуется две МО – σсв. и *σразр;
трех р-орбиталей одного атома и 3-х р-орбиталей другого атома образуется 6
МО: две σ и четыре π, из которых половина связывающих и половина
разрыхляющих.
23.
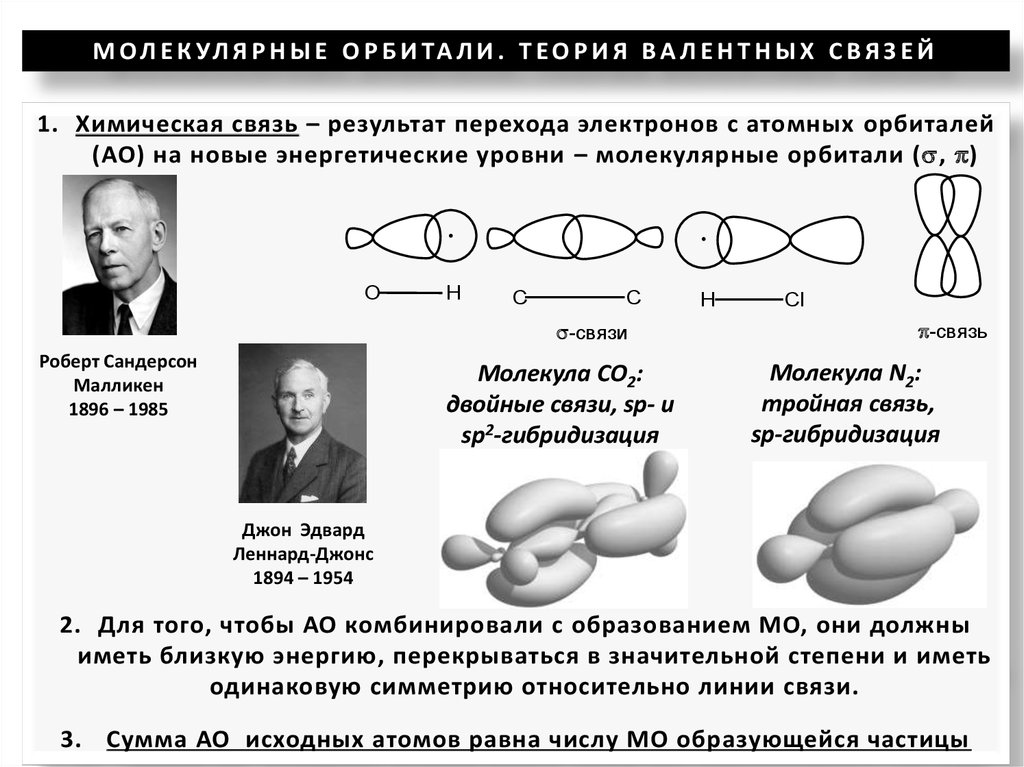
М О Л Е К УЛ Я Р Н Ы Е О Р Б И ТА Л И . Т Е О Р И Я В А Л Е Н Т Н Ы Х С В Я З Е Й1. Химическая связь – результат перехода электронов с атомных орбиталей
(АО) на новые энергетические уровни – молекулярные орбитали ( , )
О
Н
С
С
-связи
Роберт Сандерсон
Малликен
1896 – 1985
Молекула CO2:
двойные связи, sp- и
sp2-гибридизация
Н
Cl
-связь
Молекула N2:
тройная связь,
sp-гибридизация
Джон Эдвард
Леннард-Джонс
1894 – 1954
2. Для того, чтобы АО комбинировали с образованием МО, они должны
иметь близкую энергию, перекрываться в значительной степени и иметь
одинаковую симметрию относительно линии связи.
3. Сумма АО исходных атомов равна числу МО образующейся частицы
24.
3. МО в большинстве случаев многоцентровые, т.к. частицы образованыдвумя и более атомами. В первом приближении МО представляют собой
линейную комбинацию АО (МО ЛКАО).
4. Молекула (и любая иная многоатомная частица) – единое целое,
каждый электрон движется в поле всех ядер. Между атомами действуют
силы притяжения и отталкивания.
Силы притяжения больше сил отталкивания: сложение АО, область
связывания (повышение электронной плотности между атомами, s св , p св ).
Энергия МО ниже энергии каждой АО.
Силы отталкивания преобладают – вычитание АО. Электронная плотность
концентрируется за ядрами, образуется разрыхляющая МО ( s * , p * ).
Энергия МО выше энергии каждой АО.
p*
pz
1s Вычитание
1s
*1s
pz
pz
Вычитание
св
1s
Сложение
AO
Сложение
p
МО
МО
св
pz
25.
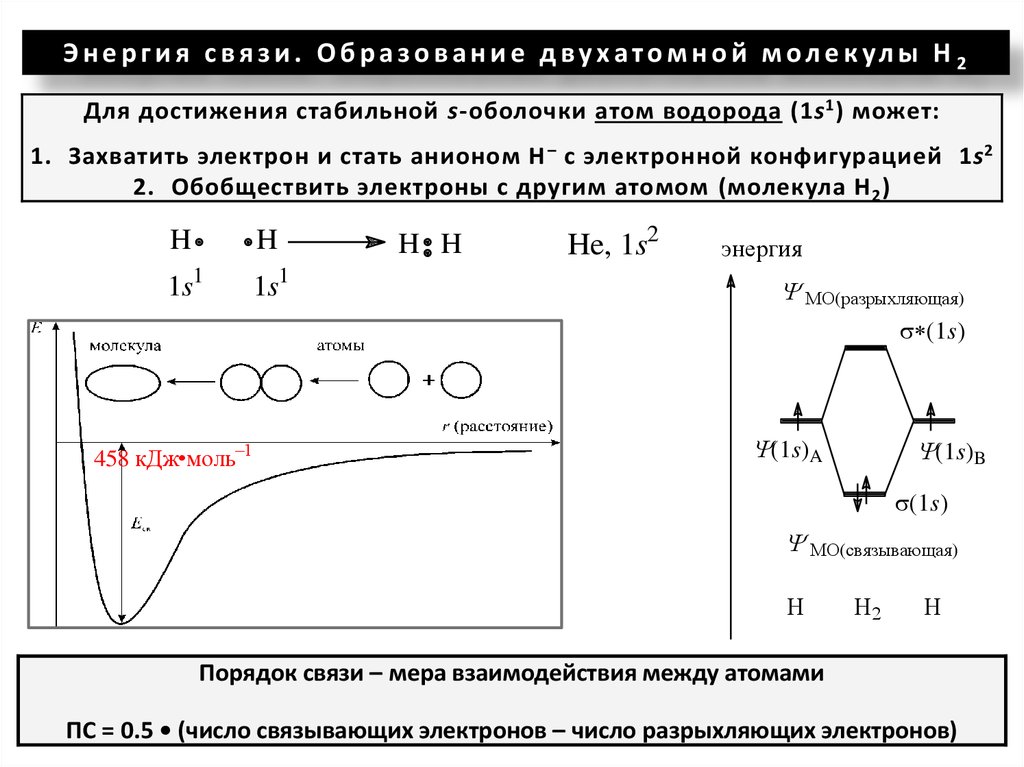
Э н е р г и я с вя з и . О б р а з о в а н и е д ву х ато м н о й м ол е к ул ы Н 2Для достижения стабильной s-оболочки атом водорода (1s 1 ) может:
1. Захватить электрон и стать анионом Н – с электронной конфигурацией 1s 2
2. Обобществить электроны с другим атомом (молекула Н 2 )
H
H
1s1
1s1
H H
He, 1s2
энергия
МО(разрыхляющая)
1s
458 кДж•моль–1
1s)A
1s)B
1s
МО(связывающая)
Н
Н2
Н
Порядок связи – мера взаимодействия между атомами
ПС = 0.5 • (число связывающих электронов – число разрыхляющих электронов)
26.
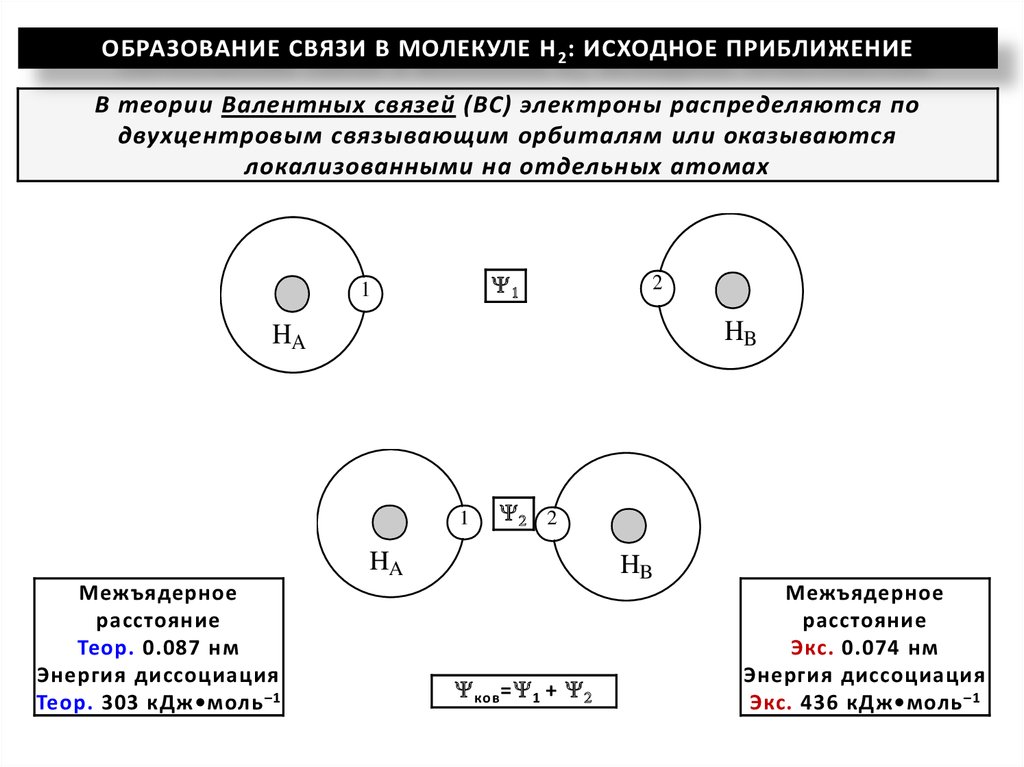
ОБРАЗОВАНИЕ СВЯЗИ В МОЛЕКУЛЕ Н 2 : ИСХОДНОЕ ПРИБЛИЖЕНИЕВ теории Валентных связей (ВС) электроны распределяются по
двухцентровым связывающим орбиталям или оказываются
локализованными на отдельных атомах
1
1
2
HB
HA
1
2 2
HA
Межъядерное
расстояние
Теор. 0.087 нм
Энергия диссоциация
Теор. 303 кДж•моль –1
HB
ков = 1 + 2
Межъядерное
расстояние
Экс. 0.074 нм
Энергия диссоциация
Экс. 436 кДж•моль –1
27.
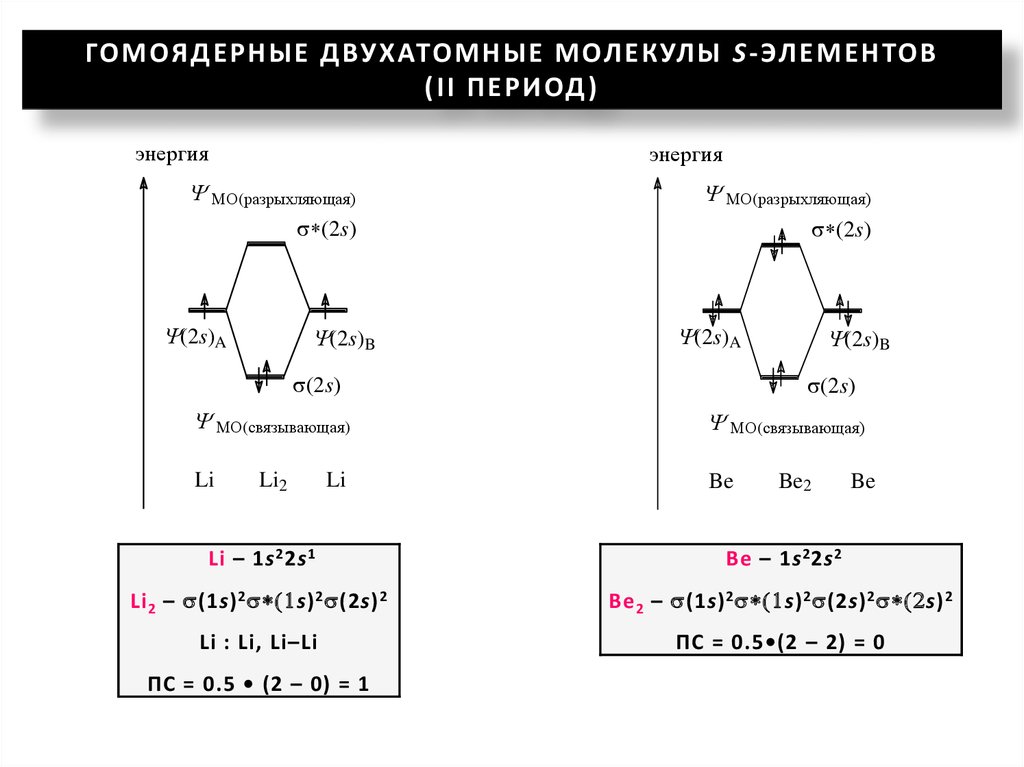
ГО М ОЯ ДЕР НЫЕ ДВУХ АТО МНЫЕ М ОЛ ЕК УЛ Ы S - ЭЛ ЕМ ЕНТОВ( I I П ЕР И ОД )
энергия
энергия
МО(разрыхляющая)
МО(разрыхляющая)
2s
2s
2s)A
2s)B
2s)A
2s
2s)B
2s
МО(связывающая)
МО(связывающая)
Li
Be
Li2
Li
Be2
Be
Li – 1s 2 2s 1
Be – 1s 2 2s 2
Li 2 – (1s) 2 1s) 2 (2s) 2
Be 2 – (1s) 2 1s) 2 (2s) 2 2s) 2
Li : Li, Li–Li
ПС = 0.5•(2 – 2) = 0
ПС = 0.5 • (2 – 0) = 1
28.
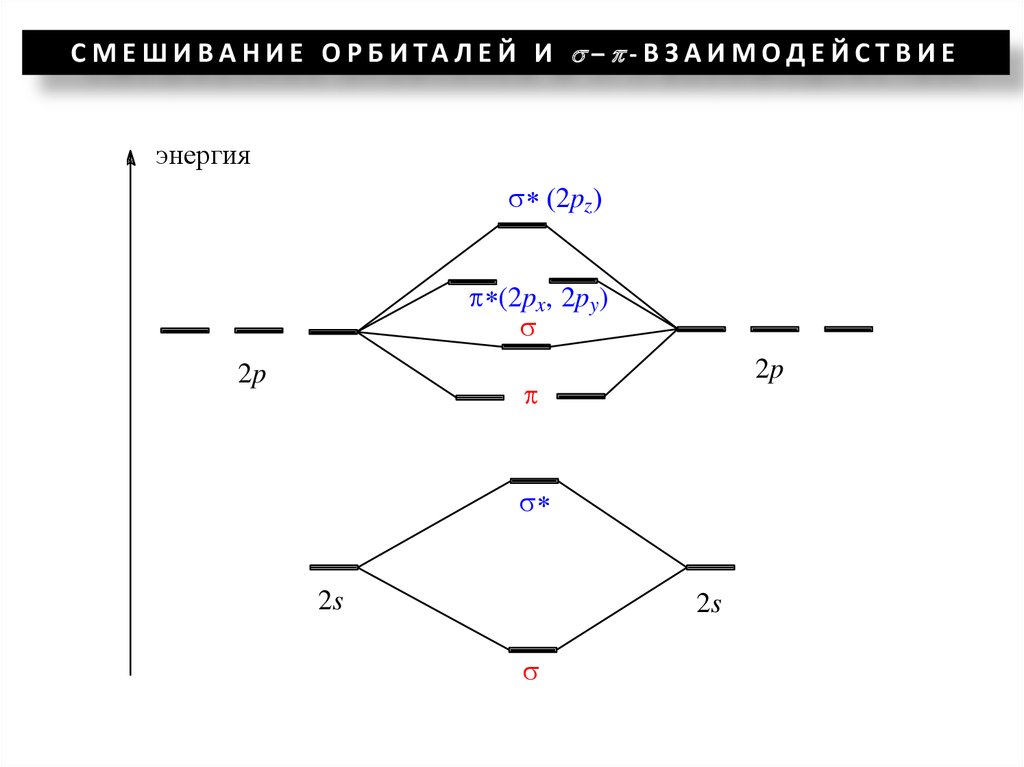
С М Е Ш И В А Н И Е О Р Б И ТА Л Е Й И – - В З А И М О Д Е Й С Т В И Еэнергия
2pz
(2px, 2py)
2p
2p
2s
2s
29.
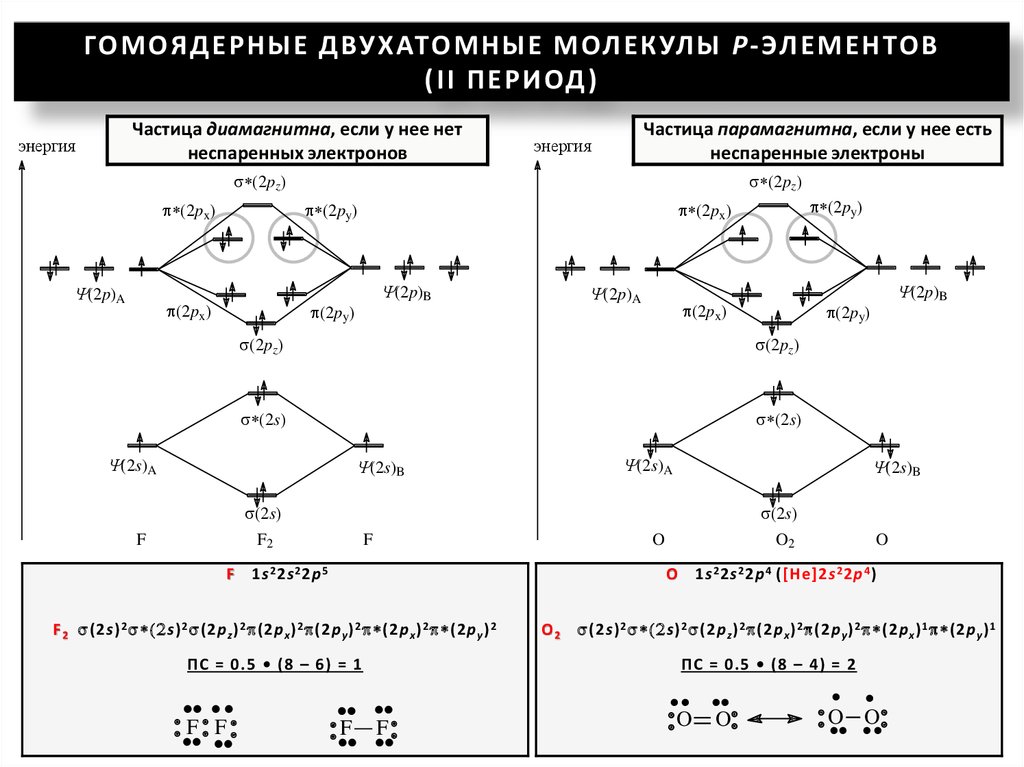
ГО МОЯ ДЕР НЫЕ ДВУХАТО МНЫЕ МОЛЕКУЛЫ Р - ЭЛ ЕМ ЕНТОВ( I I П ЕР И ОД )
Частица диамагнитна, если у нее нет
неспаренных электронов
энергия
Частица парамагнитна, если у нее есть
неспаренные электроны
энергия
2pz
2p)A
2pz
2px
2py
2px
2py
2p)B
2p)A
2px
2pz
2s
2s
2s)B
2s)A
2s)B
2s
2s
F2
F
2p)B
2py
2pz
2s)A
F
2py
2px
F
O
1s 2 2s 2 2p 5
O2
O
1s 2 2s 2 2p 4 ([He]2s 2 2p 4 )
O
F 2 (2s) 2 2s) 2 (2p z ) 2 (2p x ) 2 (2p y ) 2 (2p x ) 2 (2p y ) 2
O 2 (2s) 2 2s) 2 (2p z ) 2 (2p x ) 2 (2p y ) 2 (2p x ) 1 (2p y ) 1
ПС = 0.5 • (8 – 6) = 1
ПС = 0.5 • (8 – 4) = 2
........
F F
.... ....
F
F
.. ..
O
O
..
.. ..
O O
30.
31.
32.
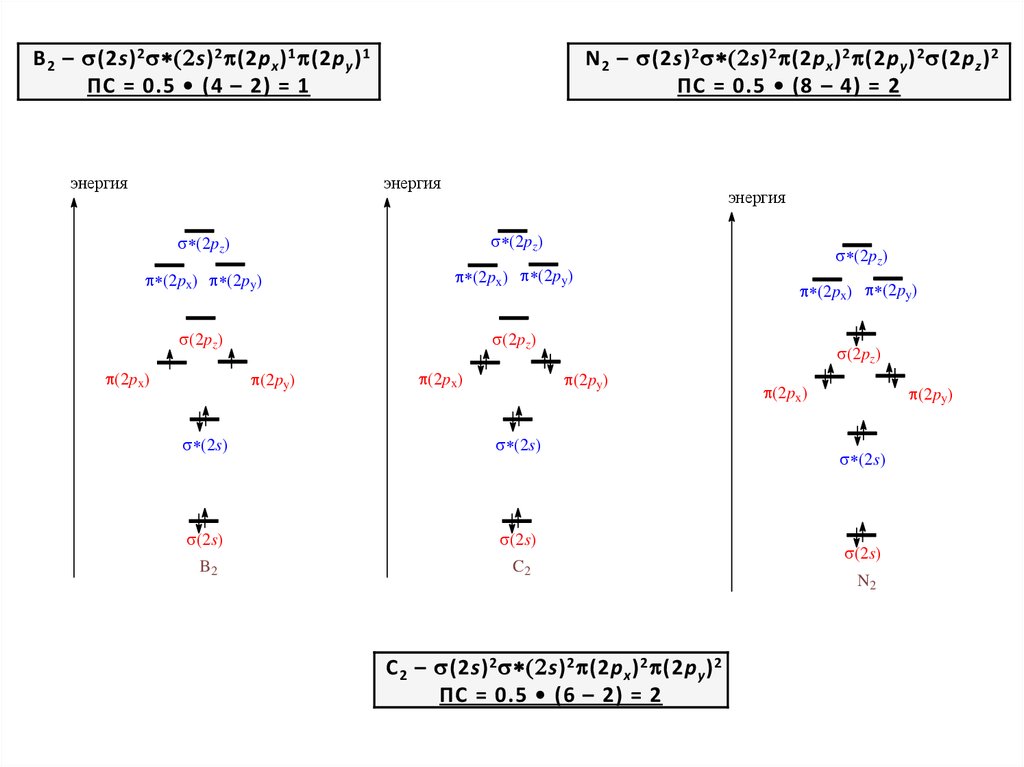
B 2 – (2s) 2 2s) 2 (2p x ) 1 (2p y ) 1ПС = 0.5 • (4 – 2) = 1
энергия
N 2 – (2s) 2 2s) 2 (2p x ) 2 (2p y ) 2 (2p z ) 2
ПС = 0.5 • (8 – 4) = 2
энергия
энергия
2pz
2pz
2px 2py
2px 2py
2pz
2pz
2px
2py
2px
2s
2s
2s
B2
C2
2px 2py
2pz
2py
2s
2pz
C 2 – (2s) 2 2s) 2 (2p x ) 2 (2p y ) 2
ПС = 0.5 • (6 – 2) = 2
2px
2py
2s
2s
N2
33.
К А К И Е С В О Й С Т В А М О Л Е К УЛ Ы Н 2 М О Г У Т Б Ы Т ЬПРЕДСКАЗАНЫ ТЕОРИЕЙ ВАЛЕНТНЫХ СВЯЗЕЙ И
МЕТОДОМ МО
Структура Льюиса показывает, что молекула Н2 имеет одну
одинарную ковалентную связь Н–Н и все валентные
электроны в ней спарены
Теория ВС: связь в молекуле Н2 может быть описана волновой
функцией ( ) с ковалентной и ионной составляющими
Метод МО: связь в молекуле Н2 носит преимущественно
ковалентный характер и осуществляется за счет
локализованной связывающей орбитали. Два валентных
электрона спарены
34.
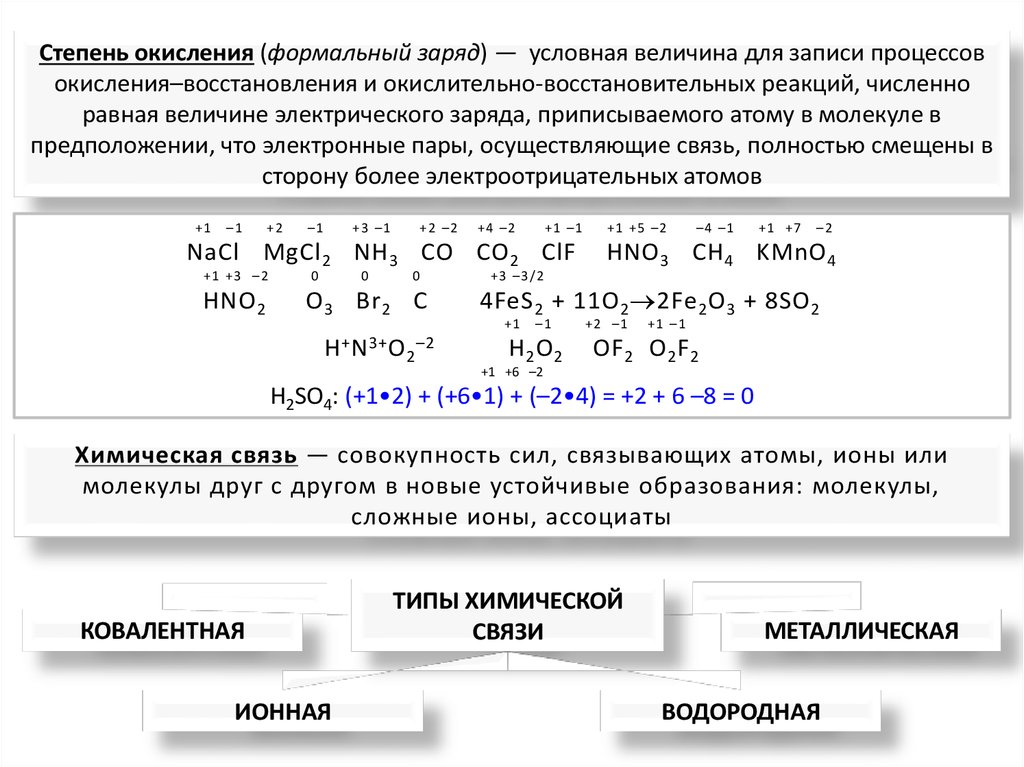
Степень окисления (формальный заряд) — условная величина для записи процессовокисления–восстановления и окислительно-восстановительных реакций, численно
равная величине электрического заряда, приписываемого атому в молекуле в
предположении, что электронные пары, осуществляющие связь, полностью смещены в
сторону более электроотрицательных атомов
+1
–1
+2
–1
+3 –1
+2 –2
+4 –2
+1 –1
NaCl MgCl 2 NH 3 CO CO 2 ClF
+1 +3 –2
HNO 2
0
0
0
O 3 Br 2 C
H + N 3+ O 2 –2
+3 –3/2
+1 +5 –2
–4 –1
+1 +7
–2
HNO 3 CH 4 KMnO 4
4FeS 2 + 11O 2 2Fe 2 O 3 + 8SO 2
+1
–1
Н2О2
+1 +6 –2
+2 –1
+1 –1
OF 2 O 2 F 2
H2SO4: (+1•2) + (+6•1) + (–2•4) = +2 + 6 –8 = 0
Химическая связь — совокупность сил, связывающих атомы, ионы или
молекулы друг с другом в новые устойчивые образования: молекулы,
сложные ионы, ассоциаты
КОВАЛЕНТНАЯ
ИОННАЯ
ТИПЫ ХИМИЧЕСКОЙ
СВЯЗИ
МЕТАЛЛИЧЕСКАЯ
ВОДОРОДНАЯ
35.
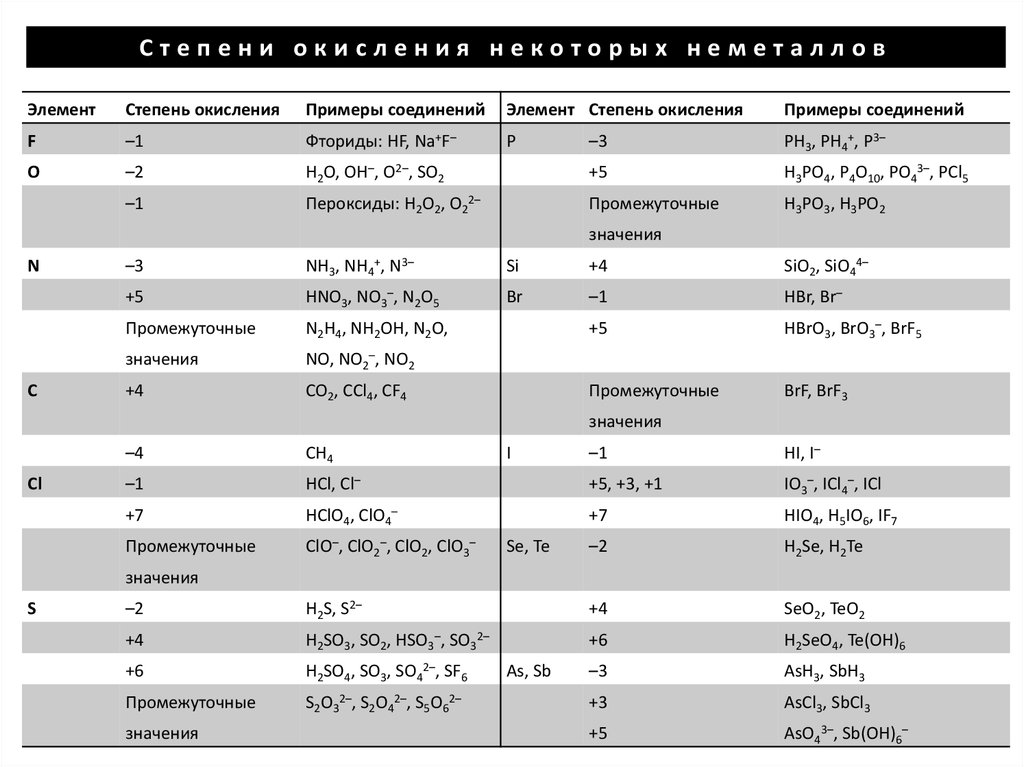
Степени окисления некоторых неметалловЭлемент
Степень окисления
Примеры соединений
Элемент Степень окисления
Примеры соединений
F
–1
Фториды: HF, Na+F–
P
–3
PH3, PH4+, P3–
O
–2
H2O, OH–, O2–, SO2
+5
H3PO4, P4O10, PO43–, PCl5
–1
Пероксиды: H2O2, O22–
Промежуточные
H3PO3, H3PO2
значения
N
C
–3
NH3, NH4+, N3–
Si
+4
SiO2, SiO44–
+5
HNO3, NO3–, N2O5
Br
–1
HBr, Br–
Промежуточные
N2H4, NH2OH, N2O,
+5
HBrO3, BrO3–, BrF5
значения
NO, NO2–, NO2
+4
CO2, CCl4, CF4
Промежуточные
BrF, BrF3
значения
Cl
–1
HI, I–
HCl, Cl–
+5, +3, +1
IO3–, ICl4–, ICl
+7
HClO4, ClO4–
+7
HIO4, H5IO6, IF7
Промежуточные
ClO–, ClO2–, ClO2, ClO3–
–2
H2Se, H2Te
–4
CH4
–1
I
Se, Te
значения
S
–2
H2S, S2–
+4
SeO2, TeO2
+4
H2SO3, SO2, HSO3–, SO32–
+6
H2SeO4, Te(OH)6
+6
H2SO4, SO3, SO42–, SF6
–3
AsH3, SbH3
Промежуточные
S2O32–, S2O42–, S5O62–
+3
AsCl3, SbCl3
+5
AsO43–, Sb(OH)6–
значения
As, Sb

















 Химия
Химия








