Похожие презентации:
Многоэлектронные атомы
1. Многоэлектронные атомы
Неразличимость тождественных частицФермионы и бозоны
Принцип запрета Паули
2. Неразличимость тождественных частиц
В классической механикевсегда можно, хотя бы в принципе, определить
индивидуальную траекторию каждой из многих
одинаковых частиц.
В квантовой механике
траектория «потеряна» с самого начала согласно
соотношениям неопределенностей.
Поэтому одинаковые частицы, которые имеют одинаковые
значения массы, электрического заряда, спина и т.д. и
находятся в общей области существования, оказываются
тождественными и принципиально
неразличимыми.
3.
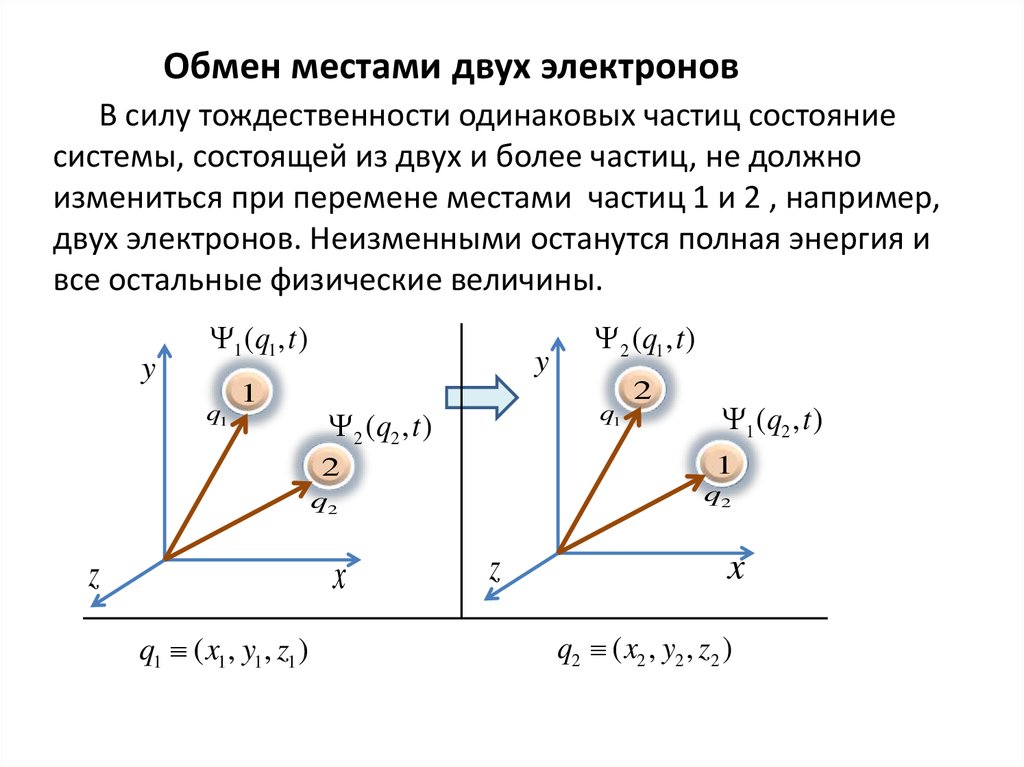
Обмен местами двух электроновВ силу тождественности одинаковых частиц состояние
системы, состоящей из двух и более частиц, не должно
измениться при перемене местами частиц 1 и 2 , например,
двух электронов. Неизменными останутся полная энергия и
все остальные физические величины.
y
1 (q1 , t )
q1
1
y
2 (q2 , t )
q1 ( x1 , y1 , z1 )
q1
2
1 (q2 , t )
2
1
q2
q2
x
z
2 (q1 , t )
z
x
q2 ( x2 , y2 , z2 )
4. Задача на поиск собственных значений оператора перестановки тождественных частиц местами
Введем оператор перестановки частиц местами Pˆ :Pˆ (q1 , q2 , t ) p (q2 , q1 , t )
(1)
Поскольку обе волновые функции в (1) описывают одно и то же
квантовое состояние, то они являются решением уравнения Шредингера
Hˆ i
t
( Pˆ )
ˆ
ˆ
H ( P ) i
t
и могут различаться только постоянным множителем. Тогда уравнение
(1) можно переписать как
ˆ
P
(2)
Подействуем на левую и правую части уравнения (2) оператором
перестановки
ˆ ˆ 2
Pˆ ( Pˆ ) Pˆ ( ) или PP
Так как дважды применяемый оператор перестановки не меняет
волновую функцию , то получаем: 2 , 2 1,
1
5. Симметричные и антисимметричные состояния
Принцип тождественностивсе возможные состояния
системы из одинаковых частиц делятся на два типа:
1. Симметричные состояния,
для которых S - функция системы одинаковых частиц
не меняет знака при перестановке частиц
местами:
S C 1 (q1, t ) 2 (q2 , t ) 1 (q2 , t ) 2 (q1, t )
Частицы, которые описываются симметричными S -функциями,
называются бозе-частицами или бозонами. Системы, состоящие из
таких частиц, подчиняются статистике Бозе-Эйнштейна, разработанной
индийским физиком Ш.Бозе для фотонов и развитой А.Эйнштейном для
идеального газа.
6.
2. Антисимметричные состояния,для которых A - функция меняет знак при перестановке
частиц местами:
A A 1 (q1 , t ) 2 (q2 , t ) 1 (q2 , t ) 2 (q1, t )
Частицы, состояния которых описываются
антисимметричными A - функциями, называются
фермионами, они подчиняются статистике Ферми-Дирака,
развитой итальянским физиком Э.Ферми и английским
физиком П.Дираком.
7.
Бозоны ифермионы
БОЗОНЫ: все частицы, имеющие нулевой и
«целочисленный спин» ( квантовое число s 0,1, 2, ):
фотоны, - мезоны и K - мезоны из семейства
элементарных частиц, участвующих в сильных
взаимодействиях и называемых адронами;
фононы в твердом теле (кванты колебаний
кристаллической решетки), и др.
ФЕРМИОНЫ:
все элементарные частицы, имеющие
«полуцелый спин» (квантовое число s 1 2,3 2, ):
электроны, протоны, нейтроны, нейтрино, …
8. Принцип запрета Паули для фермионов
Если взаимодействием между частицами можнопренебречь, то состояние отдельной частицы в системе
описывается волновой функцией и набором квантовых
чисел, а состояние всей системы – произведением
волновых функций отдельных частиц.
Предположим, что в системе ферми-частиц, где возможен
обмен местами, две частицы находятся в одном и том же
стационарном состоянии , то есть 1 2 . Тогда волновая
функция A 0 , а это означает, что такое состояние
физически не может быть реализовано.
Принцип запрета В.Паули (1925 г. , немецкий физик):
В системе тождественных фермионов не может быть
двух частиц, находящихся в одном и том же квантовом
состоянии с одним и тем же набором кантовых чисел
n, l , m, ms .
9. Периодическая система элементов
2pL-оболочка
Заполненные
состояния
2s
n=2
K-оболочка
1s2 и 2s2.
1s
H
He Li Be
B C
N
O
F
Ne
n=1
Схема заполнения электронами энергетических
состояний атомов от водорода(Z=1) до неона (Z=10).
Заполнение происходит, исходя из требования минимума
полной энергии атома с учетом принципа Паули.
Объясняется периодическая повторяемость химических
свойств атомов периодической системы элементов
Д.И.Менделеева
10.
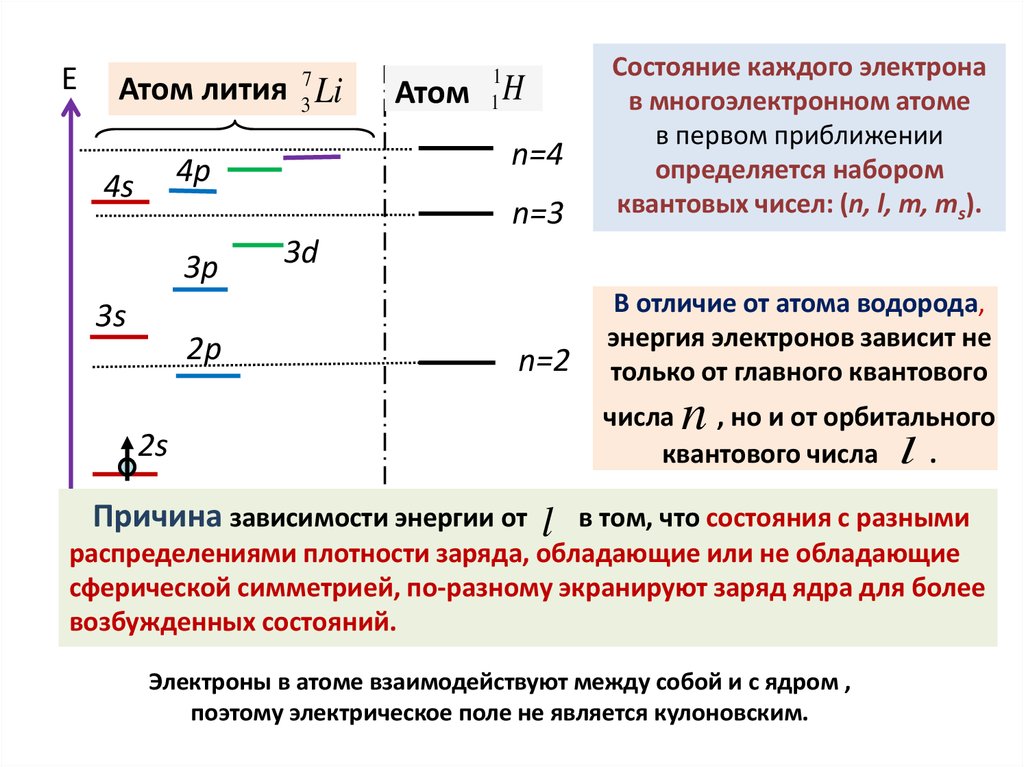
E7
3
Атом лития Li
3p
3s
2p
n=3
n=2
В отличие от атома водорода,
энергия электронов зависит не
только от главного квантового
Атом H
n=4
4p
4s
Состояние каждого электрона
в многоэлектронном атоме
в первом приближении
определяется набором
квантовых чисел: (n, l, m, ms).
1
1
3d
n
числа , но и от орбитального
квантового числа l .
2s
Причина зависимости энергии от
в том, что состояния с разными
распределениями плотности заряда, обладающие или не обладающие
сферической симметрией, по-разному экранируют заряд ядра для более
возбужденных состояний.
l
Электроны в атоме взаимодействуют между собой и с ядром ,
поэтому электрическое поле не является кулоновским.
11. Взаимодействие магнитных моментов в атоме.
В многоэлектронном атоме каждый из N электроновобладает орбитальным L i и спиновым S i моментами
i и s ,i , которые
импульса и магнитными моментами
им соответствуют.
В результате взаимодействия магнитных
моментов отдельных электронов в атоме происходит
их сложение (по правилам квантовой механики) в
результирующий магнитный момент атома
,
которому соответствует полный механический
момент M J (суммарный момент импульса
многоэлектронного атома).
В легких и средних атомах встречается
LS - связь.
12. LS-связь в легких и средних атомах
1. В результате наиболее сильного взаимодействия орбитальных магнитныхмоментов отдельных электронов образуются суммарный магнитный
орбитальный момент L и механический момент
всех электронов в атоме M L
L( L 1) ,
где L - орбитальное квантовое число атома (целое число либо ноль).
2. В результате менее сильного взаимодействия спиновых магнитных
моментов отдельных электронов образуется суммарный магнитный спиновый
момент S и суммарный спин
M
S (S 1) всех электронов в атоме,
S
где S- квантовое число суммарного спина. Если в атоме четное число
электронов, то квантовое число S является целым числом, либо равно нулю.
При нечетном числе электронов квантовое число S принимает полуцелые
значения.
3. Наиболее слабое спин-орбитальное взаимодействие между магнитными
моментами L и S приводит к образованию результирующего магнитного
момента J и механического момента всего атома
M
J ( J 1)
J
Квантовое число Jпринимает значения:
для заданной пары значений L и S .
J L S , L S 1, L S 2, , L S .
13. Обозначение квантовых состояний многоэлектронного атома
Энергия многоэлектронного атома зависит от всех квантовыхчисел n, L, S , J . Квантовое состояние атома символически
записывается в виде:
Символ:
(2 S 1)
" L" J
(" L ")
где под
понимается одна из следующих букв (S,P, …) в
схеме обозначений:
Квантовое число L : 0
1
2
3 ...
Буква : S
P
D
F ...
14.
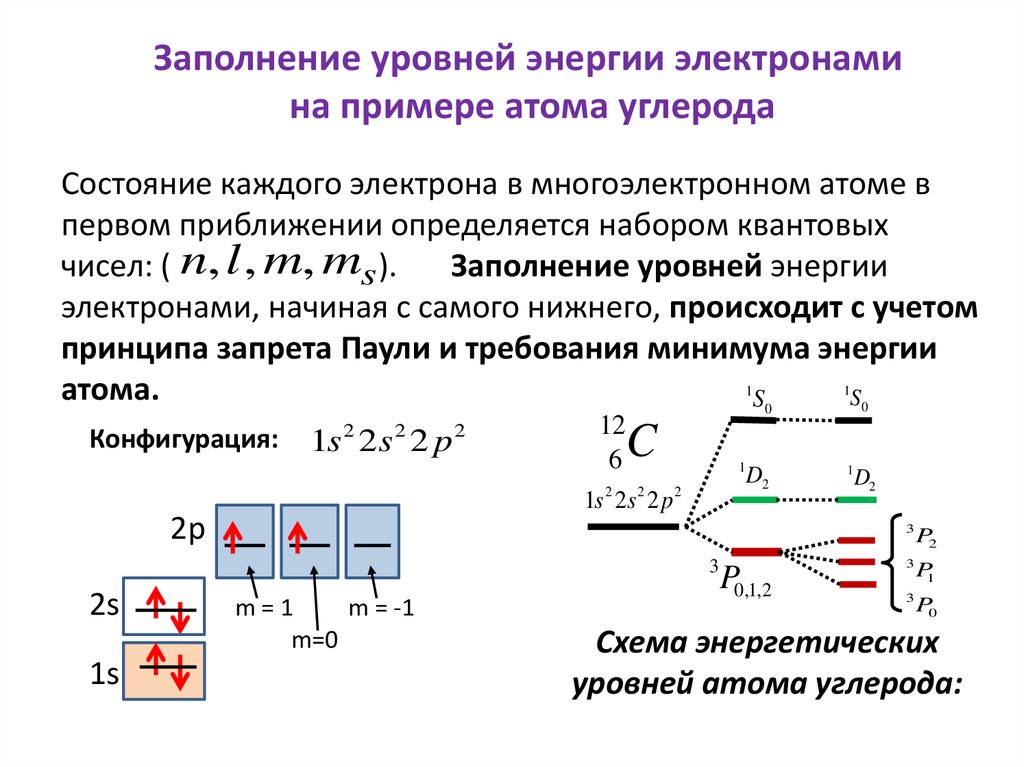
Заполнение уровней энергии электронамина примере атома углерода
Состояние каждого электрона в многоэлектронном атоме в
первом приближении определяется набором квантовых
чисел: ( n, l , m, ms ).
Заполнение уровней энергии
электронами, начиная с самого нижнего, происходит с учетом
принципа запрета Паули и требования минимума энергии
1
атома.
S
S0
1
0
Конфигурация:
1s 2 2s 2 2 p 2
12
6
C
2
2
1s 2s 2 p
1
2
D2
2p
3
2s
1s
m=1
m = -1
m=0
P0,1,2
1
D2
3
P2
3
P1
3
P0
Схема энергетических
уровней атома углерода:
15. Правила отбора при оптических переходах
Правила отбора при оптических переходах атома.Квантовая теория, исходя из закона сохранения моментов импульса,
обосновывает правила отбора для разрешенных оптических переходов
атома из одного квантового состояния в другое.
Переходы с излучением подчиняются следующим правилам
изменения квантовых чисел:
S 0, L 0, 1, J 0, 1, mJ 0, 1
Переход из состояния с ( J нач 0 ) в состояние с ( J кон 0 ) запрещен.
Примеры.
Разрешенные переходы:
Запрещенные
переходы:
2
2
D3 2 2 P1 2 ;
D3 2 S1 2 ;
2
2
2
D5 2 P1 2 ;
2
F7 2 2 D5 2
2
F5 2 P3 2
2
16.
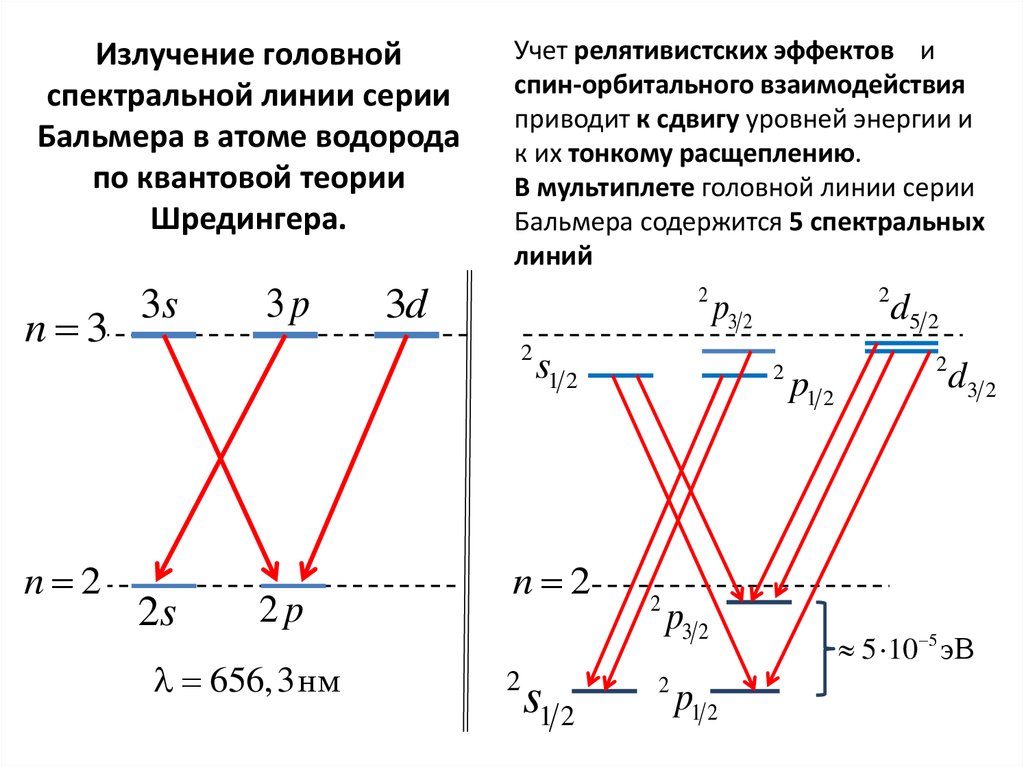
Излучение головнойспектральной линии серии
Бальмера в атоме водорода
по квантовой теории
Шредингера.
n 3
n 2
3s
3p
Учет релятивистских эффектов и
спин-орбитального взаимодействия
приводит к сдвигу уровней энергии и
к их тонкому расщеплению.
В мультиплете головной линии серии
Бальмера содержится 5 спектральных
линий
2
3d
2
2s
2p
656,3нм
s1 2
n 2
2
s1 2
2
p3 2
2
2
p3 2
2
p1 2
p1 2
d5 2
2
d3 2
5 10 5 эВ
17.
,Проекция момента импульса атома на выделенное
направление в пространстве
Согласно пространственному квантованию
результирующего момента импульса M J число
проекций на выделенное направление в пространстве
(ось z) находится по формуле
M J , z mJ
где m J - квантовое число, которое принимает
следующие значения:
mJ J , J 1, , ( J 1), J
18. Магнитный момент многоэлектронного атома
Квантово-механический расчет приводит к следующему соотношениюмежду механическим моментом и результирующим магнитным
моментом всех электронов в атоме:
3 S ( S 1) L( L 1)
e
g
J
g M J ; J g Б J ( J 1) ;
2
2 J ( J 1)
2me
где множитель g называется
физик-теоретик).
L
MJ
L
S
MS
ML
J
g-фактором Ланде (А.Ланде – немецкий
J
e
ML
2me
ML
e
S 2
MS
2me
L( L 1)
MS
S 2 Б S (S 1)
S (S 1)
19. Эффект Зеемана (Расщепление спектральных линий излучения атома в магнитном поле на несколько компонент)
Проекция магнитного моментавыделенное направление
магнитного поля равна
J
на
z внешнего
mJ 3 2
2
Jz g Б mJ
Для заданного значения J существует
2J+1 различных ориентаций магнитного
момента атома по отношению к
направлению внешнего магнитного
поля.
Атом, помещенный во внешнее
магнитное поле B0 , приобретает
дополнительную энергию
U J J B0 Jz B0 g Б mJ B0
Атомный уровень энергии во внешнем
магнитном поле расщепляется на 2J+1
подуровня.
mJ 1 2
E2
P3 2
mJ 1 2
mJ 3 2
0
2
mJ 1 2
E1
S1 2
mJ 1 2
B 0
B 0
0
0
Расщепление уровней энергии атома в
магнитном поле и разрешенные
переходы между ними.
20.
Частоты спектральных линий в эффекте ЗееманаРасщепление спектральных линий излучения паров натрия, находящихся в
магнитном поле, впервые наблюдал нидерландский физик П.Зееман в 1896 г.
Верхний уровень энергии на рисунке во внешнем магнитном поле
расщепляется на 2J 1 4 подуровня с «расстоянием» между соседними
подуровнями EP g p Б B0 , где g p 4 3 .
Нижний уровень в магнитном поле расщепляется на два подуровня с
«расстоянием» между ними ES g s Б B0 , где g s 2 .
Для оптических переходов с верхних подуровней на нижние
частоты спектральных линий излучения можно найти по
формуле
Б B0
( p)
(s)
0 g p mJ g S mJ
Переходы с излучением подчиняются следующим правилам изменения
квантовых чисел:
S 0 ; L 0, 1 ; J 0, 1 ; mJ 0, 1 .
Исключением является переход из состояния с (J=0) в состояние с (J=0),
который запрещен.
















 Физика
Физика








