Похожие презентации:
Основы теплотехники. Техническая термодинамика. (Занятие 1)
1.
ОСНОВЫ ТЕПЛОТЕХНИКИДоцент Копачёв Валерий Феликсович,
Кафедра горной механики, ауд.1331
(лаборантская: ауд.1233)
2. Литература
Теплотехника:Учебное пособие.
(Миняев Ю.Н. и др.)
УГГУ, 2009. – 202 с.
3. Литература
Баскаков А.П. и др.Теплотехника. – М.:
Энергоатомиздат,
1991г. – 224 с.
4. Литература
Лариков Н.Н.Теплотехника.
(Учебник для вузов) –
М.: Стройиздат, 1985г.
– 432 с.
5. Состав курса:
Теплотехника - общеинженерная дисциплина,изучающая методы получения,
преобразования, передачи и использования
теплоты и связанные с этим аппараты и
устройства.
Состоит из трех основных частей:
I. Техническая термодинамика
II. Основы теории теплообмена
III. Теплоэнергетика
Форма отчетности: экзамен
6. Задачи изучения курса:
Изучить методы и способы:1) Получения
2) Преобразования
3) Передачи
4) Использования теплоты и связанные с этим
аппараты и устройства.
7. Раздел 1
ТЕХНИЧЕСКАЯТЕРМОДИНАМИКА
8. Основные понятия и определения
Термодинамика – наука, изучающая законыпревращения энергии в различных процессах,
сопровождаемых поглощением или
выделением теплоты.
химическая
техническая
ТД
космоса
биологических систем
9. Основные понятия и определения
Техническая ТД – наука, которая изучаеттепловые процессы, протекающие в тепловых
двигателях и установках:
а) устанавливает закономерности взаимного
преобразования теплоты и работы, для чего
изучает свойства газов и паров (рабочих тел) и
процессы изменения их состояния,
б) устанавливает взаимосвязь между
тепловыми и механическими процессами,
протекающими в тепловых двигателях и
установках.
10. Основные понятия и определения
В термодинамике используетсяфеноменологический метод изучения
равновесных физических систем.
База термодинамики –
три основных закона!!!
11. Основные понятия и определения
ВСЕЛЕННАЯМЕТОДЫ
ТЕРМОДИНАМИКИ
МОЛЕКУЛЫ
12. Основные понятия и определения
Термодинамическая система – совокупностьматериальных тел, находящихся в
энергетическом взаимодействии между собой
и окружающей средой.
Изолированная ТС – система, которая не может
обмениваться энергией с окружающей средой.
Открытая ТС
13. Основные понятия и определения
Источник теплаРабочее тело
Холодильник
Термодинамическая система
14. Основные понятия и определения
Рабочеетело
вещество,
способное
воспринимать и отдавать теплоту, а также
совершать работу.
Термодинамические параметры состояния физические
величины,
характеризующие
состояние рабочего тела.
давление (p)
температура (T)
удельный объем (v)
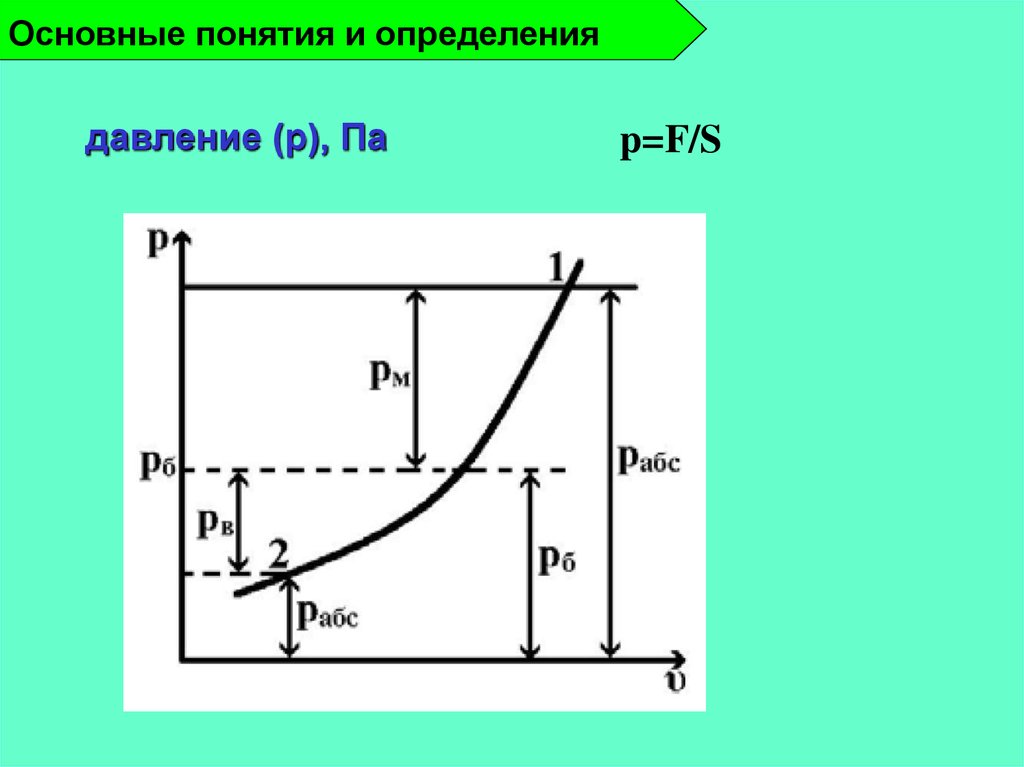
15. Основные понятия и определения
давление (p), Паp=F/S
16. Основные понятия и определения
В соответствии с молекулярно-кинетическойтеорией:
2 mc
p n
3
2
2
17. Основные понятия и определения
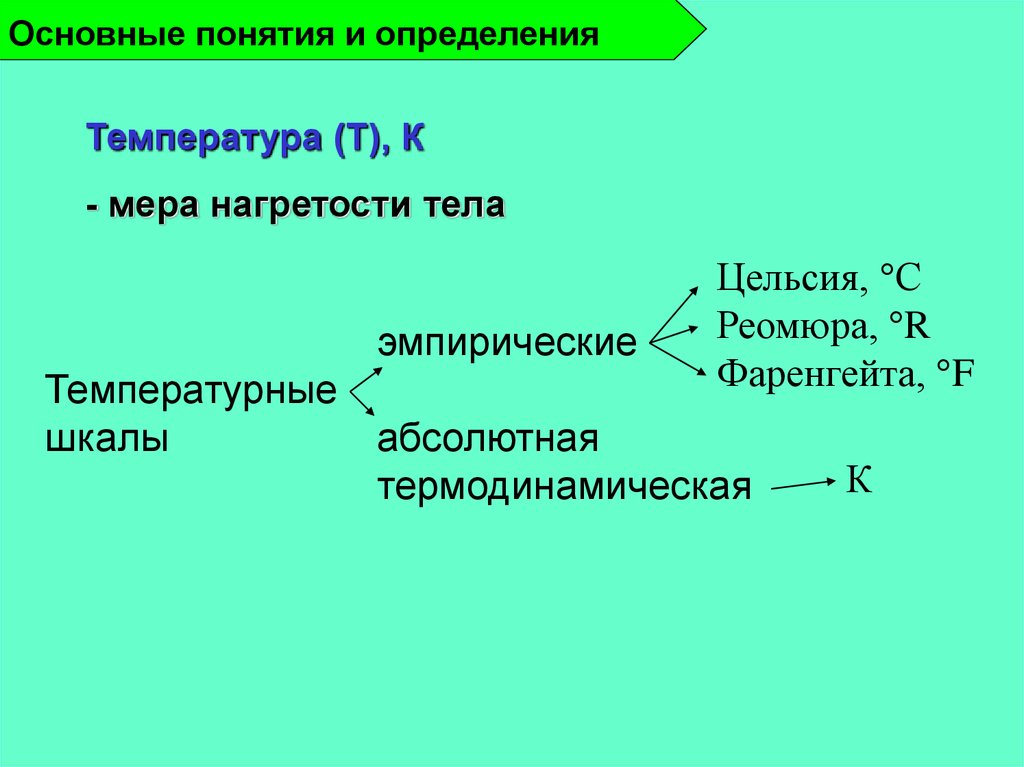
Температура (Т), К- мера нагретости тела
эмпирические
Цельсия, С
Реомюра, R
Фаренгейта, F
Температурные
абсолютная
шкалы
термодинамическая
К
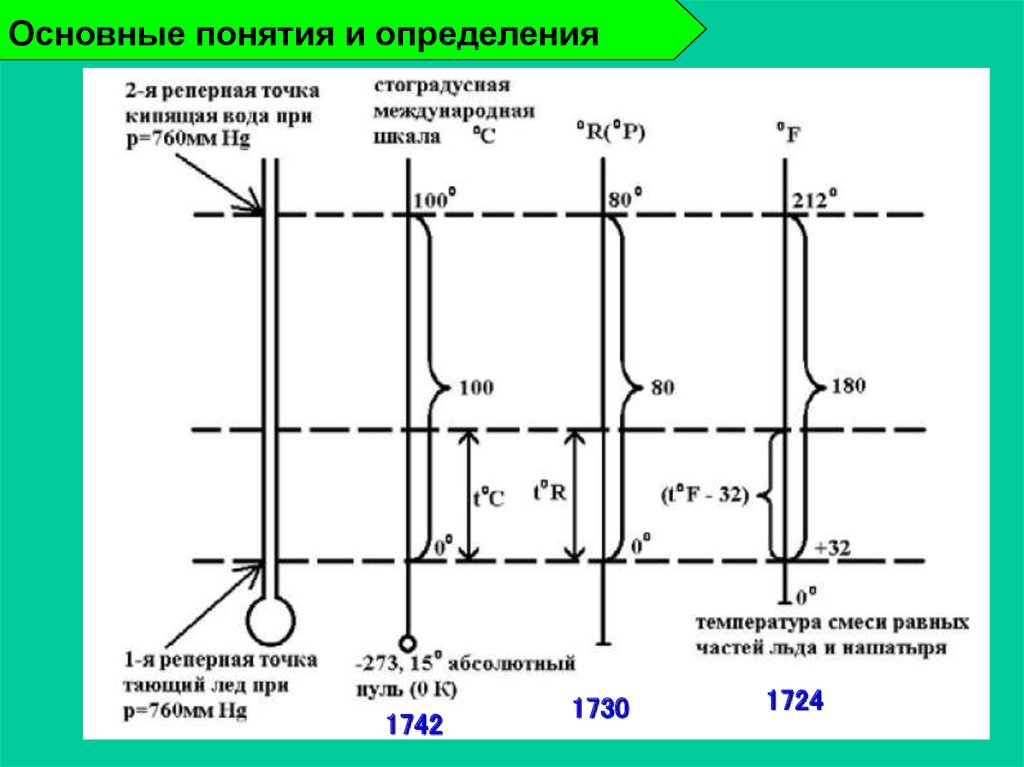
18. Основные понятия и определения
17421730
1724
19.
Температура и движение молекул20. Основные понятия и определения
В соответствии с молекулярно-кинетическойтеорией:
2 mW
T
3K
2
2
K 1,38 10 23
mW 2
2
Дж/К – постоянная Больцмана;
- кинетическая энергия молекул.
21. Основные понятия и определения
Удельный объем (v) – величина обратнаяплотности: м3/кг.
v = V/m
v = 1/ρ
22. Основные понятия и определения
Равновесное состояние системы –все ТД параметры постоянны во времени и
одинаковы во всех точках системы.
23. Основные понятия и определения
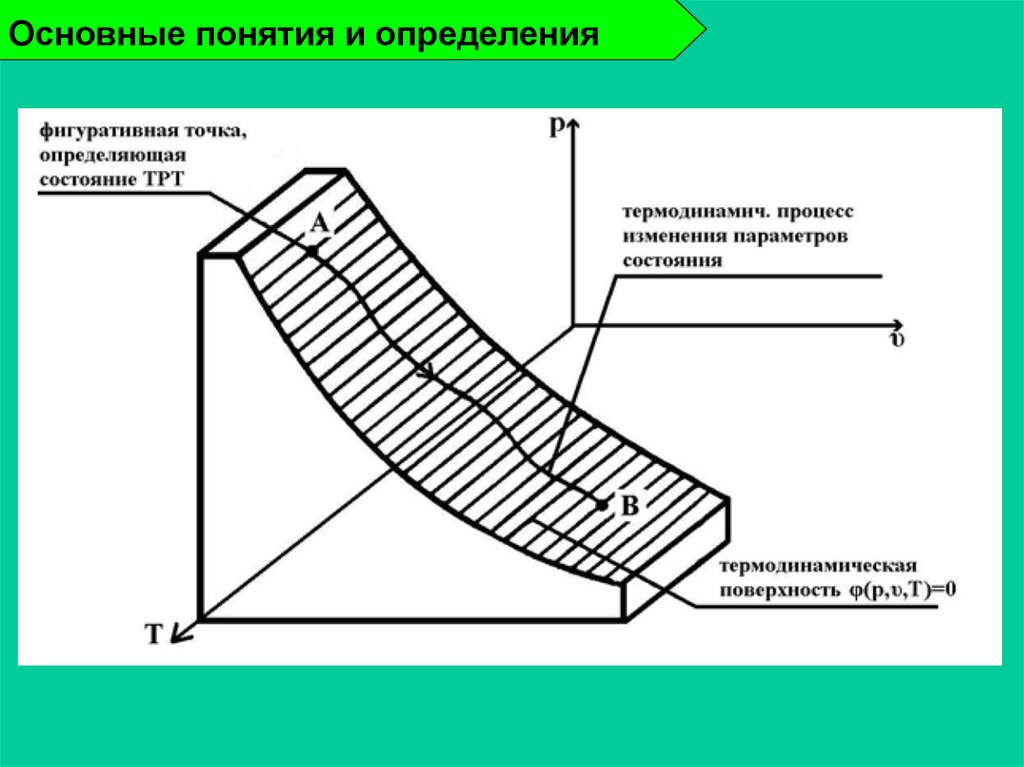
24. Основные понятия и определения
Термодинамический процесс - изменениесостояния термодинамической системы во
времени.
Равновесный процесс - процесс, в котором
все параметры системы при его протекании
меняются достаточно медленно по сравнению
с процессом релаксации.
Релаксация – процесс самопроизвольного
возвращения системы в состояние равновесия
с окружающей средой.
25. Основные понятия и определения
Идеальный газ – газ, в котором:1) нет сил взаимного притяжения между
молекулами;
2) их объем равен нулю.
26. Уравнение состояния
- функциональная связь между параметрамисостояния для равновесной термодинамической
системы.
pv RT
pV RT
Уравнение
Клапейрона
Уравнение Менделеева
27. Уравнение состояния
Закон Авогадро:в равных объёмах различных газов при
одинаковых температурах и давлениях
содержится одинаковое число молекул.
Число молекул в одном моле называют числом
Авогадро
N
23
NА
6.022 10
v
28. Уравнение состояния
Универсальная газовая постояннаяR R
Для н.у.
pн=760 мм.рт.ст.=0,1013 МПа,
V =22,4 м3/кмоль,
Тн=273 К
pV
T
0.1013 10 22.4
R
8314
273
6
Дж/кмоль К
(8,314 кДж/кмоль К)
29. Уравнение состояния
Удельная газовая постоянная R любого газа:(Дж/кг К )
R
RO2
8314
O
2
R
8314
8314
260
32
Дж/кг К
30. Применение уравнения состояния
Задача.Компрессор всасывает в 1 мин 3 м3
воздуха при t=15° C и давлении 0,1 МПа и
нагнетает его в резервуар объемом 8,5 м3. За
какое время компрессор наполнит резервуар
до давления 2 МПа, если температура воздуха в
резервуаре
47°
С.
Перед
наполнением
резервуар был соединен с атмосферой.
Имeем: p1=0,1 МПа; Т1=288 К; V1=8,5 м3; p2=2
МПа; Т2=320 К; V3=3 м3;
31. Применение уравнения состояния
pV mRTРешение:
m2 m1
х
m3
piVi
mi
RTi
p2V1 p1V1
p2 p1
RT2 RT1 V1 T2 T1
x
p1V3
p1
V3
T1
RT1
Ответ: 48 мин.



























 Физика
Физика








