Похожие презентации:
Эксергия. Термодинамические процессы в газах, парах и их смесях. (Занятие 4)
1. Часть 1
Техническаятермодинамика
Занятие 4
Эксергия. Термодинамические процессы в газах, парах и
их смесях. Термодинамические процессы идеальных
газов.
2. ЭКСЕРГИЯ
(греч. ex-высокая степень; ergon-работа)- максимальная работа, которую может
совершить ТД система при переходе из
данного состояния в состояние
термодинамического равновесия с
окружающей средой при отсутствии иных,
кроме окружающей среды источников
теплоты (РАБОТОСПОСОБНОСТЬ)
3.
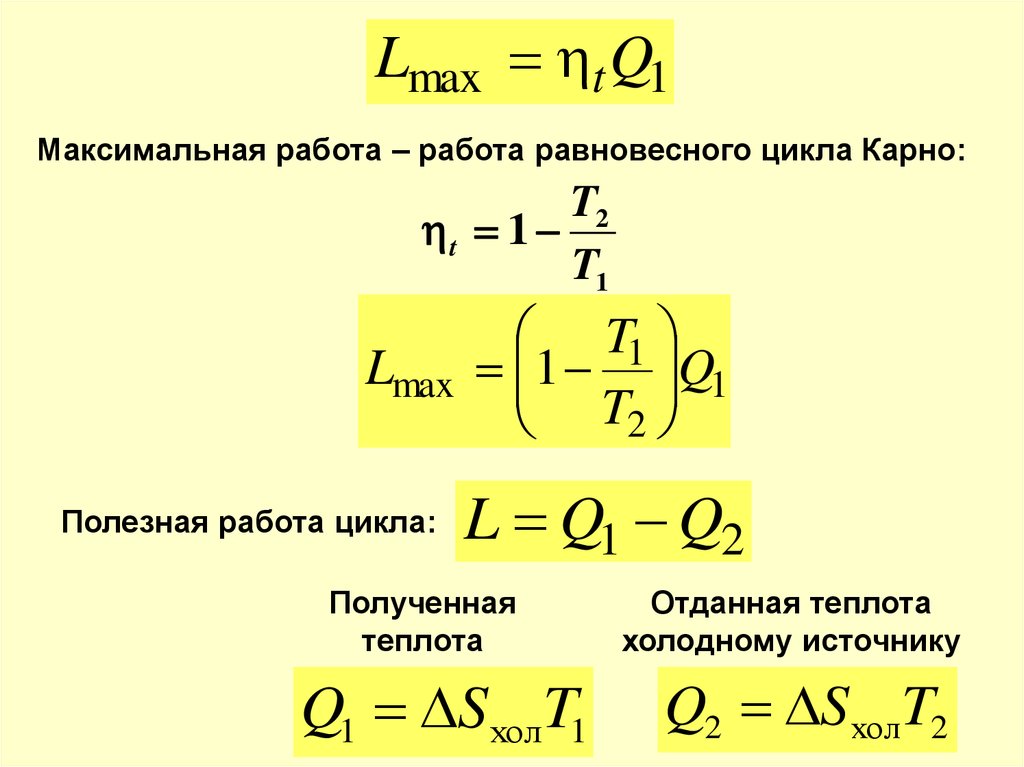
Lmax t Q1Максимальная работа – работа равновесного цикла Карно:
T2
t 1
T1
Lmax
Полезная работа цикла:
T1
1 Q1
T2
L Q1 Q2
Полученная
теплота
Q1 S холT1
Отданная теплота
холодному источнику
Q2 S холT2
4.
При равновесности:S хол Sгор
Lmax Q1 SгорT1
Но при неравновесном процессе!!!
Потеря
эксергии
L Lmax L
Q1 SгорT1 Q1 S хол T1
T1 S хол Sгор
5.
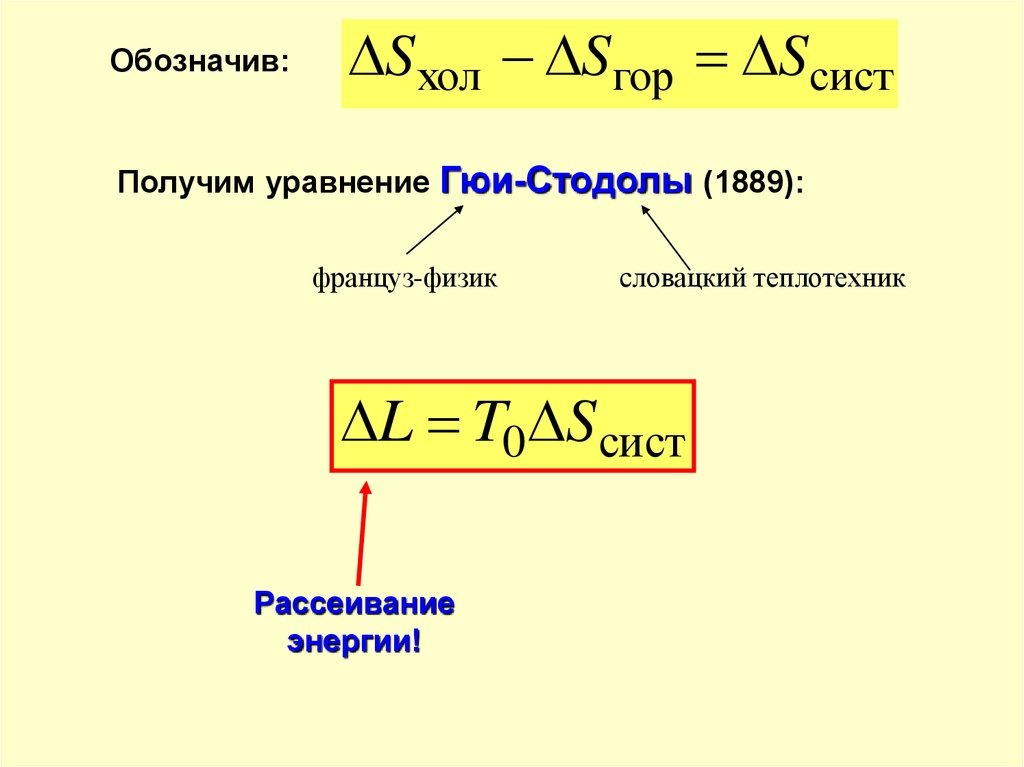
Обозначив:S хол Sгор Sсист
Получим уравнение Гюи-Стодолы (1889):
француз-физик
словацкий теплотехник
L T0 Sсист
Рассеивание
энергии!
6. Термодинамические процессы
обратимыенеобратимые
Процессы, после совершения которых в прямом,
а потом в обратном направлении вся система
тел, принимающих участие в процессе,
возвращается в свое первоначальное
состояние…
7.
обратимостьp
2
1
v
l1 2 l2 1
Линии процессов подчиняются одному уравнению!
8. Термодинамические процессы
равновесныенеравновесные
Равновесный процесс - процесс, в котором
все параметры системы при его протекании
меняются достаточно медленно по сравнению
с процессом релаксации.
9. Термодинамические процессы
Введение понятия обратимыхравновесных процессов
упрощает расчеты и дает возможность
получить приближенные результаты.
10. Основные термодинамические процессы
Изохорный (v=const)Изобарный (p=const)
Изотермический (T=const)
Адиабатный (S=const)
Политропный (n=const)
(Греч.)
«изос» - равный
«терме» - теплота
«адиабатос» непроницаемый
«поли» - много
«тропос» - путь
11. План исследования термодинамических процессов
1) Закономерность изменения состояниягаза (уравнение процесса, графическое
отображение)
2) q
3) u
4) l
5) Запись 1 закона ТД для процесса
6) i
7) s
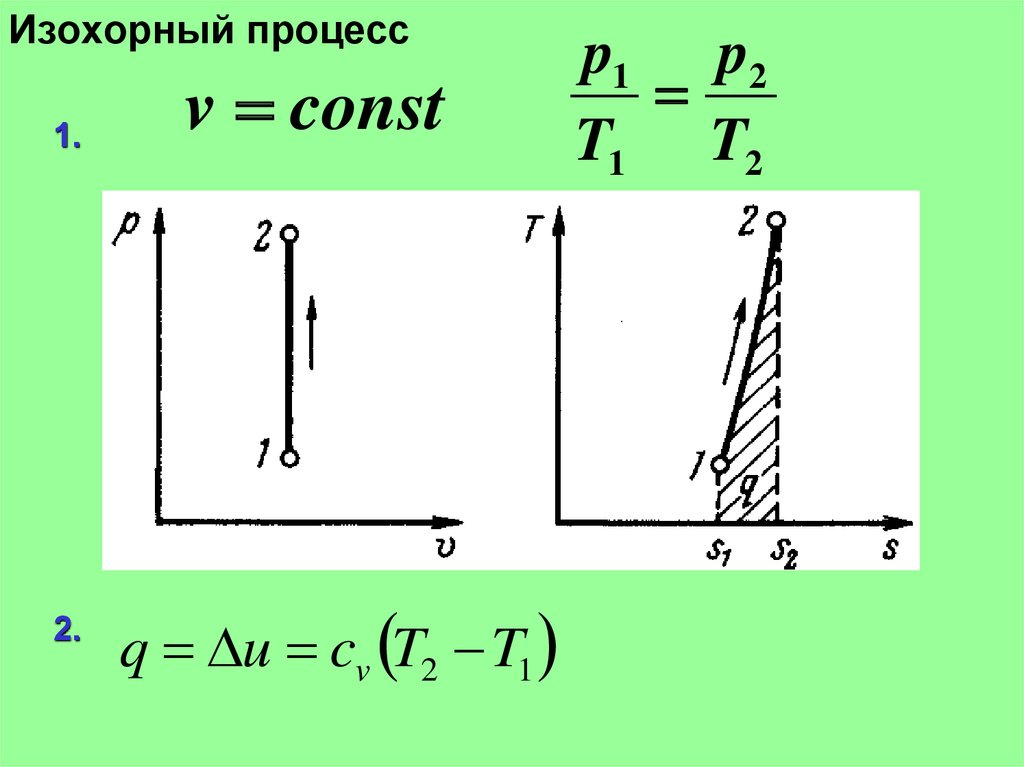
12. Изохорный процесс
1.2.
v const
q u cv T2 T1
p1 p2
T1 T2
13. Изохорный процесс
3.u cv T2 T1
v2
4.
l pdv 0
v1
5.
q u
6
i c p T2 T1
7.
T2
p2
S c p ln cv ln
T1
p1
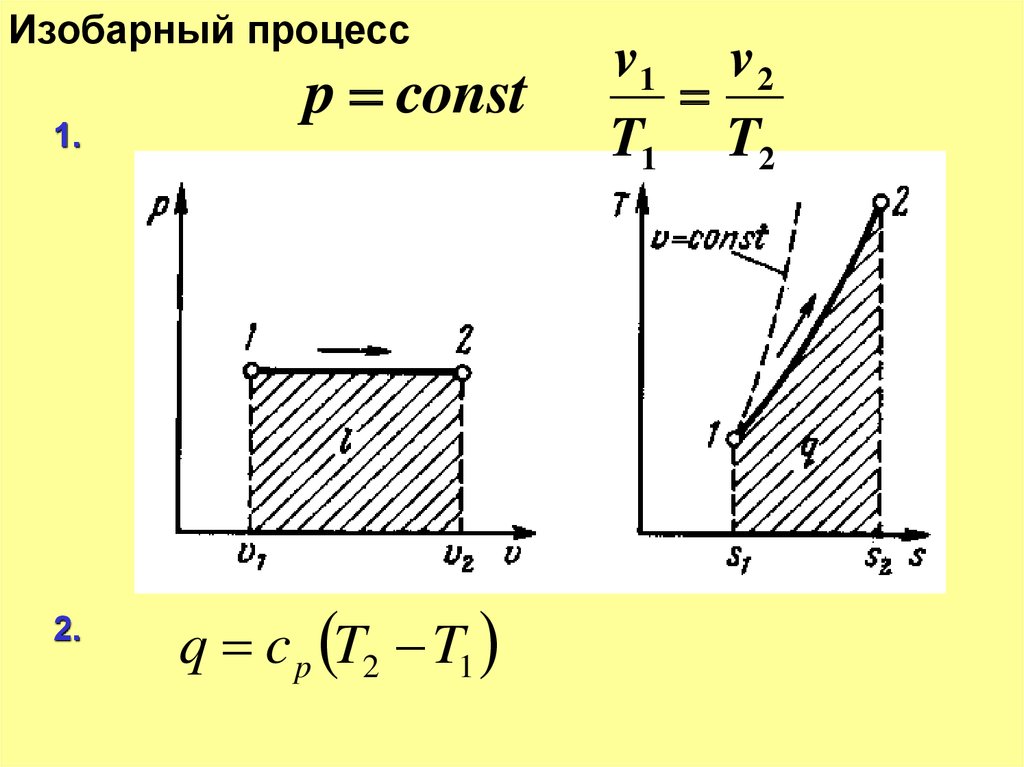
14. Изобарный процесс
1.2.
p const
q c p T2 T1
v1 v 2
T1 T2
15. Изобарный процесс
3.u cv T2 T1
4.
l p v2 v1 R T2 T1
5.
q u l
6
i c p T2 T1
7.
T2
v2
S c p ln cv ln
T1
v1
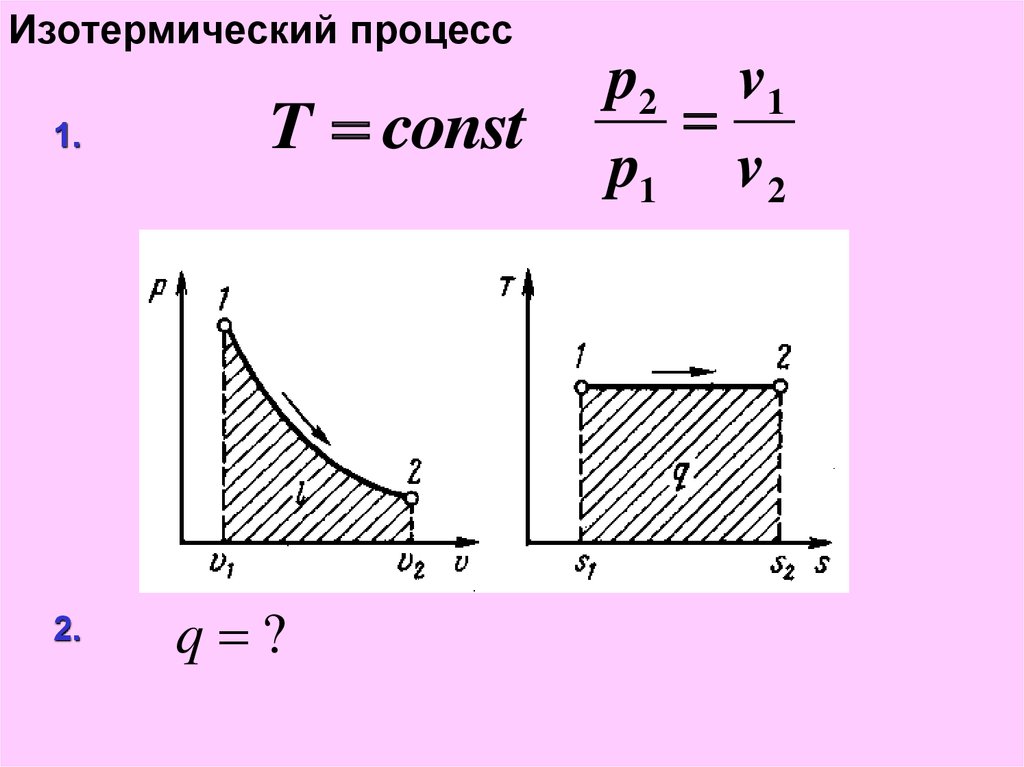
16. Изотермический процесс
1.2.
T const
q ?
p2 v 1
p1 v 2
17. Изотермический процесс
3.4.
u 0
v2
p1
l RT ln RT ln
v1
p2
5.
q l
6
i 0
7.
p1
v2
S R ln
R ln
p2
v1
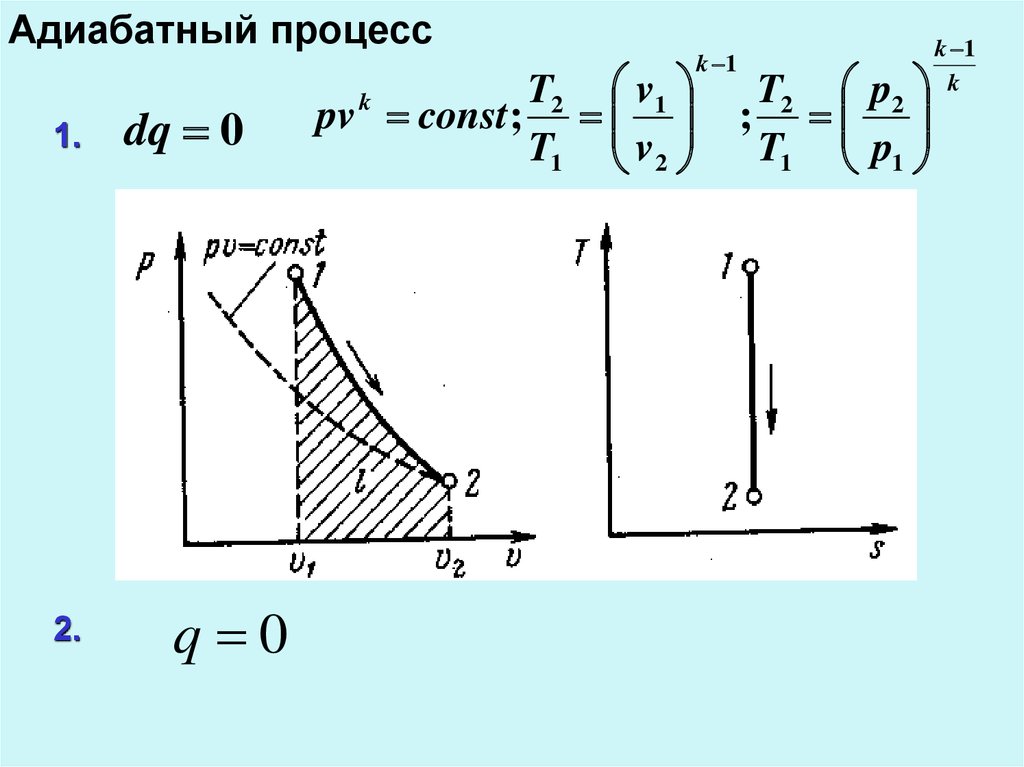
18. Адиабатный процесс
1.2.
dq 0
q 0
T2 v1
pv const ;
T1 v 2
k
k 1
T2 p2
;
T1 p1
k 1
k
19. Адиабатный процесс
3.4.
5.
6
7.
u cv T2 T1
R
1
T1 T2
p1v1 p2v2
l cv T1 T2
k 1
k 1
l u
i c p T2 T1
S 0
20. Политропный процесс
T2 v1pv const ;
T1 v 2
n
n 1
T2 p2
;
T1 p1
n 1
n
21. Политропный процесс
3.u cv T2 T1
4.
1
p1v1 p2v2
l
n 1
5.
q u l
6
7.
i c p T2 T1
T2
S сn ln
T1
q cn T2 T1
22. Обобщающее значение политропного процесса
процессxар-ка
n
c
изохорный
v=c
±
cv
изобарный
p=c
0
cP
изотермический
T=с
1
адиабатный
s=c
k
0
n
n k
cv
n 1
политропный
n=c
















 Физика
Физика








