Похожие презентации:
Масса молекул. Количество вещества
1.
Основные понятиямолекулярно-кинетической теории
– Относительная молекулярная
масса;
– количество вещества;
– постоянная Авогадро;
– молярная масса.
2.
OH
H
Так как массы молекул очень малы, удобно
использовать в расчётах не абсолютные значения
масс, а относительные.
3.
Основные понятиямолекулярно-кинетической теории
Массу частицы, измеренную
в а.е.м. (атомная единица
массы), принято называть
относительной атомной (или
молекулярной) массой.
4.
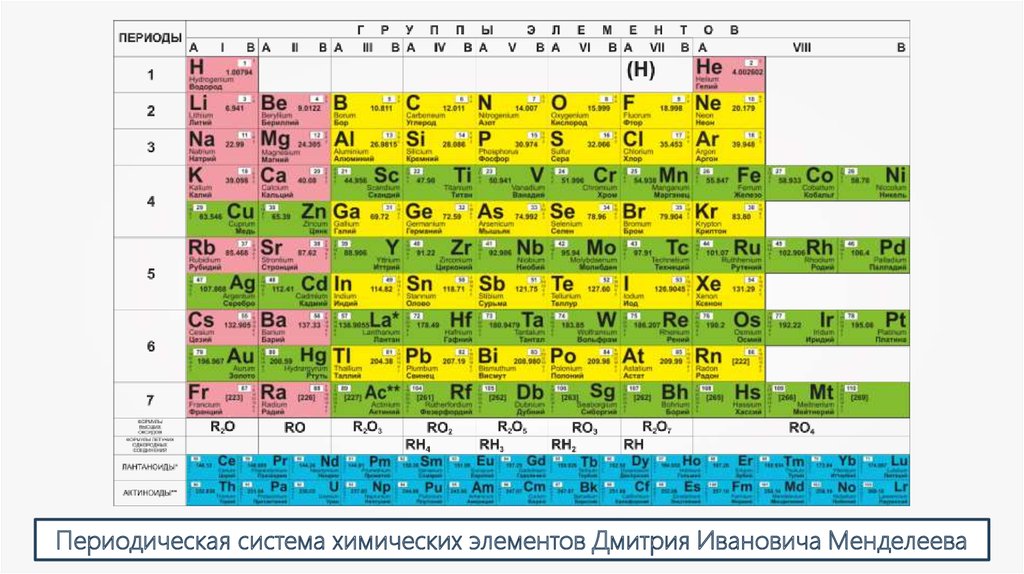
Периодическая система химических элементов Дмитрия Ивановича Менделеева5.
Основные понятиямолекулярно-кинетической теории
Относительная молекулярная
масса молекулы вещества равна
сумме относительных атомных
масс атомов, составляющих
данную молекулу.
6.
7.
Основные понятиямолекулярно-кинетической теории
CO2
Mr(CO2) ≈ 44
12 + 2 · 16 = 44
8.
9.
NA — число Авогадро1 моль равен количеству вещества, в котором
содержится столько же атомов или молекул, сколько
атомов содержится в чистом углероде массой 0,012 кг.
10.
Число Авогадро — числомолекул в одном моле
любого вещества или число
атомов в одном моле
простого вещества.
Амедео Авогадро
1776–1856 гг.
11.
Число АвогадроМасса одного атома углерода:
m0C = 1,995 · 10-23 кг.
12.
Количество вещества равноотношению числа частиц
в теле к числу Авогадро
(числу молекул в 1 моле вещества).
13.
6 · 1023 частиц6 · 1023 частиц
10 г
1г
Если два разных тела состоят из одного и того же числа
частиц, то эти тела содержат одинаковое количество
вещества (при этом массы тел могут не совпадать).
14.
Молярная масса (M) равна массе вещества, взятогов количестве 1 моль.
15.
Периодическая система химических элементов Дмитрия Ивановича Менделеева16.
Молярная масса17.
Молярная масса18.
Молярная массаCO2
Для молекул более сложного состава при расчёте учитывается
число атомов всех химических элементов в молекуле.
19.
Молярная массаm0 — масса одной молекулы вещества.
M = m0 · NA
m — масса любого количества вещества.
m = m0 · N
20.
Молярная массаm = m0 · N
M = m0 · N A
21.
Масса молекулыМасса молекулы (m0) может быть рассчитана на основе
молярной массы (M) и числа Авогадро (NA).
22.
Масса молекулыH
Атом водорода
(H)
m0(H) = 1,67 · 10-27 кг
H
H
Молекула
водорода (H2)
m0(H2) = 2 · 1,67 · 10-27 кг
23.
Размер молекулыа
Для воды диаметр а = 3 · 10–10 м.
24.
Размер молекулыа
Для газов, в которых молекулы разделены друг от друга зазором,
размер молекул оценивается средним расстоянием между ними.

























 Физика
Физика