Похожие презентации:
Расчёт теплового баланса реакционного узла. Лекция 4
1.
Расчёт теплового баланса реакционного узлаЦель расчёта теплового баланса – рассчитать тепловую
нагрузку на каждый аппарат технологической схемы.
Если процесс адиабатический – рассчитывают температуру на
выходе.
При Р = const тепловая нагрузка Q равна разности энтальпий
системы в конечном и исходном состояниях:
Q = Нкон - Нисх
2.
Расчёт удобно проводить по схеме, приведённой на рисунке:Hисх + ΔH1 + ΔH2 + ΔH3 = Hкон
Q = ΔH1 + ΔH2 + ΔH3
Нкон
Tкон
Нисх
Tисх
ΔН1
To
ΔН2
ΔH1 – изменение энтальпии при охлаждении смеси от исходной
температуры Tисх до стандартной T0;
ΔH2 – изменение энтальпии в результате протекания химических реакций
при температуре T0;
ΔH3 – изменение энтальпии при нагревании смеси от исходной
температуры To до конечной температуры Tкон;
3.
Будем считать, что ΔН<0, если тепло выделяется из системы и ΔН>0, еслитепло поглощается системой.
В качестве стандартной температуры удобно использовать температуру
298К (25oC), так как энтальпии образования веществ, необходимые для расчёта
тепловых эффектов химических реакций приводятся в справочниках именно при
этой температуре.
Энтальпию системы можно приближённо рассчитать, как сумму энтальпий
компонентов, входящих в систему. Для упрощения расчёта будем считать, что
фазовый переход и расчёт теплоты фазового перехода осуществляется при
температуре To = 298К.
1. Расчёт ΔH1:
N
H1 Gio (
i 1
To
T
исх
c pi (T )dT
( H iф )To )
N
Gio
i 1
To
T
исх
N
c pi (T )dT Gio ( H iф )To
i 1
........................................................................... Q1 .................. Q2 .......
4.
Если сpi= const, то:N
N
i 1
i 1
H1 Gioc pi (To Tисх ) Gio ( H iф )To
................... Q1 0 ........... Q2 0 .....
где
Q1 – тепло, выделяемое при охлаждении исходной смеси от
температуры Tисх до температуры To;
Q2 – тепло, выделяемое при конденсации компонентов при температуре To.
5.
2. Расчёт ΔH2 (Q3 >0 или <0) – тепло, выделяемое (поглощаемое) при протеканиихимических реакций при температуре To;
3
H 2 Gik ( H ik )To
i 1
где
M – число линейно независимых химических реакций;
ΔHik- тепловой эффект образования или исчезновения единицы массы
(кг) ключевого компонента k в реакции i.
Gik - масса ключевого компонента k, реагирующего в реакции i.
r
1000
H
i
H ik
M k | k |
где
Mk- молекулярная масса компонента k;
vk- стехиометрический коэффициент при компоненте k;
ΔHir - тепловой эффект реакции i.
6.
HirN
N
j 1
i 1
( ij H j )прод ( ij H j )исход
где vij - стехиометрический коэффициент при компоненте j в реакции i для
продуктов и исходных веществ;
Нj – энтальпия образования компонента j.
3. Расчёт ΔH3:
N
Tкон
H 3 Gi ( c pi (T )dT
i 1
To
( H iф )To )
N
Gi
i 1
Tкон
T
o
N
c pi (T )dT Gi ( H iф )To
i 1
........................................................................... Q4 .................. Q5 .......
7.
Если сpi= const, то:N
N
i 1
i 1
H 3 Gi c pi (Tкон To ) Gi ( H iф )To
................... Q4 0 ........... Q5 0 .....
где
Q4 – тепло, необходимое для нагревания исходной смеси от температуры
To до температуры Tкон;
Q5 – тепло, необходимое для испарения компонентов при температуре To.
Таким образом, тепловая нагрузка Q реакционного узла будет равна:
Q = Q 1 + Q2 + Q 3 + Q4 + Q5
При необходимости можно учесть также потери тепла в окружающую
среду и на нагрев самого реактора для периодических процессов.
8.
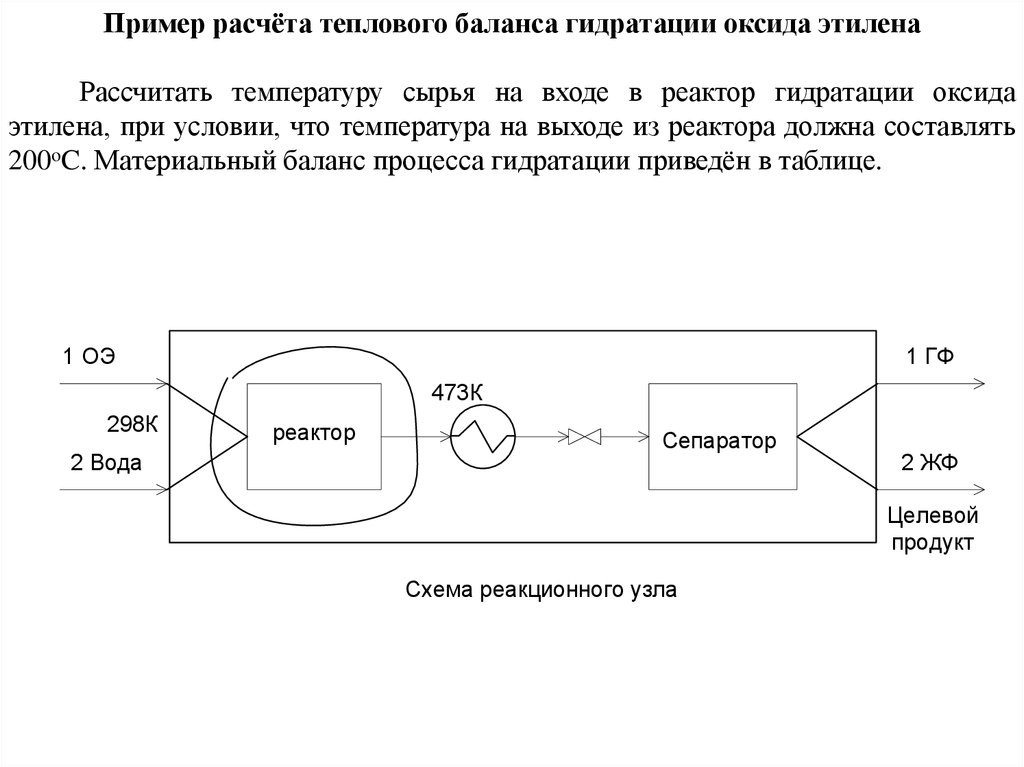
Пример расчёта теплового баланса гидратации оксида этиленаРассчитать температуру сырья на входе в реактор гидратации оксида
этилена, при условии, что температура на выходе из реактора должна составлять
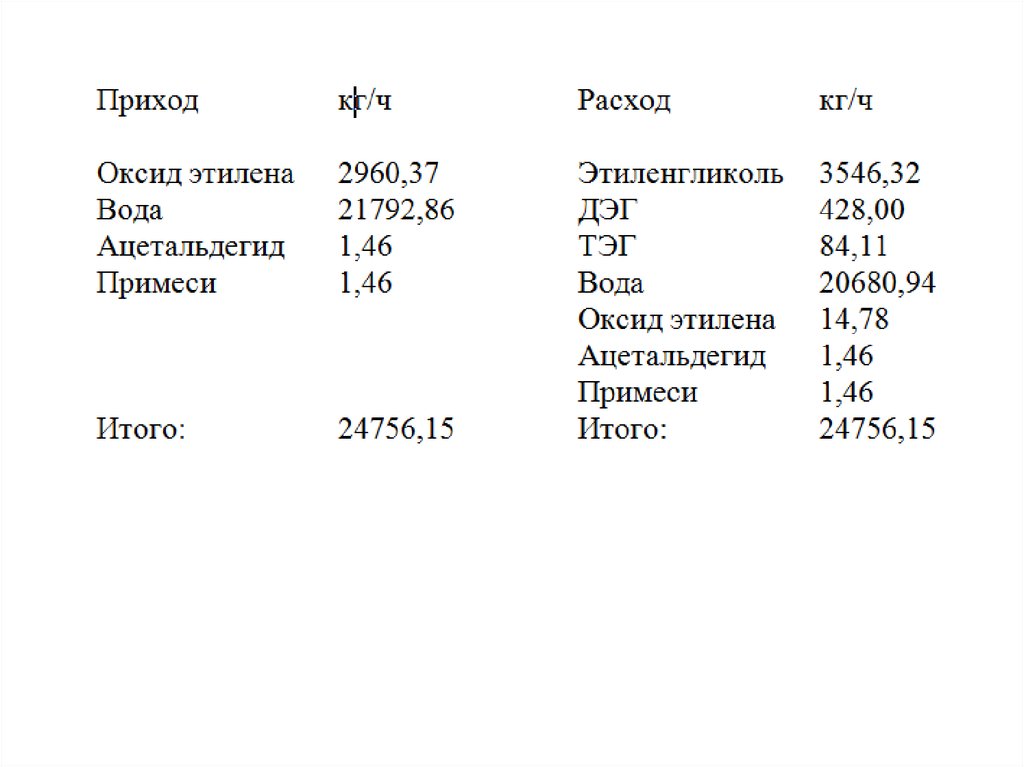
200oC. Материальный баланс процесса гидратации приведён в таблице.
1 ОЭ
1 ГФ
473К
298К
2 Вода
реактор
Сепаратор
2 ЖФ
Целевой
продукт
Схема реакционного узла
9.
10.
Расчётная схемаТкон 473K
ΔН3
Тисх = ?
ΔН1
То 298К
ΔН2
Q H1 H 2 H 3
Q 0 для адиабатического реактора
H1 H 2 H 3
11.
1. Расчёт изменения энтальпии при химическом превращенииH 2
Реакции:
1. ОЭ Н 2О ЭГ
2. 2ОЭ Н 2О ДЭГ
3. 3ОЭ Н 2О ТЭГ
Теплоты образования компонентов, Нi (ккал/моль):
Н 2О 57,80; ОЭ 12,58; ЭГ 93,05; ДЭГ 136,5; ТЭГ 156
12.
Тепловые эффекты химических реакций, (ккал/моль):1. Н r 93,05 ( 57,80) ( 12,58) 22,67
2. Н r 136,5 ( 57,80) 2( 12,58) 53,54
3. Н r 156 ( 57,80) 3( 12,58) 60,46
Тепловые эффекты химических реакций, (ккал/кг продукта):
22,67 1000
1. Н p
365,65 ккал/кг ЭГ
62
53,54 1000
2. Н r
505,09 ккал/кг ДЭГ
106
60, 46 1000
3. Н r
403,06 ккал/кг ДЭГ
150
13.
Изменение энтальпии при химических превращениях ΔН2:M
Н 2 Gi H i
i 1
Н 2 365,65 3546,32 428 505,09 84,11 403,06
1296711,9 216178,52 33901,376 1546791,8 (ккал/час)
2. Расчёт изменения энтальпии при нагреве продуктов от температуры
298К до 473К.
Теплоёмкости компонентов (ккал/кг.К), при средней температуре
от 25 до 200 оС:
СЭГ 0,72; С ДЭГ 0,63; СТЭГ 0,60; СОЭ 0,44; СН 2О 1
14.
Н 3 Gi C pi (Tкон To )Н 3 (3546,32 0,72 428,00 0,63 84,11 0,60 20680,44 1 ....)(473 298)
(2553,3 269,6 50,5 20680,4) 175 4121915 ккал/час
3. Находим ΔН1 – энтальпия охлаждения от Тнач. до 298оС:
Н1 1546791,8 4121915 2575123 (ккал/ч)
N
H1 Goi c ж
p (To Tисх ) ;
i 1
15.
(To Tисх )Н1
N
ж
G
C
oi pi
i 1
2575123
2575123
To Tисх
111,5
(2960,37 0, 44 21792,86 1 ....)
23095, 4
298 Tисх 111,5
Tисх 298 111,5 409,5
Tисх 136,5 oC













 Промышленность
Промышленность








