Похожие презентации:
Ионные кристаллы
1. Ионные кристаллы
1. Химическое строение.2. Классификация.
3. Шпинели. Феррит-шпинели. Ферриты.
4. Фазовые диаграммы феррит-образующих систем.
5. Соотношения: состав – структура – свойства феррит-шпинелей.
6. Термодинамический расчет равновесий в ферритобразующих
системах.
7. Твердые электролиты. Фазовые диаграммы. Баро-ЭДС.
8. Высокотемпературные сверхпроводники
2. Особенности ионной связи
Хронология разработки методов неорганического синтеза,важных для развития физической химии твердого тела
Твердое соединение
(прототип)
Первое сообщение
Применение
InP
Thiel (1910)
Полупроводники А3В5
ZrO2(CaO)
Ruff (1929)
Твердый электролит (кислородный сенсор)
Na- -Al2O3
Stillwell (1926)
Твердый электролит для химического источника тока Na–S
BaTiO3
Tammann (1925)
Сегнетоэлектрики
LiNbO3
Sue (1937)
Нелинейная оптика
BaFe12O19
Adelsk?ld (1938)
Ферриты
a-Si:H
Konig (1944)
Солнечные батареи
ZnS/CdS
Kroger (1940)
Люминофоры
Новые материалы технологического назначения
Материалы
Применение
Сиалон (Si,Al)3(O,N)4
Высокотемпературная керамика
MxMo6Se8 (фазы Шевреля)
Высокополевые сверхпроводники
Цеолиты (ZSM-5)
Катализ (синтез метанола и бензина)
Полиацетилен
Органические металлы и полупроводники
Жидкие кристаллы
Дисплейные устройства
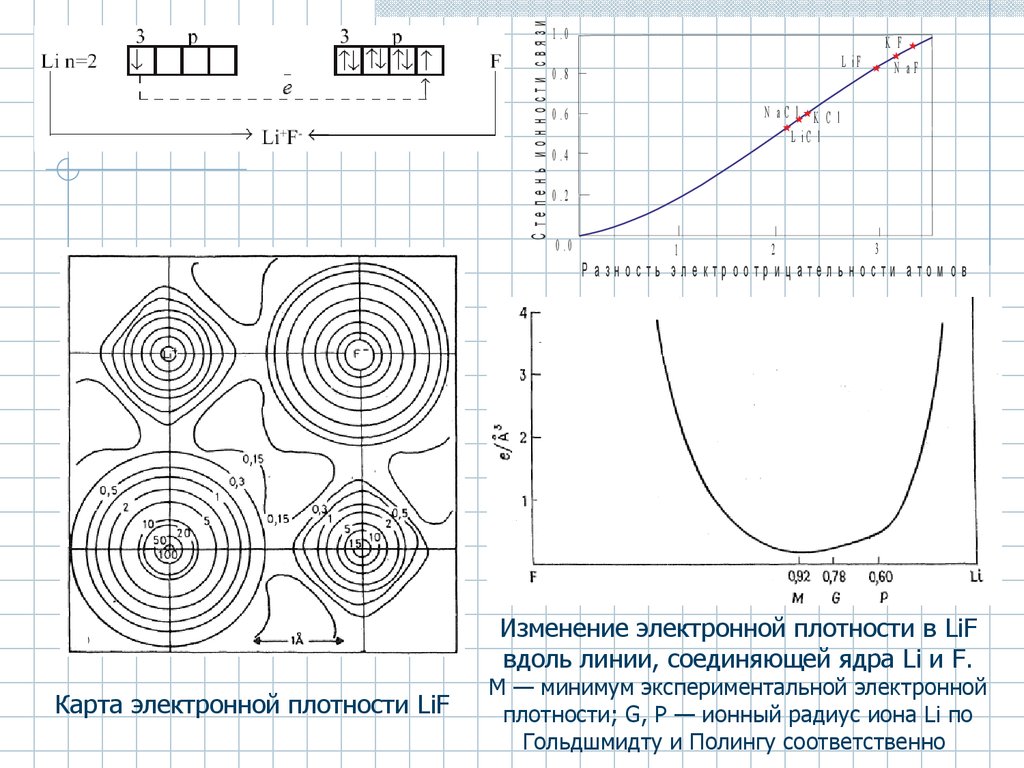
3.
С тепень ионности связи1 .0
K F
N aF
L iF
0 .8
N aC l K C l
L iC l
0 .6
0 .4
0 .2
0 .0
1
2
3
Р азность эл е ктр оотр иц ател ьно сти ато м ов
Изменение электронной плотности в LiF
вдоль линии, соединяющей ядра Li и F.
Карта электронной плотности LiF
М — минимум экспериментальной электронной
плотности; G, Р — ионный радиус иона Li по
Гольдшмидту и Полингу соответственно
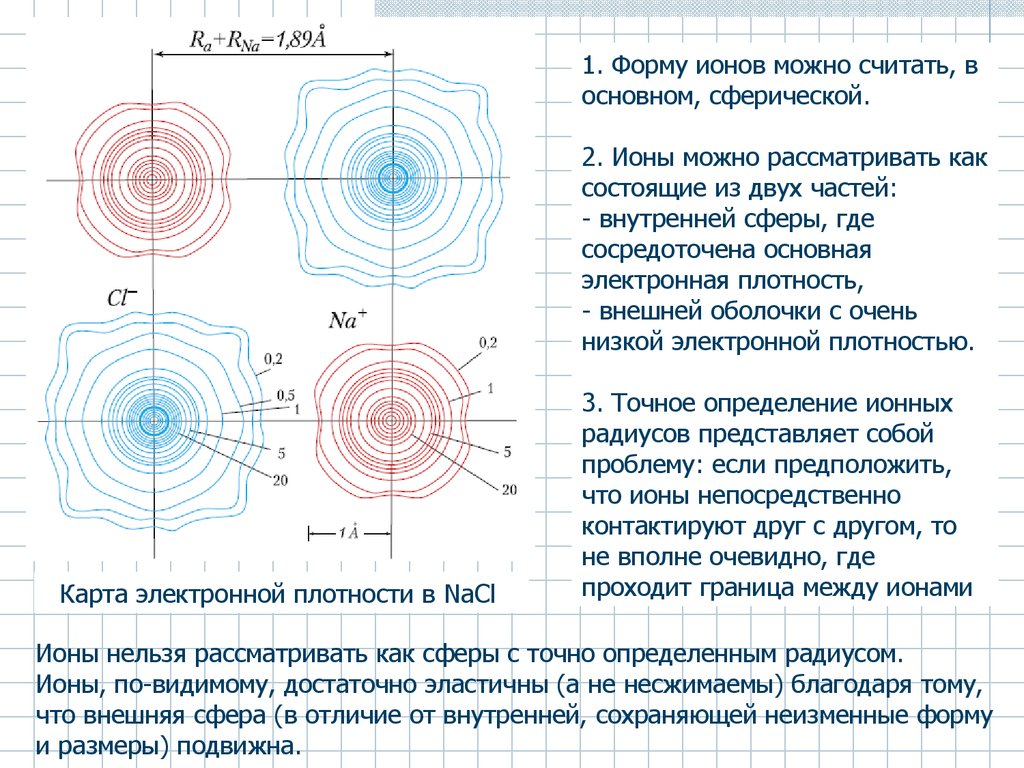
4.
1. Форму ионов можно считать, восновном, сферической.
2. Ионы можно рассматривать как
состоящие из двух частей:
- внутренней сферы, где
сосредоточена основная
электронная плотность,
- внешней оболочки с очень
низкой электронной плотностью.
Карта электронной плотности в NaCl
3. Точное определение ионных
радиусов представляет собой
проблему: если предположить,
что ионы непосредственно
контактируют друг с другом, то
не вполне очевидно, где
проходит граница между ионами
Ионы нельзя рассматривать как сферы с точно определенным радиусом.
Ионы, по-видимому, достаточно эластичны (а не несжимаемы) благодаря тому,
что внешняя сфера (в отличие от внутренней, сохраняющей неизменные форму
и размеры) подвижна.
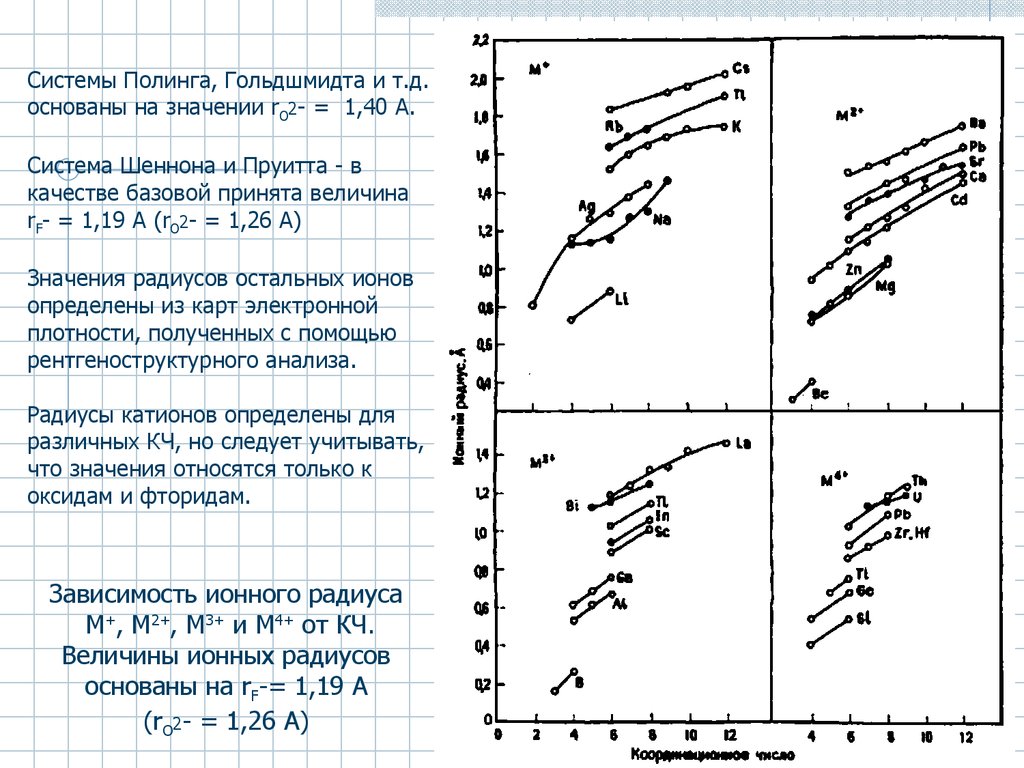
5.
Cистемы Полинга, Гольдшмидта и т.д.основаны на значении rO2- = 1,40 А.
Cистема Шеннона и Пруитта - в
качестве базовой принята величина
rF- = 1,19 А (rO2- = 1,26 А)
Значения радиусов остальных ионов
определены из карт электронной
плотности, полученных с помощью
рентгеноструктурного анализа.
Радиусы катионов определены для
различных КЧ, но следует учитывать,
что значения относятся только к
оксидам и фторидам.
Зависимость ионного радиуса
М+, М2+, М3+ и М4+ от КЧ.
Величины ионных радиусов
основаны на rF-= 1,19 А
(rO2- = 1,26 А)
6.
Тенденции изменений ионных радиусов1. Ионные радиусы s- и р-элементов по группам увеличиваются с ростом порядкового
номера (например, радиусы ионов щелочных металлов в октаэдрическом окружении);
2. В ряду изоэлектронных катионов радиусы уменьшаются с ростом заряда катиона
(например, для ряда Na+ Mg2+ Al3+ Si4+);
3. Радиусы катионов элементов, имеющих несколько степеней окисления, уменьшаются
с ростом степени окисления (например, V+ > V3+ > V4+ > V5+);
4. Радиусы катионов, для которых характерно несколько координационных чисел, с ростом
последних возрастают;
5. В ряду лантаноидов наблюдается «лантаноидное сжатие»:
- при увеличении порядкового номера размер ионов одинакового заряда уменьшается
из-за неполного экранирования заряда ядер электронами d- и особенно f-подуровней
(rLa3+ = 1,20 А, ..., rEu3+ = 1,09 А, ..., rLu3+ = 0,99 А);
- подобные эффекты наблюдаются и в рядах ионов переходных элементов;
6. Радиусы ионов переходных элементов, входящих в побочные подгруппы, меньше, чем
радиусы соответствующих ионов главных подгрупп (по тем же причинам, что и для
лантаноидов); ср., например, rRb+ = 1,63 А и rAg+ = 1,29 А, rCa2+ = 1,14 А и rZn2+ = 0,89 А;
7. Некоторые пары элементов, расположенных в периодической таблице по диагонали
друг относительно друга, имеют близкие ионные радиусы (и сходные химические
свойства), например Li+ (0,88 А) и Mg2+ (0,86 А); эта закономерность— результат
одновременного проявления первых двух тенденций.
7. Общие закономерности ионных структур
1. Ионы следует рассматривать как заряженные, деформируемые иполяризуемые сферы;
2. Структуры ионных соединений возникают под действием
электростатических сил, - каждый катион при этом окружен анионами, и
наоборот;
3. Стремление к максимизации электростатического притяжения между
ионами в структуре (т.е. увеличению энергии решетки) приводит к тому, что
если все ближайшие соседи центрального иона имеют противоположные ему
заряды, то всегда реализуется максимально возможное КЧ;
4. Ионы - соседи второго порядка - имеют заряд того же знака, что и
центральный ион, и между ними действует отталкивание. В результате этого
однотипные ионы располагаются в структуре так, чтобы быть друг от друга
как можно дальше, что в свою очередь приводит к образованию
высокосимметричных структур, обладающих максимально возможным
объемом;
5. В структурах, как правило, соблюдается локальная электронейтральность,
т.е. заряд каждого иона равен сумме электростатических зарядов, связанных с
ним ионов противоположного знака.
8. Особенности ионных структур
1. Ионы упорядочены и малоподвижны, чем обусловлена низкаяэлектропроводность таких материалов при нормальных условиях, резко
возрастающая при плавлении.
2. Межионное расстояние рассматривают как сумму радиусов катиона и аниона.
Для оксидов - rk + ra = rM + rO
3. Поляризация внешним полем тем меньше, чем больше заряд и меньше радиус
иона. В ряду с одинаковой конфигурацией внутренних электронных оболочек
1s22s22p6 поляризуемость убывает в ряду
O2– > F– > Na+ > Mg2+ > Al3+ > Si4+
Каждый ион является источником электрического поля. Напряженность поля
однозарядных ионов составляет около 108 В/м. При сопоставимых значениях
радиуса (r) и заряда (z) ионов их поляризующее действие на соседние ионы
определяется строением электронных оболочек. Поляризация возрастает в ряду
Mg2+ (0,72 Å) Co2+ (0,74 Å) Zn2+ (0,73 Å)
ns2np6
ns2np6d10–k ns2np6d10
Наличие d- и f-оболочек увеличивает поляризацию.
9.
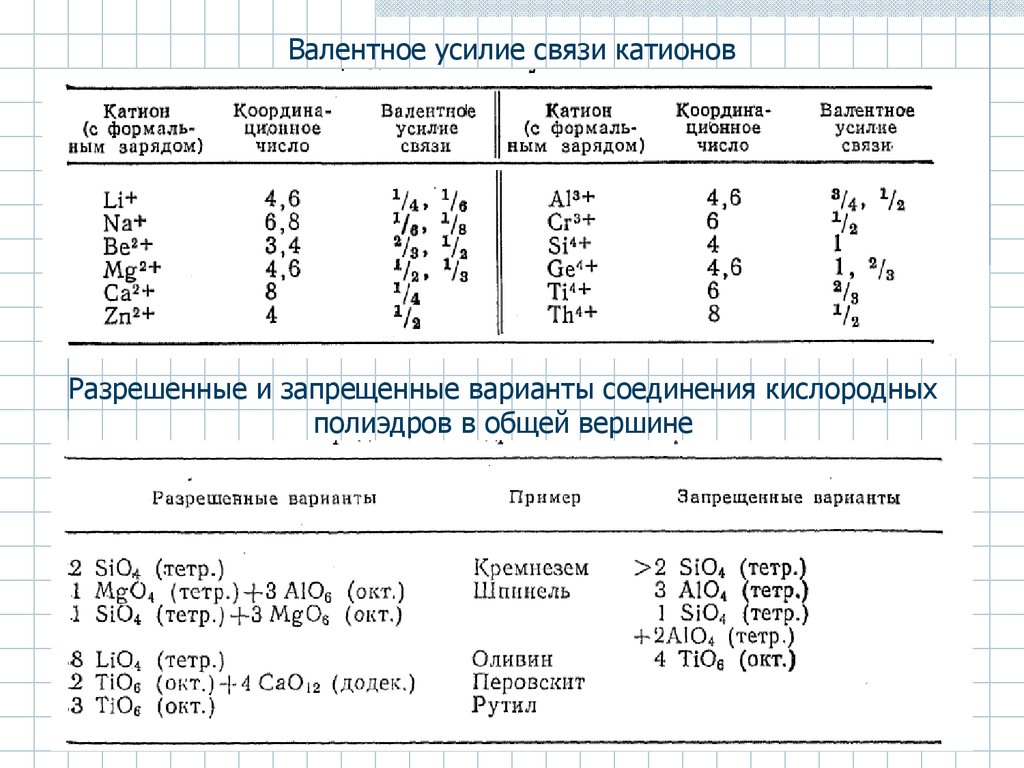
Валентное усилие связи катиона Мm+ окруженного n анионами Хх , сотдельным анионом:
= m/n
Отрицательный заряд аниона должен быть уравновешен суммарным зарядом
окружающих его катионов:
m/n = х
Примеры:
1. В шпинели MgAl2O4 имеются октаэдрические ионы Аl3+ и тетраэдрические
ионы Mg2+, каждый ион кислорода находится в тетраэдрическом окружении
трех ионов Аl3+ и одного иона Mg2+.
для Mg2+ = 2/4= 1/2
для Аl3+ = 3/6 =1/2
Тогда (3 Аl3+ 1 Mg2+) = 2
2. В силикатных структурах три тетраэдра SiO4 не могут соединяться в общей
вершине. Для Si4+ = 4/4 = 1; тогда для кислорода, соединяющего два
тетраэдра SiO4, = 2, что соответствует правилу электростатических
валентностей.
Три тетраэдра, имеющие общий кислородный ион, давали бы для него = 3
10.
Валентное усилие связи катионовРазрешенные и запрещенные варианты соединения кислородных
полиэдров в общей вершине
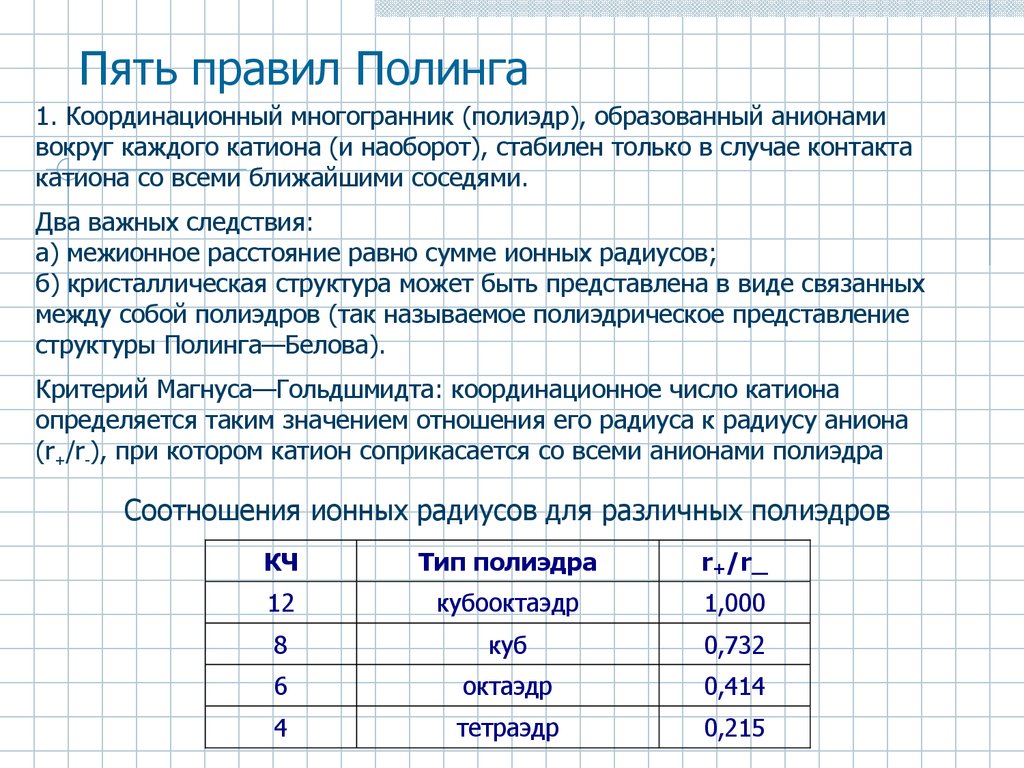
11. Пять правил Полинга
1. Координационный многогранник (полиэдр), образованный анионамивокруг каждого катиона (и наоборот), стабилен только в случае контакта
катиона со всеми ближайшими соседями.
Два важных следствия:
а) межионное расстояние равно сумме ионных радиусов;
б) кристаллическая структура может быть представлена в виде связанных
между собой полиэдров (так называемое полиэдрическое представление
структуры Полинга—Белова).
Критерий Магнуса—Гольдшмидта: координационное число катиона
определяется таким значением отношения его радиуса к радиусу аниона
(r+/r-), при котором катион соприкасается со всеми анионами полиэдра
Соотношения ионных радиусов для различных полиэдров
КЧ
Тип полиэдра
r+/r_
12
кубооктаэдр
1,000
8
куб
0,732
6
октаэдр
0,414
4
тетраэдр
0,215
12.
2. (Правило электростатической валентности). Сумма валентных усилий,сходящихся на анионе, равна абсолютной величине его заряда (валентности).
Валентным усилием s называют отношение заряда катиона к его КЧ; так, в
кристалле Аа+Вb- с катионом, имеющим КЧ = n, правило электростатической
валентности выражается соотношением
s
i
i
a
b,
n
в СаТiO3 со структурой перовскита
КЧ(Са2+) = 12; s(Ca2+) = 1/6;
KЧ(Ti4+) = 6 и s(Ti4+) = 2/3;
в окружении каждого аниона О2- находится 4 Са2+ и 2 Ti4+, следовательно,
s = 4 (1/6) + 2 (2/3) = 2, т.е. валентности О2-.
3. Устойчивость ионных кристаллов уменьшается в следующей
последовательности типов соединения полиэдров в структуре:
общая вершина > общее ребро > общая грань.
4. В сложном кристалле (не менее двух различных катионов) катион с
большим зарядом и меньшим КЧ стремится соединить свой полиэдр с другими
через вершины.
13.
5. (Правило экономичности, или парсимонии). Каждый химический элементстремится занять в структуре единственный тип полиэдра.
Зная КЧ ионов в Ca3Al2Si3O12 (структура граната, КЧ(Са2+) = 8, КЧ(Аl3+) = 6,
K4(Si4+) = 4) и полагая, согласно правилу 5, единственный вариант схождения
валентных усилий катионов на кислороде (тогда в ближайшем окружении
кислорода находится два Са, один Аl и один Si, т.е. 2 = 1/4 + 1/4 + 1/2 + 1),
можно «предсказать» структуру граната как набор из имеющих общую
вершину пары додекаэдров, октаэдра и тетраэдра.
Правила Фаянса:
- поляризующее действие катиона тем больше, чем больше его эффективный
заряд и меньше радиус;
- поляризуемость аниона тем больше, чем больше его заряд и радиус;
- незавершенная валентная оболочка усиливает поляризующее действие.
Например, усиление поляризации ионов в ряду соединений CaF2—Hgl2—SiS2
(поляризующее действие Si4+>> Hg2+> Са2+, поляризуемость S2- > I F )
приводит к изменению геометрии соединения полиэдров от их трехмерного
связывания в CaF2, через двухмерные сетки в иодиде ртути, к линейным
цепочкам в сульфиде кремния (т.е. фактически ковалентному соединению,
подчиняющемуся правилу Музера—Пирсона).
14. Правила о соотношениях радиусов
В структурах ионных кристаллов КЧ ионов определяютсяэлектростатической природой взаимодействий. Электростатическое
притяжение между соседними ионами с противоположными зарядами
обеспечивает максимальную энергию решетки кристалла.
Возможные сочетания ионов, образующих то или иное соединение, и
принимаемая последним структура зависят от относительных размеров
ионов.
1. Катион должен непосредственно касаться соседей-анионов, что
ограничивает нижний предел радиуса катиона, способного занять
позицию.
2. Превышение допустимого размера катиона может нарушить контакт
соседних анионов.
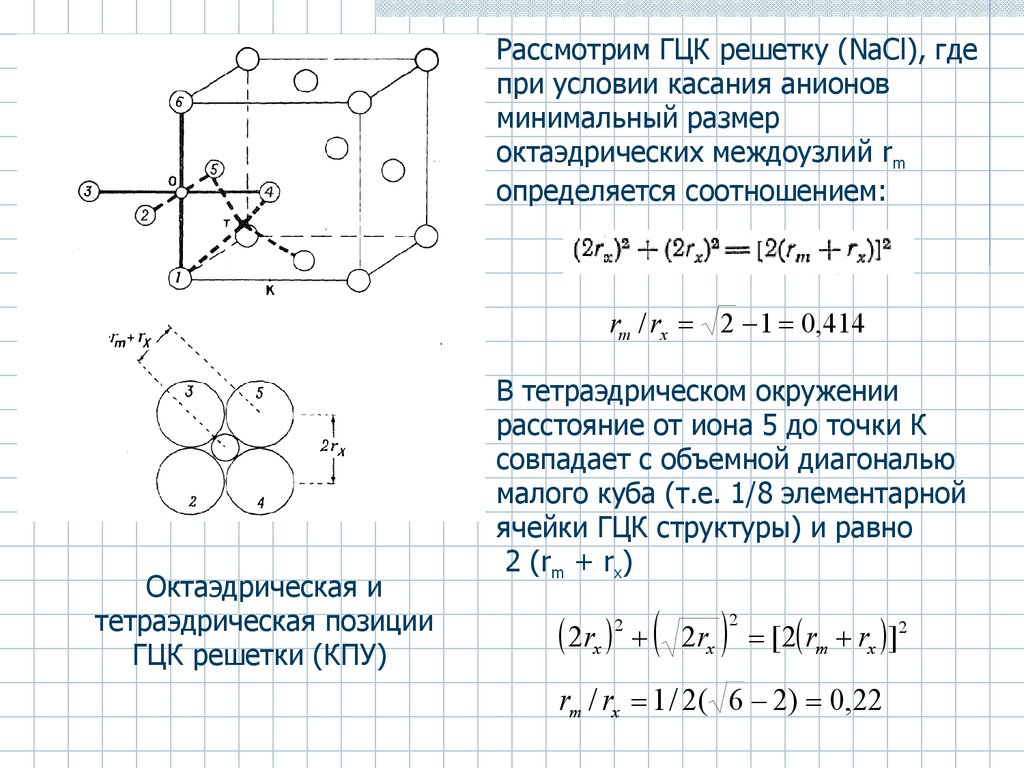
15.
Рассмотрим ГЦК решетку (NaCl), гдепри условии касания анионов
минимальный размер
октаэдрических междоузлий rm
определяется соотношением:
rm / rx 2 1 0,414
Октаэдрическая и
тетраэдрическая позиции
ГЦК решетки (КПУ)
В тетраэдрическом окружении
расстояние от иона 5 до точки К
совпадает с объемной диагональю
малого куба (т.е. 1/8 элементарной
ячейки ГЦК структуры) и равно
2 (rm + rx)
2rx
2
2rx
2
[2 rm rx ]2
rm / rx 1 / 2( 6 2) 0,22
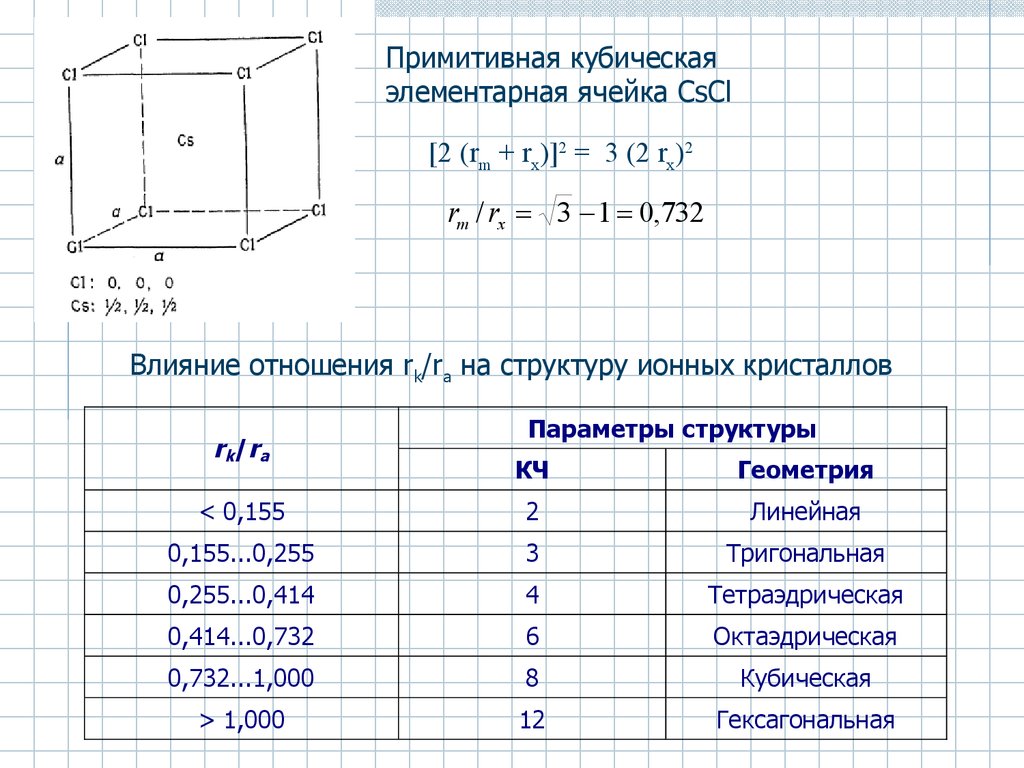
16.
Примитивная кубическаяэлементарная ячейка CsCl
[2 (rm + rх)]2 = 3 (2 rх)2
rm / rx 3 1 0,732
Влияние отношения rk/rа на структуру ионных кристаллов
rk/rа
Параметры структуры
КЧ
Геометрия
< 0,155
2
Линейная
0,155...0,255
3
Тригональная
0,255...0,414
4
Тетраэдрическая
0,414...0,732
6
Октаэдрическая
0,732...1,000
8
Кубическая
> 1,000
12
Гексагональная
17. Энергия связи в ионном кристалле
Энергия взаимодействия пары ионов (Z1, Z2)E1 2
Z1Z 2e 2
b
n
a1 2
a1 2
b – постоянная сил отталкивания
n – показатель Борна
a1 2 a0
F1 2
dE1 2 Z1Z 2e 2 nb
n 1 0
2
da
a
a
E1 2
Z1Z 2e 2 1
1
a1 2 n
n A nB
n
2
Z1Z 2e 2 a n 1
b
n
18. Полная энергия решетки ионного кристалла
AZ1Z 2e 2 1Ei j
1 A – постоянная Маделунга
a
n
a RA RB
ai j a i j
1 6 12
8
6
24
A
...
i j
1
2
3
4
5
i j
AN A Z1Z 2e 2 1
E
1
4 0 a n
Тип структуры
Пример
КЧ
соединения
Хлорид натрия
NaCl, AgCl, CdO, PbS
6
Хлорид цезия
CsCl, TlCl, RbF
8
Вюрцит
ZnS, BeO, ZnO, CdS
4
Сфалерит (цинковая обманка) ZnS, CuCl, AgI, HgS
4
NiAs
6
PtS
4 (квадрат)
Флюорит
CaF2, PbF2, UO2, Na2S
8 (4)
Рутил
TiO2, MgF2, MnO2, NiF2
6 (3)
Куприт
Cu2O
4 (2)
A
1,7476
1,7627
1,6407
1,6381
1,6656
1,6049
5,039
4,816
4,332
19.
Уточнения для энергии кристалла:1. Более точно борновское отталкивание выражается зависимостью
= 0,35 0,05 А
Ур-ние Борна-Майера для энергии решетки ионного
кристалла
2
U
AZ1Z 2 e N A
1
4 0 r
r
2. Минимальный уровень энергии кристалла составляет
3. Взаимодействие наведенных диполей приводит к ван-дер-ваальсову
притяжению между ионами
Вклады уточнений (кДж/моль)
20.
Ур-ние Капустинского для энергии решетки ионного кристалла= 0,345 А=1,745 V – число ионов в одной формульной единице
Термохимические радиусы сложных
анионов
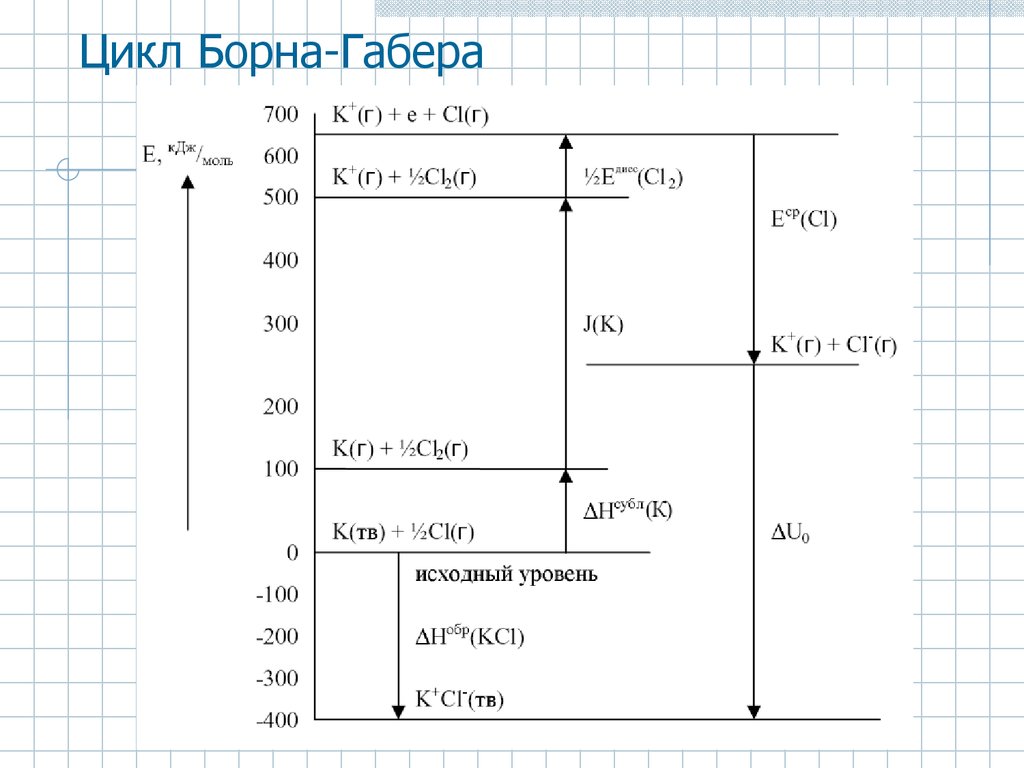
21. Цикл Борна-Габера
22.
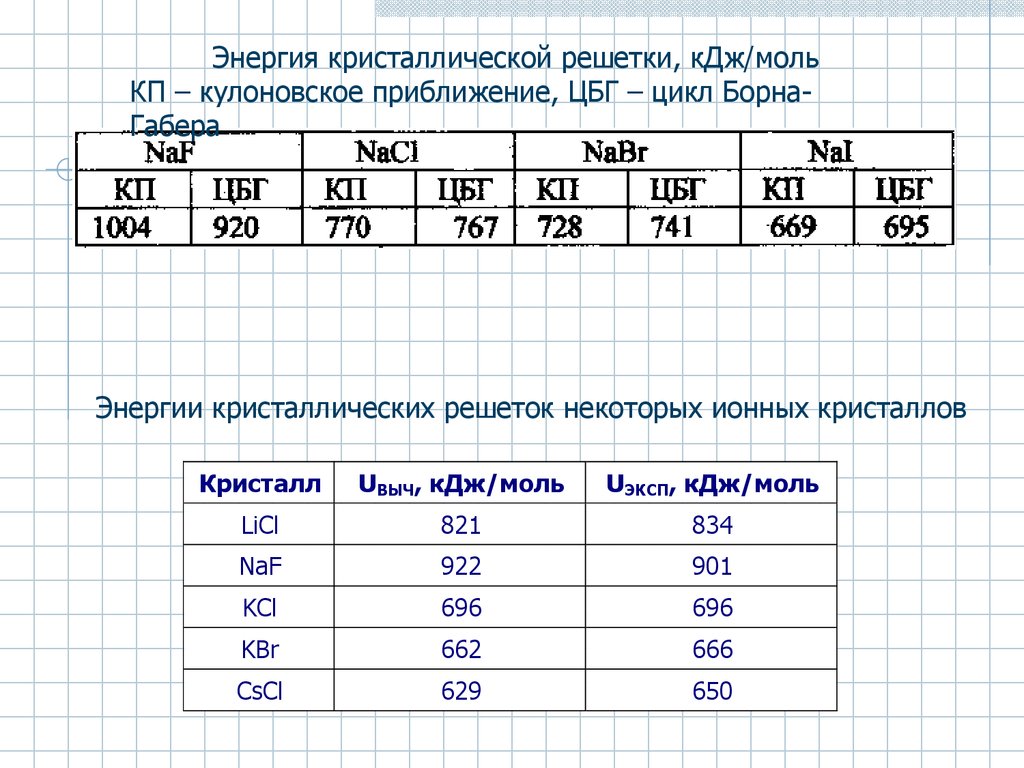
Энергия кристаллической решетки, кДж/мольКП – кулоновское приближение, ЦБГ – цикл БорнаГабера
Энергии кристаллических решеток некоторых ионных кристаллов
Кристалл
UВЫЧ, кДж/моль
UЭКСП, кДж/моль
LiCl
821
834
NaF
922
901
KCl
696
696
KBr
662
666
CsCl
629
650
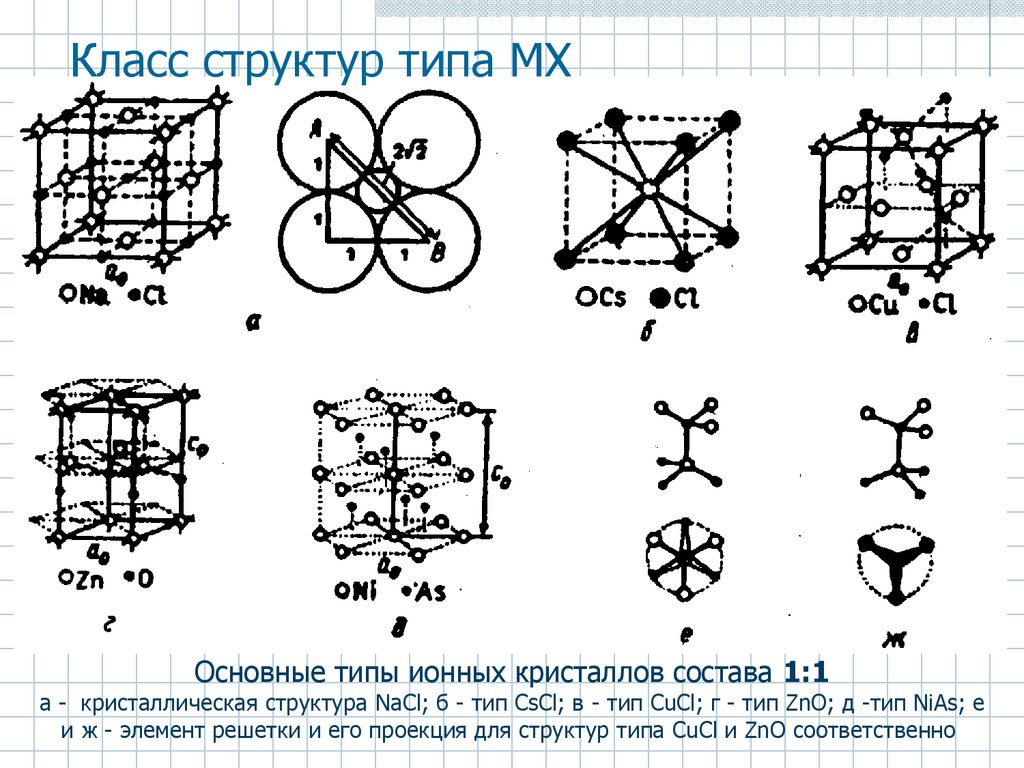
23. Класс структур типа MX
Основные типы ионных кристаллов состава 1:1а - кристаллическая структура NaCl; б - тип CsCl; в - тип CuCl; г - тип ZnO; д -тип NiAs; е
и ж - элемент решетки и его проекция для структур типа CuCl и ZnO соответственно
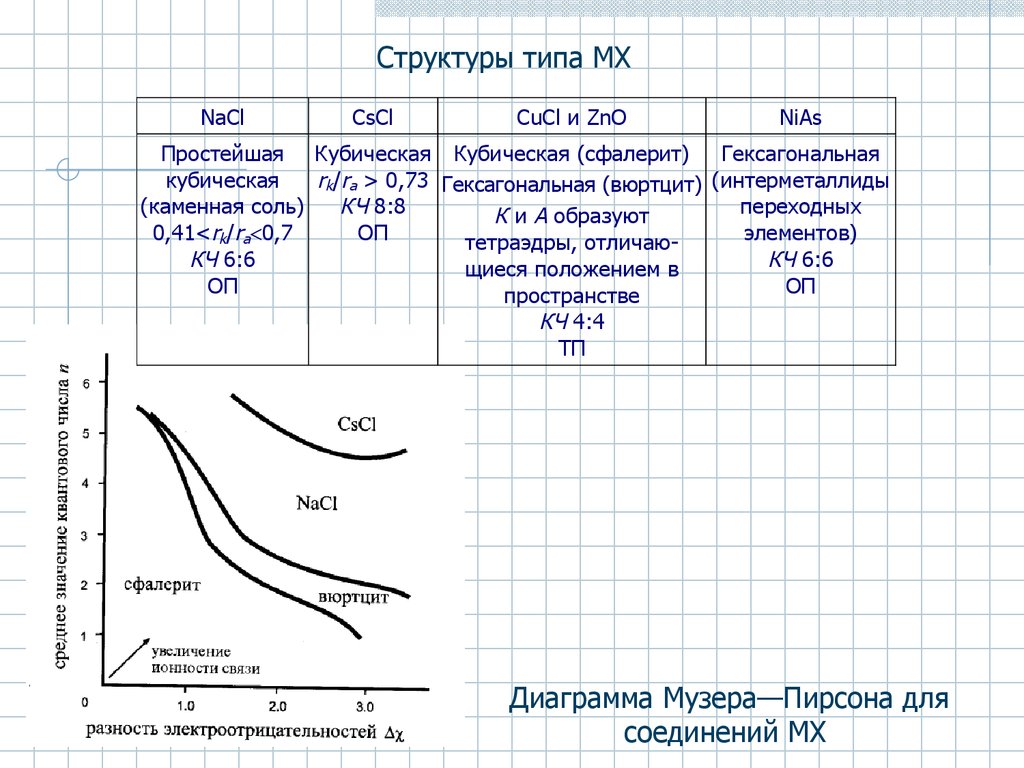
24.
Структуры типа МХNaCl
CsCl
CuCl и ZnO
NiAs
Простейшая Кубическая Кубическая (сфалерит) Гексагональная
кубическая
rk/rа > 0,73 Гексагональная (вюртцит) (интерметаллиды
(каменная соль)
КЧ 8:8
переходных
К и А образуют
0,41<rk/rа 0,7
ОП
элементов)
тетраэдры, отличаюКЧ 6:6
КЧ 6:6
щиеся положением в
ОП
ОП
пространстве
КЧ 4:4
ТП
Диаграмма Музера—Пирсона для
соединений MX
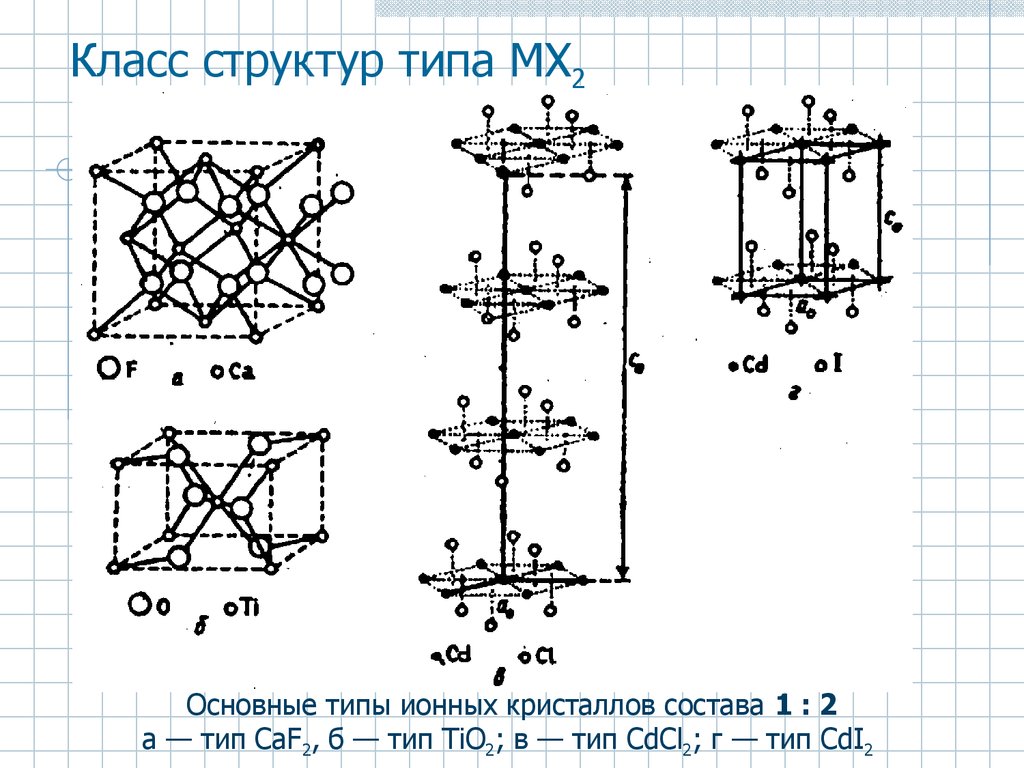
25. Класс структур типа MX2
Основные типы ионных кристаллов состава 1 : 2а — тип CaF2, б — тип TiO2; в — тип CdCl2; г — тип CdI2
26.
Структуры типа МХ2СаF2
TiO2*
CdI2
CdCl2
Кубическая Гексагональная (рутил) Гексагональная Ромбоэдрическая
(флюорит)
или тетраэдрическая (халькогениды,
(хлориды)
rk/rа > 0,7
(анатаз)
иодиды)
КЧ 6:3
КЧ 8:4
0,7 > rk/rа > 0,4
КЧ 6:3
1/2 ОП слоями
ТП
КЧ 6:3
1/2 ОП слоями
ОП
* ТiO2 – типичный ионный кристалл, но его же можно рассматривать как
неорганический полимер, поскольку известны гомологические ряды общей
формулы TinO2n.
27.
Структуры и отношения радиусов в оксидахОтношение радиусов O и Ge в тетраэдрической координации лежит на границе,
предсказываемой для КЧ = 4 и КЧ = 6, что коррелирует с фактом полиморфизма
GeO2, который может иметь структуру как SiO2, так и рутила.
28.
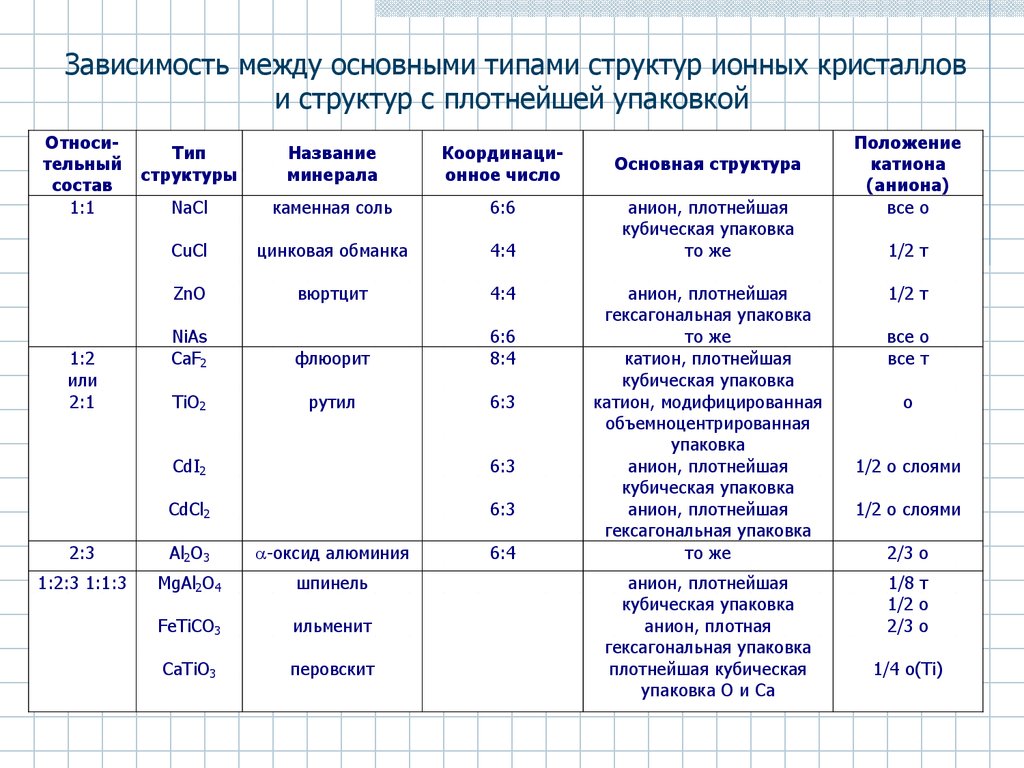
Зависимость между основными типами структур ионных кристаллови структур с плотнейшей упаковкой
Относительный
состав
1:1
1:2
или
2:1
Тип
структуры
Название
минерала
Координационное число
NaCl
каменная соль
6:6
CuCl
цинковая обманка
4:4
ZnO
вюртцит
4:4
NiAs
CaF2
флюорит
6:6
8:4
TiO2
рутил
6:3
CdI2
6:3
CdCl2
6:3
2:3
Al2O3
-оксид алюминия
1:2:3 1:1:3
MgAl2O4
шпинель
FeTiCO3
ильменит
CaTiO3
перовскит
6:4
Основная структура
анион, плотнейшая
кубическая упаковка
то же
анион, плотнейшая
гексагональная упаковка
то же
катион, плотнейшая
кубическая упаковка
катион, модифицированная
объемноцентрированная
упаковка
анион, плотнейшая
кубическая упаковка
анион, плотнейшая
гексагональная упаковка
то же
анион, плотнейшая
кубическая упаковка
анион, плотная
гексагональная упаковка
плотнейшая кубическая
упаковка О и Са
Положение
катиона
(аниона)
все о
1/2 т
1/2 т
все о
все т
о
1/2 о слоями
1/2 о слоями
2/3 о
1/8 т
1/2 о
2/3 о
1/4 o(Ti)
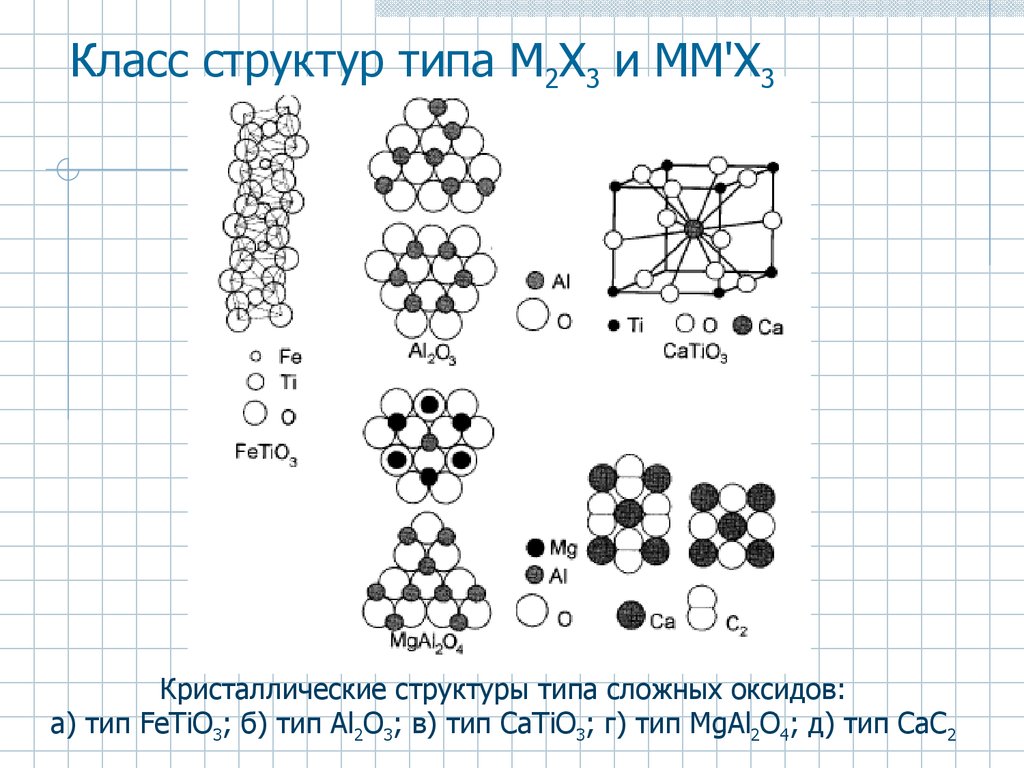
29. Класс структур типа M2Х3 и ММ'Х3
Кристаллические структуры типа сложных оксидов:а) тип FeTiO3; б) тип Аl2O3; в) тип СаТiO3; г) тип MgAl2O4; д) тип СаС2
30.
М2Х3 - -Аl2O3 (корунд), Sc2O3, La2O3, слоистые кристаллы типа Sb2S3, кубическиеи гексагональные кристаллы типа Ga2S3. М - в ОП решетки О2- (ГПУ)
В ММ‘X3 слои между О2- поочередно заняты катионами М и М'.
Сумма зарядов М и М' обычно равна шести, необходимое условие образования
структуры - близость ионных радиусов гМ rМ,.
Искажение кристаллической решетки, приводящее к смене структурного типа
соединения ММ'Х3 характеризуют фактором толерантности Гольдшмидта
t0 ( Rm R0 )
2( Rm¢ R0 )
Структурные типы соединений ММ'О3 и значения их факторов толерантности
Соединение
to
Структурный тип,
КЧ(М): КЧ(М')
FeTiO3
МnТiO3
0,78
0,80
ильменит
6:6
СаТiO3
ВаТiO3
0,85
0,97
перовскит
12:6
MgCO3
СаСO3
1,20
1,35
кальцит
6:3
SrCO3
ВаСO3
1,47
1,56
арагонит
9:3
RbNO3
CsNO3
1,65
1,75
RbNO3
12:3
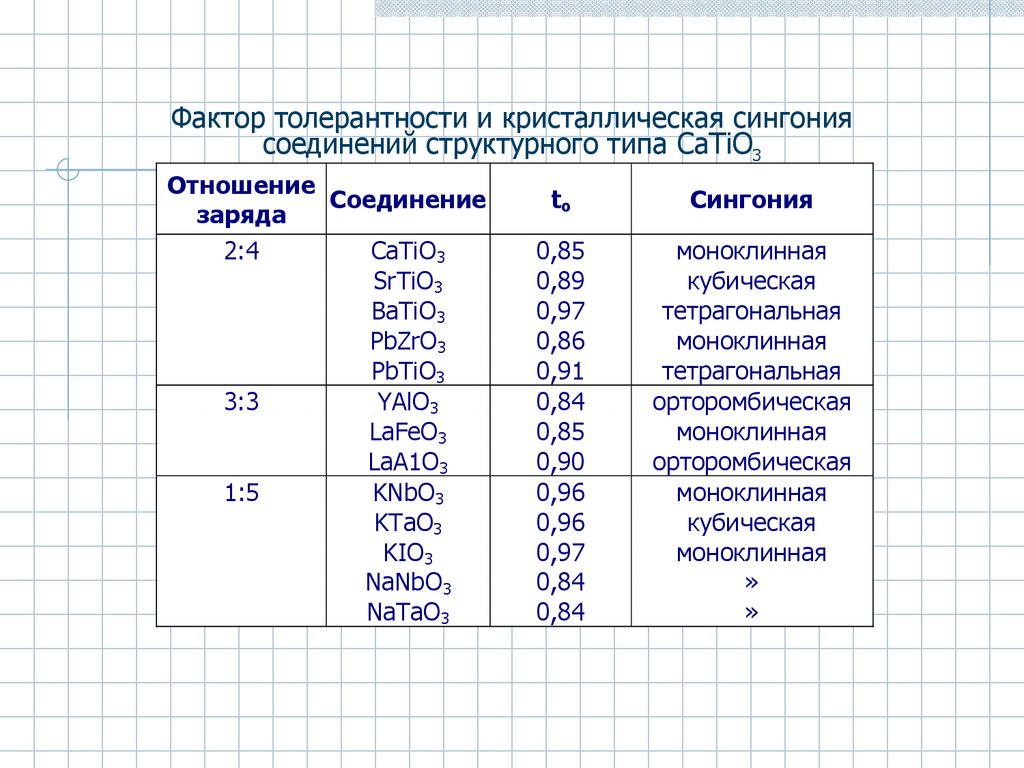
31.
Фактор толерантности и кристаллическая сингониясоединений структурного типа CaTiO3
Отношение
Соединение
заряда
2:4
CaTiO3
SrTiО3
BaTiO3
PbZrO3
PbTiО3
3:3
YAlО3
LaFeO3
LaA1О3
1:5
KNbO3
KTaО3
KIO3
NaNbO3
NaTaO3
to
Сингония
0,85
0,89
0,97
0,86
0,91
0,84
0,85
0,90
0,96
0,96
0,97
0,84
0,84
моноклинная
кубическая
тетрагональная
моноклинная
тетрагональная
орторомбическая
моноклинная
орторомбическая
моноклинная
кубическая
моноклинная
»
»
32. Класс структур типа MM’2X4 (шпинели)
Катионы и анионы, образующие ионные структуры типа шпинелиТип
Ион
(заряд)
А
МII М'III
Mg, Са, Zn, Cd, Hg, Sn, Al, Ga, In, Ti, V, Cr, O, S, Se, Те
Cr, Mn, Fe, Co, Ni, Cu Mn, Fe, Co, Ni, Rh
В
MV М'II
Ge, Sn, Pb, Ti, V, Mo
Mg, Zn, Mn, Fe, Co, О, S
Ni, Cu
С
MVI M'I
Mo, W
Li, Na, Ag
М
M'
X
O
В нормальных шпинелях (MM¢2X4) при КПУ в элементарной ячейке
образуются 64 тетраэдрические и 32 октаэдрические пустоты (узлы)
В них размещаются 8 M2+ (1/8 всех ТП, обозначают 8a)
и 16 M3+ (1/2 всех ОП, обозначают 16d)
33.
Шпинели М¢[MM¢]X4 , где половина катионов М' занимает 1/8 всех ТП, адругая половина катионов М' и все катионы М — 1/2 всех ОП, называют
обращенными шпинелями.
Распределение катионов определяется симметрией химических связей.
Zn2+ и Сd2+ всегда занимают ТП, Ni2+ или Cr3+ располагаются в ОП.
Соединения типа М'[ММ']Х4
Помимо нормальных и обращенных шпинелей возможно промежуточное
распределение катионов по позициям (смешанные шпинели).
Смешанная шпинель - M2+xFe3+(1–x)[M2+(1–x)Fe3+(1+x)]O4 - твердый р-р
нормальных и обращенных шпинелей.
Катионное распределение рассчитывается с помощью параметра
(степень обращения), который соответствует доле катионов М,
находящихся в октаэдрических позициях
На величину влияют:
- размер ионов,
- степень ковалентности связи,
- энергией стабилизации кристаллического поля.
Величина определяется совместным действием всех факторов.
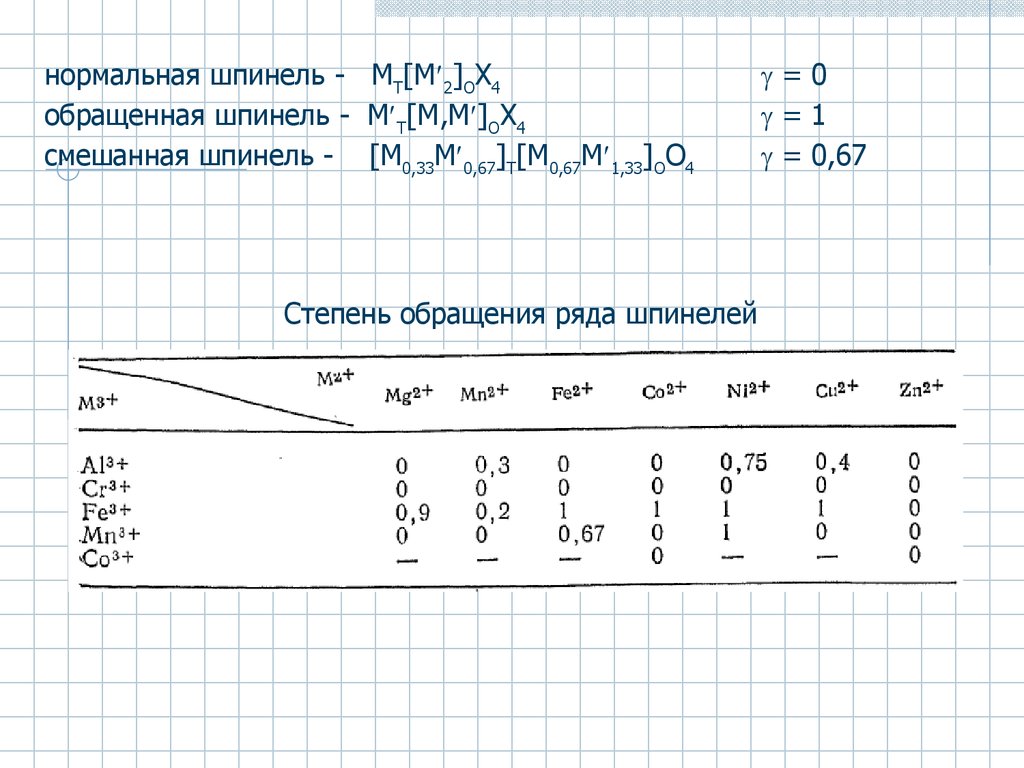
34.
нормальная шпинель - MТ[M¢2]OX4обращенная шпинель - M¢T[M,M¢]OX4
cмешанная шпинель - [M0,33M¢0,67]T[M0,67M¢1,33]OO4
Степень обращения ряда шпинелей
=0
=1
= 0,67
35. Сверхобменное взаимодействие и антиферромагнетизм
Шпинели, содержащие Fen+ (и др. ионы, обладающие высокиммагнитным моментом ), называют феррит-шпинелями (ФШ).
Ферриты - МFe2O4 , где М – Fe2+, Ni2+, Cu2+, Mg2+.
Fe3O4 имеет структуру Fe3+Т[Fe2+, Fe3+]ОО4
Модель Нееля представляет структуру шпинели в виде двух
антипараллельных магнитных подрешеток 8a и 16d.
Основную роль в определении магнитных свойств играет
антиферромагнитное взаимодействие 8a O2– 16d. Взаимодействие
спинов, приводящее к антиферромагнетизму, называется обменным.
36.
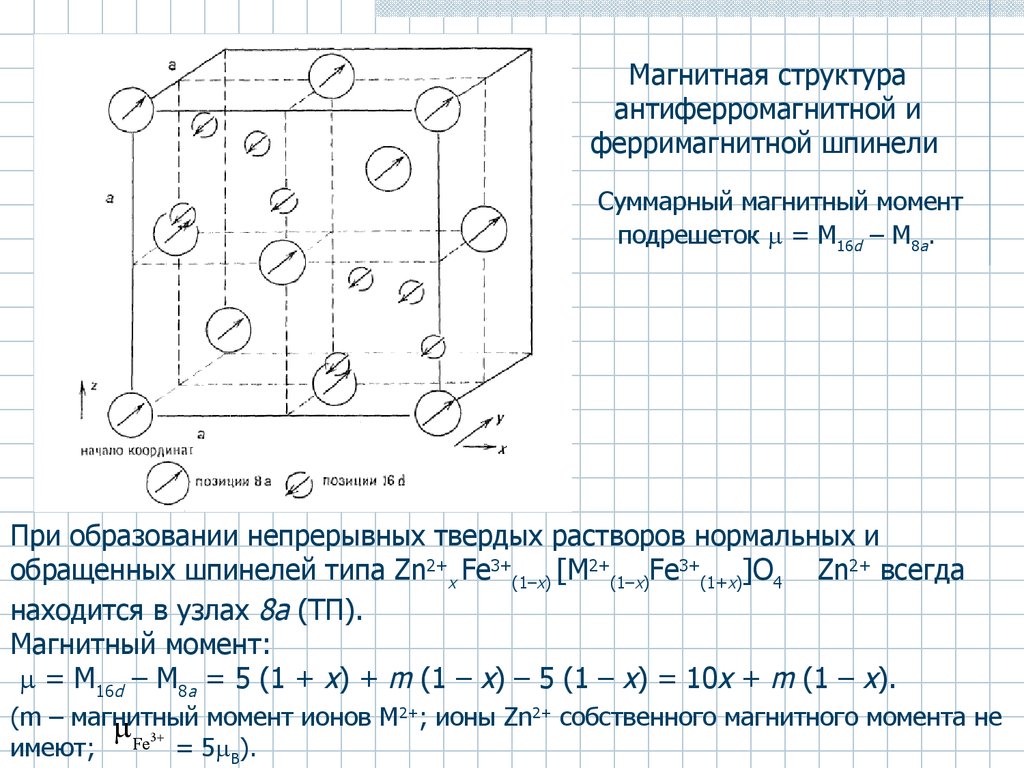
Магнитная структураантиферромагнитной и
ферримагнитной шпинели
Суммарный магнитный момент
подрешеток = M16d – M8a.
При образовании непрерывных твердых растворов нормальных и
обращенных шпинелей типа Zn2+x Fe3+(1–x) [M2+(1–x)Fe3+(1+x)]O4 Zn2+ всегда
находится в узлах 8a (ТП).
Магнитный момент:
= M16d – M8a = 5 (1 + x) + m (1 – x) – 5 (1 – x) = 10x + m (1 – x).
2+
2+
(m – магнитный
Fe3 момент ионов М ; ионы Zn собственного магнитного момента не
имеют;
= 5 В).
37.
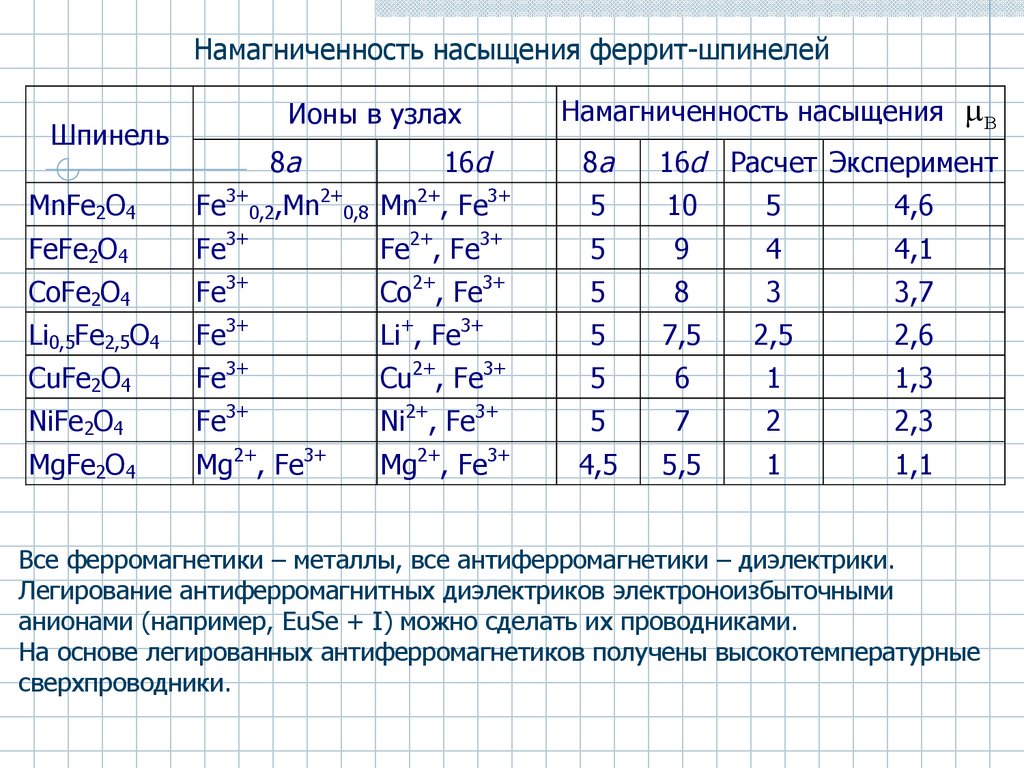
Намагниченность насыщения феррит-шпинелейИоны в узлах
Шпинель
8a
16d
Намагниченность насыщения B
8a
16d Расчет Эксперимент
MnFe2O4
Fe3+0,2,Mn2+0,8 Mn2+, Fe3+
5
10
5
4,6
FeFe2O4
Fe3+
Fe2+, Fe3+
5
9
4
4,1
CoFe2O4
Fe3+
Co2+, Fe3+
5
8
3
3,7
Li0,5Fe2,5O4
Fe3+
Li+, Fe3+
5
7,5
2,5
2,6
CuFe2O4
Fe3+
Cu2+, Fe3+
5
6
1
1,3
NiFe2O4
Fe3+
Ni2+, Fe3+
5
7
2
2,3
MgFe2O4
Mg2+, Fe3+
Mg2+, Fe3+
4,5
5,5
1
1,1
Все ферромагнетики – металлы, все антиферромагнетики – диэлектрики.
Легирование антиферромагнитных диэлектриков электроноизбыточными
анионами (например, EuSe + I) можно сделать их проводниками.
На основе легированных антиферромагнетиков получены высокотемпературные
сверхпроводники.
38.
Структура сверхкристалла,образующегося при введении
электронов в антиферромагнетик
Электроны способны изменить магнитное упорядочение в антиферромагнетике могут создавать в них ферромагнитные области в виде отдельных включений капель. При этом возникает сверхкристалл из проводящих ферромагнитных
капель в антиферромагнитном диэлектрике. С увеличением количества вводимых
электронов объем капель растет, они сливаются, после чего проводящая фаза
становится основной и возникает сверхкристалл из изолирующих
антиферромагнитных капель в ферромагнитном кристалле-проводнике.
При нагревании такого соединения сначала плавится сверхкристалл.
Аналогичным образом может действовать магнитное поле. Слабое поле может
изменить тип сверхкристалла, а более сильное – даже привести к его плавлению.
Под воздействием магнитного поля проводимость ферромагнитного кристалла
изменится незначительно, а антиферромагнитного – изменится на 10 порядков.
В LaMnO4, сверхкристаллы существуют при комнатной температуре
В YBa2Cu3O7 образуются сверхпроводящие капли.
39. Ферриты
Классификация ферритов1. Феррит-шпинели.
Наиболее широко применяемые ферриты – NiO-ZnO-Fe2O3, MnO-ZnO-Fe2O3,
Ni-Co-ферриты.
2. Феррогранаты. Гранат - Са3Al2(SiO4)3, феррит-гранат - M3Fe2(FeO4)3.
M – катионы Y или лантаноидов. Феррит-гранаты имеют кубическую ОЦК и
отличаются высоким электрическим сопротивлением, низкими магнитными
потерями, широким интервалом намагниченности насыщения. Используются их в
устройствах СВЧ техники.
3. Магнетоплюмбит – гексагональные ферриты состава BaFe12O19, в общем виде –
nBaO·2MO·mFe2O3.
Отличаются большими внутренними магнитными полями (полями анизотропии)
Имеют значения магнитной энергии, близкой к лучшим металлическим магнитам
(на основе сплавов Sm-Co имеют магнитную энергию 200–250 кДж/м3).
4. Ортоферриты с орторомбической структурой типа перовскита CaTiO3-MFeO3.
M – Y, Gd, Eu, Er, Sm, Nd, La, Ce и др.
Ферриты всех типов синтезируются
- по керамической технологии (из оксидов) термическим разложением растворов
солей,
- соосаждением гидроксидов, получением твердых растворов изоморфных солей.
- возможен низкотемпературный синтез с использованием процессов типа
40. Ферритобразующие системы
Система NiO-ZnO-Fe2O3 (ферриты на основе твердых р-ров NiFe2O4 и ZnFe2O4)Тпл NiFe2O4 на воздухе – 1640°С в атмосфере кислорода – 1740°С.
При 1300 °С рО2 = 1 атм.
Тпл ZnFe2O4 невозможно определить, поскольку Zn испаряется по реакции
ZnFe2O4 = Zn0 + Fe2O3 + 0,5O2
Диаграмма состояния системы NiO-Fe2O3
41.
Система ZnO-MnO-Fe2O3При Т < 1000°С фаза шпинели отсутствует. Шпинель может быть получена
только закалкой от более высоких температур, причем режим охлаждения будет
определять фазовый состав, структуру и магнитную проницаемость феррита
Диаграмма состояния
системы MnO-Fe2O3
Зависимость начальной магнитной
проницаемости в системе
MnO-Fe2O3-ZnO от состава.
Охлаждение в вакууме 5 мин
42.
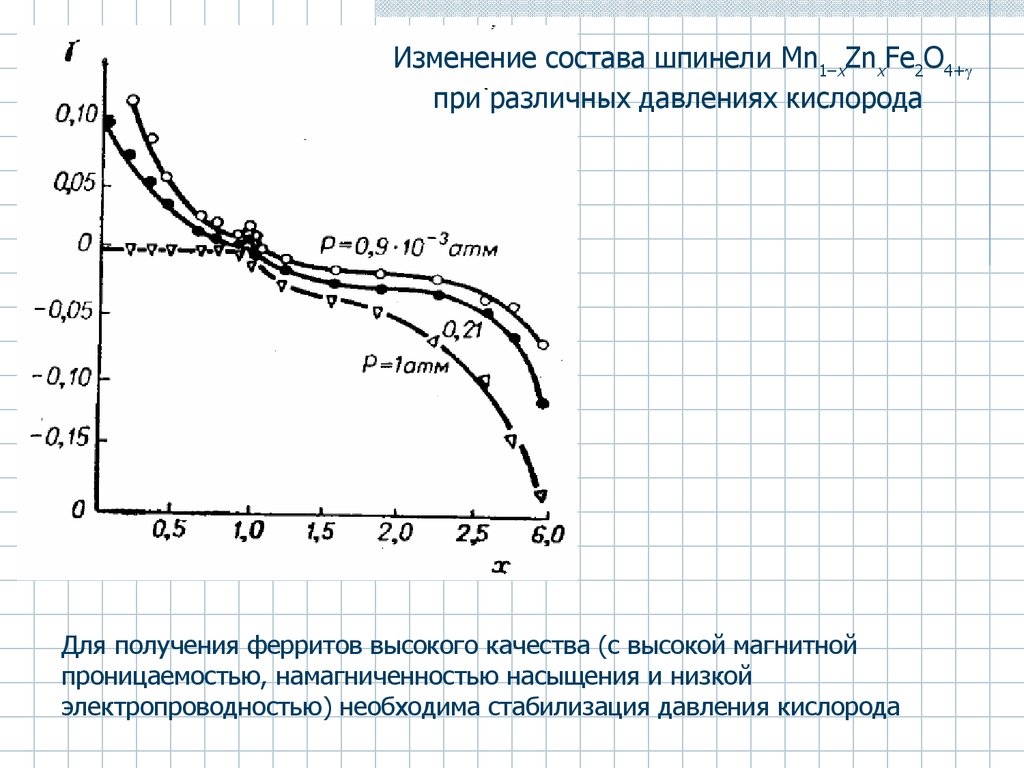
Изменение состава шпинели Mn1–xZnxFe2O4+при различных давлениях кислорода
Для получения ферритов высокого качества (с высокой магнитной
проницаемостью, намагниченностью насыщения и низкой
электропроводностью) необходима стабилизация давления кислорода
43. Термодинамическое описание синтеза феррит-шпинелей
Форма и ориентирование кристаллической структуры продуктовгетерогенных реакций зависит от структуры исходных фаз. Это
вызвано тем, что форма и ориентировка зародышей при
кристаллизации в анизотропной среде соответствуют минимуму
свободной энергии. Последний обеспечивается максимальным
сходством в расположении атомов на соприкасающихся
поверхностях реагентов и продуктов реакции.
Ориентированная кристаллизация возможна в случае: разность
энергии образования двухмерного зародыша G2M и энергии адгезии
Gad меньше или равна энергии образования трехмерного зародыша
G3M при неориентированной кристаллизации
G2M – Gad G3M
Ориентированная кристаллизация возможна при предельной
разности параметров сопрягающихся решеток < 18%.
44.
Выделяют 3 группы твердофазных реакций:- структура продукта отличается от структуры реагентов, состав
переменный (шпинели на основе NiAl2O4);
- структура продукта является модифицированной структурой одного
из реагентов (W3Nb14O44, W7Nb18O66 имеют моноблочную структуру
сдвига, производную от структуры Nb2O5);
- образуются твердые растворы с различными отклонениями от
идеальности (магнезиовюстит, смешанные феррит-шпинели).
Для определения типа образующихся продуктов, необходимо измерить
химический потенциал хотя бы одного из реагентов.
Используют обратимые электрохимические цепи (для систем типа
Ni-Pt, Ni-Pd измеряют ЭДС (Е) цепи с твердым электролитом (ТЭ)
– Pt NiO,Ni ZrO2(CaO) NiPty, NiO Pt +
Ni + yPt NiPty
K
aNiPt y
aNi aPty
При избытке Pt К и Е зависят только от активности Ni.
–RTlnK = –RTlnaNi = Ni = –2EF и aNi = exp(–EF/RT).
Где F - постоянная Фарадея
В зависимости от мольной доли никеля NNi, можно найти
aNi в соединении NiPty и по уравнению Гиббса–Дюгема
i dni
45.
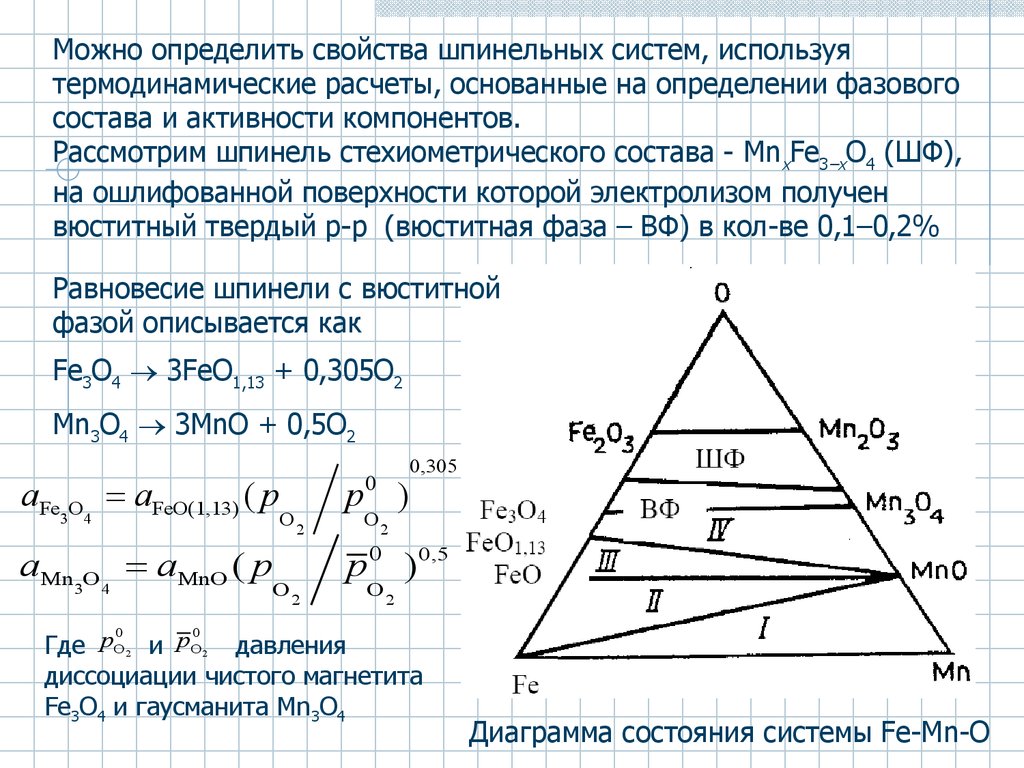
Можно определить свойства шпинельных систем, используятермодинамические расчеты, основанные на определении фазового
состава и активности компонентов.
Рассмотрим шпинель стехиометрического состава - MnxFe3–xO4 (ШФ),
на ошлифованной поверхности которой электролизом получен
вюститный твердый р-р (вюститная фаза – ВФ) в кол-ве 0,1–0,2%
Равновесие шпинели с вюститной
фазой описывается как
Fe3O4 3FeO1,13 + 0,305O2
Mn3O4 3MnO + 0,5O2
0
0,305
aFe O aFeO(1,13) ( p
p )
aMn O aMnO ( p
p 0 )0,5
3
O2
4
3
O2
4
0
O2
O2
0
Где pO и pO давления
диссоциации чистого магнетита
Fe3O4 и гаусманита Mn3O4
2
2
Диаграмма состояния системы Fe-Mn-O
46.
Для определения активности нужно определить pO2 надравновесными шпинельной и вюститной фазами. Используют
электрохимическую ячейку с твердым электролитом:
–Pt Fe,FeOy ZrO2(CaO) ШФ,BФ Pt+
Для электрохимической реакции
2Fe3O4 + ne 6FeO + O2
6
aFeO
pO
pO2
EnF
2
ln K ln 2
ln *
*
RT
aFe O pO
pO2
3 4
pO pO* exp( EnF RT )
2
2
2
pO*
2 давление кислорода над механической смесью порошка
где –
Fe и FeOу (электрод сравнения твердофазной ячейки).
Свободная энергия образования шпинели в зависимости от состава:
G (Fe, Mn)3O4 RT ( N Fe O ln aFe O N Mn O ln aMn O )
3 4
где N – мольная доля оксида.
3 4
3 4
3 4
47.
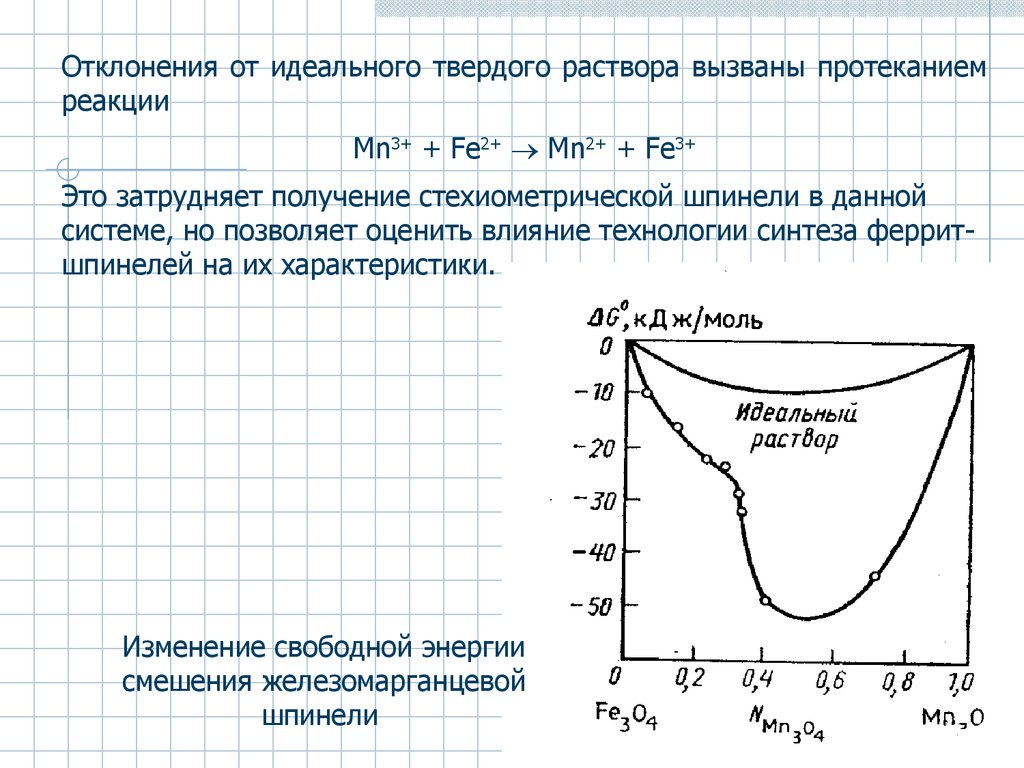
Отклонения от идеального твердого раствора вызваны протеканиемреакции
Mn3+ + Fe2+ Mn2+ + Fe3+
Это затрудняет получение стехиометрической шпинели в данной
системе, но позволяет оценить влияние технологии синтеза ферритшпинелей на их характеристики.
Изменение свободной энергии
смешения железомарганцевой
шпинели
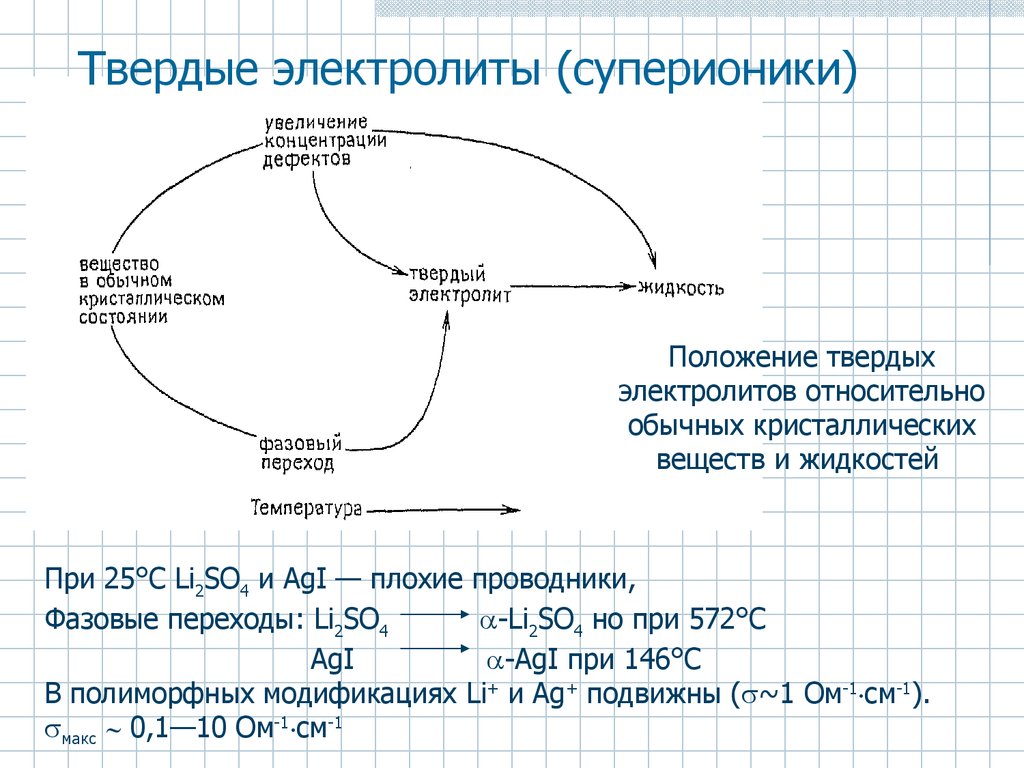
48. Твердые электролиты (суперионики)
Положение твердыхэлектролитов относительно
обычных кристаллических
веществ и жидкостей
При 25°С Li2SO4 и AgI — плохие проводники,
Фазовые переходы: Li2SO4
-Li2SO4 но при 572°С
AgI
-AgI при 146°С
В полиморфных модификациях Li+ и Ag+ подвижны ( ~1 Ом-1 см-1).
макс 0,1—10 Ом-1 см-1
49.
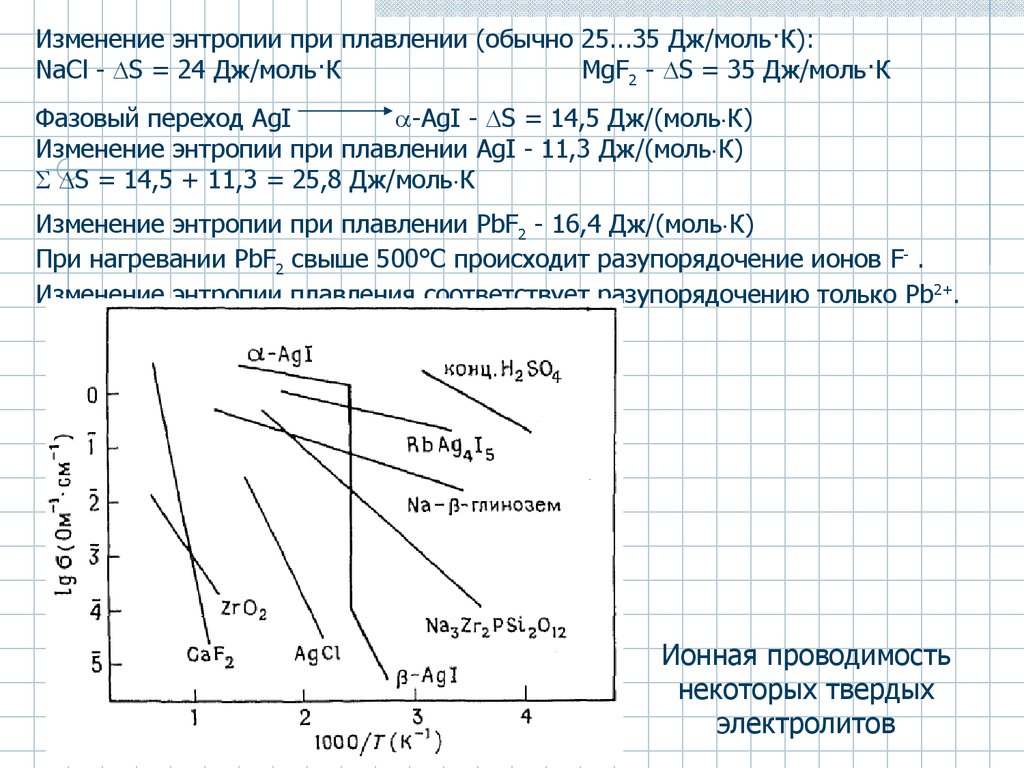
Изменение энтропии при плавлении (обычно 25...35 Дж/моль·К):NaCl - S = 24 Дж/моль·К
MgF2 - S = 35 Дж/моль·К
Фазовый переход AgI
-AgI - S = 14,5 Дж/(моль К)
Изменение энтропии при плавлении AgI - 11,3 Дж/(моль К)
S = 14,5 + 11,3 = 25,8 Дж/моль К
Изменение энтропии при плавлении PbF2 - 16,4 Дж/(моль К)
При нагревании PbF2 свыше 500°С происходит разупорядочение ионов F- .
Изменение энтропии плавления соответствует разупорядочению только Pb2+.
Ионная проводимость
некоторых твердых
электролитов
50. Классификация ионных кристаллов по типу разупорядоченности структуры
1. Ионные кристаллы с собственной разупорядоченностью (тепловымидефектами Френкеля и Шоттки), например AgCl, Al2O3.
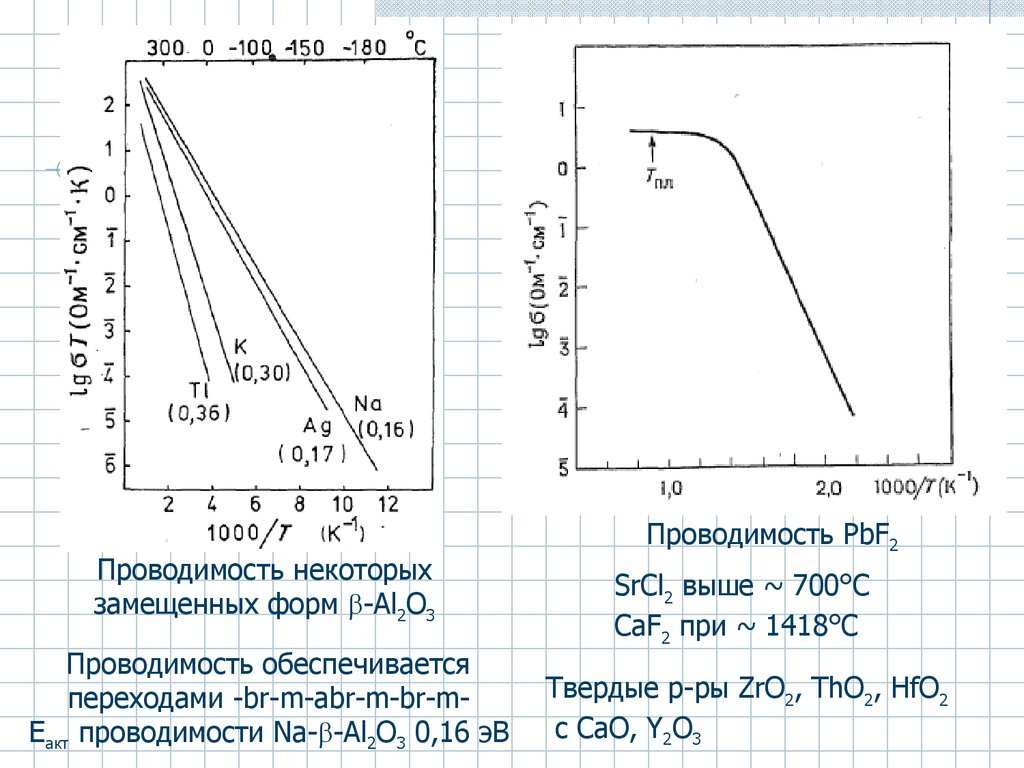
2. Ионные кристаллы с примесной разупорядоченностью – SrCl2
(температура перехода в проводящее состояние – 700°C), CaF2
(1418°C), ZrO2-CaO, Y2O3, Sc2O3 и др.
Примеси катионов с меньшим зарядом в ZrO2 приводят к образованию
кислородных вакансий и обусловливают возникновение проводимости по
механизму "эстафетного" переноса под воздействием внешнего поля, по
напряженности превышающего энергию активации электропроводности
3. Ионные кристаллы со структурной разупорядоченностью. Переход в
состояние ТЭ связан с разупорядочением одной из подрешеток.
51.
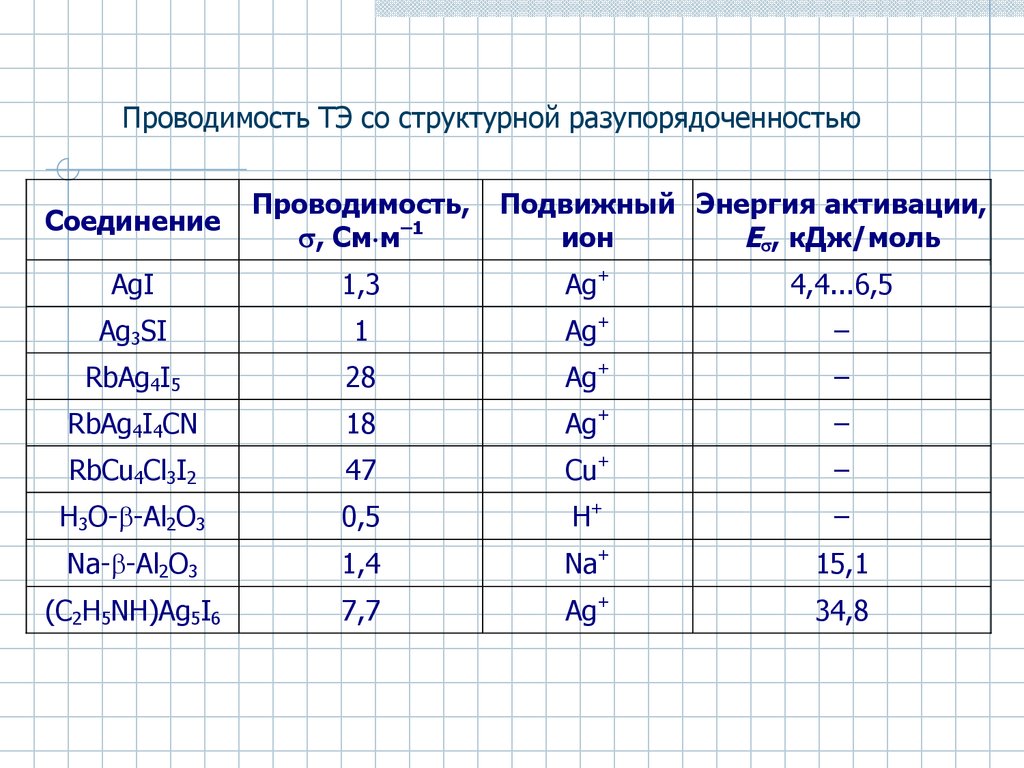
Проводимость ТЭ со структурной разупорядоченностьюСоединение
Проводимость,
, См м–1
Подвижный Энергия активации,
ион
Е , кДж/моль
AgI
1,3
Ag+
4,4...6,5
Ag3SI
1
Ag+
–
RbAg4I5
28
Ag+
–
RbAg4I4CN
18
Ag+
–
RbCu4Cl3I2
47
Cu+
–
H3O- -Al2O3
0,5
H+
–
Na- -Al2O3
1,4
Na+
15,1
(C2H5NH)Ag5I6
7,7
Ag+
34,8
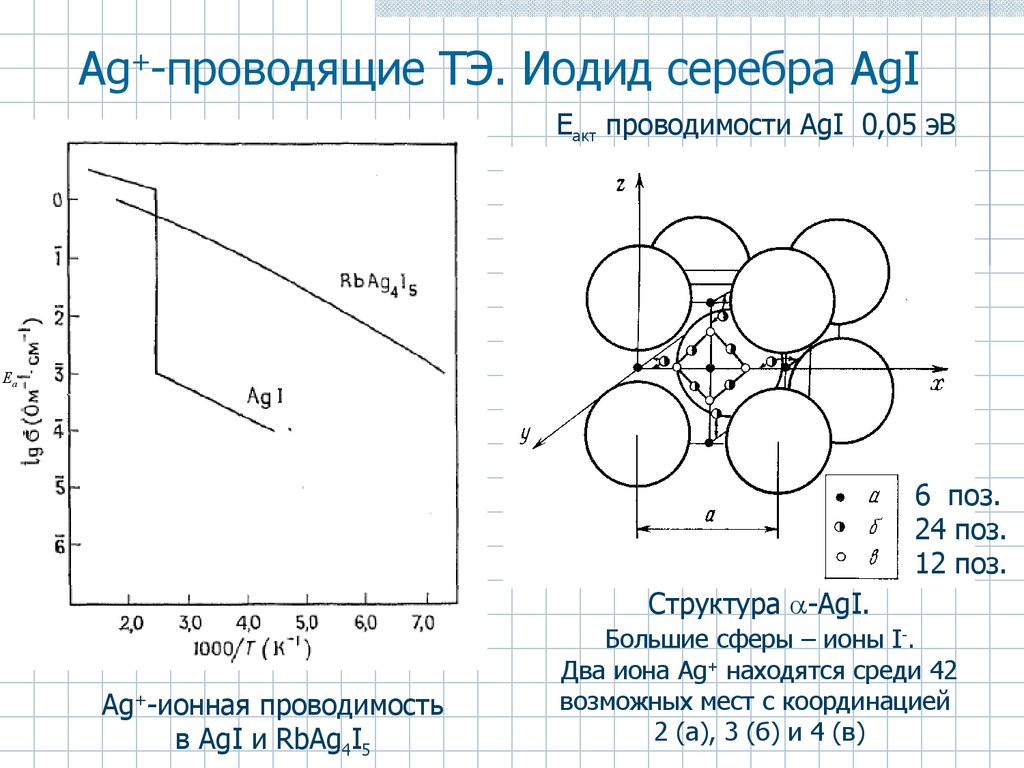
52. Аg+-проводящие ТЭ. Иодид серебра AgI
Eакт проводимости AgI 0,05 эВЕа
6 поз.
24 поз.
12 поз.
Структура -AgI.
Аg+-ионная проводимость
в AgI и RbAg4I5
Большие сферы – ионы I-.
Два иона Аg+ находятся среди 42
возможных мест с координацией
2 (а), 3 (б) и 4 (в)
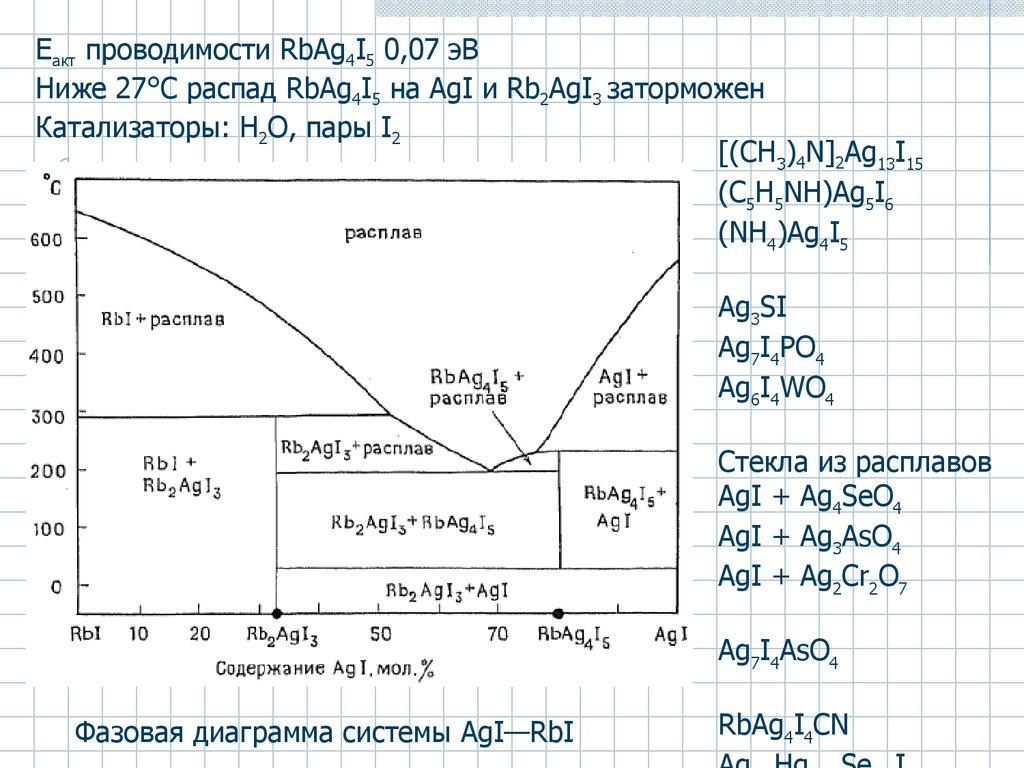
53.
Eакт проводимости RbAg4I5 0,07 эВНиже 27°C распад RbAg4I5 на AgI и Rb2AgI3 заторможен
Катализаторы: H2O, пары I2
[(CH3)4N]2Ag13I15
(C5H5NH)Ag5I6
(NH4)Ag4I5
Ag3SI
Ag7I4PO4
Ag6I4WO4
Стекла из расплавов
AgI + Ag4SeO4
AgI + Ag3AsO4
AgI + Ag2Cr2O7
Ag7I4AsO4
Фазовая диаграмма системы AgI—RbI
RbAg4I4CN
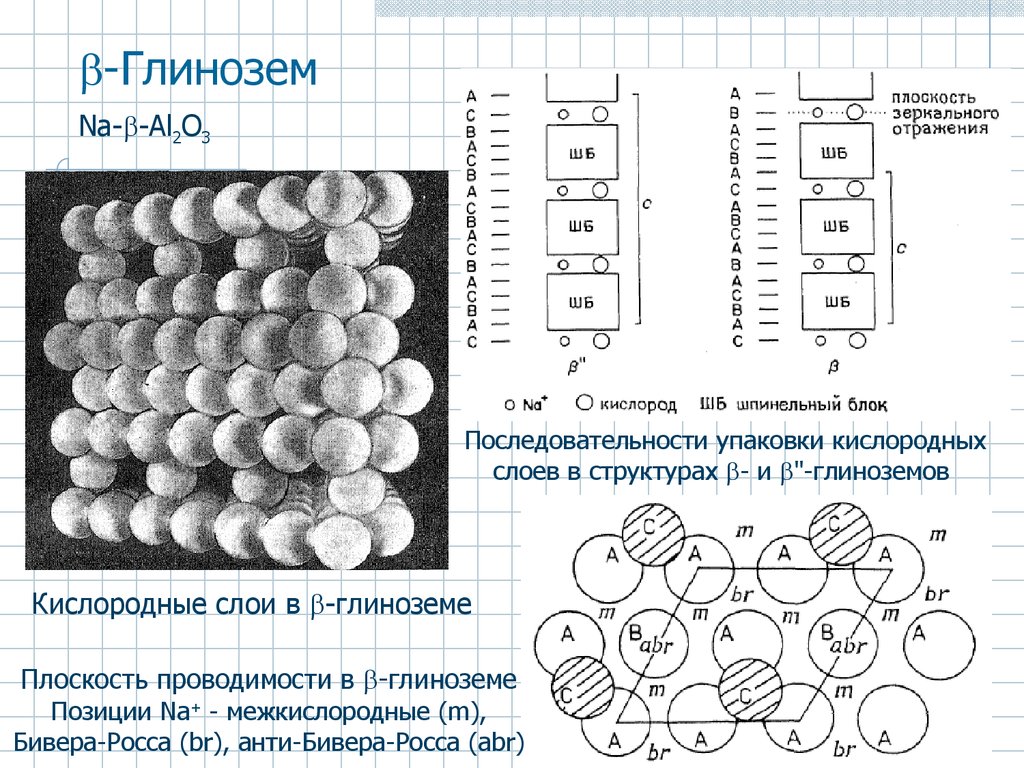
54. -Глинозем
-ГлиноземNa- -Al2O3
Последовательности упаковки кислородных
слоев в структурах - и "-глиноземов
Кислородные слои в -глиноземе
Плоскость проводимости в -глиноземе
Позиции Na+ - межкислородные (m),
Бивера-Росса (br), анти-Бивера-Росса (abr)
55.
Проводимость некоторыхзамещенных форм -Al2O3
Проводимость обеспечивается
переходами -br-m-abr-m-br-mEакт проводимости Na- -Al2O3 0,16 эВ
Проводимость PbF2
SrCl2 выше ~ 700°C
CaF2 при ~ 1418°C
Твердые р-ры ZrO2, ThO2, HfO2
с CaO, Y2O3
56. Поиски новых твердых электролитов
Предпосылки проявления веществом высокой ионной проводимости:1. Наличие большого числа подвижных ионов одного сорта (т.е. n в
уравнении = nе должно быть большим);
2. Наличие большого числа незанятых позиций, доступных для
подвижных ионов;
3. Малое различие в энергиях незанятых и занятых позиций и малая
величина активационного барьера при перескоке иона из одной
позиции в соседнюю;
4. Наличие открытых каналов для миграции подвижных ионов в
структуре (предпочтительно построенной по типу трехмерного
каркаса);
5. Анионная подрешетка (каркасного типа) должна быть легко
поляризуема
57.
Na3Zr2PSi2O12 - NASICON (от англ. Na +- superionic conductor).Структурный каркас NASICON образован сочленением вершин октаэдров
ZrO6 и тетраэдров (Р,Si)O4; при этом образуется трехмерная сеть каналов,
в которых располагаются ионы Na+.
Натриевая проводимость NASICON сравнима по уровню с проводимостью
-глинозема.
Li4SiО4 и Li4GeО4 имеют
проводимость по Li+ 10-4
Ом-1 см-1 при 300-400°С
Их структуры (соединения
построены из изолированных
тетраэдров SiО4 и GeО4,
образующих сетки
полиэдрических пустот с общими
гранями, внутри которых
размещаются ионы Li+) - удобная
матрица для легирования
Li14ZnGe4О16 (LISICON) –
= 10-1 Ом-1 см-1 при 300°С,
Проводимость некоторых Li+-проводников
Li3,5V0,5GeО0,5О4 –
= 5.10-5 Ом-1 см-1 при 25 °С
58. БароЭДС
Низкая электронная проводимость ТЭ позволяет наблюдать явление бароЭДС возникновение электрического потенциала под действием давления.Используют симметричную электрохимическую ячейку, состоящую из двух
серебряных электродов, разделенных ТЭ.
Ei E
i (2, 3)
E
i (3, 4)
E
i (4, 5)
d Ag(0) d e (0) , P
/ qi
Ag(2, 5)
dP
dP
qi
где mAg(0) и me(0) – химические потенциалы ионов Ag+ и е при нулевом давлении
d e (0) dP
Ee E1,2
dP
T qe
d Ag (0) V0
E Ei Ee
P
dP T qi
V0/qi = имеет размерность [ ] = В/Па.
V0
M
108
30
м3
17
10
3
26
DN A 10,5 10 6, 02 10
i =V0/qi = 1,06 10–10 В/Па.
e = – 2,4·10–11 В/Па






























 Химия
Химия








