Похожие презентации:
Химическая связь в твердых телах. Классификация твердых тел по типу химической связи
1. Лекции 3-4 Химическая связь в твердых телах. Классификация твердых тел по типу химической связи
2.
Ионная решётка состоит из ионовпротивоположного знака, чередующихся в узлах.
В атомных решётках атомы связаны ковалентной
или металлической связью. Примером вещества с
атомно-ковалентной решёткой является алмаз.
Металлы и их сплавы образуют атомнометаллические кристаллы.
Узлы молекулярной кристаллической решётки
образованы молекулами. В кристаллах молекулы
связаны за счёт межмолекулярного
взаимодействия
3. Таблица 1 − Тип кристаллической решётки и свойства веществ
Типкристалллической
решётки
Молекулярная
Атомно
ковалентная
Атомно
металлическая
Ионная
Структурная
частица
Молекула
Атом
Атом
Ион
Характер
связи
между
структурными
частицами
Ван-дер-ваальсовы
взаимодействия(дисперсионн
ое,
диполь-дипольное),
водородная связь
Ковалентная
Сильно
делокализованная
Ионная
Прочность связи
Слабая
Сильная
Сильная
Сильная
Температура
плавления
Низкая
Высокая
Большой диапазон
значений
Высокая
Электрическая
проводимость
Диэлектрики
Диэлектрики
или
полупроводники
Проводники
Диэлектрики
Примеры
O2, CO2, Br2, H2O, C6H6
C (алмаз), SiO2,
ZnS
Na, Zn, Fe, латунь
NaCl, KOH,
Na2CO3
4. Зонная теория кристаллов
5.
Зонная теория кристалловтеория представляетсобой теорию молекулярных орбиталей для
системы с очень большим числом (~ 1023) атомов.
В представления теории молекулярных орбиталей
при взаимодействии двух атомов происходит
перекрывание атомных орбиталей с образованием
связывающих и разрыхляющих молекулярных
орбиталей и каждое такое атомное энергетическое
состояние расщепляется на два, в системе из
четырёх атомов − на четыре, в системе из восьми
атомов − на восемь и т.д. молекулярных
состояний.
Чем больше атомов в системе, тем больше
молекулярных состояний
6.
Пусть из N атомов образуется кристалл, тогда каждоеатомное состояние сместиться энергетически и
расщепится на N состояний.
Так как число N очень велико (в 1 см3 металлического
кристалла содержится 1022 − 1023 атомов), то N состояний
сближаются, образуя энергетическую зону.
Энергетическое различие состояний электронов в пределах
зоны составляет всего лишь 10-22 эВ, поэтому изменение
энергии электрона в зоне можно представить как
непрерывную полосу энергии.
Орбитали энергетической зоны можно считать аналогами
молекулярных орбиталей, простирающихся по всему
кристаллу
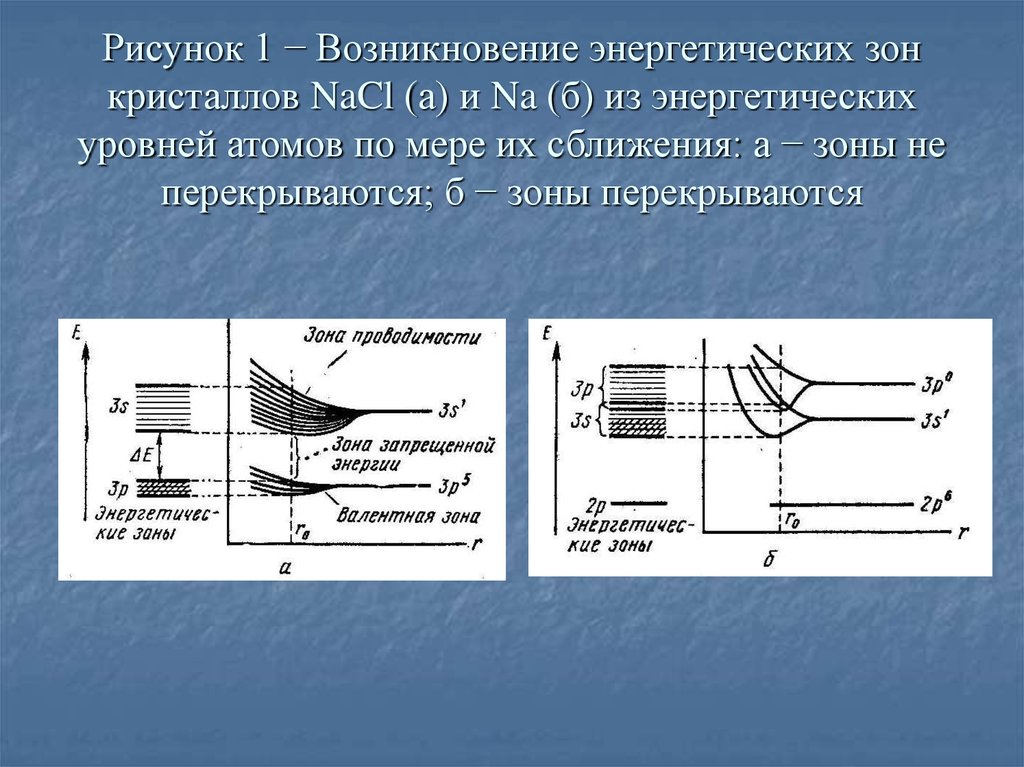
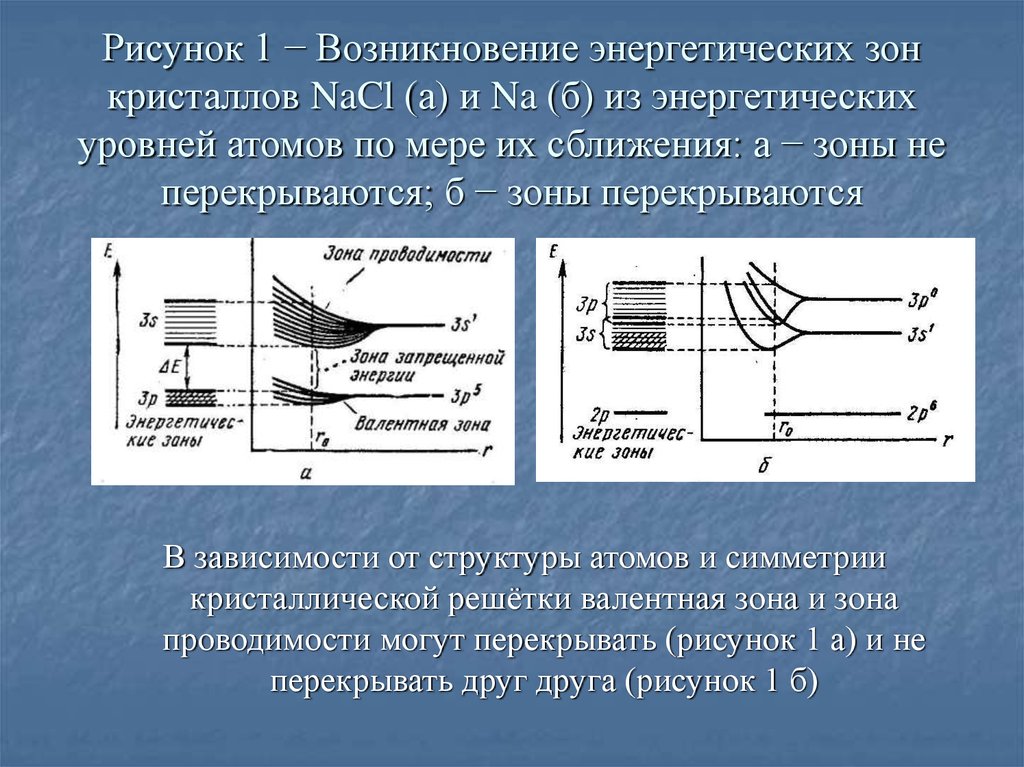
7. Рисунок 1 − Возникновение энергетических зон кристаллов NaCl (а) и Na (б) из энергетических уровней атомов по мере их
сближения: а − зоны неперекрываются; б − зоны перекрываются
8.
Орбитали энергетической зоны заполняются двумяэлектронами, как и орбитали атома и молекулы, в порядке
их расположения по энергиям и в соответствии с
принципом Паули.
Следовательно, максимально возможное число электронов в
зонах, возникающих за счёт перекрывания атомных s-, p-,
d-, f- орбиталей, соответственно равно 2N (s-зона), 6N (pзона), 10N (d-зона), 14N (f-зона).
Зона, которую занимают электроны, осуществляющие связь,
называется валентной (на рисунке 1 степень заполнения
валентной зоны показана штриховкой).
Свободная зона, расположенная энергетически выше
валентной, называется зоной проводимости
9. Рисунок 1 − Возникновение энергетических зон кристаллов NaCl (а) и Na (б) из энергетических уровней атомов по мере их
сближения: а − зоны неперекрываются; б − зоны перекрываются
В зависимости от структуры атомов и симметрии
кристаллической решётки валентная зона и зона
проводимости могут перекрывать (рисунок 1 а) и не
перекрывать друг друга (рисунок 1 б)
10.
Если зоны не перекрываются, то между зонамиимеется энергетический разрыв, именуемый
запрещённой зоной.
В соответствии с характером расположения и
заполнения зон вещества являются диэлектриками
(изоляторами), полупроводниками и
проводниками (металлами).
Ширина запрещённой зоны ∆Е диэлектриков
составляет более 3 эВ, полупроводников − от 0,1
до 3 эВ.
В металлических кристаллах вследствие
перекрывания зон запрещённая зона отсутствует
11.
Металлические кристаллы. У элементов типанатрия и меди имеется только один валентный sэлектрон, так что в их кристаллах валентная зона,
построенная из атомных s-орбиталей, заполнена
лишь наполовину.
Следовательно, при незначительном возбуждении
энергетическое состояние каждого из электронов
может меняться в пределах всей энергетической
зоны.
Это имеет место, например, при приложении к
металлу электрического поля.
Тогда электроны начинают двигаться в направлении
поля, что определяет электрическую
проводимость металлов
12.
В случае элементов с двумя валентными электронами s-зоназаполнена.
Однако если s- и p-уровни в изолированных атомах близки,
то в кристаллах соответствующие зоны перекрываются.
Следовательно, и в этом случае число валентных электронов
недостаточно для заполнения энергетических уровней
перекрывающихся зон.
Таким образом, металлические кристаллы образуются
элементами, в атомах которых число валентных
электронов мало по сравнению с числом энергетически
близких валентных орбиталей.
Вследствие этого химическая связь в металлических
кристаллах сильно делокализована
13.
Ковалентные кристаллы.Заполнение энергетических зон ковалентного
кристалла рассмотрим на примере алмаза, у
которого ширина запрещённой зоны ∆Е = 5,7 эВ.
Электроны атомов углерода полностью заполняют
валентную зону.
Поскольку переход электронов из валентной зоны в
зону проводимости требует большой энергии
возбуждения, которая в обычных условиях не
реализуется, алмаз является диэлектриком.
14.
Ионные кристаллы.В кристалле хлорида натрия валентные электроны
атомов Na (3s1) и Cl (3s23p5) заполняют валентную
энергетическую зону 3p.
В представлении теории ионной связи это отвечает
переходу электронов от атомов Na к атомам Cl и
образованию ионов Na+ и Cl-.
Поскольку энергетическое различие между
валентной 3p-зоной и свободной 3s-зоной велико
(∆Е ~6 эВ), в обычных условиях NaCl
электронной проводимостью не обладает
15.
Молекулярные кристаллы.В молекулярных кристаллах молекулы
связаны друг с другом за счёт
межмолекулярных элекростатических сил;
энергетические уровни локализованы в
пределах молекулы.
Переход электронов между молекулами в
обычных условиях не происходит
16.
Совокупность химически связанных атомов(например, молекула, кристалл)
представляет собой сложную систему
атомных ядер и электронов.
В образовании химической связи между ними
из всех существующих в природе сил
существенны только электростатические
силы, т.е. силы взаимодействия
электрических зарядов, носителями
которых являются электроны и ядра атомов
17. Рисунок 2– Энергия связи для гомоядерных молекул (кДж). В скобках указаны значения на единицу порядка связи (для тех молекул,
где это имеетсмысл)
Химические связи образуются в результате понижения энергии системы,
которая складывается из средней потенциальной и средней
кинетической энергии электронов. Уменьшение потенциальной
энергии, происходящее при обобществлении электронов в
гомоядерных двухатомных молекулах, сильно зависит от положения
атомов в периодической системе
18.
В гетероядерных двухатомных молекулах смещениеэлектронной плотности происходит, потому что в
этом случае энергия понижается еще больше, чем
при симметричном (ковалентном) распределении.
Если электроны в связи сконцентрированы ближе к
одному из атомов, говорят, что связь обладает
ионным характером.
Ионный характер проявляется в наличии у связи
дипольного момента и в энергии связи Do, или,
точнее, в избыточной энергии связи по сравнению
с гипотетической величиной DAB , которую
можно было бы ожидать при равномерном
распределении электронов
19.
Современные методы исследования позволяютэкспериментально определить пространственное
расположение в веществе атомных ядер.
Согласно квантово-механическим представлениям
можно говорить лишь о вероятности нахождения
электронов в той или иной точке поля атомных
ядер.
Данному пространственному размещению атомных
ядер отвечает определённое распределение
электронной плотности.
Выяснить, как распределяется электронная
плотность, и означает описать химическую связь в
веществе
20.
В зависимости от характера распределенияэлектронной плотности в веществе различают три
основных типа химической связи: ковалентную,
ионную и металлическую, которые в «чистом»
виде проявляются редко, а также особый вид
связи Ван-дер-Ваальсовые межмолекулярные
силы.
В большинстве соединений имеет место наложение
разных типов связи.
В твердых телах реализуются все типы химической
связи, включая ковалентную, ионную,
металлическую, донорно-акцепторную
(координационную), силы Ван-дер-Ваальса
21. Таблица 2‑ Типы и особенности химических связей в твердых телах
Таблица 2- Типы и особенностихимических связей в твердых
телах
Характеристика
связи
Пространственная
направленность
связи
Энергия
связи,
кДж/моль
Частицы, соединяемые
данной связью
Ковалентная связь
Одна или
несколько
электронных - пар,
образованных за
счет
обобществления
электронов
соединяющихся
атомов
есть
400—1000
атомы
неметаллов,
одинаковые
для
простых веществ и
различные
для
химических
соединений
22.
Ионная связьЭлектростатическое
взаимодействие
положительно и
отрицательно
заряженных ионов
нет
400—2000
обычно
простые
катионы, образованные
из металлов и простые
или сложные анионы,
включающие
неметаллы
Металлическая связь
Взаимодействие
катионов остова и
электронного газа
нет
400—1000
атомы
металлов,
одинаковые
для
простых веществ и
различные
для
интерметаллидов
23.
Координационная связьКоординирующий
атом передает
неподеленную
электронную пару
другим атомам или
ионам, связь частично
ковалентная
есть
400—1000
ионы или атомы металлов с
ионами
элементов,
имеющими
высокую
электроотрицательность
Ван-дер-Ваальсова связь
Возникает между
диполями и легко
поляризуемыми
частицами
в некоторой
степени
0,2—20
полярные молекулы (диполь
-дипольное взаимодействие,
водородная связь); полярная
молекула
с
легкополяризуемой
молекулой
или атомом (индукционное
взаимодействие);
неполярные, поляризуемые
атомы
или
молекулы
(дисперсионное
взаимодействие)
24.
Природа химической связи едина, в ее основе лежитэлектромагнитное взаимодействие электронов и ядер
атомов, составляющих вещество.
Неметаллы образуют соединения с ковалентной связью, если
разница в электроотрицательности атомов не слишком
велика и электроны, принадлежащие соединяющимся
атомам, формируют общие электронные пары.
У соединений металлов с неметаллами доминирует ионная
связь, хотя она чаще всего поляризована и по существу
занимает промежуточное положение между ионной и
ковалентной связью.
Обширная группа твёрдофазных химических соединений может
быть отнесена к числу комплексов с координационной
связью.
Два и более металлических элемента образуют
интерметаллиды с доминирующей металлической связью.
Несомненного внимания заслуживают и твёрдофазные
соединения с Ван-дер-Ваальсовым (в частности,
водородным) типом связи
25.
Для многих твердых химических индивидовхарактерен полиморфизм (аллотропия), причем
переход из одной кристаллической модификации
в другую нередко сопровождается изменением
типа химической связи.
Например, при низкотемпературном превращении
белого олова в серое металлическая связь
меняется на ковалентную.
В твердофазных химических соединениях между
составляющими их различными ионами, атомами
или атомными группами могут действовать
различные химические связи
26.
В гептагидрате сульфата железа (II) FeSO4 . 7H2O(железный купорос) каждая молекула воды
образована благодаря ковалентной полярной связи
двух атомов водорода с одним атомом кислорода,
далее вокруг каждого иона Fe (II) группируются
шесть молекул воды, образуя комплексный ион
[Fe(H2O)6]2+ (координационная связь), наконец,
этот комплексный ион посредством ионной связи
соединен с соседними ионами SO42-, а благодаря
водородной связи (вариант Ван-дер-Ваальсового
взаимодействия) - с седьмой молекулой воды
27. Ионная связь
28.
Ионную связь образуют сильно различающиеся по своейэлектроотрицательности элементы, один из которых легко
теряет электроны, превращаясь в катион, а другой
приобретает их и становится анионом.
Для качественного и количественного описания ионной связи
не требуется привлечения квантовой механики.
Ионную связь удовлетворительно описывает теория атома
Бора.
Первоначально Коссель считал, что при взаимодействии
разнородные атомы стремятся приобрести конфигурацию
внешней электронной оболочки инертных газов.
Это достигается отдачей и присоединением электронов.
Атомы, отдающие свои электроны, превращаются в
положительно заряженные ионы, а присоединяющие
электроны - в отрицательные ионы.
Химическая связь обеспечивается за счет электростатического
притяжения образовавшихся ионов
29.
Способность элементов образовывать простые ионыобусловлена электронной структурой их атомов.
Эту способность можно оценить величиной
энергии ионизации и сродства атомов к электрону.
Легче всего образуют катионы элементы с малой
энергией ионизации − щелочные и щелочноземельные металлы.
Образование же в условиях обычных химических
превращений простых катионов других элементов
менее вероятно, так как это связано с затратой
большой энергии на ионизацию атомов
30.
Простые анионы легче всего образуют рэлементы VII группы вследствие ихвысокого сродства к электрону.
Присоединение одного электрона к атомам
кислорода, серы, углерода, некоторым
другим элементам сопровождается
выделением энергии.
Присоединение же последующих электронов
с образованием свободных много зарядных
простых анионов места не имеет
31.
Поэтому соединения, состоящие из простых ионов,немногочисленны.
Они легче всего образуются при взаимодействии
щелочных и щелочно-земельных металлов с
галогенами.
Однако и в этом случае электронная плотность
между ионами не равна нулю, и поэтому можно
говорить лишь о преимущественном проявлении
ионной связи.
Радиусы одноатомных многозарядных ионов
представляют собой условные величины
32.
В решетке ионного кристалла происходит не толькопритяжение между разноименными ионами, но и
отталкивание одноименных ионов.
В этих условиях устойчивость подобных кристаллов
объясняется тем, что расстояние между разноименными
ионами меньше, чем между одноименными.
Поэтому силы притяжения превалируют над силами
отталкивания.
По своим электрическим свойствам ионные кристаллы
стехиометрического состава относятся к диэлектрикам.
В них электронная проводимость ничтожно мала и
преобладает ионная проводимость.
Однако ионные кристаллы с нарушенной стехиометрией
обладают электронной или дырочной проводимостью в
зависимости от механизма нарушения стехиометрии
33.
Идеально ионных соединений в природе несуществует.
Даже при химическом взаимодействии наиболее
электронегативных элементов образуются
соединения, в которых межатомная связь не на
100 % иона.
В молекулах и кристаллах ионная связь должна
рассматриваться как предельный случай частично
ионной связи.
Прежде всего об этом свидетельствуют
экспериментальные данные по эффективным
зарядам атомов, входящих в состав соединений
34. Принципиальные положения, необходимые для понимания ионных структур:
ионы следует рассматривать как заряженные, деформируемые иполяризуемые сферы;
структуры ионных соединений возникают под действием
электростатических сил; каждый катион при этом окружен анионами, и
наоборот;
стремление к максимизации электростатического притяжения между
ионами в структуре (т.е. к увеличению энергии решетки) приводит к тому,
что если все ближайшие соседи центрального иона имеют
противоположные ему заряды, то всегда реализуется максимально
возможное КЧ;
ионы - соседи второго порядка - имеют заряд того же знака, что и
центральный ион, и между ними действует отталкивание. В результате
этого однотипные ионы располагаются в структуре так, чтобы быть как
можно дальше друг от друга, что в свою очередь приводит к образованию
высокосимметричных структур, обладающих максимально возможным
объемом;
в структурах, как правило, соблюдается локальная электронейтральность,
т.е. заряд каждого иона равен сумме электростатических зарядов,
связанных с ним ионов противоположного знака
35.
Первое положение очевидно: эластичностьионов следует из того факта, что их
размеры различны для различных значений
координационных чисел, а поляризуемость
ионов проявляется при отклонениях от
чисто ионного типа связи
36.
Второе и четвертое положение означают, что, еслипредставить кристалл как трехмерную решетку точечных
зарядов, то корректность расчета сил, обеспечивающих
единство кристалла, и полной энергии взаимодействия
ионов как суммарной кулоновской энергии решетки будет
соблюдена.
По закону Кулона сила F, действующая между двумя
частицами с зарядами Z+e и Z-е, находящимися на
расстоянии r друг от друга, равна
(1)
Z Z e2
F
r2
Применив это выражение к каждой паре ионов в кристалле и
подсчитав, таким образом, суммарную силу
взаимодействия между всеми ионами, можно найти в
конечном итоге энергию решетки кристалла
37.
Третье положение устанавливает условие «контакта»соседних ионов.
Однако, учитывая характер распределения электронной
плотности в ионных кристаллах, количественно оценить
степень «контакта» достаточно сложно.
Тем не менее, сформулированное положение имеет важное
значение, поскольку, несмотря на зависимость кажущихся
размеров ионов от координационного числа, большинство
ионов, особенно небольших, проявляет максимальные
координационные числа.
Так, КЧ Ве2+ и Li+ равны 4 и 6 соответственно.
Размеры ионов не постоянны, но изменяются в довольно
узких пределах
38.
Четвертое положение о максимизации объемаионного кристалла (идея О' Кифа) кажется
неожиданным, так как рассматривая структуры
ионных соединений и другие плотноупакованные
структуры, в курсе кристаллохимии мы говорили
о том, что элементарная ячейка при прочих
условиях должна иметь минимальный объем.
В ионных кристаллах в основном действует сила
катион-анионного взаимного притяжения
ближайших соседей, и эта сила достигает
максимума при некотором удалении катиона от
аниона (при слишком сильном сближении катиона
и аниона силы отталкивания электронных
оболочек становятся больше сил притяжения)
39.
На притяжение ближайших соседей накладывается эффектотталкивания одинаково заряженных ионов-соседей
второго порядка.
Ионы одного знака должны располагаться как можно дальше
друг от друга, что ослабляет их взаимное отталкивание;
это общее правило ограничено необходимостью
минимальных катион-анионных расстояний и
максимальных КЧ.
Суммарное действие этих факторов приводит к образованию
упорядоченной и высокосимметричной подрешетки
одинаково заряженных ионов.
О' Кифом было показано, что такое их расположение
характеризуется максимальным объемом, а искажения
структур, вообще говоря, приводят к уменьшению объема
40.
Показательной в этом отношении может бытьструктура рутила.
Зигзагообразный изгиб кислородных слоев
вызывает в ней уменьшение КЧ кислорода
от 12 (типично для ГПУ) до 11 (как в
примитивной тетрагональной упаковке).
Это искажение не меняет окружения титана
кислородом, а также обратного окружения,
однако общий объем структуры возрастает
благодаря этому на 2-3 %
41.
Пятое положение выражает сущность правилаэлектростатических валентностей, второго в наборе
правил, сформулированных Полингом для ионных
кристаллов:
В устойчивой кристаллической структуре общая сила
валентных связей, которые приходятся на один анион от
всех соседних катионов, равна заряду аниона.
Согласно этому правилу, заряд любого иона, например
аниона, должен быть уравновешен равным по величине,
но противоположным по знаку зарядом окружающих
катионов.
Однако не следует забывать, что эти катионы одновременно
связаны с другими анионами, и при расчете необходимо
учитывать лишь тот положительный заряд, который
относится к связи катиона с рассматриваемым анионом
42.
Валентное усилие связи (%) катиона Мm+,окруженного п анионами Хx-, с отдельным
анионом рассчитывается по формуле
m/n
(2)
Отрицательный заряд любого аниона должен
быть уравновешен суммарным зарядом
окружающих его катионов, т.е.
(3)
m / n x
43.
В шпинели MgAl2O4 имеются октаэдрическиеионы А13+ и тетраэдрические ионы Mg2+,
каждый ион кислорода находится в
тетраэдрическом окружении трех ионов
А13+ и одного иона Mg2+:
для Mg2+ = 2/4 =1/2
для А13+ = 3/6= 1/2
Тогда валентные усилия связи катионов
(ЗА13+ + lMg2+) = 2
44.
Можно показать, что в силикатныхструктурах три тетраэдра SiO4 не могут
соединяться в общей вершине.
Для Si4+ = 4/4=1; тогда для кислорода,
соединяющего два тетраэдра SiO4, Σ =2,
что соответствует правилу
электростатических валентностей.
Три тетраэдра, гипотетически имеющие
общий кислородный ион, давали бы для
него Σ = 3, чего быть не может
45.
Данное правило Полинга является ключом кпониманию возможных и невозможных типов
соединения полиэдров в структурах кристаллов.
В таблице 3 для некоторых часто встречающихся
катионов приведены формальные заряды,
координационные числа и усилие связи .
Существуют также топологические ограничения
числа соединяющихся полиэдров; так, число
октаэдров, имеющих общую вершину, не может
быть больше шести (как в структуре NaCl) и т.д.
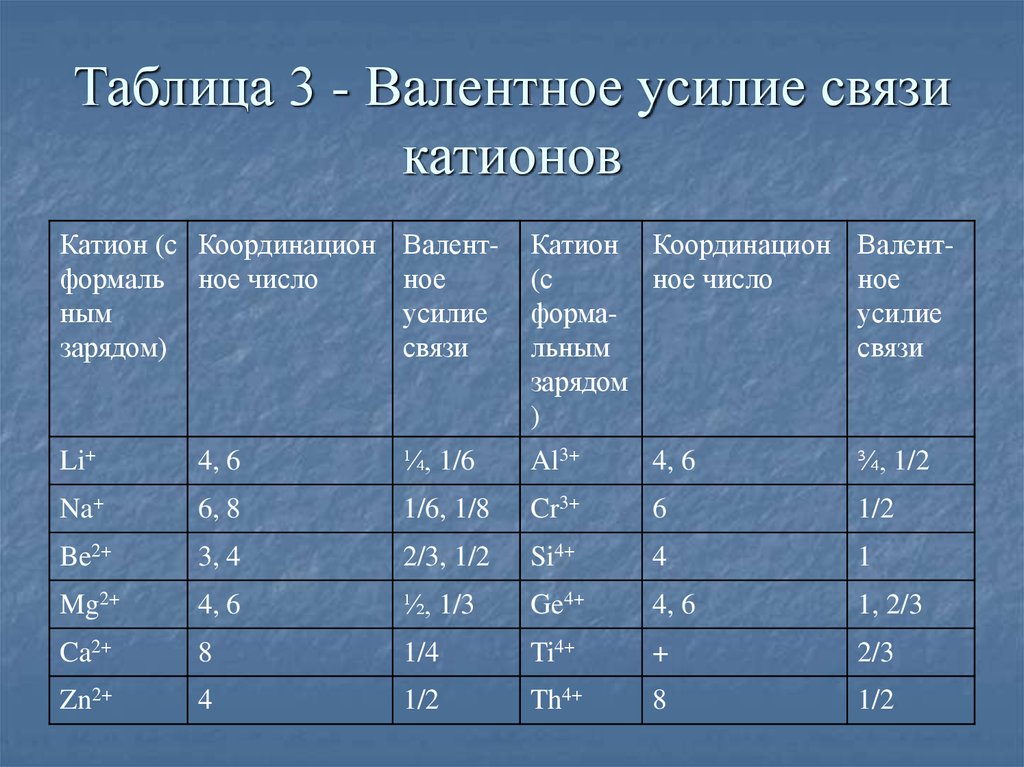
46. Таблица 3 ‑ Валентное усилие связи катионов
Таблица 3 - Валентное усилие связикатионов
Катион (с Координацион Валентформаль ное число
ное
ным
усилие
зарядом)
связи
Катион Координацион Валент(с
ное число
ное
формаусилие
льным
связи
зарядом
)
Li+
4, 6
¼, 1/6
Al3+
4, 6
¾, 1/2
Na+
6, 8
1/6, 1/8
Cr3+
6
1/2
Be2+
3, 4
2/3, 1/2
Si4+
4
1
Mg2+
4, 6
½, 1/3
Ge4+
4, 6
1, 2/3
Ca2+
8
1/4
Ti4+
+
2/3
Zn2+
4
1/2
Th4+
8
1/2
47.
Топологию полиэдров определяет третье правило Полинга:Существование ребер и особенно граней, общих для двух
атомных полиэдров, в координационной структуре
уменьшат ее стабильность.
Первое правило Полинга утверждает:
Вокруг каждого катиона образуется анионный полиэдр,
причем катион-анионные расстояния определяются
суммой радиусов, а координационное число
катиона - отношением радиусов.
Идея равенства катион-анионного расстояния и суммы
ионных радиусов в неявном виде входит в любую систему
ионных радиусов, поскольку основное назначение такой
системы и состоит в корректном предсказании межионных
расстояний
48.
В ряде случаев межатомные взаимодействия и энергияобразования твердофазных веществ могут быть с
достаточной точностью рассчитаны без обращения к
методам квантовой механики.
Это в первую очередь относится к тем твердым телам,
соседние атомы в которых характеризуются большим
различием электроотрицательностей, достаточным чтобы
полярность связи между ними была настолько высокой,
чтобы ее можно было рассматривать как полный переход
одного или нескольких электронов от атома к атому.
В этом случае направленная ковалентная связь между
образующими кристалл атомами может быть заменена
ненаправленным кулоновским притяжением и
отталкиванием перекрывающихся электронных оболочек
на малых межатомных расстояниях
49.
Энергия парного кулоновского притяжениядвух находящихся на расстоянии r
противоположно заряженных ионов с
зарядовыми числами z1 и z2 (относительно
состояния их бесконечного взаимного
удаления) может быть записана как:
E ïàð
z1 z 2 e 2
4 0 r
1
где 0 — диэлектрическая постоянная;
е — элементарный заряд
(4)
50.
Для перехода от этого выражения к энергии Еi иона сзарядовым числом zi в кристалле необходимо
просуммировать энергии парных взаимодействий по всем
ионам кристалла:
Ai z i e 2
(5)
E
i
ri
где ri, - расстояние от данного иона до ближайших соседей;
Аi, - параметр, который определяется структурой
кристалла:
rN z
1
Ai
i ni ni
,
(6)
4 0 n
rni
(суммирование ведется по координационным сферам;
rni - расстояние от рассматриваемого атома до n-й
координационной сферы; Nni - число ионов в
координационной сфере; zni - зарядовые числа ионов; знак
(+) перед слагаемым берут, если координационная сфера
заряжена разноименно с рассматриваемым ионом;
знак (-) - в противоположном случае)
51.
Молярная энергия кулоновского притяжениявещества при этом составит
E ïðèò
1
N A Ei ,
2
(7)
где суммирование ведут по элементарной
ячейке; NA — число Авогадро.
Для бинарного кристалла с одним типом
кристаллографических позиций для атомов
каждого элемента и формула может быть
записана в виде
AN z z e
(8)
E
2
A 1 2
ïðèò
r
52.
Определяемый типом кристаллической структуры параметрА, входящий в формулу (8) или (чаще) пропорциональную
ему безразмерную величину , называют постоянной
Маделунга.
Прямой расчет этой величины суммированием
приводившегося выше знакопеременного ряда затруднен
медленной сходимостью последнего (приемлемая
точность может быть достигнута лишь при включении в
расчет нескольких десятков тысяч атомов), в связи с чем
был предложен ряд методов ускоренного расчета.
Наиболее простой из них (метод Эвьена) заключается в
суммировании по ионам, находящимся в элементарных
ячейках, расположенных вокруг рассматриваемого иона, с
соблюдением условия электронейтральности (т.е. ионы на
границе рассматриваемого участка принадлежат ему не
полностью)
53. Значения постоянной Маделунга А' для некоторых распространенных структурных типов
NaClCsCl
NiAs
Вюрцит
Сфалерит
Флюорит
Рутил
1,7476
1,7627
1,6650
1,6410
1,6380
2,5200
2,4080
54.
Для перехода от энергии кулоновского притяжения к полнойэнергии ионного кристалла достаточно к энергии,
определяемой формулами (7) или (8), добавить энергию
отталкивания электронных оболочек.
Для зависимости этой энергии от межатомного расстояния
(r) было предложено несколько полуэмпирических
выражений, наиболее удобным из которых оказалось
предложенное
М. Борном и Майером:
(9)
Eîòò C exp( r / )
с учетом которого полная энергия кристалла составляет
(10)
Az1 z 2 e 2
E N A
r
C exp( r / )
55.
Значение входящей в потенциал отталкиванияэкспоненты для равновесного межатомного
расстояния (r0) может быть определено из условия
механического равновесия системы (dЕ/dr = 0) и
оно равно
(11)
Az1 z 2 e 2
exp( r0 / )
Cr02
Подстановка этого выражения в (11) дает формулу
Борна— Майера для энергии ионного кристалла:
N AAz1 z 2 e 2
(12)
E
1
r0
r0
56.
Экспериментально энергия ионной кристаллическойрешетки может быть определена по
термохимическому циклу (циклу Борна - Габера),
включающему атомизацию простых веществ,
ионизацию атомов (перенос электрона от атома
одного типа к атому другого типа) и образование
кристаллической решетки из ионизированного
газа.
Если известны энергии атомизации, потенциал
ионизации, сродство к электрону и теплота
образования рассматриваемого вещества из
простых веществ, то может быть вычислена
энергия кристаллической решетки по
термохимическому закону Гесса
57.
Формула (12) хорошо описывает энергию образованиярешеток галогенидов щелочных металлов, несколько
хуже - оксидов и галогенидов щелочноземельных
металлов и значительно хуже - сульфидов, селенидов,
соединений металлов в высоких степенях окисления и т.д.
Это связано с тем, что химическая связь в этих веществах не
является; полностью ионной.
Отклонение от ионной модели может быт следствием
поляризаций (смещения электронной плотности) анионов
с относительно рыхлыми электронными оболочками под:
действием катионов с достаточно высокой плотностью
заряда (т.е. может происходить перенос части электронной
плотности от аниона обратно к катиону)
58. Правила Фаянса
Поляризующая способность катионаувеличивается с уменьшением его размеров.
Поляризуемость аниона растет с увеличением
его размеров.
Чем выше зарядовые числа катиона и аниона,
тем выше их поляризующая способность и
поляризуемость соответственно.
Наличие у иона электронной оболочки
благородного газа уменьшает поляризующую
способность катиона и поляризуемость аниона
59.
Быстрое (экспоненциальное) возрастание потенциаламежатомного отталкивания при сближении ионов
позволяет приближенно рассматривать их как жесткие
шары определенного радиуса.
Введение понятия ионного радиуса позволяет получить
приближенное выражение для энергии ионной связи, не
включающее параметры, характеризующие конкретную
кристаллическую структуру.
Из приведенных выше данных можно сделать вывод, что
значение константы Маделунга (А'), приведенное для
1 атома формульной единицы, для перечисленных
структурных типов меняется относительно мало (от 0,803
для структуры рутила до 0,881 для структуры CsCl)
60.
А.Ф. Капустинский, взяв приведенную для 1 атома константуМаделунга для структуры NaCl (ANaCl) в качестве среднего
значения и заменив кратчайшие межатомные расстояния
на сумму ионных радиусов катиона и аниона (rк + rа),
предложил вместо ( 12) упрощенную универсальную
формулу
(13)
N AANaCl nz1 z 2 e 2
E
(1
)
2(rk ra )
rk ra
где п — число атомов на формульную единицу; 0 = 0,0345
нм.
Несмотря на большое число упрощающих предположений
при выводе формулы (13), она дает удовлетворительные
значения для большинства соединений с ионной связью, и,
кроме того, может быть с успехом использована для
теоретического рассмотрения термодинамики твердых
растворов

























































 Химия
Химия








